瑞芬太尼联合脐血间充质干细胞移植对脊髓损伤大鼠电生理及后肢功能的影响
李 敏, 杨 磊, 叶 奎
(1. 赤峰学院附属医院麻醉科, 赤峰024005;2. 赤峰市平庄矿区医疗集团医院麻醉科, 赤峰024076;3.天津市第四中心医院血管外科, 天津300140)
瑞芬太尼联合脐血间充质干细胞移植对脊髓损伤大鼠电生理及后肢功能的影响
李 敏1, 杨 磊2, 叶 奎3
(1. 赤峰学院附属医院麻醉科, 赤峰024005;2. 赤峰市平庄矿区医疗集团医院麻醉科, 赤峰024076;3.天津市第四中心医院血管外科, 天津300140)
目的 检测脐血间充质干细胞(UCMSC)移植联合瑞芬太尼对大鼠脊髓损伤电生理的影响及后肢功能变化。方法 83只成年Wistar大鼠,建立脊髓损伤模型,造模成功的80只大鼠运用随机数字表法分为4组。①UCMSC移植组,经尾静脉泵注等体积UCMSC细胞液; ②对照组,尾静脉注入培养液; ③瑞芬太尼组,瑞芬太尼注射液(2 mL·kg-1·h-1)尾静脉泵注4 h; ④联合组,尾静脉注射UCMSC细胞后,经尾静脉泵注瑞芬太尼注射液(2 mL·kg-1·h-1) 持续4 h。依次于移植前及移植后1周、2周、4周、6周通过大鼠脊髓损伤(BBB)评分、改良Tarlov 评分、斜板试验进行运动功能评定。移植后4周取材行荧光显微镜观测PKH-26标记的UCMSC存活及病理切片HE染色及分布情况。第4周进行辣根过氧化物酶(HRP)示踪分析神经纤维的再生情况,行运动诱发电位(MEP)和体感诱发电位(SEP)分析大鼠神经电生理恢复情况。结果 造模后,大鼠下肢运动功能评价联合组优于UCMSC移植组及瑞芬太尼组,UCMSC移植组和瑞芬太尼组优于对照组。瑞芬太尼组和UCMSC移植组损伤区可见少量神经轴索样的结构,该脊髓空洞比较小,联合组可见较多的神经轴索样结构,未见脊髓空洞。HE染色,对照组可见脊髓组织缺失及脊髓空洞形成,无神经轴索通过。移植后4周 HRP阳性神经纤维数和PKH-26阳性细胞,对照组最少,联合组最多,UCMSC移植组和瑞芬太尼组次之,组间差异均有统计学意义(P<0.05)。MEP潜伏期,对照组>瑞芬太尼组与UCMSC移植组>联合组,且各组间差异均有统计学意义(P<0.05); SEP潜伏期,对照组<瑞芬太尼组与UCMSC移植组<联合组,且各组间差异均有统计学意义(P<0.05)。结论 瑞芬太尼对脊髓损伤起到神经保护的作用,UCMSC移植的同时泵注瑞芬太尼能够促进脊髓损伤大鼠神经突触的再生,改善大鼠电生理功能及肢体运动功能。
脐血间充质干细胞(UCMSC); 瑞芬太尼; 大鼠; 脊髓损伤
脊髓损伤系脊髓受到暴力所造成的组织损害。在浑身遭遇的种种创伤性疾病中,脊髓损伤的发生率、死亡率和残疾率都较高[1-3]。严重的脊髓损伤即使经治疗挽救了生命,但其所引发的运动、记忆等后遗症却极大地影响患者的生活质量,给患者家庭与社会造成巨大的经济和精神负担[4-6]。近年来,人们进行了大量有关脊髓损伤后功能修复的探索,虽取得一定疗效但神经功能的缺损却无法获得更佳的改善[7,8]。如何解决此问题一直是在基础理论研究和临床实践上困惑医学界的重大难题。
近年来,关于干细胞的研究成果不仅打破了神经元毁伤无法再生的传统概念,还提出干细胞具有很强增殖和分化能力,它已在脊髓损伤修复方面突出了不可估量的临床应用价值[9,10]。然骨髓间充质干细胞具有容易染菌,繁殖生长分化能力随传代增多而下降,限定了其在临床治疗中的普遍应用。脐血间充质干细胞(UCMSC)与骨髓MSCs 相比, 除生物学特性相似外,显示出进一步低沉的免疫原性,且此类细胞在特殊既定的前提下可定向分化为神经元样细胞。瑞芬太尼系一类效果很强的阿片类镇痛药,因它能被迅速分解,具备半衰期短、药物耐受性好等特性,在临床麻醉中普遍使用。研究表明,瑞芬太尼对大鼠脊髓损伤有修护效果。本实验旨在观察UCMSC移植联合瑞芬太尼对脊髓损伤电生理的影响及大鼠后肢功能变化。
1 材料与方法
1.1 实验动物
清洁级雌性Wistar大鼠83只, 体质量200~250 g购自内蒙古大学实验动物研究中心[SCXK(蒙)2015-0001]。实验过程中对动物的处置符合动物伦理学标准[SYXK(蒙)2015-0001]。
1.2 主要试剂
胰蛋白酶、L-DMEM培养基(美国Gibco BRL公司产品); PBS液(上海纪宁实业有限公司); 流式细胞术检测用荧光抗体(美国BD公司); EDTA(天津市化学试剂一厂); 细胞培养箱(美国Thermo Forma 公司), PKH-26、水合氯醛(美国Sigma公司)。
1.3 方法
1.3.1 模型的建立及实验分组 采用体积分数10%的水合氯醛按350 mg/kg腹腔注射麻醉 Wistar大鼠。将Wistar大鼠于俯卧位固定在无菌实验平台上,腰背部备皮,全身消毒处理后,按T8-9棘突为切口中心,自大鼠背部正中逐层切开,充分显露T7-10的棘突和椎板, 咬除T8-9棘突和部分椎板, 暴露硬膜保持完整, 作为损伤区。按照改良的Allen法打击[11,12]造模, 将10 g重物自由落下, 撞击大鼠硬膜及脊髓组织, 大鼠尾巴痉挛摆动且双下肢瘫痪表明造模成功。用双氧水冲洗伤口, 逐层缝合大鼠损伤区切口。造模后每日挤尿2~3次, 直至大鼠恢复排尿反射。剔除造模失败的2只及做骨髓MSCs培养时处死的1只, 余下80只大鼠纳入实验。将其随机分为4组: 各20只/每组: ①对照组尾静脉注射1 mL细胞培养液; ②UCMSC移植组:大鼠尾静脉注射1 mL UCMSC (3×l06个/mL); ③瑞芬太尼组:经尾静脉泵注瑞芬太尼(1.2 μg·kg-1·h-1)4 h; ④联合组: 大鼠尾静脉注射1mL UCMSC(3×l06个/mL),同时经尾静脉泵注瑞芬太尼(1.2μg·kg-1·h-1)4h。
1.3.2 大鼠UCMSC的培养 无菌环境下,给待分娩雌鼠行剖宫产术,取脐带血20 mL, 放置培养皿中, 预先配置体积分数15%胎牛血清的DMEM培养液,使用该培养液于培养皿内冲洗脐带血3次[12]。无菌注射器抽取含有Hank’s液冲洗2次,制成细胞悬液。以1 000 r/min,离心12 min,去上清液,加入含有10%的胎牛血清(FBS),100 U/mL青霉素G钠,100 μg/mL硫酸链霉素,0.25 μg/mL两性霉素B的DMEM基培养[13]。常温静置24 h后,贴壁细胞为UCMSC细胞,弃除未贴壁的细胞。每2日更换培养液,每6 h观测一次细胞生长情况,生长95%后传代,第3代用于实验。
1.3.3 BBB评分、改良Tarlov 评分、斜板试验进行运动功能评定 分别于移植前及移植后1周、2周、4周、6周采用BBB评分、改良Tarlov 评分及斜板试验对各组大鼠进行运动功能评定。BBB评分[13,14]:共22级,0级: 后肢完全瘫痪,21级: 功能正常,主要观察指标包括关节活动次数, 运动负荷、范围,前肢、后肢及前爪、后爪、尾巴的协调程度。改良Tarlov 评分: 0级: 后肢无活动, 不能负重; 1级: 后肢可见活动但不能负重; 2级: 后肢活动频繁或有力,不能负重; 3级: 后肢可支持体重, 能走1~2步; 4级:可行走,仅有轻度障碍; 5级: 行走正常。斜板试验: 大鼠放置在光滑的木板上, 体轴垂直于板的垂直轴, 每个试验斜板的角度增加5°,当最大角度时大鼠可停留5 s,则认为有功能价值[15]。采取双盲法进行相关评分,评分均为两人合评。每组随机检测5只,共检测3次,取均值。
1.3.4 荧光显微镜观测PKH-26标记的UCMSC存活情况 移植后4周,将1 mL LDMEM培养基(含体积分数5%胎牛血清)和5 μL PKH-26溶液放入1.5 mL离心管中, 离心后即得PKH-26标记液。当细胞贴壁达80%时, 弃去离心管内液体,用PBS冲洗3次,加入40 μL/cm2PKH-26标记液,置于含体积分数5%CO2培养箱中, 37 ℃温育20 min。弃液, 37 ℃下加入LDMEM溶液(含体积分数5%FBS)5 mL, 温育10 min。弃去溶液, 用购置的培养液洗涤3次。对细胞的标记形态及标记效果进行观察。
1.3.5 荧光显微镜观察HE染色及分布情况 于移植后4周对上述各组大鼠中随机取5只,质量分数10%的水合氯醛腹腔麻醉后,开胸,暴露心脏,由升主动脉为入口对大鼠进行插管处理,插管深度至右心耳, 用质量分数4%多聚甲醛固定,冲洗用生理盐水。从病变部位取长约1 cm的完整脊髓,经分级系列酒精脱水,纵向切片,厚约20 μm。行HE染色,并观察。随机取5个视野,用高倍荧光显微镜(200×)观察,计数每个视野内PKH-26的阳性细胞数,并取其平均值作为PKH-26的细胞数。
1.3.6 辣根过氧化物酶(HRP)示踪分析神经纤维的再生情况 于移植后4周, 等量生理盐水溶解HRP。各组随机取5只大鼠, 麻醉后手术暴露脊髓。在T10髓背正中静脉左/右侧1 mm处进针玻璃微管, 进针深度1.5 mm。于40 min内匀速注射50% HRP 1 μL,将微管停留脑内30 min, 封闭切口, 正常饲养3 d。质量分数10%的水合氯醛麻醉后, 以温热的质量分数4%多聚甲醛+质量分数1.25%戊二醛固定液150 mL进行心脏灌注, 并切取脊髓(T3-T11), 并其浸入4 ℃的质量分数30%葡萄糖溶液,浸泡20 h后,取出脊髓制作成30 μm的横切面冰冻切片。对切片进行DAB 加强染色后以中性树胶封片。在光学显微镜下计数脊髓横切面上HRP 阳性神经纤维束数目, 各组随机抽取5张切片进行阳性纤维束计数。
1.3.7 运动诱发电位(MEP)和体感诱发电位(SEP)分析大鼠神经电生理恢复情况 于移植后4周, 各组随机选取5只大鼠,参考文献[16,17]的方法用Keypoint 4诱发电位仪测定MEP和SEP。质量分数10%水合氯醛腹腔注射麻醉,将其平放在水平面上, 后肢固定刺激电极。记录电极安放于冠状缝和矢状缝愈合线的相交处头皮下(即后肢皮层感觉区),参考电极置于其后方0.5 cm处。给予直流方波电脉冲刺激, 以后肢轻微抽动为宜, 电流强度为5~15 mA,波宽0.2 ms, 频率3 Hz, 叠加次数50~60次, 记录SEP潜伏期及波幅的变化,观察神经电生理恢复情况。MEP检测: 麻醉后将针状刺激电极置于顶冠状缝前2 mm、矢状缝旁2 mm处头皮下(即大脑皮质运动区), 刺激强度40 mA, 刺激波宽0.1 ms, 刺激频率 1 Hz, 叠加次数 300~500 次, 扫描速度 5 ms/D, 灵敏度5 μV/D。观察记录MEP和SEP的变化。
1.4 统计学处理
2 结果
2.1 UCMSC的形态观察
体外培养3 d的UCMSC,悬浮细胞逐渐坏死破碎,有较多贴壁细胞出现,可见形成的细胞集落,细胞胞体呈梭形,体积较大,形态以梭形、多角形为主,类似成纤维细胞,有粗大突起伸出。按照标准骨髓间充质干细胞的体外扩增流程按1∶2~1∶3传代,放入体积分数5%的CO2培养箱内进行传代细胞的培养,3周后形成几十到几百个细胞的克隆,进一步传代培养后,细胞体积逐步增大,为成纤维样的长梭形细胞,单个核,有较长的突起,折光性较强。随着细胞的迅速增殖,3周后细胞生长可达 80%~90%融合,形态均一,呈长梭形,类似于骨髓MSCs。本研究采用培养第3代的UCMSC进入实验(图1)。

图1 UCMSC的形态观察
2.2 大鼠下肢运动功能评定
移植后,大鼠下肢运动功能评价联合组优于UCMSC移植组及瑞芬太尼组,UCMSC移植组和瑞芬太尼组优于对照组(P<0.05)。各组大鼠下肢运动功能评分见表1、2、3。
2.3 PKH-26标记UCMSC存活
移植后4周 HRP阳性神经纤维数和PKH-26阳性细胞:对照组最少(图2A),联合组最多(图2D),UCMSC移植组(图2B)和瑞芬太尼组(图2C)次之,组间差异均有统计学意义(P<0.05)。

表1 各组大鼠BBB评分评定结果

表2 各组大鼠改良Tarlov 评分评定结果

表3 各组大鼠斜板试验评定结果

图2 各组PKH26标记的阳性细胞(×200)
2.4 HE染色及分布情况
对照组可见脊髓组织缺失及脊髓空洞形成,无神经轴索通过(图3A)。瑞芬太尼组和UCMSC移植组损伤区可见少量神经轴索样的结构,该脊髓空洞比较小(图3B、C),联合组可见较多的神经轴索样结构,未见脊髓空洞(图3D)。

图3 各组大鼠的病理学观察(HE×200)
2.5 HRP示踪分析神经纤维的再生
HRP示踪法显示瑞芬太尼组、UCMSC移植组及联合组可见HRP标记的神经锥体细胞穿越损伤区。对照组(图4A)大鼠T8 以上节段可见较少的HRP阳性颗粒标记的神经锥体细胞。瑞芬太尼组(图4B)及UCMSC移植组(图4C)的HRP阳性神经锥体细胞数目较联合组少,但较对照组多。联合组(图4D)脊髓可见到较多HRP阳性颗粒标记的神经锥体细胞。瑞芬太尼组、UCMSC移植组于对照组比较,联合组于瑞芬太尼组、UCMSC移植组比较,均具有明显的统计学差异(P<0.05),各组大鼠HRP阳性颗粒标记的神经锥体细胞见表4、图4。

表4 各组大鼠HRP阳性颗粒标记的神经锥体细胞
2.6 MEP和SEP分析大鼠神经电生理恢复
MEP和SEP的潜伏期:对照组>瑞芬太尼组与UCMSC移植组>联合组,且各组间差异均有显著性意义(P<0.05); 波幅: 对照组<瑞芬太尼组与UCMSC移植组<联合组,且各组间差异均有显著性意义(P<0.05)(表 5)。
3 讨论
脊髓损伤是一种可导致严重后果的创伤性疾病[18,19]。脊髓损伤的病理机制较为复杂, 病理生理过程主要包括两个阶段,即原发性损伤与脊髓损伤后脊髓出血水肿造成的继发性损伤[20-23]。继发性损伤在原发性损伤基础上,损伤脊髓组织发生复杂的病理生理反应, 进而导致脊髓组织结构、功能的继发性损害,给脊髓损伤后功能恢复造成障碍[24-27]。临床中针对脊髓损伤后继发性损害的治疗较多,多采用药物治疗,然而药物不良反应较多,因此也限制了其发展[28-30]。大量研究[31,32]表明,干细胞移植对大鼠脊髓损伤具有保护作用,这一结论已得到公认。实验研究[33,34]表明,UCMSC具有增殖力强、免疫原性低、利于进行细胞移植,可以作为修复神经功能受损的一种有效方法。研究[35,36]表明,UCMSC移植到受损伤的脊髓组织中,能产生新的神经细胞,可以促进脊髓组织的再生修复。
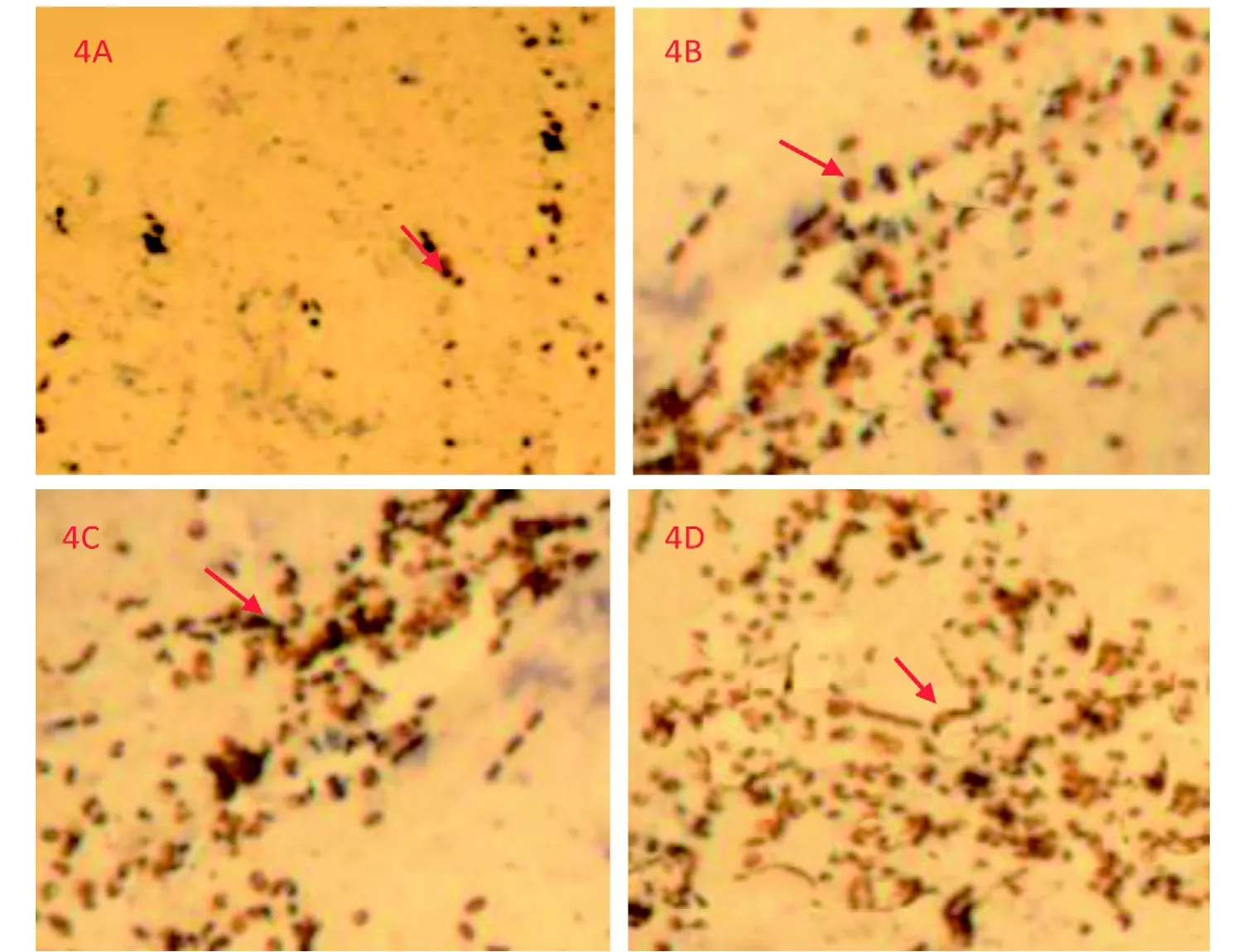
图4 伤后8 周各组HRP阳性神经纤维数(×200)

表5 各组大鼠MEP和SEP变化
脊髓损伤后采取早期药物治疗可以对脊髓损伤患者运动功能的恢复起到重要的辅助治疗作用。瑞芬太尼可保护中枢系统减轻或免受损伤。此外,瑞芬太尼起效迅速、清除速率快,能够抑制细胞凋亡,维持脊髓缺血损伤区域金属元素 Ca2+等的稳定,且少有不良反应,已被广泛应用于临床。早期应用瑞芬太尼等药物能够抑制脊髓缺血再灌注损伤诱导的细胞凋亡, 发挥药物预处理效应。
本研究通过行运动功能评定、荧光显微镜观测、病理切片HE染色观察及神经电生理等的检测,观察大鼠脊髓损伤后功能的恢复情况,研究结果显示, 移植后4周, 大鼠下肢运动功能评价联合组优于UCMSC移植组及瑞芬太尼组, UCMSC移植组和瑞芬太尼组优于对照组。瑞芬太尼组和UCMSC移植组损伤区可见少量神经轴索样的结构,该脊髓空洞比较小,联合组可见较多的神经轴索样结构,未见脊髓空洞。HE染色,对照组可见脊髓组织缺失及脊髓空洞形成,无神经轴索通过。移植后4周HRP阳性神经纤维数和PKH-26阳性细胞: 对照组最少,联合组最多,UCMSC移植组和瑞芬太尼组次之,每组间差异均有统计学意义。MEP和SEP的潜伏期: 对照组>瑞芬太尼组与UCMSC移植组>联合组; 对照组<瑞芬太尼组与UCMSC移植组<波幅联合组。这一系列结论说明UCMSC移植和瑞芬太尼均可对脊髓损伤大鼠发挥治疗作用,可促进脊髓损伤大鼠神经突触的再生,改善其大鼠肢体运动功能,但联用后对脊髓损伤大鼠具有更佳的修护作用。
综上所述,瑞芬太尼联合UCMSC能显著改善大鼠脊髓损伤后神经功能缺失状况,对脊髓损伤起到神经保护的作用,UCMSC移植的同时泵注瑞芬太尼能够促进脊髓损伤大鼠神经突触的再生,改善其大鼠电生理功能及肢体运动功能,从而施展修护脊髓损伤作用。目前关于干细胞移植治疗脊髓损伤仍处于动物实验阶段,仍需进一步探索及大量的相关性实验研究推动,才可促进临床试验的应用。
[1] 高平, 孙占胜, 王伯珉, 等. 骨髓间充质干细胞诱导成神经元样细胞移植治疗脊髓损伤[J]. 中国组织工程研究, 2013,17(23):4256-4263.
[2] 冯大雄, 钟德君, 宋跃明, 等. 静脉移植脐血间充质干细胞治疗大鼠脊髓损伤的实验研究[J]. 中华实验外科杂志,2006, 23(12):1572.
[3] Carter LM, McMahon SB, Bradbury EJ. Delayed treatment with Chondroitinase ABC reverses chronic atrophy of rubrospinal neurons following spinal cord injury[J]. Exp Neurol, 2011, 228(1):149-156.
[4] 冯玉, 白文芳, 许伟成, 等. 低频电磁场促进骨髓间充质干细胞移植修复大鼠脊髓损伤的实验研究[J]. 中国组织工程研究, 2013, 17(32):5819-5826.
[5] 王东, 张建军, 杨忠旭, 等. 神经干细胞NgR基因沉默移植治疗大鼠脊髓损伤[J]. 中国危重病急救医学, 2010, 22(1):28-31.
[6] 段艳萍, 黄素群, 冯林森, 等. GAP-43治疗大鼠完全性脊髓损伤后GFAP表达的变化及意义[J].神经解剖学杂志,2011, 27(6):670-674.
[7] Amr SM, Gouda A, Koptan WT, et al. Bridging defects in chronic spinal cord injury using peripheral nerve grafts combined with a chitosan-laminin scaffold and enhancing regeneration through them by co-transplantation with bonemarrow-derived mesenchymal stem cells: case series of 14 patients[J]. J Spinal Cord Med, 2014, 37(1):54-71.
[8] 叶正旭, 李静, 黄景辉, 等. 成年脊髓损伤大鼠脊髓神经干细胞的体外培养及分化研究[J]. 中华创伤骨科杂志, 2009,11(10):956-959.
[9] 张晓辉, 张建宁, 康春生, 等. hTERT正、反义表达载体转染大鼠骨髓间充质干细胞的实验研究[J]. 中华神经医学杂志, 2006, 5(3):217-221.
[10] Morizane K, Ogata T, Morino T, et al. A novel thermoelectric cooling device using Peltier modules for inducing local hypothermia of the spinal cord: The effect of local electrically controlled cooling for the treatment of spinal cord injuries in conscious rats[J]. Neurosci Res, 2012,72(3):279-282.
[11] Young W. Spinal cord contusion models[J]. Prog Brain Res,2002, 137:231-255.
[12] 张海明, 张映. 神经生长因子对神经元作用的研究进展动物医学进展[J]. 动物医学进展, 2006, 27(9):39-41.
[13] Pallini R, Vitiani LR, Bez A, et al. Homologous transplantation of neural stem cells to the injured spinal cord of mice[J].Neurosurgery, 2005, 57(5):1014-1025.
[14] Dosenko VE, Nagibin VS, Tumanovskaya LV, et al.Postconditioning prevents apoptotic necrotic and autophagic cardiomyocyte cell death in culture[J]. Fiziol Zh, 2005,51(3):12-17.
[15] 訾英, 范广宇, 朱悦. 脊髓干细胞移植对脊髓损伤后神经功能的影响[J].中华实验外科杂志, 2006, 23(10):1257-1258.
[16] Albin RL, Mink JW. Recent advances in Tourette syndrome research[J]. Trends Neurosci, 2006, 29(3):175-182.
[17] Chi GF, Kim MR, Kim DW, et al.Schwann cells differentiated from spheroid-forming cells of rat subcutaneous fat tissue myelinate axons in the spinal cord injury[J]. Exp Neurol,2010, 222(2):304-317.
[18] 刘晓刚, 邓宇斌, 蔡辉. 控释胶质细胞源性神经营养因子与骨髓间充质干细胞源神经元样细胞移植可减少脊髓损伤后空洞形成[J].中国组织工程研究, 2013, 17(1):68-73.
[19] 刘琇, 章涛. 脊髓损伤治疗研究进展[J]. 实用医学杂志,2014, (18):3008-3010.
[20] 薛荣利, 张媛媛, 李泽慧, 等. 骨髓间充质干细胞在大鼠脊髓损伤治疗中的应用[J]. 解放军医药杂志, 2015, 27(10):4-7.
[21] Morizane K, Ogata T, Morino T, et al. A novel thermoelectric cooling device using Peltier modules for inducing local hypothermia of the spinal cord: The effect of local electrically controlled cooling for the treatment of spinal cord injuries in conscious rats[J]. Neurosci Res, 2012, 72(3):279-282.
[22] 王伟, 景桂霞, 赵新京, 等. 瑞芬太尼预处理对大鼠脑缺血再灌注损伤细胞凋亡的影响[J]. 西安交通大学学报, 2011,32(1):128-130.
[23] Hurtado A, Marcillo A, Frydel B, et al. Anti-CD11d monoclonal antibody treatment for rat spinal cord compression injury[J]. Exp Neurol, 2012, 233(2):606-611.
[24] 阮智, 黄慧. 异体骨髓间充质干细胞移植治疗大鼠脊髓损伤[J]. 中国组织工程研究与临床康复, 2010, 36:6729-6732.
[25] Duchossoy Y, David S, Baulieu EE, et al. Treatment of experimental spinal cord injury with 3β-methoxy-pregnenolone[J]. Exp Brain Res, 2011, 1403:57-66.
[26] 段大鹏, 苏权, 胡伟, 等.同种异体骨髓间充质干细胞移植治疗大鼠脊髓损伤的时效性分析[J].中国骨伤, 2013, 26(10): 845-849.
[27] 王欢, 孟凌新, 崔少千, 等. 脊柱侧凸术中"唤醒后矫形"预防脊髓损伤的临床研究[J].中华外科杂志, 2010, 48(6):432-434.
[28] Li X, Cai. M The effect of L-bupivacaine on BIS levels in the maintenance doses of propofol and fentanyl during general anesthesia in Chinese people[J]. Drug Res (Stuttg), 2014, 64(12):675-679.
[29] 赵学正, 唐开. 骨髓间充质干细胞治疗大鼠脊髓损伤移植途径的实验[J]. 中华骨与关节外科杂志, 2015, 8(3):246-252.
[30] Li Z, Zhao W, Liu W, et al.Transplantation of placenta-derived mesenchymal stem cell-induced neural stem cells to treat spinal cord injury[J]. Neural Regen Res, 2014, 9(24):2197-2204.
[31] 刘艳. 瑞舒芬太尼和丙泊酚在脊柱侧凸矫正术唤醒试验中的应用[J]. 中国医师进修杂志, 2009, 32(9):43-44.
[32] Song Q, Xu R, Zhang Q, et al.Therapeutic effect of transplanting bone mesenchymal stem cells on the hind limbs' motor function of rats with acute spinal cord injury[J] Int J Clin Exp Med, 2014,7(1):262-267.
[33] Park DY, Mayle RE, Smith RL,et al.Combined transplantation of human neuronal and mesenchymal stem cells following spinal cord injury[J]. Global Spine J, 2013, 3(1):1-6.
[34] Cui X, Chen L, Ren Y, et al.Genetic modification of mesenchymal stem cells in spinal cord injury repair strategies[J].Biosci Trends, 2013,7(5):202-208.
[35] 李劲松, 张立涛. 小剂量芬太尼复合瑞舒芬太尼在小儿脊柱侧弯矫正术唤醒试验中的应用 [J]. 河北医药, 2011, 33(1):91-92.
[36] 贾丽玲, 曹定睿, 张维智, 等. 瑞芬太尼预处理对脑缺血/再灌注大鼠脑组织MDA含量和SOD活性的影响[J]. 中国医药指南, 2010, 8(5):27-29.
Remifentanil Combined with Cord Blood Mesenchymal Stem Cells Transplantation on Hindlimb Function and Electrophysiology in Spinal Cord Injured Rats
LI Min1, YANG Lei2, YE Kui3
(1. Department of Anesthesiology, Affiliated Hospital of Chifeng College, Chifeng 024005, China;2. Department of Anesthesiology,Chifeng City General Hospital Medical Group Mining Pingzhuang, Chifeng 024076, China; 3. Department of Vascular Surgery, Tianjin Fourth Central Hospital,Tianjin 300140, China)
ObjectiveTo determine the effects of cord blood mesenchymal stem cells (UCMSC)transplantation combined with remifentanil on electrophysiology and hindlimb functionon in spinal cord injured rats.MethodsThe spinal cord injury model was established in 83 adult Wistar rats, the model rats were randomly divided into four groups. ①UCMSC transplantation group, via the tail vein infusion of equal volumes UCMSC cell sap. ② control group, refers to tail vein injection medium group.③ remifentanil group, remifentanil injection (2 mL·kg·h-1) via tail vein infusion of 4 h. ④ combined group, UCMSC cells injected intravenously via the tail vein and combined with infusion of remifentanil injection solution (2 ml·kg·h-1) continued 4 h. The spinal cord injury (BBB) score was evaluated before and 1 week, 2 weeks, 4 weeks and 6 weeks after transplantation. The modified Tarlov score and the slant plate test were used to evaluate the motor function. The survival and pathology of PKH-26-labeled UCMSC were observed by fluorescence microscopy at 4 weeks after transplantation. HRP (Horse Reddish Peroxidase) was used to analyze the regeneration of nerve fibers in the fourth week. MEP motor evoked potential and SEP somatosensory evoked potential were used to analyze the nerve Physiological recovery.ResultsCompared with UCMSC transplantation group and remifentanil group, UCMSC transplantation group and remifentanil group were better than the control group. There was a small amount of axonal-like structure in the injury area of Rufentini group and UCMSC transplantation group.The syndromes of the syringes were relatively small, and the ganglion-like structure was seen in the combined group. No syringomyelia was found. HE staining, the control group can be seen spinal cord loss and syringomyelia formation, no nerve axon through. The number of HRP-positive nerve fibers and PKH-26 positive cells were the lowest in the control group and the most in the control group, UCMSC transplantation group and remifentanil group were significantly different between the two groups at 4 weeks after transplantation (P<0.05). MEP incubation group> remifentanil group and UCMSC transplantation group> and the difference between the groups were statistically significant (P<0.05); SEP incubation period, control group, remifentanil group and UCMSC group, and the difference was statistically significant (P<0.05).ConclusionRemifentanil may play a role in neuroprotective effects on spinal cord injury. At the same time, UCMSC transplanted with remifentanil can promote the regeneration of neuronal synapses in rats with spinal cord injury and improve the electrophysiological function and limb motor function of rats.
Cord Blood Mesenchymal Stem Cells (UCMSC); Remifentanil; Rat; Spinal cord injury
Q95-33
A
1674-5817(2017)05-0363-09
10.3969/j.issn.1674-5817.2017.05.005
2016-07-11
2017-06-14
李 敏(1983-), 女, 主治医师, 从事主要麻醉学工作。E-mail:liminrftn@163.com
叶 奎, E-mail:maomao111a@126.com

