甘薯淀粉加工废渣生产蛋白饲料的工艺
沈维亮,靳艳玲,丁 凡,余金龙,方 扬,谭 力,易卓林,何开泽,赵 海
(1.中国科学院成都生物研究所,中国科学院环境与应用微生物重点实验室,四川 成都 610041; 2.中国科学院成都生物研究所,环境微生物四川省重点实验室,四川 成都 610041; 3.绵阳市农业科学研究院,四川 绵阳 621000)
甘薯淀粉加工废渣生产蛋白饲料的工艺
沈维亮1,2,靳艳玲1,2,丁 凡3,余金龙3,方 扬1,2,谭 力1,2,易卓林1,2,何开泽1,2,赵 海1,2
(1.中国科学院成都生物研究所,中国科学院环境与应用微生物重点实验室,四川 成都 610041; 2.中国科学院成都生物研究所,环境微生物四川省重点实验室,四川 成都 610041; 3.绵阳市农业科学研究院,四川 绵阳 621000)
以甘薯淀粉加工废渣为原料,研究了以酿酒酵母、产朊假丝酵母以及双菌混合培养生产菌体蛋白的工艺。结果表明:以酿酒酵母为菌种,其最佳培养条件为自然pH值、薯渣含水率75%、培养温度32℃、接种量10%、尿素1.5%、纤维素酶0.5%、异淀粉酶0.5%,薯渣中真蛋白质量分数达12.01%;以产朊假丝酵母为菌种,除尿素添加量为1%外,其利用甘薯渣生产菌体蛋白的最适培养条件与酿酒酵母一致,薯渣中真蛋白质量分数达16.36%;以酿酒酵母和产朊假丝酵母进行混合接种培养时,其最佳接种配比为1∶1,此时薯渣中真蛋白质量分数达18.08%。
甘薯;废渣;菌体蛋白;饲料
我国是世界第一大甘薯生产国,据联合国粮食和农业组织(Food and Agriculture Organization,FAO)统计,2014年我国甘薯产量为7 154万t,占全球甘薯总产量的67%。近年来,我国加工用甘薯的比例逐渐提升,但是目前我国甘薯加工产品种类很少,仍以淀粉、粉丝、粉条等“三粉”加工为主。根据国家甘薯产业技术体系2010~2011年的调查资料分析,北方薯区淀粉加工所占比例为 58.7%,长江中下游薯区和南方薯区分别为44.4% 和31.3%[1]。每加工1 t鲜薯产生2~3 t废渣,其含水量在75%以上,不易储存和运输,若不能有效利用,极易腐败变质而造成环境污染[2-4]。因此,如何开发利用甘薯淀粉加工废渣已经成为当前我国甘薯淀粉行业亟需解决的难题。
同时,我国是一个饲料蛋白资源严重短缺的大国,每年需从国外进口大量豆粕、鱼粉等以填补国内市场的不足[5],利用食品工业废料、农副产品下脚料、农作物秸秆等废弃物资源培养酵母菌、乳酸菌等可饲用菌体蛋白是当前研究开发的热点[6-9],既可变废为宝,解决日益严峻的环境污染问题,又为快速发展的养殖业提供短缺的高蛋白饲料。鉴于此,本研究以甘薯淀粉加工废渣为原料,综合应用酶解与微生物固体培养技术,通过正交试验,获得甘薯渣生产蛋白饲料的最佳工艺,提高甘薯渣中微生物菌体蛋白的含量,为废渣的综合利用提供参考,并为解决甘薯淀粉加工业的环境污染问题开辟新途径。
1 试验材料
1.1 微生物菌种
酿酒酵母(Saccharomycescerevisiae)、产朊假丝酵母(Candidautilis)为本实验室保存菌种。
1.2 原料
甘薯渣由中国科学院成都生物研究所双流中试基地提供。
1.3 试剂
α-淀粉酶购自诺维信公司,标准酶活力为90 KNU/ml,KNU为诺维信液化酶的专有单位,1 KNU的定义在37℃、pH5.6时,每小时水解5.26 g淀粉的酶量;糖化酶购自诺维信公司,标准酶活力为500 AGU/ml,AGU为诺维信糖化酶专有单位,1 AGU的定义是指在25℃、pH4.3标准条件下,每分钟水解1 mmol麦芽糖所需的酶量;纤维素酶购自绵阳禾本生物工程有限公司,CMC滤纸酶活>1 000 U/g,1个纤维素酶活力单位定义是指在50℃、pH4.5条件下,每分钟催化滤纸纤维水解生成1 μmol葡萄糖所需的酶量;果胶酶购自绵阳禾本生物工程有限公司,标准酶活力>1 000 U/ml,1个果胶酶活力单位定义是指在50℃、pH 4.5条件下,每分钟催化果胶多糖水解生成1 μmol还原糖所需的酶量;异淀粉酶购自绵阳禾本生物工程有限公司,标准酶活力>5 000 U/g,1个异淀粉酶活力单位定义是指在50℃、pH 6.5条件下,每分钟催化支链淀粉水解生成1 μmol葡萄糖所需的酶量。
1.4 仪器设备
ELSD 2000高效液相色谱仪:美国奥泰公司;IS-RDS 3恒温培养箱:美国精琪公司;Kjeltec 2200 凯氏定氮仪:丹麦FOSS公司。
2 方法
2.1 测定方法
淀粉含量参照GB/T 5009.9-2008改进后的方法测定[10-11]。色谱条件:采用Aminex HPX-87P糖分析柱,柱温79℃。以超纯水为流动相,控制流速0.6 ml/min,蒸发光检测器温度110℃,载气压力0.32 MPa,进样量20 μl,所得的结果为糖浓度,再除以1.1即为淀粉含量;总灰分参照GB/T 5009.4-2010采用直接灰化法测定[12-13];粗蛋白质参照GB/T 5009.5-2010采用半微量凯氏定氮法测定[12-13];真蛋白测定时先将样品用10%三氯乙酸洗3次,浸出水溶性含氮物,过滤,滤渣烘干,再按照粗蛋白质的测定方法测定滤渣中蛋白氮含量[11,14]。粗纤维参照GB/T 6434-2006采用酸性洗涤纤维法测定[11,13]。
2.2 菌种种子液制备
酵母蛋白胨葡萄糖培养基(YPD)115℃灭菌30 min,冷却至室温后接种菌种,28℃、转速180 r/min培养24 h。
2.3 薯渣菌种培养
除特别说明外,甘薯渣(含水率约75%)中加入0.5%KH2PO4、0.1% α-淀粉酶和0.5%糖化酶,无需灭菌。按10%的接种量加入OD600为1的酵母菌种子液,搅拌均匀,30℃培养3 d。
2.4 酿酒酵母培养条件优化
2.4.1基础培养条件优化
以薯渣的含水率、培养温度、接种量和尿素添加量为考察因素,设计4因素3水平L9(34)正交试验,以优化薯渣生产菌体蛋白的工艺条件,试验设计见表1。

表1 酿酒酵母基础培养条件正交试验因素水平表
2.4.2酶添加优化
以薯渣中真蛋白含量作为考察指标,选择异淀粉酶、纤维素酶、果胶酶为考察因素,设计3因素4水平L16(43)正交试验,以优化酶的添加种类和添加量,试验设计见表2。

表2 酶添加正交试验因素水平表
2.5 产朊假丝酵母培养条件优化
选择培养温度、接种量及尿素添加量为考察因素,设计3因素2水平L4(23)正交试验,以优化产朊假丝酵母的培养条件,试验设计见表3。

表3 产朊假丝酵母培养条件正交试验因素水平表
2.6 数据分析
所有试验数据为3次重复的平均值,采用DPS软件进行数据的统计分析。
3 结果与讨论
3.1 甘薯渣基本成分分析
按照2.1的测定方法,检测了甘薯渣的基本成分,结果见表4。甘薯浆和甘薯渣扫描电镜照见图1。

表4 甘薯渣主要组成成分(干基)

图1 甘薯浆和甘薯渣扫描电镜照
由表4可以看出,甘薯渣中淀粉质量分数高达54.6%,与文献报道一致,根据淀粉提取工艺水平不同,甘薯渣中残余淀粉质量分数一般为41.45%~67.53%[15-17],如直接丢弃将成为污染环境的主要COD来源,如作为培养微生物的原料,能为微生物提供充足碳源维持生长。另外,甘薯渣中粗纤维质量分数也较高,达到了25.42%。如图1所示,在未提取过淀粉的甘薯浆中,淀粉颗粒存在于纤维素、果胶等多糖形成的细胞壁中,而提取淀粉后的甘薯渣中仍残余大量淀粉颗粒,且基本都包埋于堆积的细胞壁中,很难再进一步提取出来。同时,甘薯渣中的蛋白质量分数则很低,仅有2.85%。因蛋白质含量低、粗纤维含量高,导致适口性差、营养价值低,而不适宜直接作为家畜饲料使用。
3.2 酿酒酵母培养条件优化
3.2.1基础培养条件优化
甘薯渣中蛋白质含量较低,为保障微生物在其中快速生长,本研究通过外加尿素的方式为微生物提供氮源,并通过微生物的生长将廉价的无机氮源转化为易于被动物利用的微生物菌体蛋白。根据表1的试验方案考察了以酿酒酵母为菌种时甘薯渣含水率、培养温度、接种量和尿素添加量对产物真蛋白含量的影响。试验结果见表5。
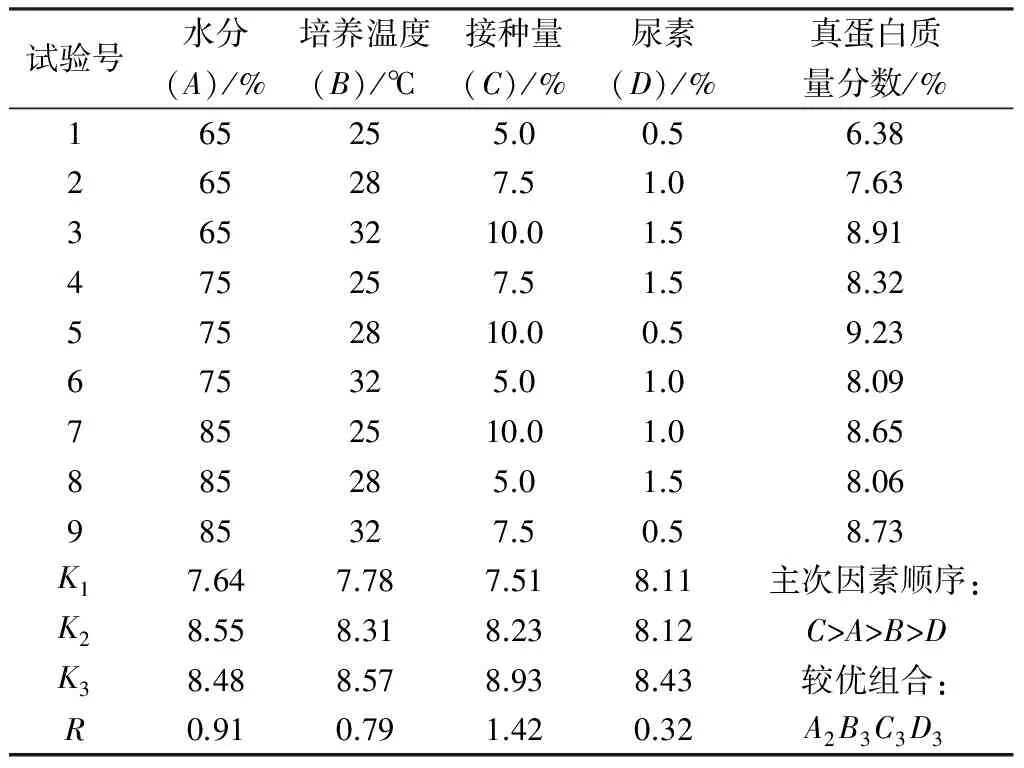
表5 酿酒酵母基础培养条件优化正交试验结果
由表5可见,影响产物真蛋白含量的主次因素顺序为C、A、B、D,即接种量对培养产物中真蛋白含量的影响最大,其次是甘薯渣的含水率和培养温度,二者对蛋白质含量也有显著影响,而尿素的添加量对菌体蛋白生产影响较小,其极差R分别为1.42,0.91,0.79和0.32。各因素的优水平组合为A2B3C3D3,即薯渣含水率75%,培养温度32℃,接种量10%,尿素添加1.5%,在该条件下培养甘薯渣,产物中真蛋白质量分数可达到9.46%。
3.2.2酶添加优化
甘薯渣中剩余的大量的纤维素与果胶具有较强的吸水性与持水性,导致甘薯渣黏度大,培养过程中传质传热困难。此外,甘薯渣中淀粉质量分数高达54.6%,其中75%左右为支链淀粉[18],支链淀粉中的α-1,6-糖苷键不易被糖化酶水解,异淀粉酶能专一性地切开支链淀粉分支点的α-1,6-糖苷键,可剪下整个侧支,形成直链淀粉,有助于淀粉糖化迅速且完全[19]。因此选用异淀粉酶、纤维素酶和果胶酶这三种酶处理薯渣。根据表2的试验方案,考察了异淀粉酶、纤维素酶、果胶酶对产物真蛋白含量的影响。试验结果见表6。
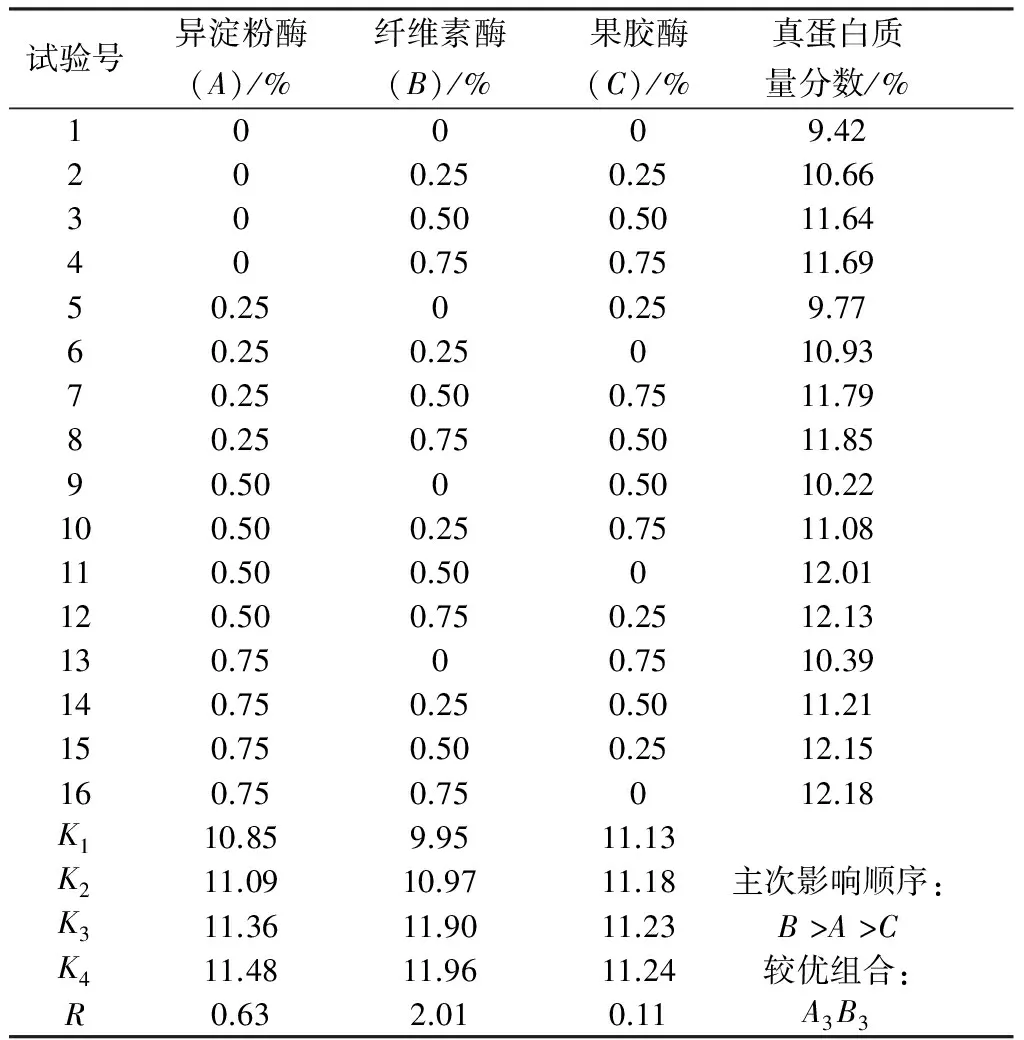
表6 酶添加正交试验结果
由表6可见,从真蛋白含量的R值可以看出,影响真蛋白含量的因素排列顺序为B>A>C,其中,B和A的影响较显著,C则不显著。说明培养过程中纤维素的水解对蛋白质含量影响最大,当纤维素酶添加量为0.5%时最有利于提高培养饲料中的蛋白质含量,一方面与纤维素酶水解纤维素提供易于被微生物利用的葡萄糖有关,另一方面可能与纤维素酶可降低甘薯渣的黏度有关,黏度下降有利于酵母的扩散、传质、传热,使酵母保持较高的活力,从而增加繁殖速度,积累菌体蛋白。基于薯渣中纤维素含量较高这一特点,产纤维素酶的微生物常被研究者采用与酵母菌混合培养。贠建民利用白地霉∶产朊假丝酵母∶酿酒酵母按8∶1.5∶0.5比例接种,混合培养55 h,真蛋白质量分数由培养前的4.08%提高到培养产物中的16.52%[11]。赵华采用黑曲霉、里氏木霉、枯草芽孢杆菌、酿酒酵母四种菌株进行混菌固态培养甘薯渣,粗蛋白质质量分数从6.37%提高到9.75%[20]。虽然产纤维素酶微生物的应用往往可以提高蛋白质含量,但是产酶的稳定性、霉菌产生的霉腐异味、霉菌的食用安全性以及培养步骤和控制条件的复杂性等均易造成饲料品质的不可控。相较之下,本研究的酵母菌加0.5%的纤维素酶和0.5%的异淀粉酶培养,甘薯渣中真蛋白由培养前的2.85%提高到12.01%,增幅达321%,且所用酶制剂价格低廉,效果稳定,在提高饲料蛋白质的同时使产品品质更有保证。另外,异淀粉酶对培养饲料中蛋白质含量的影响也较大,R值为0.63,而果胶酶的影响则相对较小。由极差分析结果所得的最优水平为A4B4C4,因为最优组合A4B4C4中酶的使用种类最多,使用量也最大,而蛋白质产量较组合A3B3无显著优势,因此,综合成本和蛋白质产量考虑,我们选择A3B3即0.5%的纤维素酶和0.5%的异淀粉酶为最适酶添加组合。
综上所述,酿酒酵母的最佳培养条件为:甘薯渣含水率75%,培养温度32℃,接种量10%,尿素添加1.5%,同时添加0.5%的纤维素酶和0.5%的异淀粉酶,其培养产物中真蛋白质量分数达到12.01%。
3.3 产朊假丝酵母培养条件优化
根据以上试验,确定了酶处理甘薯渣的最佳添加组合为分别添加0.5%的纤维素酶和异淀粉酶,以及甘薯渣固态培养的最适含水率为75%,在此基础上,按L4(23)正交设计,研究了产朊假丝酵母在不同培养温度、接种量及尿素添加量条件下对甘薯渣中真蛋白含量的影响,结果见表7。

表7 产朊假丝酵母培养条件正交试验结果
表7结果显示,以产朊假丝酵母单菌培养时影响甘薯渣真蛋白含量的主次因素顺序为:培养温度、接种量、尿素添加量,其极差R分别为2.05、1.1 和0.38。优选方案培养温度为32℃,接种量为10%,尿素添加量为1%,产物真蛋白质量分数最高,为16.36%,高于酿酒酵母的真蛋白产量。
3.4 双菌混合培养
以上单一菌种培养试验表明,不同菌种对甘薯渣的真蛋白产量有不同影响。产朊假丝酵母的培养产物中真蛋白含量最高,但其风味欠佳,培养后具有强烈的腐臭味,酿酒酵母的真蛋白产量次之,但培养后产物具有怡人的醇香和酯香味。为了兼顾蛋白质含量和风味,对上述两种酵母混合接种进行了研究。根据对酿酒酵母及产朊假丝酵母最优培养条件比较分析后确定的适宜条件为:甘薯渣含水率75%,培养温度32℃,尿素1%,纤维素酶0.5%和异淀粉酶0.5%。在此基础上,以总接种量为10%设定了3个菌种配比:a(产朊假丝酵母∶酿酒酵母为4∶1),b(产朊假丝酵母∶酿酒酵母为1∶1)和c(产朊假丝酵母∶酿酒酵母为1∶4)。
双菌不同接种比例对甘薯渣真蛋白含量的影响见图2。
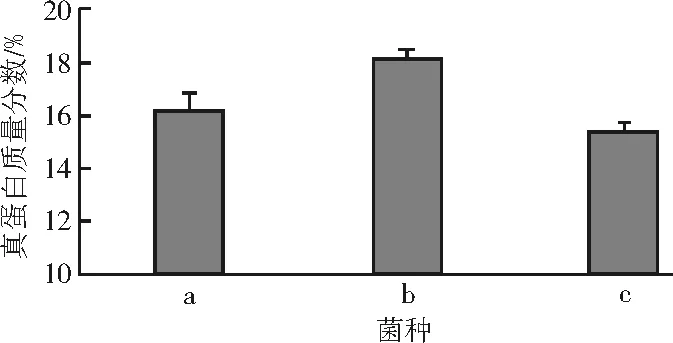
图2 双菌不同接种比例对甘薯渣真蛋白含量的影响
结果显示,由于不同菌种组合中两种菌的配比不同,使得组合固态培养甘薯渣的分解利用能力有所差异,只有组合b产物真蛋白含量高于单菌种培养的最高真蛋白含量。在产物风味方面,a无醇香味且有显著腐臭味,b略有一些腐味,c有少许的醇香味。因此,在实际生产中以总蛋白产量为主时,可以双菌混合培养或者为简化工序仅接种产朊假丝酵母;以酿酒酵母为菌种时,则总蛋白产量稍少,但有良好的醇香风味。
4 结论
(1)通过正交试验确定酿酒酵母的最佳培养条件为:甘薯渣含水率75%,培养温度32℃,接种量10%,尿素1.5%,纤维素酶0.5%,异淀粉酶0.5%,其培养产物中真蛋白质量分数达到12.01%,且具有醇香风味。
(2) 产朊假丝酵母最佳培养条件为:甘薯渣含水率75%,培养温度32℃,接种量10%,尿素1%,纤维素酶0.5%,异淀粉酶0.5%,其培养产物中真蛋白质量分数达到16.36%,但风味略差。
(3)当产朊假丝酵母∶酿酒酵母为1∶1时,培养产物真蛋白质量分数最高,达18.08%,且可兼顾风味及蛋白质产量。
[1] 马代夫,李 强,曹清河,等.中国甘薯产业及产业技术的发展与展望[J].江苏农业学报,2012,28(5):969-973.
[2] 马代夫.我国甘薯产业发展若干问题的思考[J].农业工程技术,2013(11):21-24.
[3] MAYER F,HILLEBRANDT J O.Potato pulp:microbiological characterization,physical modification,and application of this agricultural waste product[J].Applied Microbiology and Biotechnology,1997,48(4):435-440.
[4] 岳昌海,朱许慧,侯文贵,等.甘薯渣酒精培养条件优化[J].化学工业与工程,2011,28(2):49-54.
[5] 祖国仁,刘 阳,陈 辉,等.利用白酒糟生产高蛋白饲料的研究[J].大连轻工业学院学报,1999,18(1):44-47.
[6] IRENE P,RUBEN M,HAGERager T J.Lactic acid production using waste generated from sweet potato processing[J].International Journal of Food Science and Technology,2014,49:641-649.
[7] RAJESH N,PAUL R R.Value addition of vegetable wastes by solid-state fermentation using aspergillus niger for use in aquafeedindustry[J].Waste Management,2010,30(11):2 223-2 227.
[8] GELINAS P.Protein enrichment of potato processing waste through yeast fermentation[J].Bioresource Technology,2007(98):1 138-1 143.
[9] ADELIA C,BOWELL B.Sweet potato:a review of its past,present,and future role in human nutrition[J].Advanced in Food and Nutrition Research,2007,52:1-59.
[10] 刘 勇,龚月生.苹果渣培养生产蛋白饲料的研究[J].中国饲料,2006(13):38-40.
[11] 贠建民,刘陇生,安志刚,等.马铃薯淀粉渣生料多菌种固态培养生产蛋白饲料工艺[J].农业工程学报,2010,26(2):399-404.
[12] 赵凤敏,李树君,方宪法.马铃薯薯渣固态培养制作蛋白饲料的工艺研究[J].农业机械学报,2006(8):35-37.
[13] 刘雪莲,杨希娟,孙小凤,等.固态培养马铃薯渣生产菌体蛋白饲料的研究[J].中国酿造,2009,203(2):115-117.
[14] 胡艳丽,王克然.饲料中真蛋白的测定[J].河南畜牧兽医综合版,2007,28:31-33.
[15] 单成俊,周剑忠,黄开红,等.挤压膨化提高甘薯渣中可溶性膳食纤维含量的研究[J].江西农业学报.2009,21(6):90-91.
[16] 刘惠知,王升平,周映华,等.红薯渣及其利用[J].饲料博览,2013(7):41-43.
[17] 曹健生,陈其恒,和云萍.甘薯粉渣的营养成分含量及再利用研究[J].安徽农业科学,2014,42(26):9 174-9 175.
[18] SIDEBOTTOM C,KIRKLAND M,STRONGIHARM B,et al.Characterization of the difference of starch branching enzyme activities in normal and low-amylopectin maize during kernel development[J].Journal of cereal science,1998,27(3):279-287.
[19] 王晓燕,廖昌珑,杨云娟,等.异淀粉酶在饲料工业中的应用价值[J].饲料研究,2010(4):15-17.
[20] 赵 华,王雪涛,汤加勇,等.复合益生菌固态培养改善甘薯渣营养价值的研究[J].动物营养学报,2015,27(4):1 191-1 198.
Proteinfeedpreparationtechnologyfromsweetpotatoresidue
SHEN Wei-liang1,2,JIN Yan-ling1,2,DING Fan3,YU Jin-long3,FANG Yang1,2,TAN Li1,2,YI Zhuo-lin1,2,HE Kai-ze1,2,ZHAO Hai1,2
(1.Key Laboratory of Environmental and Applied Microbiology,Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu 610041,China;2.Environmental Microbiology Key Laboratory of Sichuan Province,Chengdu 610041,China;3.Mianyang Institute of Agricultural Science,Mianyang 621000,China)
Sweetpotato starch residue was used as the raw material to investigate the culture technology for protein production bySaccharomycescerevisiae,Candidautilisand the mixed strains.The results showed that the optimized culture conditions forSaccharomycescerevisiaewere as follows:natural pH,moisture content of sweetpotato residue75%,culture temperature 32℃,inoculum 10%,urea 1.5%,cellulase 0.5%,isoamylase 0.5%.Under these optimized conditions,true protein content in sweetpotato residue reached 12.01%.The optimized culture conditions forCandidautiliswere similar as that ofSaccharomycescerevisiaeexcept urea content (1%),true protein content in sweetpotato residue reached 16.36%.When the mixed strains were used,the optimized inoculation proportion was 1∶1,and the protein content in sweetpoato residue reached 18.08%.
sweetpotato;residue;microbial protein;feed
2017-09-13;
2017-11-28
现代农业产业技术体系建设专项(CARS-10-B22)、中国科学院环境与应用微生物重点实验室/环境微生物四川省重点实验室开放研究基金(Y1D5031101)。
沈维亮(1982-),男,博士,助理研究员,研究方向为甘薯产后加工。
靳艳玲(1981-),女,博士,副研究员,主要研究以生化技术进行甘薯产后加工。
10.7633/j.issn.1003-6202.2017.12.011
S816.9
A
1003-6202(2017)12-0041-05
梅竹)

