自身免疫性胰腺炎合并胰管结石一例并文献复习
孙晖 辛磊 王雷 刘晓 廖专 李兆申
自身免疫性胰腺炎合并胰管结石一例并文献复习
孙晖 辛磊 王雷 刘晓 廖专 李兆申
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是由自身免疫介导的一种特殊类型的慢性胰腺炎(chronic pancreatitis,CP)[1-2],约占所有CP的2%[3]。AIP的组织学亚型分为1型和2型[4],以淋巴细胞及浆细胞浸润为主要病理特征[5],主要影像学特征包括局灶性或弥漫性胰腺增大、主胰管不规则狭窄[6]。其临床表现无特异性,包括梗阻性黄疸[7]、腹部不适、体重减轻、新发或加重的糖尿病等[8]。近年来对AIP的报道日渐增多,但有关AIP合并胰管结石的病例却仍少见。为进一步总结其临床特征,现报道长海医院诊治的1例AIP合并胰管结石患者,并复习相关文献。
一、病例资料
患者男,61岁。因“上腹痛1月余,皮肤巩膜黄染2周”入院。1个月前无明显诱因出现上腹持续性钝痛,进食后加重,无放射痛,无恶心、呕吐,无寒战、发热,无皮肤、巩膜黄染。当地医院查血淀粉酶240 U/L,CT提示胰腺体积增大伴周围少量渗出、胆总管胰内段炎症,按“急性胰腺炎”行非手术治疗后好转出院。数天后患者出现皮肤、巩膜黄染伴阵发性腹痛,当地医院查总胆红素181.8 μmol/L、直接胆红素151.7 μmol/L、谷丙转氨酶189 U/L、谷草转氨酶85 U/L。PET-CT示胰腺形态饱满,FDG摄取明显升高,考虑炎性病变,AIP可能性大。入院后查IgG4 5.5 g/L(正常值<2 g/L),诊断为1型AIP、IgG4相关性硬化性胆管炎。完善检查后行ERCP+胆管支架置入术(置入10F塑料支架),并口服醋酸泼尼松40 mg/d,4周后每2周减量5 mg,黄疸等症状逐渐缓解。2个月后当醋酸泼尼松减量至10 mg/d时患者再次出现皮肤黄染伴瘙痒,再次行ERCP+胆管支架置入术,并调整口服醋酸泼尼松至20 mg/d,加用硫唑嘌呤50 mg/d,缓慢减量,黄疸逐渐消退。5个月后患者再次出现皮肤黄染,再次调整醋酸泼尼松至30 mg/d+硫唑嘌呤75 mg/d,待黄疸消退后逐渐减少醋酸泼尼松用量至5 mg/d,患者无明显不适,定期查肝功能等均无明显异常。4个月后复查胰腺CT示胰腺萎缩、胰管多发结石。行胰管结石体外冲击波碎石术(extracorporeal shock wave lithotripsy,ESWL)2次(共10 000次震波,治疗能级5级),随访至今无明显不适症状。
二、文献复习
以“自身免疫性胰腺炎”、“胰管结石”等中英文关键词在PubMed、OVID、EBSCO、sciencedirect、万方、中国知网等数据库检索,最后筛选出3篇相关的报道,共190例AIP患者[9-11]。
190例患者在AIP诊断后随访76至91个月,其中55例(28.9 %)患者新发胰管结石。合并胰管结石的55例患者以男性为主(85.5%),36例(65.5%)有长期饮酒史,初始诊断AIP时影像学检查提示局灶型和弥漫型AIP分别为21例和34例,45例(81.8%)伴有胰管狭窄。51例(92.7%)接受激素治疗,19例(34.5%)出现一次或多次复发(表1)。
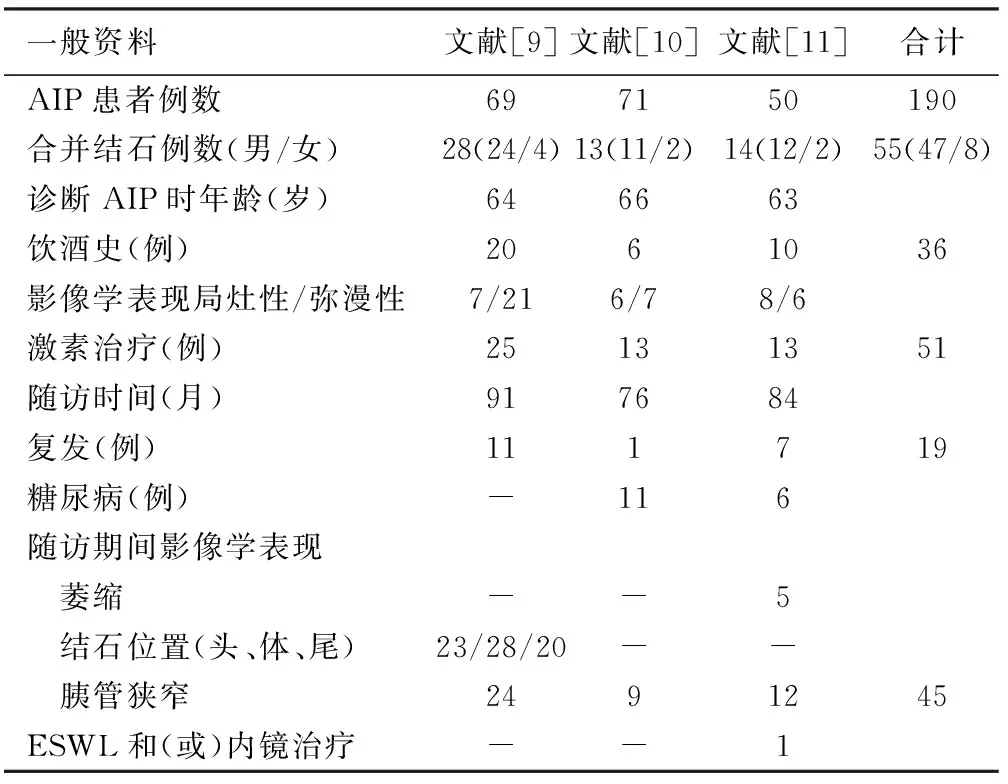
表1 190例AIP患者相关资料
注:-:资料缺失
讨论AIP是一种特殊类型的CP,但既往研究多认为AIP很少合并胰管结石[12-13]。笔者报道的此例AIP患者,首次发病时影像学检查提示胰腺形态饱满,未见结石,行ERCP治疗置入胆管支架,并给予激素治疗后相关症状缓解。此后病情多次复发,反复调整激素及免疫抑制剂用量,在起病25个月后影像学检查提示胰腺萎缩、胰管结石,并予以ESWL治疗。近来国外也有AIP合并胰管结石的报道,本研究复习3篇文献,总结190例AIP患者,随访76~91个月,有55例(28.9%)出现胰管结石。这提示随着随访时间延长,AIP患者出现结石的情况并非少见。
胰管结石是CP典型的病理学特征,是胰腺组织损伤不断进展的产物[14]。AIP经典的病理学特征是淋巴细胞与浆细胞显著浸润,伴有胰腺纤维化,以早期胰腺肿胀增大、晚期胰腺实质广泛纤维化从而导致胰腺萎缩和硬化为主要特点[15]。对AIP合并胰管结石的发病机制尚无定论,可能是由于受累胰腺导管狭窄或闭塞导致胰液中某些蛋白质分泌异常[16],胰液引流不畅,继而引起胰管结石形成,同时多次疾病复发更增加了胰管结石形成的风险[17]。其次,患者自身遗传因素及生活习惯(如饮酒、吸烟)等也可能与病程中结石的形成密切相关。
对AIP发生胰管结石的危险因素亦无定论。就AIP不同亚型而言,有研究发现,合并胰管结石的患者均为1型AIP,2型AIP患者未见胰管结石形成[9,18-20]。长期饮酒史是普通CP发生胰管结石的危险因素[18,21],本研究纳入的3篇报道中,合并结石患者有36例(65.4%)有嗜酒史,提示酒精摄入也可能增加AIP患者发生胰管结石的风险。但Maruyama等[9]研究认为,酒精摄入并非其危险因素,而Hirano等[10]的研究对酒精摄入量进行量化,多因素分析表明1型AIP患者酒精摄入量>50 g/d是胰管结石形成的独立危险因素(OR7.47;P=0.040)。AIP病情复发也是结石形成的潜在危险因素,笔者报道的病例在31个月内复发2次,所复习的55例患者中有19例也在激素治疗后复发。Takayama等[12]的研究发现11例复发患者中有6例(54.5%)形成了胰管结石,与非复发患者相比,胰管结石的形成与复发显著相关(P=0.0019),并且AIP可以在多次复发后发展成CP。Hart 等[20]发现AIP患者中也有7%出现了胰管结石,并且复发的患者比无复发的患者,更容易形成胰管结石(P<0.001)。此外,胰管不同程度的阻塞和胰液的淤滞亦是胰管结石形成的重要危险因素[22]。据Maruyama等[9]多因素分析证实,胰管狭窄是AIP中胰管结石形成的重要独立危险因素(OR4.4,P=0.019),同时他们也发现少数患者在胰腺体、尾区胰管狭窄,但却在胰头出现胰管结石。因此,尚不能将所有结石的形成归结为胰液引流不畅所致。
对AIP合并胰管结石的治疗与普通CP合并胰管结石相似。现有报道均采用单纯ESWL或ESWL联合ERCP治疗[23]。Maruyama等[23]研究发现,与CP合并胰管结石相比,AIP合并结石的患者常在胰管结石附近存在胰管狭窄,并且从主胰管中成功取石的比例较低[24]。在其研究发现,AIP中胰管结石周围的胰管狭窄更明显,这与普通CP中广泛分布的胰管狭窄不同,在这样的AIP患者中,ESWL中击碎的结石有时可能难以通过周围狭窄的胰管,同样也会降低内镜治疗的疗效。该研究还认为老年AIP患者合并胰管结石,其临床症状较少。因此,为避免治疗相关风险,老年患者、无疼痛症状患者以及胰管结石周围胰管狭窄者均不建议积极行ESWL和内镜治疗。
[1] Yoshida K,Toki F,Takeuchi T,et al.Chronic pancreatitis caused by an autoimmune abnormality.Proposal of the concept of autoimmune pancreatitis[J].Dig Dis Sci,1995,40(7):1561-1568.
[2] Okazaki K, Uchida K. Autoimmune Pancreatitis: The Past, Present, and Future[J]. Pancreas, 2015,44(7):1006-1016.DOI: 10.1097/MPA.0000000000000382.
[3] Paik WH, Ryu JK, Park JM, et al. Clinical and pathological differences between serum immunoglobulin G4-positive and negative type 1 autoimmune pancreatitis[J]. World J Gastroenterol, 2013,19(25):4031-4038.DOI: 10.3748/wjg.v19.i25.4031.
[4] Ikeura T, Manfredi R, Zamboni G, et al. Application of international consensus diagnostic criteria to an Italian series of autoimmune pancreatitis[J]. United European Gastroenterol J, 2013,1(4):276-284.DOI: 10.1177/2050640613495196.
[5] 《中华胰腺病杂志》编委会. 我国自身免疫性胰腺炎共识意见(草案2012,上海)[J]. 中华胰腺病杂志, 2012,12(6):410-418.DOI: 10.3760/cma.j.issn.1674-1935.2012.06.017.
[6] Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology[J]. Pancreas, 2011,40(3):352-358.DOI: 10.1097/MPA.0b013e3182142fd2.
[7] Gardner TB, Chari ST. Autoimmune pancreatitis[J]. Gastroenterol Clin North Am, 2008,37(2):439-460.
[8] Maire F, Le Baleur Y, Rebours V, et al. Outcome of patients with type 1 or 2 autoimmune pancreatitis[J]. Am J Gastroenterol, 2011,106(1):151-156.DOI: 10.1038/ajg.2010.314.
[9] Maruyama M, Arakura N, Ozaki Y, et al. Risk factors for pancreatic stone formation in autoimmune pancreatitis over a long-term course[J]. J Gastroenterol, 2012,47(5):553-560.DOI: 10.1007/s00535-011-0510-y.
[10] Hirano K, Tada M, Isayama H, et al. High alcohol consumption increases the risk of pancreatic stone formation and pancreatic atrophy in autoimmune pancreatitis[J]. Pancreas, 2013,42(3):502-505.
[11] Matsubayashi H, Kishida Y, Iwai T, et al. Transpapillary biliary stenting is a risk factor for pancreatic stones in patients with autoimmune pancreatitis[J]. Endoscopy International Open, 2016, 04(08):E912-E917.DOI:10.1055/S-0042-111201.
[12] Takayama M, Hamano H, Ochi Y, et al. Recurrent attacks of autoimmune pancreatitis result in pancreatic stone formation[J]. Am J Gastroenterol, 2004,99(5):932-937.
[13] Kawa S, Hamano H, Ozaki Y, et al. Long-term follow-up of autoimmune pancreatitis: characteristics of chronic disease and recurrence[J]. Clin Gastroenterol Hepatol, 2009,7(11 Suppl):S18-S22.DOI: 10.1016/j.cgh.2009.07.041.DOI: 10.1016/j.cgh.2009.07.041.
[14] Lankisch PG, Otto J, Erkelenz I, et al. Pancreatic calcifications: no indicator of severe exocrine pancreatic insufficiency[J]. Gastroenterology, 1986,90(3):617-621.
[15] Finkelberg DL, Sahani D, Deshpande V, et al. Autoimmune pancreatitis[J]. N Engl J Med, 2006,355(25):2670-2676.
[16] Hart PA, Zen Y, Chari ST. Recent Advances in Autoimmune Pancreatitis[J]. Gastroenterology, 2015,149(1):39-51.DOI: 10.1053/j.gastro.2015.03.010.
[17] Maruyama M, Watanabe T, Kanai K, et al. Autoimmune pancreatitis can develop into chronic pancreatitis[J]. Orphanet J Rare Dis, 2014,9:77.DOI: 10.1186/1750-1172-9-77.
[18] Vonlaufen A,Wilson JS,Apte MV.Molecular mechanisms of pancreatitis: current opinion[J].J Gastroenterol Hepatol,2008,23(9):1339-1348.DOI:10.1111/j.1440-1746.2008.05520.x.
[19] Uchida K, Yazumi S, Nishio A, et al. Long-term outcome of autoimmune pancreatitis[J]. J Gastroenterol, 2009,44(7):726-732.DOI: 10.1007/s00535-009-0049-3.
[20] Hart PA, Kamisawa T, Brugge WR, et al. Long-term outcomes of autoimmune pancreatitis: a multicentre, international analysis[J]. Gut, 2013,62(12):1771-1776.DOI: 10.1136/gutjnl-2012-303617.
[21] Cavallini G, Talamini G, Vaona B, et al. Effect of alcohol and smoking on pancreatic lithogenesis in the course of chronic pancreatitis[J]. Pancreas, 1994,9(1):42-46.
[22] Xin L, He YX, Zhu XF, et al. Diagnosis and treatment of autoimmune pancreatitis: experience with 100 patients[J]. Hepatobiliary Pancreat Dis Int, 2014,13(6):642-648.
[23] Maruyama M, Watanabe T, Kanai K, et al. Extracorporeal shock wave lithotripsy treatment of pancreatic stones complicated with advanced stage autoimmune pancreatitis[J]. BMC Gastroenterol, 2015,15:28.DOI: 10.1186/s12876-015-0255-9.
[24] Buijs J, Cahen DL, van Heerde MJ, et al. The Long-Term Impact of Autoimmune Pancreatitis on Pancreatic Function, Quality of Life, and Life Expectancy[J]. Pancreas, 2015,44(7):1065-1071.
10.3760/cma.j.issn.1674-1935.2017.06.014
200433 上海,第二军医大学长海医院消化内科
李兆申,Email: zhaoshen-li@hotmail.com
2017-05-31)
冀凯宏)

