胰腺分裂伴胰腺炎并发胰腺假性囊肿一例并文献复习
崔光星 杨建锋 金杭斌 顾伟刚 程思乐 张筱凤
胰腺分裂伴胰腺炎并发胰腺假性囊肿一例并文献复习
崔光星 杨建锋 金杭斌 顾伟刚 程思乐 张筱凤
胰腺分裂(pancreas divisum, PD)是因胚胎发育过程中腹胰管与背胰管融合失败所致,是胰管发育过程中最常见的先天变异。少部分PD个体可伴发急性复发性胰腺炎、慢性胰腺炎或胰型腹痛。内镜逆行性胰胆管造影(ERCP)为首选诊断方法。胰腺假性囊肿是重症急性胰腺炎或胰腺外伤的并发症,多在急性胰腺炎发作后4周形成,外科手术或内镜引导下引流为主要治疗方式。临床上,PD继发胰腺炎合并胰腺假性囊肿并不多见。杭州市第一人民医院诊治了1例青少年PD合并胰腺假性囊肿患者,又检索“PubMed”、万方全文数据库、维普科技期刊数据库、中国知网全文数据库,剔除重复、资料不全文献,共得到8篇PD合并胰腺假性囊肿的英文文献,对此进行回顾性分析。
一、病例资料
患者男,16岁。因“上腹痛1年,发现胰腺囊肿4月”入我院。患者1年前无明显诱因出现中上腹持续性剧烈胀痛,并放射至腰背部,恶心、呕吐,呕吐后腹痛不缓解。于当地三级医院住院治疗,查血清淀粉酶明显升高,腹部CT示“胰腺炎,腹腔积液”,诊断为“重症急性胰腺炎”,给予对症治疗后好转出院。出院后定期复查腹部超声未见异常。4个月前腹部B超检查发现胰尾部、脾脏与左肾之间囊实性包块,考虑“胰腺囊腺瘤”;腹部CT示“胰腺假性囊肿”,大小约6.0 cm×4.0 cm。因患者无任何不适,未予特殊处理。20 d前上腹部B超提示囊肿增大,大小约6.8 cm×6.2 cm,为进一步治疗于2011年6月30日收治我院。体检:皮肤巩膜无黄染,全腹无压痛、反跳痛及肌紧张,左上腹可触及囊实性肿块,压之不适。实验室检查:血清淀粉酶64 U/L,肝肾功能、电解质、血脂、自身抗体、CA19-9、CEA等均在正常范围。MRCP示胰胆管正常,胰尾部囊性病灶,大小约6.2 cm×5.6 cm。2 d后内镜超声(EUS)检查见轻度胃底静脉曲张、胰尾部囊肿,即在EUS引导下行囊肿穿刺引流术,囊液检测淀粉酶含量70 000 U/L,术后囊肿明显缩小。术后4 d B超见囊肿再次增大,约6.2 cm×5.8 cm,考虑囊肿与胰管相通,故行ERCP。术中见主乳头半圆形,插管造影仅胰管头端显影;副乳头插管造影见副胰管显影至胰尾部,于是切开副乳头0.5 cm,副胰管内置入长6 cm、直径5 Fr猪尾塑料内支架。ERCP诊断:完全性胰腺分裂症,胰腺假性囊肿。术后恢复顺利并出院。2个月后在ERCP下更换支架。3个月后再行ERCP,见内支架引流通畅,无移位、脱落,造影见副胰管扩张,再置入长6 cm、直径4 Fr内支架,行副胰管双支架内引流。5个月后再行ERCP拔除两支架,副乳头插管造影见造影剂排空良好。术后MRCP示胆胰管显示良好,粗细均匀,胰尾部小圆形长T2信号影,约1.2 cm×1.0 cm,结合病史考虑假性囊肿可能。患者出院后随访至今45个月,腹痛未再复发,胰腺假性囊肿消失。
二、结合文献复习(表1)
1.临床资料:本组1例加文献报道[1-8]8例共9例患者,其中男性6例,女性3例,男女比为2∶1。年龄8~50岁,平均26岁。首发症状均为急性胰腺炎表现,如腹痛、腹胀,伴恶心、呕吐等。病因中6例与PD明确相关,余3例中2例为创伤性胰腺炎,1例既往有大量饮酒史,不能明确PD与胰腺炎相关性。假性囊肿最大直径2.5~19.6 cm,平均9.2 cm;囊肿位于胰头部2例,颈部1例,体尾部4例,2例未提及。5例囊肿与主胰管相通,4例囊肿与主胰管不相通。
2.诊断:结合胰腺炎病史及影像学检查,诊断胰腺假性囊肿并不困难。其中8例通过ERCP明确诊断,1例通过MRCP做出诊断。
3.治疗及随访:假性囊肿与主胰管相通的5例患者中4例行内镜下治疗,1例行外科手术;不相通的4例患者中2例行内镜治疗,2例行外科干预。无手术相关并发症出现,术后症状缓解率达100%。5例随访资料完整,随访3~45个月,平均19.2个月,假性囊肿均明显缩小甚至消失,仅1例1年后再发胰腺炎,经非手术治疗后治愈。
讨论胰腺假性囊肿是胰腺炎的并发症,亦可由外伤引起,发生率为5%~15%[9]。囊肿多位于胰体尾部,诊断并不困难。多数囊肿经非手术治疗后可自行吸收。若囊肿持续存在6周以上,进行性增大到直径≥6 cm,囊肿压迫出现症状或合并感染、出血时需手术治疗。手术方法主要有外科内引流术(如囊肿空肠Roux-en-Y吻合术),内镜引流术(如内镜下经胃囊肿穿刺引流术[10],E-CG),经皮穿刺置管外引流术等。E-CG经过近30年的发展,已成为假性囊肿的首选治疗方式,尤其是超声内镜的发明极大地降低了出血风险、提高了成功率。
PD的发生率约为10%。多数PD者无症状。当PD存在副乳头狭窄致背侧胰管胰液排出受阻、胰管呈高压状态时可导致胰腺炎,少部分可继发复发性胰腺炎、慢性胰腺炎或慢性腹痛,称之为症状性PD。
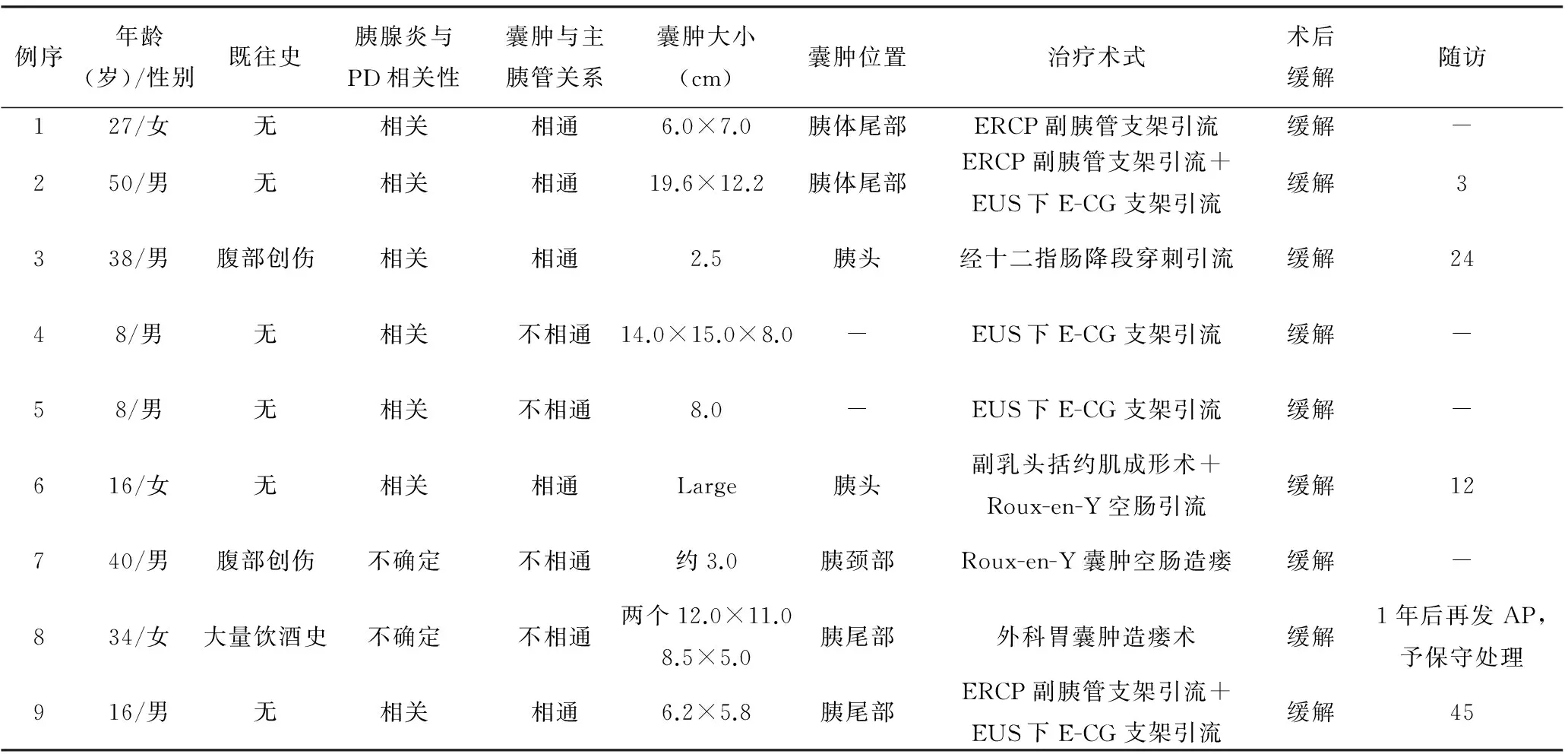
表1 9例患者的临床资料
注:-:无资料
ERCP是诊断PD的金标准,表现为[11](1)主乳头插管造影见腹侧胰管短小,呈马尾状或树枝状分布,长度通常在1~4 cm,且不超过腹中线,而胰体尾部胰管无显影;(2)副乳头插管造影可见贯穿全胰腺的背侧胰管,与腹侧胰管间无交通支则为完全性PD,若存在纤细的交通支则为不完全性PD。无症状PD无需处理;症状性PD的干预手段主要有内镜治疗与外科手术。Liao等[12]的一项系统性回顾研究报道,症状性PD患者内镜与外科治疗缓解率分别为69.4%和74.9%,差异无统计学意义(P=0.106)。内镜治疗因创伤小、并发症低,目前已成为症状性PD的首选。常用的内镜治疗技术有副乳头括约肌切开术、副胰管支架置入术及副乳头括约肌切开联合副胰管支架置入术等。不同症状性PD对于内镜治疗敏感性存在明显差异,PD伴反复发作性胰腺炎的内镜治疗缓解率优于PD伴慢性胰腺炎(81.2%比68.8%,P<0.05)及PD伴胰型腹痛(81.2%比53.1%,P<0.05)[4]。内镜治疗效果不佳者,可再行外科手术,常见的术式有经十二指肠副乳头切开成形术、副胰管空肠侧侧吻合术、胰腺部分或全切术等。
PD伴胰腺炎合并假性囊肿国内尚无相关报道,国外报道也不多,其原因可能为(1)PD个体多无症状,仅少数伴发胰腺炎;(2)假性囊肿多为重症胰腺炎或急性胰腺创伤的并发症;(3)半数以上囊肿可自行吸收,仅少数需要手术干预。
PD合并假性囊肿的诊断基于既往有胰腺炎病史,并排除胆石症、嗜酒、高钙血症、高脂血症、创伤及药物等多见病因;腹部B超、CT等影像学检查提示胰腺囊肿;通过ERCP诊断出PD。
PD合并假性囊肿的治疗主要有内镜与外科手术。内镜治疗首先需明确PD是否为胰腺炎的病因,还需判断假性囊肿与主胰管是否相通。若PD明确为胰腺炎病因且假性囊肿与主胰管互通,则需“双管齐下”,即同时处理假性囊肿及PD所致的副胰管高压状态。ERCP下副胰管引流为必备措施[1-3],即一旦副乳头引流通畅,囊肿很可能消退,而E-CG促进了囊肿缩小;反之,若假性囊肿与主胰管不相通,则E-CG引流囊肿为必要条件。是否引流副胰管取决于胰管高压状态,如副乳头形态无异且引流通畅则可暂不处理[4-5];副乳头肿大且引流不畅者则需行背侧胰管引流。术前判断囊肿与主胰管是否相通较为困难,常先行E-CG,根据术后囊肿体积的变化,再予判断[5]。本例患者先在EUS引导下行E-CG,数日后B超复查见囊肿复大如初,推断其与主胰管相通,故行ERCP并诊断出PD,行副乳头切开及副胰管支架引流。术后随访见囊肿明显缩小,并于6个月后再行ERCP下双支架引流,长期随访至今,腹痛未再复发,胰腺假性囊肿消失。外科手术常见术式有经十二指肠副乳头括约肌成形术联合Roux-en-Y空肠引流、Roux-en-Y下囊肿空肠造瘘、胃壁囊肿造瘘等,亦获得较好的缓解率[6-8],然而其创伤较大且可能导致消化道改道(如Roux-en-Y术式),故可作为内镜治疗无效时的替代治疗。
[1] Gold RP, Berman H, Fakhry J, et al. Pancreas divisum with pancreatitis and pseudocyst[J]. Am J Roentgenol, 1984, 143(6): 1352-1353.
[2] Arifuddin R, Baichi M, Ullah A. Pancreatic pseudocysts and a cyst-duodenal fistula complicating severe necrotizing pancreatitis from pancreas divisum[J]. Dig Dis Sci, 2007,52(11): 3143-3144. DOI: 10.1007/s10620-006-9403-y.
[3] Chryssou EG, Prassopoulos P, Mouzas J, et al. The course of traumatic pancreatitis in a patient with pancreas divisum: a case report[J]. BMC Gastroenterol, 2003, 3: 4.
[4] Makin E, Harrison PM, Patel S, et al. Pancreatic pseudocysts in children: treatment by endoscopic cyst gastrostomy[J]. J Pediatr Gastroenterol Nutr, 2012, 55(5): 556-558.DOI: 10.1097/MPG.0b013e3182574fc9.
[5] Jazrawi SF, Barth BA, Sreenarasimhaiah J. Efficacy of endoscopic ultrasound-guided drainage of pancreatic pseudocysts in a pediatric population[J]. Dig Dis Sci, 2011, 56(3): 902-908.DOI: 10.1007/s10620-010-1350-y.
[6] Tuggle DW, Smith EI. Pancreas divisum, pancreatic pseudocyst, and choledochal cyst in an 8-year-old child[J]. J Pediatr Surg, 1989, 24(1): 52-53.
[7] Portis M, Meyers P, Mcdonald JC, et al. Traumatic pancreatitis in a patient with pancreas divisum: clinical and radiographic features[J]. Abdom Imaging, 1994, 19(2): 162-164.
[8] Mukherrjee K, Melvin WV. Pancreatic pseudocyst in the setting of chronic pancreatitis and pancreas divisum[J]. Am Surg, 2008, 74(8): 755-757.
[9] Poornachandra KS, Bhasin DK, Nagi B, et al. Clinical, biochemical, and radiologic parameters at admission predicting formation of a pseudocyst in acute pancreatitis[J]. J Clin Gastroenterol, 2011, 45(2): 159-163. DOI: 10.1097/MCG.0b013e3181dd9d14.
[10] Kozarek RA, Brayko CM, Harlan J, et al. Endoscopic drainage of pancreatic pseudocyts[J]. Gastrointest Endosc, 1985,31(5):322-328.
[11] Lehman GA, Sherman S. Diagnosis and therapy of pancreas divisum[J]. Gastrointest Endosc Clin N Am, 1998, 8(1): 55-77.
[12] Liao Z, Gao R, Wang W, et al. A systematic review on endoscopic detection rate, endotherapy, and surgery for pancreas divisum[J]. Endoscopy, 2009, 41(5): 439-444.DOI: 10.1055/s-0029-1214505.
10.3760/cma.j.issn.1674-1935.2017.06.013
310000 杭州,杭州市第一人民医院消化内科
张筱凤 Email:zxf837@tom.com
2016-10-13)
屠振兴)

