低频电针对SNI神经痛大鼠脊髓背角P物质表达的影响
何晓芬,蒋永亮,叶佳瑜,颜思思,邵晓梅,吴媛媛,杜俊英,陈晓军,陈利芳,严伟,方剑乔,赵文胜
低频电针对SNI神经痛大鼠脊髓背角P物质表达的影响
何晓芬1,蒋永亮1,叶佳瑜1,颜思思1,邵晓梅1,吴媛媛1,杜俊英1,陈晓军1,陈利芳1,严伟2,方剑乔1,赵文胜3
(1.浙江中医药大学第三临床医学院,杭州 310053;2.浙江省人民医院,杭州 310014;3.浙江中医药大学附属浙江省中西医结合医院,杭州 310003)
探讨低频电针对神经痛大鼠的干预效应及对脊髓背角P物质(substance P,SP)的调节作用。将SD大鼠随机分为正常组(normal)、假手术组(sham SNI)、手术组(SNI)和电针组(SNI+EA),每组8只。采用坐骨神经分支选择性损伤(spared nerve injury,SNI)模型建立大鼠神经痛模型,2 Hz电针治疗选取术侧足三里、昆仑穴,每日1次,治疗14 d。检测大鼠术侧后足缩腿阈(paw withdrawal threshold,PWT),观察大鼠痛觉超敏反应。用免疫荧光法检测术侧脊髓背角SP阳性表达。SNI组大鼠术侧PWT明显降低(<0.01),电针能提高SNI神经痛大鼠术侧的PWT(<0.01)。SNI组大鼠健侧痛阈无显著变化(>0.05)。SNI组大鼠术侧脊髓背角SP表达增多(<0.01),健侧脊髓背角SP阳性表达增多(<0.05),电针能降低SNI大鼠术侧脊髓背角SP表达(<0.01),电针对健侧脊髓背角SP表达无显著改变(>0.05)。Sham SNI组大鼠术侧、健侧PWT和术侧、健侧脊髓背角SP表达均无显著变化(>0.05)。低频电针能改善大鼠神经痛,其机制可能与其有抑制术侧脊髓背角SP表达有关。
电针;神经痛;脊髓背角;P物质;大鼠
神经病理痛,如中风后遗痛、疱疹后遗痛、三叉神经痛等,是临床上常见、多发又难治的慢性疼痛疾病,针灸尤其是电针疗法作为治疗痛症的一种常用方法,已被广泛应用于神经病理痛的治疗,其疗效亦十分明确[1-5],然而电针治疗神经病理痛的机制有待进一步研究。P物质(Substance P,SP)是与伤害性信息传导密切相关的神经活性物质,存在于背根神经节和脊髓背角[6-8]。已有研究表明,在多种慢性疼痛中[9-10],SP作为疼痛递质通过感觉神经传入纤维向上传递至脊髓中枢,参与疼痛在脊髓中枢的传导和调制[11]。课题组前期研究发现,电针可以通过下调神经病理痛大鼠背根神经节SP的表达以减轻神经痛[12],但对电针能否通过调控脊髓背角SP表达以发挥镇痛效应有待进一步研究。本研究拟建立坐骨神经选择性损伤(spared nerve injury,SNI)模型,通过观察电针对SNI神经痛大鼠脊髓背角SP阳性表达的影响,以进一步探讨电针镇痛的可能机制。
1 材料和方法
1.1 实验动物
选用清洁级健康雄性Sprague Dawley(SD)大鼠32只,体重(180±20)g,购自中国科学院上海实验动物中心[SCXK(沪)2008-0016],由浙江中医药大学实验动物中心饲养。饲养期间给予啮齿类动物标准颗粒饲料及自由饮水,12 h循环灯光。
1.2 仪器设备与实验试剂
足底机械痛测量仪(意大利UGO BASILE公司)、韩式穴位神经刺激仪(北京华卫产业开发公司)、0.25 mm×13 mm无菌针灸针(苏州医疗用品厂有限公司)、恒温手术台(Harvard公司)、冰冻切片机(美国Thermo公司)、激光共聚焦显微镜(日本Nikon公司)、兔抗大鼠SP多克隆抗体(美国Abcam公司)。
1.3 分组与造模
采用完全随机法将大鼠随机分为4组,即正常组(Normal)、假手术组(Sham SNI)、手术组(SNI)、电针组(SNI+EA),每组8只。采用坐骨神经分支选择性损伤神经痛大鼠模型[13]。SD大鼠称重后,用10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉。大鼠俯卧位固定在手术台上,右后肢剃毛,碘伏消毒,乙醇脱碘。在大鼠股骨中点下约0.5 cm处,将大鼠皮肤切开约1 cm,钝性分离臀部肌肉和股二头肌,暴露坐骨神经主干及其分支(胫神经、腓肠神经和腓总神经),用5/0丝线将胫神经和腓总神经紧紧结扎,在结扎远侧端距神经干远端约2~4 mm处切断,腓肠神经保留完整性。避免过分牵拉及损伤神经。然后逐层缝合伤口,并在术侧大腿肌注4~5单位青霉素以预防感染。Sham SNI组大鼠仅暴露神经,不进行结扎与切断,其余操作同SNI组。Normal组不做任何处理。
1.4 电针干预
造模1 d后开始电针干预。电针组选取术侧足三里、昆仑,采用0.25 mm×13 mm毫针,进针后连接韩氏穴位神经刺激仪进行电刺激,频率选用2 Hz,电流强度先用1 mA,每10 min递增1 mA,共治疗30 min,每日治疗1次,共治疗14 d。Normal、Sham SNI、SNI组不进行电针干预,仅给予同电针组相同的固定。
1.5 痛阈检测
采用动态足底测量仪检测大鼠双侧后足缩腿阈(paw withdrawal threshold,PWT),作为大鼠痛觉异常的指标。各组大鼠于基础痛阈测量前,进行3 d适应性测痛,以减少环境对实验大鼠痛阈的影响。测量时将大鼠置于铁丝网上透明塑料盒内,待大鼠安静后(即停止梳理毛发和探索活动),将类似Von Frey丝的金属丝置于大鼠后足足底外侧(腓肠神经支配区域)。启动机械泵,刺激力量从0 g开始以2.5 g/s递增,直至引发大鼠逃逸反应(缩腿),此时电子记录器记录的数值即为大鼠痛阈。设定最大刺激力量为50 g,以免大鼠足跖损伤。痛阈检测时间点为造模前(base)、造模后1 d (D1)、电针后14 d(D14)3个时间点,检测所有大鼠术侧和健侧PWT。连续测量5次,每次间隔5 min,去最大值和最小值后,取3次缩腿阈的平均值作为一个时间点痛阈值。
1.6 免疫荧光法检测脊髓背角SP水平
用10%水合氯醛0.35 mL/100 g的剂量腹腔注射麻醉大鼠,开胸暴露心脏,经左心室、升主动脉用生理盐水(4℃预冷)快速灌注,直至流出液为澄清液体,接着缓慢推注4%多聚甲醛150 mL,随后以先快后慢的方式滴注4%多聚甲醛500 mL。快速取出大鼠腰段脊髓(即腰膨大),置于4%多聚甲醛溶液中后固定6 h,继以移入15%、 30% 蔗糖溶液梯度脱水,经液氮速冻后,置入﹣80℃冰箱保存。取出大鼠脊髓,用OCT包埋后,固定于冰冻切片机的冻头上,以50mm厚度修片至所需组织部位,以30mm切取组织。小心取出切片,TBST漂洗10 min×3次;用10%驴血清(TBST稀释),37℃孵育1 h,以增加细胞通透性和封闭非特异性结合点,切勿洗片;加入兔抗大鼠SP多克隆抗体(1:1000),4℃孵育过夜, TBST漂洗10 min×3次;加入Alexa Fluor®488驴抗兔IgG(H+L)(1:400,用含10%驴血清的TBST稀释),进行免疫荧光标记,37℃孵育(避光)1 h,TBST漂洗10 min×5次(避光);将漂洗干净的切片转移至处理好的载玻片上,擦干水渍,滴加抗荧光淬灭封片液封片;激光共聚焦显微镜下观察并摄取图片。选用ImageProPlus6.0病理图像分析系统计算阳性细胞率。每组选取3只大鼠,每只大鼠取5张不连续切片,分别记录大鼠术侧腰段脊髓背角浅层(Ⅰ~Ⅱ层)内磷酸化SP阳性像素点和区域总像素点,并计算其阳性百分率。
1.7 统计学方法
本实验所有数据采用均数±标准误表示。术侧、健侧PWT数据采用多次重复测量方差分析方法分析,其余数据均采用单因素方差()分析,以<0.05为差异有统计学意义。
2 结果
2.1 电针对SNI大鼠术侧PWTs变化的影响
动态观察造模前(base)、造模后1 d和14 d术侧足跖PWT变化。如表1所示,造模前各组大鼠术侧足跖基础(base)PWT差异无统计学意义(>0.05)。造模后各时间点,SNI组和SNI+EA组大鼠术侧足跖PWT显著降低,明显低于Normal组和Sham SNI组大鼠(<0.01)。电针治疗1 d、14 d后,SNI+EA组大鼠术侧PWT明显高于SNI组。造模后各时间点,Sham SNI组大鼠术侧足跖PWT与Normal组比较差异均无统计学意义(>0.05)。
2.2 电针对SNI大鼠健侧PWT变化的影响
动态观察造模前(base)、造模后1 d和14 d健侧足跖痛阈变化。
如表2所示,造模前各时间点各组大鼠健侧足跖PWT差异均无统计学意义(>0.05)。

表1 电针对SNI大鼠术侧PWTs变化的影响 (±s,g)
注:与Normal组比较1)<0.01;与Sham SNI组比较2)<0.01;与SNI组比较3)<0.01
2.3 电针对SNI大鼠术侧脊髓背角SP阳性细胞表达变化的影响
如表3所示,Normal组和Sham SNI组大鼠术侧脊髓背角SP阳性细胞表达(图1)差异无统计学意义(>0.05)。与Normal组和Sham SNI组比较,SNI组大鼠术侧脊髓背角SP阳性细胞表达明显升高(<0.01);与SNI组比较, SNI+EA组大鼠术侧脊髓背角SP阳性细胞表达明显下降(<0.01)。

表2 电针对SNI大鼠健侧PWTs变化的影响 (±s,g)

表3 电针对SNI大鼠术侧脊髓背角SP阳性细胞表达变化的影响 (±s,%)
注:与Normal组比较1)<0.01;与Sham SNI组比较2)<0.01;与SNI组比较3)<0.01

图1 为术侧脊髓背角SP阳性细胞表达免疫荧光代表图;
(免疫荧光×100)
2.4 电针对SNI大鼠健侧脊髓背角SP阳性细胞表达的影响
如表4所示,Normal组和Sham SNI组大鼠健侧脊髓背角SP阳性细胞表达(图2)差异无统计学意义(>0.05)。与Normal组和Sham SNI组比较,SNI组大鼠健侧脊髓背角SP阳性细胞表达明显升高(<0.05);SNI组和SNI+EA组大鼠健侧脊髓背角SP阳性细胞表达差异无统计学意义(>0.05)。

表4 电针对SNI大鼠健侧脊髓背角SP阳性细胞表达变化的影响 (±s,%)
注:与Normal组比较1)<0.05;与Sham SNI组比较2)<0.05
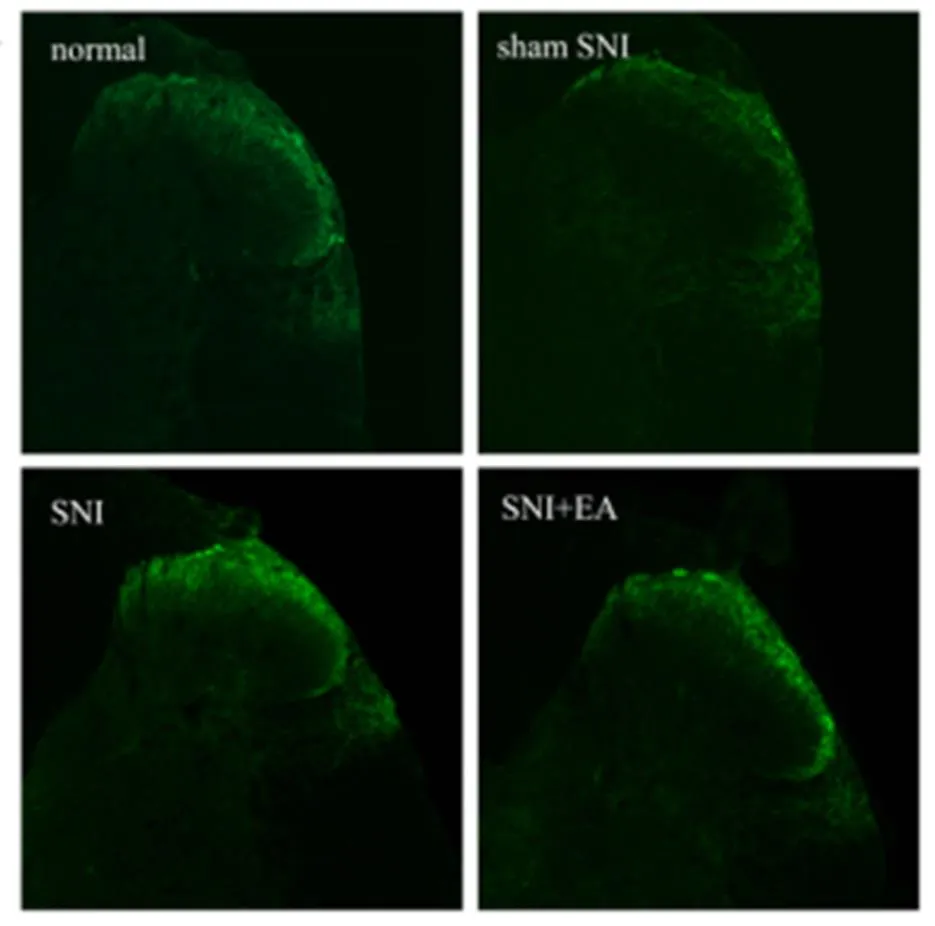
图2 为健侧脊髓背角SP阳性细胞表达免疫荧光代表图;
(免疫荧光×100)
3 讨论
神经病理痛是临床常见的病症之一,由于其发病机制复杂,一直是基础和临床研究的重点和难点[14-16]。目前常用的神经病理痛模型有脊神经选择结扎模型[17]、坐骨神经部分结扎模型[18]、坐骨神经慢性压迫模型[19]以及坐骨神经选择性损伤(SNI)模型[13]。SNI模型制作时,选择性结扎腓总神经及切断胫神经后远端,保留腓肠神经的完整性,是相对比较新型的神经痛制作模型,主要模拟临床上外周神经损伤所致的神经病理痛,具有制作简单、模型稳定、重复性好等优势[20-22],课题组前期已成功建立SNI模型[23],用于急性和慢性实验的行为学及机制探讨。我们在实验中观察到,造模后SNI模型大鼠健侧机械痛阈无明显变化,而模型制作1 d后,SNI模型大鼠术侧机械痛阈明显降低,一直持续至实验结束,表明神经病理痛模型成功建立。
神经病理痛可归属于中医学“痹证”范畴,中医学理论认为“不通则痛”“经脉者,所以能决生死,处百病,调虚实,不可不通”。基于“始足胫者,先取足阳明而汗出”理论,故本实验选取足三里穴。昆仑穴具有通利关节、舒经活络作用[24],故同时选用昆仑穴。本实验结果显示电针治疗可显著提高SNI大鼠痛阈,与前期实验结果相一致[23],已有研究证明多次重复针刺具有累积效应,其疗效随着治疗次数的增加而明显增加。而针刺耐受是影响镇痛效果的重要因素,针刺耐受导致电针随着治疗次数的增加其镇痛作用反而降低[25-26],本实验电针治疗14 d痛阈没有高于电针治疗1 d的痛阈,可能由于针刺耐受导致电针随着治疗次数的增加其镇痛作用反而降低而致,也有可能是由于SNI神经病理痛大鼠疼痛一直在逐渐加重所致。
神经肽SP是速激肽家族中重要一员[27-28],广泛分布于中枢神经系统和外周组织中[29-31]。脊髓作为伤害性信号向上位脑结构传递的中继站,初级伤害性传入神经终末止于脊髓背角的不同层,并且与不同的二级脊髓神经元接触,从而使脊髓背角成为疼痛信息传递和整合的初级中枢,所以本研究选择大鼠脊髓背角脊髓来作为研究部位。脊髓的SP是公认的与伤害性信息传导密切相关的神经活性物质[30,32],参与多种疼痛过程[33]。研究表明大鼠注射甲醛后发现脊髓背角Ⅰ、Ⅱ层SP免疫阳性物表达明显增强,也有研究表明大鼠左侧后爪足底切口可增加同侧脊髓背角SP免疫反应[9],也有研究表明SNL神经痛模型大鼠健侧脊髓背角的小胶质细胞阳性细胞表达增多[34]。本实验结果也显示SNI模型大鼠术侧脊髓背角SP阳性物表达明显增多,且主要表达在脊髓背角浅层,健侧脊髓背角SP阳性物表达也明显增多,这可能与病理状态下自身代偿有关。电针能显著降低脊髓背角SP阳性物表达,对健侧脊髓背角上升的SP阳性物表达虽有下调作用,但是无统计学差异,可能与只选取了术侧的足三里和昆仑穴有关,建议在以后的研究中选用双侧足三里和昆仑穴对神经病理痛进行治疗。
综上所述,我们的研究表明,低频电针能改善神经病理痛,其机制可能与抑制术侧脊髓背角SP的表达有关。本实验阐明了电针治疗神经病理痛的部分机制,有利于电针更广泛、更有效地运用于临床上神经病理痛的治疗。
[1] 孙晶,方剑乔,邵晓梅,等.方剑乔教授分期治疗三叉神经痛[J].中国针灸,2016,36(2):191-193.
[2] 姜丽芳,顾一煌.深刺夹脊穴结合等电势电针围刺治疗带状疱疹神经后遗痛的临床观察[J].中国中医急症,2016,25(5):913-915.
[3] 杨欢,郑小兰,罗振中.电针刺激对糖尿病神经病理性疼痛大鼠脊髓p38MAPK的影响[J].广东医学,2016,37 (17):2555-2557.
[4] 李守栋.电针对神经病理痛模型大鼠机械性痛阈的影响[J].吉林中医药,2009,29(12):1093-1094.
[5] 黄爱苹,谢磊,薛纯纯,等.慢病毒载体介导的BDNF基因与电针对神经病理痛模型大鼠痛阈的影响[J].中国实验诊断学,2011,15(6):959-962.
[6] 宋雪松,高金贵,孙木,等.背根神经节压迫对大鼠痛行为及脊髓背角内降钙素基因相关肽的影响[J].中华麻醉学杂志,2004,24(1):44-47.
[7] Chatani K, Kawakami M, Weinstein JN,. Characte- rization of thermal hyperalgesia, c-fos expression, and alterations in neuropeptides after mechanical irritation of the dorsal root ganglion[J].(1976), 1995,20(3):277-289.
[8] 毛豪丽,姜虹.P物质与整形外科术后镇痛的研究进展[J].组织工程与重建外科,2008,4(1):59-60.
[9] 胡兴国,钟敏,曾因明.鞘内注射新斯的明对手术切口引起的大鼠脊髓背角P物质表达的影响[J].中国疼痛医学杂志,2005,11(2):96-99.
[10] 张瑞,王清秀,郭慧琴,等.坐骨神经慢性压迫损伤性疼痛与脊髓背角P物质关系研究[J].中国实用医药,2008,3(34):5-7.
[11] Henry JL. Future basic science directions into mecha- nisms of neuropathic pain[J]., 2004,18 (4):306-310.
[12] 蒋永亮,尹小虎,沈亚芳,等.低频电针对脊神经结扎大鼠痛敏化的干预作用[J].中国康复理论与实践,2014,20(3):211-214.
[13] Decosterd I, Woolf CJ. Spared nerve injury: an animal model of persistent peripheral neuropathic pain[J]., 2000,87(2):149-158.
[14] 韩济生.神经病理性疼痛热点谈[J].医学研究杂志,2011,40(11):1-2.
[15] 陆悦,李京,樊碧发,等.慢性神经病理痛患者疲乏现况及影响因素调查分析[J].中国全科医学,2014, (2):184-187.
[16] 刘鹏,张伟,张少博,等.内源性大麻素及其受体在神经病理痛治疗中的研究进展[J].中南大学学报(医学版),2016,41(8):879-884.
[17] Kim SH, Chung JM. An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J]., 1992,50(3):355-363.
[18] Seltzer Z, Dubner R, Shir Y. A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury[J]., 1990,43(2):205-218.
[19] Bennett GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]., 1988,33(1):87-107.
[20] 武百山,杨立强,岳剑宁,等.背根神经节脉冲射频对大鼠SNI疼痛模型机械性痛阈的影响[J].中国实验诊断学,2012,16(8):1376-1377.
[21] 魏小洁,郭曲练,王懿春,等.鞘内注射布托啡诺对SNI模型大鼠脊髓背角NMDAR表达的影响[J].中国现代医学杂志,2008,18(18):2616-2621.
[22] 马骋,李翠贤,余黎,等.电针对大鼠神经病理痛SNI模型脊髓背角传入神经末梢Glu的影响[J].南京中医药大学学报,2010,26(5):379-382,411.
[23] 颜思思,蒋永亮,叶佳瑜,等.SNI大鼠神经痛维持期脊髓背角TRPV1的活化形式及低频电针干预作用[J].浙江中医药大学学报,2016,40(5):323-329.
[24] 鲁世君,朱建春.654—2昆仑穴注射治疗坐骨神经痛97例[J].中国针灸,1996,16(8):56.
[25] Wang JY, Meng FY, Chen SP,. Analysis on interrelation between electroacupuncture-induced cumulative analgesic effect and hypothalamic cholinergic activities in chronic neuropathic pain rats[J]., 2012,18(9):699-707.
[26] Gim GT, Lee JH, Park E,. Electroacupuncture attenuates mechanical and warm allodynia through suppression of spinal glial activation in a rat model of neuropathic pain[J]., 2011,86(5-6):403 -411.
[27] Lotz M, Vaughan JH, Carson DA. Effect of neuropeptides on production of inflammatory cytokines by human monocytes[J]., 1988,241(4870):1218- 1221.
[28] 唐美霞,杜若桑,耿俊龙,等.基于痛性相关神经肽CGRP、SP及其受体NK-1探讨腧穴电针防治急性发作期偏头痛机制[J].中国中医急症,2017,26 (2):216-218.
[29] Massari VJ, Tizabi Y, Park CH,. Distribution and origin of bombesin, substance P and somatostatin in cat spinal cord[J]., 1983,4(5):673-681.
[30] Li YS, Wang JX, Jia MM,. Dragon’s blood inhibits chronic inflammatory and neuropathic pain responses by blocking the synthesis and release of substance P in rats[J]., 2012,118(1):43-54.
[31] Wong BJ, Minson CT. Altered thermal hyperaemia in human skin by prior desensitization of neurokinin-1 receptors[J]., 2011,96(6):599-609.
[32] Kuraishi Y, Hirota N, Sato Y,. Evidence that substance P and somatostatin transmit separate information related to pain in the spinal dorsal horn[J]., 1985,325(1-2):294-298.
[33] Jimenez-Andrade JM, Bloom AP, Stake JI,. Pathological sprouting of adult nociceptors in chronic prostate cancer-induced bone pain[J]., 2010, 30(44):14649-14656.
[34] Liang Y, Qiu Y, Du J,. Inhibition of spinal microglia and astrocytes contributes to the anti-allodynic effect of electroacupuncture in neuropathic pain induced by spinal nerve ligation[J]., 2016,34(1):40-47.
Effect of Low-frequency Electroacupuncture on Substance P Expression in the Spinal Dorsal Horn in SNI Neuralgia Rats
1,1,1,1,1,1,1,1,1,2,1,3.
1.Z310053,; 2.310014,;310003,
To investigate the intervening effect of low-frequency electroacupuncture on rat neuralgia and its regulating effect on substance P (SP) in the spinal dorsal horn.SD rats were randomized to normal, sham operation (sham SNI), operation (SNI) and electroacupuncture (SNI+EA) groups, 8 rats each. A rat model of neuralgia was made by spared sciatic nerve injury (SNI). Points Zusanli(ST36) and Kunlun(BL60) on the operation side were given 2 Hz electroacupuncture once daily for 14 days. The rat hind paw withdrawal threshold (PWT) was measured on the operation side to observe its pain hypersensitivity. SP-positive expression in the spinal dorsal horn on the operation side was determined by immunofluorescence.Operative side PWT decreased significantly in the SNI group of rats (<0.01). Electroacupuncture increased operative side PWT in the SNI neuralgia rats (<0.01). Pain threshold on the healthy side had no marked change in the SNI group of rats (>0.05). SP-positive expression in the spinal dorsal horn increased on the operation side (<0.01) and also on the healthy side (<0.05) in the SNI group of rats. Electroacupuncture decreased SP-positive expression in the spinal dorsal horn on the operation side in the SNI rats (<0.01). Electroacupuncture did not significantly change SP-positive expression in the spinal dorsal horn on the healthy side (>0.05). PWT on the operation and healthy sides and SP-positive cell expression in the spinal dorsal horn on the operation and healthy sides had no marked changes in the SNI group of rats (>0.05).Low-frequency electroacupuncture can relieve rat neuralgia. Its mechanism may be related to it inhibiting SP-positive expression in the spinal dorsal horn on the operation side.
Electroacupuncture; Neuralgia; Spinal dorsal horn; Substance P; Rats
1005-0957(2017)12-1469-06
R2-03
A
10.13460/j.issn.1005-0957.2017.12.1469
2017-05-20
浙江省自然科学基金项目(LY16H270013,LQ17H270003,LY14H270007,LY14H270002);国家自然科学基金项目(81303038,81303039,81473772);浙江中医药大学校级科研基金项目(2013ZZ06)
何晓芬(1986—),女,实验师
方剑乔(1961—),男,教授,博士生导师,Email:fangjianqiao7532@163.com
赵文胜(1970—),男,副教授,硕士生导师,Email:zjmzhaowensheng@163.com

