恩度促进与肺癌细胞A549共培养体系中的HUVEC凋亡及其机制研究
马 芬, 冯 锋
(江苏省南京明基医院 肿瘤科, 江苏 南京, 210019)
恩度促进与肺癌细胞A549共培养体系中的HUVEC凋亡及其机制研究
马 芬, 冯 锋
(江苏省南京明基医院 肿瘤科, 江苏 南京, 210019)
恩度; 肺癌细胞A549; HUVEC凋亡; 机制
本研究对恩度促进与肺癌细胞A549共培养体系中的HUVEC凋亡及其机制进行了研究,现报告如下。
1 材料与方法
1.1 材料
购买烟台麦得津生物工程有限公司生产的重组人血管内皮抑制素,购买中国科学院上海细胞库提供的人脐静脉内皮细胞HUVECs、人非小细胞肺癌A549细胞株,购买湖南长沙长锦科技有限公司生产的CO2培养箱,购买杭州四季青公司生产的批号为110213的胎牛血清,购买武汉博士德生物工程有限公司生产的Bax, Bcl-2抗体、链霉素亲和生物素酶复合物(SABC), 购买南京凯基生物公司生产的Annexin V2FITC凋亡检测试剂盒,购买日本Olympus IX71倒置荧光显微镜奥林巴斯BX51荧光显微镜,购买新加坡ESCO公司生产的超净工作台,购买GIBCO生产的DMEM与RPMI1640培养基,购买美国Sigma公司生产的3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT), 购买日本Osaka Takeda公司生产的O-(氯乙酰-氨基酰基)烟曲霉醇(TNP-470), 购买美国Moleculor Devices生产的SPECTRAmax190酶联分析仪, Corning Transwll迁移小室直径、孔径分别为6 mm、5 μm。
1.2 方法
1.2.1 A549细胞与HUVECs细胞共培养体系的建立: 将对数生长期的A549取出来,对其进行消化,在此过程中将0.25%胰腺充分利用起来,在RPMI-1640培养基中加入,将A549单细胞悬液制备出来,密度为2×104细胞/mL。同时将对数生长期的HUVECs细胞取出来,对其进行消化,在此过程中将0.01%EDTA充分利用起来,在RPMI-1640培养基中加入,将HUVECs单细胞悬液制备出来,密度为1×105细胞/mL。分别在A549细胞、HUVECs上接种6孔板Transwell小室的上室、下室,在RPMI-1640培养基中加入,其含10%胎牛血清,培养成分为100 U/mL链霉素+100 U/mL青霉素,以使上室细胞培养在培养基中得到切实有效的保证。在37 ℃、5% CO2培养箱中对Transwell板进行培养。
1.2.2 恩度共培养体系中对HUVECs生长抑制作用: 在下室HUVECs长到75%~85%融合度的情况下,用含药培养基处理细胞。恩度的浓度分别为10、20、40、80、100 μg/mL, 阳性对照组为终浓度为25 μg/mL的TNP-470, 空白对照组加100 μL培养基代替,另将对照孔设置为本底,其属于无细胞培养液,体积同上,含有相应浓度药物,每组将3个平行孔设置起来。进行2 d的孵育后将每孔的含药血清弃去,将1 mL不含血清的培养基重新加入,另将20 μL 5 mg/mL的MTT液加入,在培养箱中进行4 h的孵育,将液体弃去,将100 μL二甲基亚砜(DMSO)加入每孔,在振荡器中进行10 min的振荡,在580 nm波长处采用酶联免疫检测仪对OD值进行测定,计算出生长抑制率,方法为对照组与实验组OD值之差与对照组OD值的百分率,实验重复3次。
1.2.3 HUVECs凋亡测定: 对细胞进行接种,并对其进行药物处理,然后进行2 d的培养,对细胞凋亡进行测定,在此过程中将Annexin V-FITC试剂盒充分利用起来,用胰酶-EDTA消化下室HUVECs细胞,将细胞收集起来,将消化终止,在此过程中将培养基充分利用起来。每个样本计数1×104细胞。对收集的细胞进行2遍的润洗,在此过程中将冷的PBS充分利用起来,用500 μL结合缓冲液悬浮细胞,将5 μL Annexin V-FITC加入其中,以轻柔的动作混匀。测定前将5 μL PI加入其中,同时在暗处放置,进行15 min的避光反应。上机测定,每组平行2个样本。
1.2.4 恩度对HUVECs中Bcl-2与Bax凋亡蛋白的影响检测: 对恩度对共培养体系中HUVECs中Bcl-2与Bax凋亡蛋白的影响进行评价,在此过程中将链霉亲和生物素酶复合物(SABC)方法充分利用起来。将HUVECs接种在玻片上,恩度的浓度为10、20、40 μg/mL。进行2 d的培养后用PBS对细胞进行3次清洗,每次1 min,室温下对4%多聚甲醛进行90 min的固定,进行3次洗涤,在此过程中将PBS充分利用起来,每次2 min。进行30 min的处理,在此过程中将H2O2充分利用起来,进行3次洗涤,在此过程中将PBS充分利用起来,每次2 min, 然后在37 ℃的温度下对10%封闭血清进行20 min的孵育。将1∶200 Bcl-2与1∶200 Bax抗体加入其中,在37 ℃的温度下进行2 h的孵育,之后将二抗加入其中,进行20 min的孵育,用PBS洗涤,对样本进行处理,在此过程中将SABC溶液充分利用起来。最后用0.3 mg/mL 3, 3′-二氨基联苯胺(DAB)处理,镜下对反应时间进行控制,轻度复染、洗涤、封片,在此过程中分别将苏木素、PBS、中性树胶充分利用起来。采用Image-ProPlus图像分析软件镜下拍片。阴性对照组用PBS将一抗取代掉。
1.2.5 Bcl-2与Bax蛋白检测: 进行Western blotting, 对细胞进行消化并将其收集起来,在此过程中将胰酶-EDTA充分利用起来,将400 μL裂解液加入其中前将冰冷PBS加入其中进行3次润洗,在冰上放置对细胞进行30 min的裂解。在4 ℃离心机中进行离心,速率和时长分别为14 000 r/min、5 min, 将上清液提取出来,对蛋白质浓度进行测定,然后进行SDS-PAGE转膜。室温下对TBST进行1 h的封闭,在此过程中将含5%胎牛血清白蛋白(BSA)充分利用起来,将Bcl-2与Bax抗体加入,在4 ℃温度的摇床过夜。将1∶1 000 HRP-IgG二抗加入其中杂交,洗膜后显色。在凝胶成像系统中放置,分析Bcl-2与Bax蛋白的相对表达量。
1.3 统计学分析
应用统计软件SPSS 16.0分析所得数据,用均数±标准差表示所有数据,各组数据组间差异比较用One-way ANOVA方差分析,检验水准α=0.05。
2 结 果
恩度对HUVECs增殖抑制作用、诱导HUVECs细胞凋亡情况分析见表1。恩度对HUVECs中Bcl-2与Bax蛋白表达的影响分析见表2。

表1 恩度对HUVECs增殖抑制作用、诱导HUVECs细胞凋亡情况分析
与正常组比较, *P<0.05; 与TNP-470比较, #P<0.05。
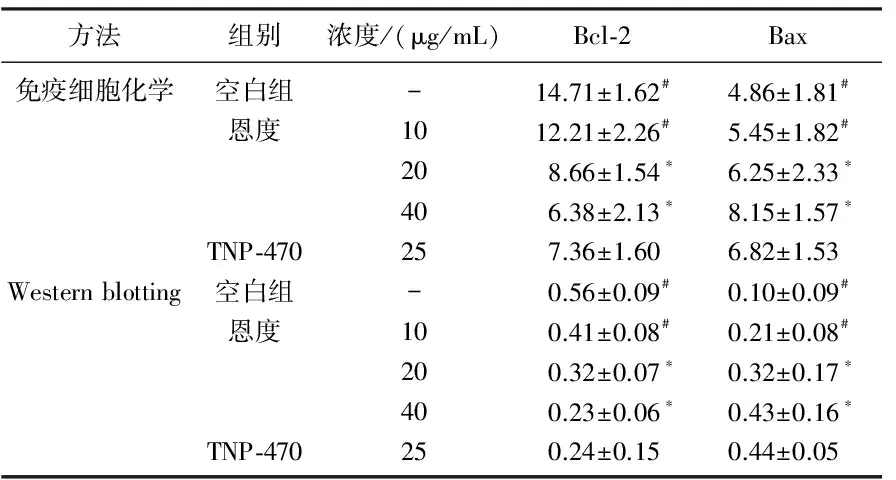
表2 恩度对HUVECs中Bcl-2与Bax蛋白表达的影响分析 %
与空白组比较, *P<0.05; 与TNP-470比较, #P<0.05。
3 讨 论
重组人血管内皮抑制素注射液(恩度)属于一种血管内皮生长抑制剂,特点为新型、多靶点,能够对肿瘤血管生成进行抑制,在多种肿瘤的治疗中均得到了有效应用[1-3]。相关医学研究[6-8]表明,恩度能够对血管生成及肿瘤生长、侵袭、迁移进行抑制,途径为在肿瘤微血管内皮细胞特异性地作用。近年来,在肿瘤患者的发病率及死亡率中,肺癌在日益加重的环境污染、吸烟等因素的影响下已经位居首位[9]。通常情况下,恩度是临床治疗肺癌过程中通常采用的药物[10]。现阶段,很多相关医学研究均对恩度对血管内皮生长因子、成纤维生长因子等的表达进行调控进行了报道,但是却很少有相关医学研究对恩度对血管内皮细胞凋亡的影响进行报道。
本研究结果显示,恩度对HUVECs增殖抑制率、诱导HUVECs细胞凋亡率均随着浓度的提升而提升(P<0.05), 10、20 μg/mL恩度对HUVECs增殖抑制率、诱导HUVECs细胞凋亡率均显著低于25 μg/mL TNP-470(P<0.05), 80、100 μg/mL恩度对HUVECs增殖抑制率、诱导HUVECs细胞凋亡率均显著高于25 μg/mL TNP-470(P<0.05), 但40 μg/mL恩度、25 μg/mL TNP-470对HUVECs增殖抑制率、诱导HUVECs细胞凋亡率之间的差异均无统计学意义(P>0.05), 20、40、80、100 μg/mL恩度、25 μg/mL TNP-470诱导HUVECs细胞凋亡率均显著高于正常组(P<0.05), 但10 μg/mL恩度、正常组诱导HUVECs细胞凋亡率之间的差异无统计学意义(P>0.05); 免疫细胞化学、Western blotting下20、40 μg/mL恩度、25 μg/mL TNP-470对HUVECs中Bcl-2蛋白表达均显著低于空白组(P<0.05), Bax蛋白表达均显著高于空白组(P<0.05), 10 μg/mL恩度对HUVECs中Bcl-2蛋白表达均显著高于25 μg/mL TNP-470(P<0.05), Bax蛋白表达均显著低于25 μg/mL TNP-470(P<0.05), 但20、40 μg/mL恩度、25 μg/mL TNP-470对HUVECs中Bcl-2与Bax蛋白表达差异均无统计学意义(P>0.05), 10 μg/mL恩度、空白组对HUVECs中Bcl-2与Bax蛋白表达差异均无统计学意义(P>0.05), 说明恩度促进与肺癌细胞A549共培养体系中的HUVEC凋亡的机制为对Bcl-2家族蛋白进行调控。
[1] 许成云, 倪庆桂, 樊馨, 等. 重组人血管内皮抑制素对肺微血管内皮细胞增殖及其周期分布的影响[J]. 临床肿瘤学杂志, 2009, 14(5): 410-413.
[2] 李忠义, 刘江秋, 徐璐, 等. 重组人血管内皮抑制素对小鼠Lewis肺癌肿瘤抑制作用[J]. 中国肿瘤生物治疗杂志, 2003, 10(4): 274-276.
[3] 殷宗宝, 王洪武, 邓超, 等. 重组人血管内皮抑制素注射液对低O2高CO2肺动脉高压大鼠IL-6, eNOS, VEGF 的影响[J]. 实用医学杂志, 2010, 26(18): 3311-3313.
[4] 辛庆锋, 俊辉. 冬凌草甲素抗肿瘤作用机制研究进展[J]. 医学综述, 2008, 14(3): 455-456.
[5] 王玉彬, 李迪诺, 岳莉. 重组人血管内皮抑制素对人胃癌MGC-803细胞株VEGF表达的影响[J]. 江苏医药, 2011, 37(13): 1504-1506.
[6] 张春玲, 吴立军, 左海军, 等. 冬凌草甲素通过改变Bax/Bcl-xL表达激活caspase-3诱导A375-S2细胞凋亡[J]. 中国药理学通报, 2004, 20(6): 669-672.
[7] 蔡鲁平, 蔡瑞兴, 翟继萌. Glubran2胶介入栓塞在肺癌咯血中的应用效果[J]. 实用心脑肺血管病杂志, 2014, 22(10): 93-95.
[8] 王志强. sFRP、WIF-1、CD133、CD44在肺癌组织中的表达及其临床意义[J]. 实用心脑肺血管病杂志, 2014(02): 8-9.
[9] Feng L, Xu Y H, Wang S S, et al. Preventative Effects of 4, 4′-Diphenylmethane-bis(methyl) Carbamate Isolated from Cortex Mori on Human Umbilical Vein Endothelial Cell Dysfunction Induced by Advanced Glycation End Products[J]. Phytother Res, 2012, 26(3): 412-419.
[10] ZHANG Y, WU Y, Tashiro S, et al. Involvement of PKC signal pathways in oridonin-induced autophagy in HeLa cells: a protective mechanism against apoptosis[J]. Biochem Biophys Res Commun, 2009, 378(2): 273-278.
R 734.2
A
1672-2353(2017)23-081-03
10.7619/jcmp.201723026
2017-06-28

