破伤风抗毒素致不良反应158例文献分析
徐学君,程幼苗,徐德琴
破伤风抗毒素致不良反应158例文献分析
徐学君,程幼苗,徐德琴
目的探讨破伤风抗毒素致不良反应的一般规律,为临床安全用药提供参考。方法以“破伤风抗毒素”“TAT”为检索词,检索中国知网(CNKI)、万方数据库、维普期刊全文数据库1996-01至2016-10收录的有关破伤风抗毒素引起不良反应的文献资料,筛选并收集相关报告,按年龄、性别、给药途径、原患疾病、不良反应发生时间、累及器官/系统及临床表现、过敏史、转归等进行统计、分析。结果经检索,破伤风抗毒素致不良反应文献145篇,共158例。不良反应在20~39岁的人群发生最多(58.23%);用药20 min内不良反应发生率高达43.04%,主要累及全身性损害(89.24%),临床主要表现为过敏性休克(46.84%)、过敏反应(39.87%)、血清病(2.53%)。156例好转或痊愈(98.73%),2例死于过敏性休克(1.27%)。结论临床应警惕破伤风抗毒素引起的过敏性休克等严重不良反应,确保用药安全。
破伤风抗毒素;不良反应;文献分析
破伤风抗毒素(tetanus antitoxin,TAT)是由破伤风类毒素免疫马所得的血浆,经胃酶消化后纯化制成的液体抗毒素球蛋白制剂,其主要成分为经胃酶消化后的马破伤风免疫球蛋白,能中和破伤风毒素,临床主要用于破伤风的预防和治疗[1]。随着破伤风抗毒素在临床的广泛使用,其所致不良反应的报道日趋增多。笔者通过文献检索,收集国内破伤风抗毒素所致不良反应的报道,进行统计、分析,探讨其引起不良反应的一般规律,旨在为临床安全使用破伤风抗毒素提供参考。
1 资料与方法
1.1 资料来源 以“破伤风抗毒素”和“TAT”为检索词,检索中国知网(CNKI)、万方数据库、维普期刊全文数据库1996-01至2016-10收录的有关破伤风抗毒素引起不良反应的文献资料,筛选并收集相关报告。
1.2 纳入及排除标准 纳入标准:(1)破伤风抗毒素引起不良反应的病例报道;(2)无重要信息缺失,可进行因果判断。排除标准:(1)同一病例重复报道;(2)二次文献或综述。
1.3 统计内容及方法 收集不良反应所涉及患者的年龄、性别、原发疾病、用药情况、不良反应发生时间、不良反应累及器官/系统及临床表现、过敏史、不良反应转归等资料,利用Excel表格进行统计、分析。
2 结 果
最终纳入报道破伤风抗毒素致不良反应的文献145篇,共涉及158例患者。
2.1 性别与年龄分布 破伤风抗毒素致158例不良反应患者,其中男98例(62.02%),女59例(37.34%),性别不明1例(0.63%),男女比例为1.66∶1;年龄最小7个月,最大77岁,其中20~29岁44例(27.85%),30~39岁48例(30.38%),发生不良反应最多的年龄是20~39岁,共92例,占总例数的58.23%。患者性别、年龄分布见表1、表2。

表1 破伤风抗毒素不良反应患者性别分布 (n;%)
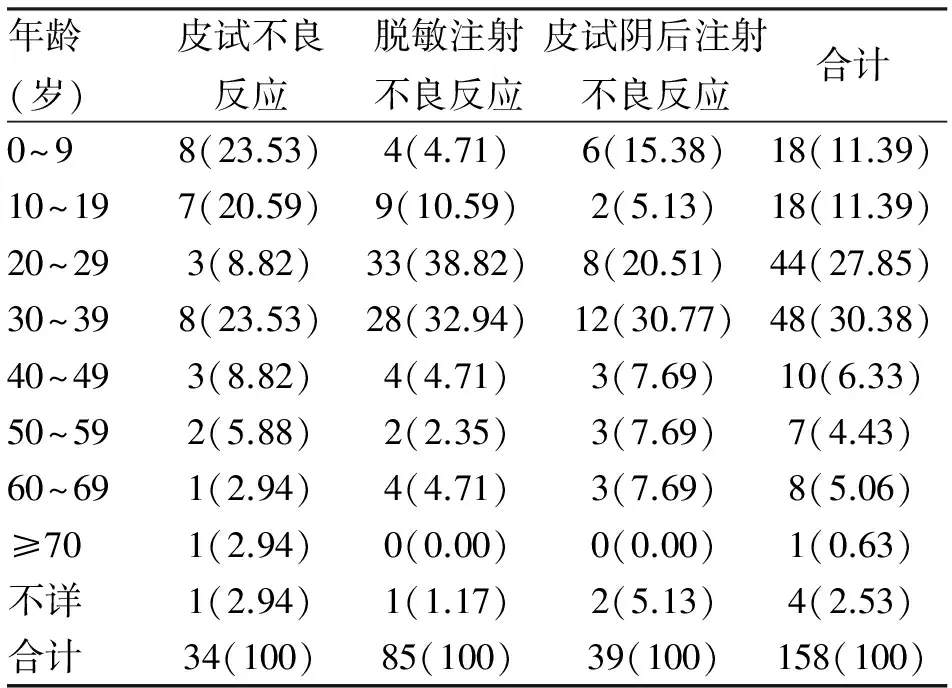
表2 破伤风抗毒素不良反应患者年龄分布 (n;%)
2.2 原患疾病和过敏史 158例中,手外伤46例(29.11%),头外伤28例(17.72%)和足外伤21例(13.29%),合计95例,占60.13%;文献未说明部位的外伤20例(12.66%),腿外伤10例(6.33%),面部外伤10例(6.33%),额头外伤8例(5.06%),眼部外伤6例(3.80%),前臂外伤5例(3.16%),会阴部外伤、掌骨骨折并头皮裂伤、左手腕部刀割伤、破伤风均为1例(均占0.63%),合计63例,占39.87%。158例中,无过敏史53例(33.54%),有青霉素和其他药物过敏史9例(5.70%),有家族过敏史2例(1.26%),文献中未见过敏史记录94例(59.49%)。
2.3 给药途径 158例中,皮内注射56例(35.44%),肌内注射16例(10.13%),静脉滴注1例(0.63%),先皮下注射后再皮下或肌内注射(脱敏注射)85例(53.80%)。
2.4 不良反应发生时间 158例中,用药至出现不良反应,最短为20 s,最长为10 d,20 min以内68例,占43.04%;皮试不良反应 34例(21.52%),脱敏注射不良反应 85例(53.80%),皮试阴性后注射不良反应 39例(24.68%)。见表3。
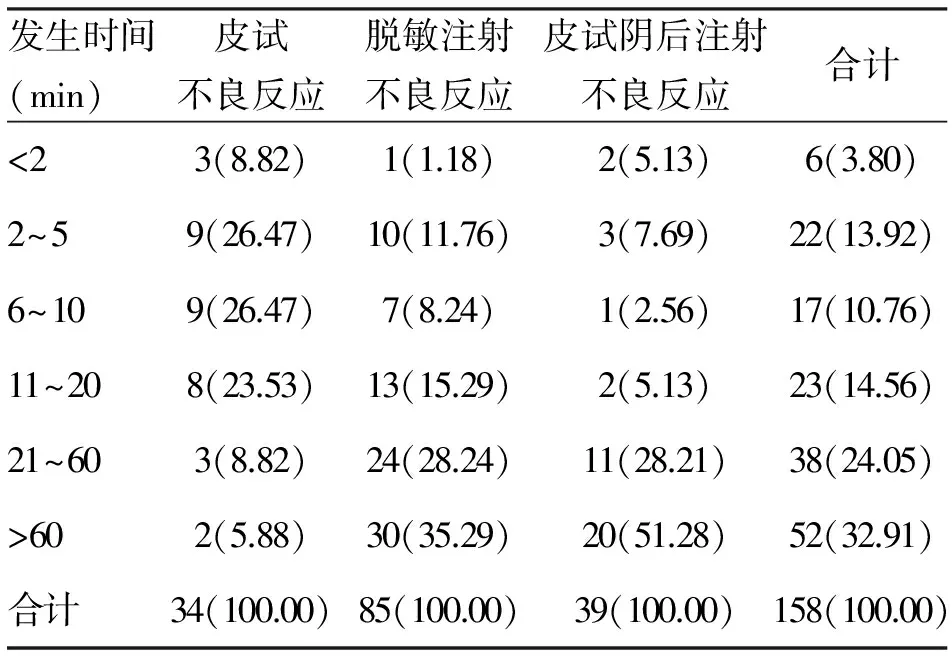
表3 破伤风抗毒素不良反应患者发生时间分布 (n;%)
2.5 不良反应累及器官、系统及临床表现 158例不良反应累及器官、系统包括全身性损害、泌尿系统、呼吸系统等160例次患者的不良反应同时累及多个器官、系统,以全身性损害、泌尿系统损害和呼吸系统损害居多(表4)。
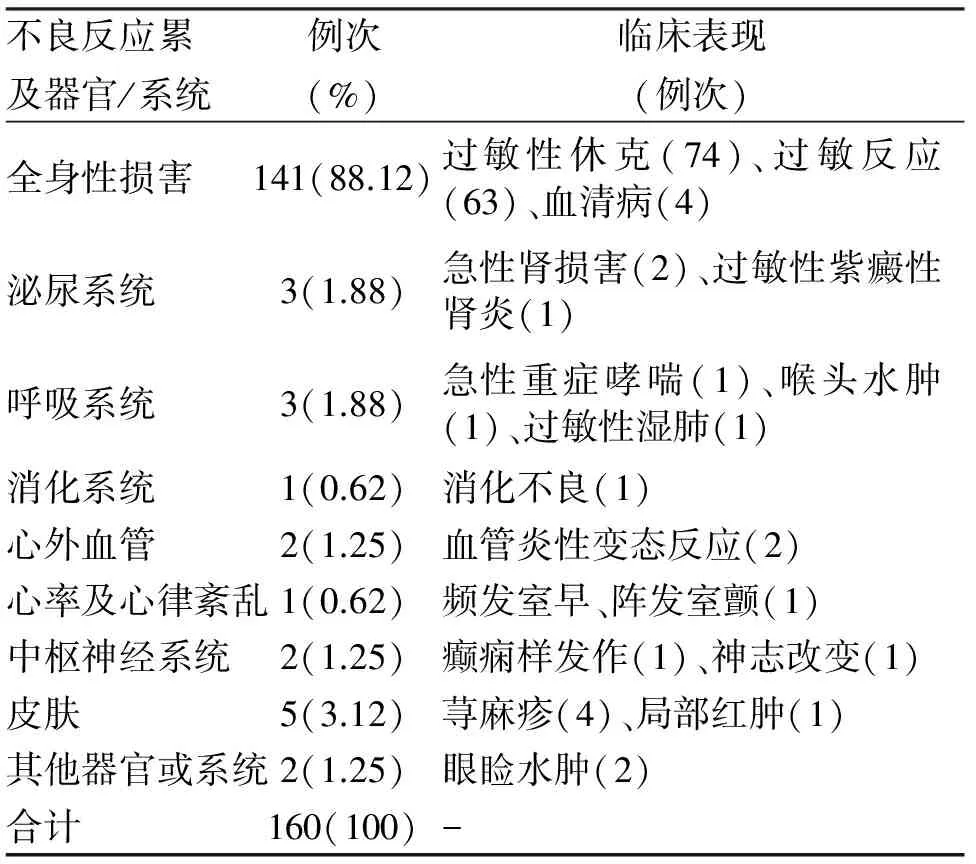
表4 破伤风抗毒素不良反应患者累及器官/系统及临床表现分布
2.6 转归 患者皮内试验、脱敏注射出现不良反应后均立即停药。158例不良反应患者,一般给予抗组胺药、葡萄糖酸钙、糖皮质激素治疗,过敏性休克立即给予肾上腺素,并予以吸氧、心电监护,1例消化道不良反应患者肌内注射甲氧氯普胺[2],1例过敏性紫癜性肾炎患者给予糖皮质激素和细胞毒类药物治疗[3],1例神志改变患者仅予吸氧和心电监护[4]。158例经对症处理后,156例好转或痊愈,2例过敏性休克患者经抢救无效死亡[5,6]。
3 讨 论
3.1 不良反应与性别、年龄 通过对158例分析,男性较多,是女性的1.66倍;发生不良反应最多的年龄范围是20~39岁,共92例,占总例数的58.23%。主要是因为破伤风类毒素用于预防和治疗破伤风的男性患者、20~39岁的患者居多[7,8]。
3.2 不良反应与原患疾病、过敏史 由于破伤风抗毒素的适应证所限,158例不良反应患者中,157例原患疾病为开放性外伤,占99.37%,1例原患疾病为破伤风,占0.63%,可见破伤风抗毒素主要用于开放性外伤,特别是创口深、污染严重,有感染破伤风危险者。158例中,无过敏史53例,占33.54%,未见过敏史记录94例,占59.49%,有青霉素和其他药物过敏史9例,占5.70%,有家族过敏史2例,占1.26%。为了防止过敏反应的发生,破伤风抗毒素说明书中明确标明,注射前必须先做过敏试验并详细询问既往过敏史,凡患者及其直系亲属曾有支气管哮喘、枯草热、湿疹或血管神经性水肿等病史,或对某种物质过敏,或患者过去曾注射马血清制剂者,应特别提防过敏反应的发生。收集报道的病例中,尽管所有患者注射前均作了过敏试验,但未见过敏史记录的患者比例仍高达59.49%,应引起临床重视。
3.3 给药途径 158例中,皮内注射56例,占35.44%,肌内注射16例,占10.13%,静脉滴注1例,占0.63%,脱敏注射(先皮下注射,后皮下或肌内注射)85例,占53.80%;皮试不良反应 34例(21.52%),脱敏注射不良反应 85例(53.80%),皮试阴性后注射不良反应 39例(24.68%)。提示,注射破伤风抗毒素前的皮内试验、因皮内试验阳性而脱敏注射过程中,以及皮内试验阴性而注射破伤风抗毒素,均应密切观察不良反应的发生;对于皮试阳性拟进行脱敏注射给药者,由于发生不良反应的风险较大,建议注射破伤风免疫球蛋白。
3.4 不良反应发生时间 由表3可知,破伤风抗毒素所致不良反应,43.04%发生在用药20 min之内,表明破伤风抗毒素引起的不良反应主要为速发型不良反应,提示患者在用药过程中,应密切观察用药反应,尤其是用药后的前20 min,发现异常,立即采取应对措施。用药1 h后发生不良反应的患者占32.91%,黄旭等[9]报道,1例21岁男性患者,在脱敏注射破伤风抗毒素完毕观察40 min,返家卧床3 h后发生过敏性休克。孔飞飞等[10]报道,1例26岁女性患者,肌内注射破伤风抗毒素10 d后于注射部位出现荨麻疹。临床应警惕可能迟发的不良反应,对因破伤风抗毒素皮内试验阳性而脱敏注射的患者,以及有药物、食物、花粉等过敏史的患者,均应适当延长观察时间。
3.5 不良反应与累及器官、临床表现 本调查结果可知,158例不良反应累及器官/系统以全身性损害为主,占88.12%,其次为泌尿系统、呼吸系统及心血管等,临床主要表现为过敏性休克、过敏反应、血清病、急性肾损害、急性重症哮喘、血管炎性变态反应等,其中以破伤风抗毒素引起I型变态反应为主,破伤风抗毒素对人体是一种异体蛋白,具有抗原性,进入人体后刺激机体产生特异性抗体IgE,IgE吸附在皮肤、支气管黏膜等微血管壁周围的肥大细胞或血液中的嗜碱性粒细胞表面,使机体处于致敏状态,当相同的抗原再次进入致敏的机体与IgE抗体结合,肥大细胞和嗜碱性粒细胞脱颗粒,释放组胺、蛋白水解酶、趋化因子等血管活性物质,使毛细血管扩张、平滑肌收缩、腺体分泌增加,引起Ⅰ型变态反应[5,11]。
3.6 不良反应与转归 158例经对症处理后,156例好转或痊愈,2例过敏性休克患者经抢救无效死亡。158例中,过敏性休克74例,占46.84%,过敏反应63例,占39.87%,为了预防过敏反应的发生和保证过敏性休克的救治成功,皮内试验前,应详细询问有无药物过敏史、家族药物过敏史、是否注射过破伤风抗毒素,向患者说明皮内试验和注射使用破伤风抗毒素可能引起不良反应的风险,取得患者的同意与理解,最好让患者书面签字认可,以防医患纠纷的发生;对于头部外伤伴恶心、呕吐的患者,待症状缓解后再进行皮内试验;大量饮酒的患者,最好在饮酒8 h后皮内试验[12]。严格按照有关操作常规或药品说明书,规范皮内试验、脱敏注射操作。皮内试验期间、脱敏注射期间及皮试阴性后注射破伤风抗毒素,均应严密观察患者的面色、神志、情绪、生命体征、试验局部及全身皮肤变化情况,询问患者有无心慌、气短及注射局部皮肤、全身皮肤是否瘙痒情况,一旦发生过敏性休克,让患者平卧,头侧向一侧,保持呼吸道通畅,及时清除呼吸道分泌物,必要时给予气管插管或气管切开;立即皮下或肌内注射肾上腺素,同时给予心肺复苏并吸氧,静脉注射地塞米松、葡萄糖酸钙,迅速建立静脉通道,适量补液,监测生命体征。破伤风抗毒素致过敏性休克抢救成功的关键是及时发现、及时应用肾上腺素[13]。皮内试验阳性的患者,建议注射破伤风人免疫球蛋白。
破伤风抗毒素总的不良反应发生率虽然不高,一旦发生往往比较严重,发生的过敏性休克,如不及时抢救,会危及患者生命;发生的肾脏及心血管不良反应,治愈需要较长时间,甚至难以治愈。为减少破伤风抗毒素不良反应的发生,使用前应询问患者有无药物、食物、花粉等过敏史及家族药物过敏史,规范皮内试验和注射操作,密切观察患者体征变化,防范过敏性休克等严重不良反应的发生;注射室应配备抗组胺药、糖皮质激素、肾上腺素等,以应对突发的严重不良反应。
[1] 陈新谦,金有豫,汤 光. 新编药物学[M]. 17版. 北京:人民卫生出版社,2011:929-930.
[2] 王亚玲,郑晓玲.精制破伤风抗毒素致消化道不良反应1例[J].医药导报,2014,33(1):121.
[3] 马忠金.精制破伤风抗毒素致过敏性紫癜性肾炎1例[J].医药导报,2014,33(7):972.
[4] 田 鹏.破伤风抗毒素致神志改变1例[J].中国现代药物应用,2012,6(20):13.
[5] 孙 蓉,班炳坤,韦敬土.破伤风抗毒素皮试致儿童过敏性休克死亡1例[J].中国医院药学杂志,2015,35(10):968.
[6] 席雪洁,杨晓燕,马桂华.注射TAT致病人过敏性休克死亡一例教训[J].首都医药,2000,7(3):34.
[7] 李娟菊.TAT皮试阳性率增高的原因分析与对策[J]. 中国实用医药,2010,5(18):88-89.
[8] 李文素,张梦云.破伤风抗毒素皮试结果判断和注射方法分析[J].河北医药,2012,34(3):471-472.
[9] 黄 旭,刘旭东,张建忠.TAT脱敏注射后致过敏性休克二例[J].中国疗养医学,2001,10(1):59.
[10] 孔飞飞,沈 洁,郭良君,等.破伤风抗毒素致严重过敏反应3例[J].中国药物警戒,2012,9(9):569-570.
[11] 马 波.注射破伤风抗毒素后致过敏性休克1例抢救和护理体会[J].基层医学论坛,2015,19(6):卷首页,758.
[12] 武占鹏,牛建华.醉酒后肌肉注射破伤风抗毒素致过敏性休克1例[J].医学理论与实践,2013,26(18):2498.
[13] 董德胜,周孟云,李 晨,等.破伤风抗毒素皮试致过敏性休克与救治1例[J].医学理论与实践,2012,25(16):2010-2011.
Literatureanalysisof158casesofadversedrugreactionscausedbytetanusantitoxin
XU Xuejun, CHENG Youmiao, and XU Deqin.
Department of Pharmacy, Anhui Provincial Corps Hospital,Chinese People’s Armed Police Force, Hefei 230041, China
ObjectiveTo study adverse drug reactions(ADRs)caused by tetanus antitoxin and provide reference for safe use of drugs in clinic.MethodsLiterature on ADRs caused by tetanus antitoxin, which was published between January 1996 and October 2016, was retrieved from Wanfang database, CNKI and VIP database with “tetanus antitoxin” and “TAT” as the key words. Related reports were collected and analyzed in terms of age, gender, routes of administration, primary diseases, the time of occurrence of ADRs , human organs or systems involved, allergy history, clinical manifestations and the results.ResultsA total of 145 pieces of literature, including 158 cases of ADRs caused by tetanus antitoxin, were retrieved. ADRs caused by tetanus antitoxin often occurred among people aged 20 to 39(58.23%). ADRs occurred within 20 min after medication (43.04%), and were mainly manifested as systemic damage (89.24%). Clinical manifestations were mainly allergic shock(46.84%), allergic reaction(39.87%)and serum sickness(2.53%). 98.73% of the cases were improved or cured after symptomatic treatment, but there were two cases(1.27%)of death.ConclusionsDoctors should be alert to severe ADRs caused by tetanus antitoxin, such as allergic shock, to ensure drug safety.
tetanus antitoxin; adverse drug reaction; literature analysis
徐学君,硕士,主任药师。
230041 合肥,武警安徽总队医院药剂科
徐德琴,E-mail:xudeqin5658@foxmail.com
R969.3
(2017-03-20收稿 2017-09-18修回)
(责任编辑 岳建华)

