含氮六元杂环氮氧自由基有机催化剂的结构与活性关系
陈可先, 尹 璐, 谢海英
(1.浙江工商大学 食品与生物工程学院,浙江 杭州 310018; 2.浙江大学 化学系,浙江 杭州 310027; 3.浙江新和成股份有限公司,浙江 绍兴 312500)
含氮六元杂环氮氧自由基有机催化剂的结构与活性关系
陈可先1, 尹 璐2, 谢海英3
(1.浙江工商大学 食品与生物工程学院,浙江 杭州 310018; 2.浙江大学 化学系,浙江 杭州 310027; 3.浙江新和成股份有限公司,浙江 绍兴 312500)
基于氮氧自由基有机催化剂的催化分子氧氧化技术是近年来催化领域关注的热点之一。采用理论方法研究了吡啶环和吡嗪环取代N-羟基邻苯二甲酰亚胺(NHPI)苯环所得含氮六元杂环催化剂的结构与催化活性,考察了质子酸HCl对这类催化剂催化活性的影响。结果表明,含氮六元杂环催化剂的催化活性均高于NHPI,部分催化剂的活性可与高效催化剂N,N′-二羟基邻苯二甲酰亚胺(NDHPI)相当;吡嗪环比吡啶环更有助于提高催化剂的催化活性;HCl与这类催化剂芳环的氢键相互作用可以提高催化剂的催化活性。本研究有助于加深对该类催化剂本征催化活性的认识,也有助于为该类催化剂的催化机理研究和催化氧化实验提供理论指导。
NHPI; 杂环; 密度泛函理论; 催化氧化
自20世纪90年代,Y.Ishii等[1]成功将氮氧自由基有机催化剂N-羟基邻苯二甲酰亚胺(NHPI,见图1)结合过渡金属盐助催化剂(Ishii体系)应用于多种烃类化合物及其衍生物的分子氧氧化反应以来,基于NHPI衍生物及其类似物的催化氧化体系的研究层出不穷,大量综述报道了该领域的研究进展[2-8]。该类催化剂一直受到催化领域广泛关注的主要原因是其在温和条件下具有的卓越催化氧化性能,并能实现目标产物高选择性制备和反应条件的无金属无溶剂化,具有潜在的工业化应用前景。
尽管氮氧自由基有机催化剂在大量的催化氧化反应中显示出许多优点,但仍有较多因素限制其工业化应用进程,如催化剂的热稳定性差[4,9]、可回收循环套用性差[4]、烃类底物中的可溶性差(需要极性溶剂溶解)[10]和使用量大[2-8]。此外,虽然催化剂可配合使用的助催化剂种类繁多[11-12],但大多数在反应中会分解或转化,极大地增加了产物分离等方面的困难。近年来,该领域的研究主要是围绕这几个方面的挑战展开,主要体现在氮氧自由基催化剂结构(苯环或萘环、丁二酰亚胺环或NOH基团)的修饰与改变。如多氮氧自由基催化剂N,N′,N″-三羟基异氰基尿酸(THICA)[11,13]和N,N′-二羟基邻苯二甲酰亚胺(NDHPI)[14],既提高了催化剂的热稳定性,也降低了催化剂的使用量;疏水链修饰的氮氧自由基催化剂提高了烃类底物中的溶解性[10,15];金属有机框架材料支载氮氧自由基催化剂实现了无溶剂催化氧化[16];离子液体/聚合物/硅材料支载氮氧自由基催化剂,提高了催化剂的可回收套用性能[17-18];萘酰亚胺类光敏分子修饰氮氧自由基催化剂减少了助催化剂的使用[19];芳/烷氧基修饰氮氧自由基催化剂(N-alkoxyphthalimides)实现了无金属无溶剂下的光或热诱发的催化氧化反应[20]。
本文在文献[11-12,18,20-23]的基础上,以甲苯为模型底物,采用理论方法研究了3种基于吡啶环和吡嗪环取代NHPI结构中苯环的含氮杂环氮氧自由基催化剂,分别为N-羟基-2,3-吡啶二甲酰亚胺(NHQI)、N-羟基-3,4-吡啶二甲酰亚胺(NHCI)和6-羟基-吡咯并[3,4-b]吡嗪-5,7-二酮(HPPDO)(见图1),并以盐酸为模型考察了质子酸对这类催化剂结构与催化活性(夺取氢原子的能垒)的影响。通过本文的研究,可以更好地理解这些催化剂在催化氧化反应中的本征催化机制、结构与活性关系以及产物酸对催化剂活性的本征影响。
1 实验方法
本文的理论计算均在Gaussian 09软件[24]上操作完成,并采用了密度泛函理论方法B3LYP。B3LYP方法已广泛应用于氮氧自由基催化剂相关的理论计算研究中[11-12,18,20-23]。所有分子结构的几何优化和频率分析均采用B3LYP/6-311+G(d)方法,并通过分析对角化Hessian矩阵和振动模式,确保所有结构为低能量稳定点且无虚频,而过渡态有且仅有一个虚频且其振动方向分别指向反应物与产物。过渡态的合理性采用内禀反应坐标(IRC)方法进行了验证[25]。氮氧自由基夺取甲苯中甲基氢原子的能垒采用B3LYP/6-311++G(d,p)//B3LYP/6-311+G(d)方法计算。该方法准确可靠,能给出较理想的能垒数据[11,21-23]。所有氮氧自由基前体NO—H键能采用B3LYP/6-311+G(d)方法并结合与苯酚(O—H键能为371.3 kJ/mol[11])的等键反应进行计算。采用B3LYP/6-31G(d,p)方法扫描了催化剂的二面角C—N—O—H的势能面,步长为5度,共37步。
2 结果与讨论
2.1 催化剂的结构与电子性质

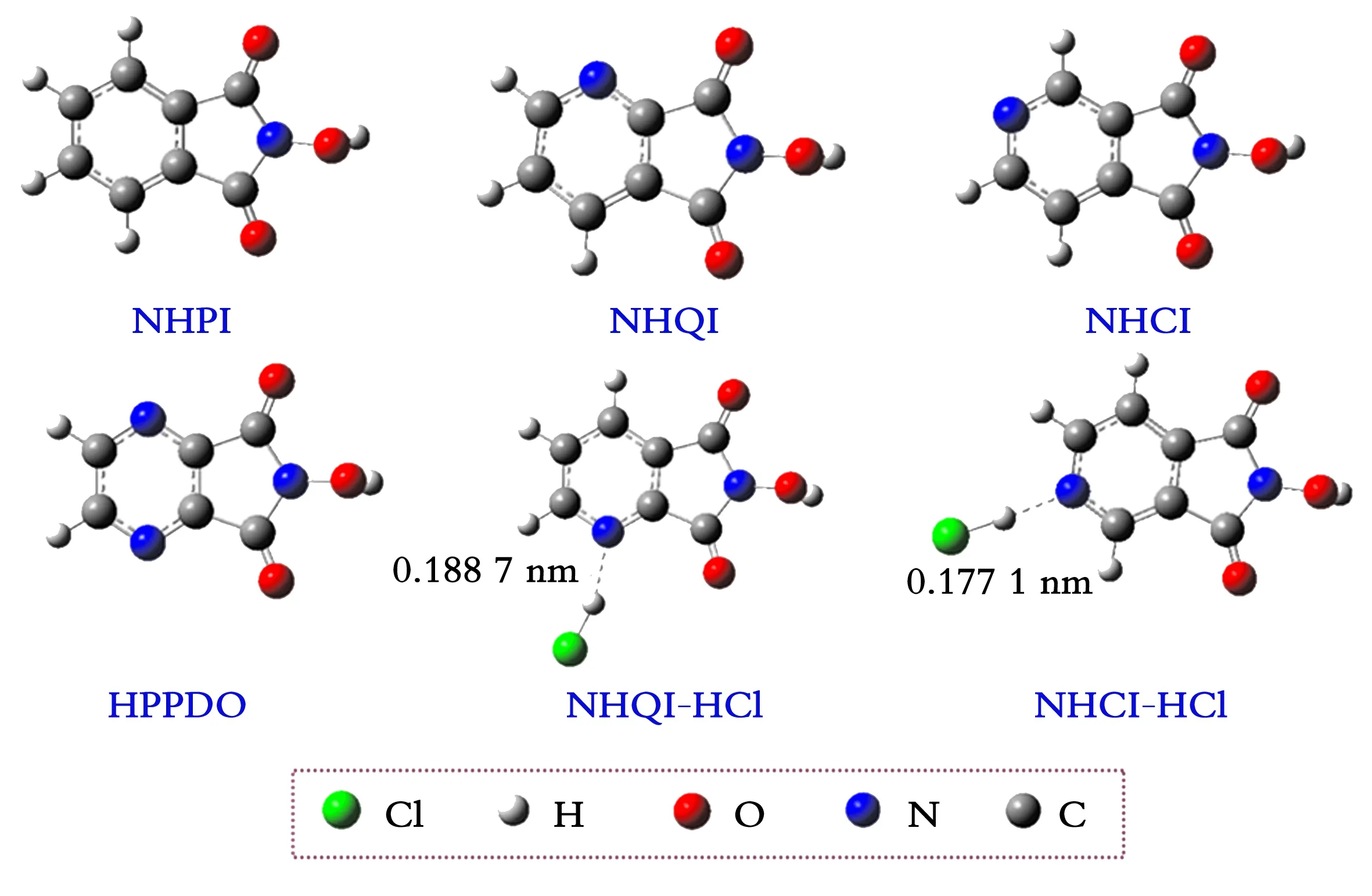
图1 B3LYP/6-311+G(d)水平下氮氧自由基催化剂的结构
催化剂的几何参数和电子参数见表1。由表1中催化剂的几何参数可知,含氮六元杂环(吡啶环和吡嗪环)催化剂的N—O—H键角和N—OH键长几乎相同,而且不受催化剂N原子周围HCl存在的影响,说明这些催化剂在几何结构没有差别。其中,这些催化剂的N—OH键角比NHPI大约4°,N—OH键长与NHPI相差不大。催化剂失去NOH基团中的氢原子后便可形成氮氧自由基N—O·。所有氮氧自由基中的N—O键长比催化剂中的N—O键长缩短了约0.012 0 nm,这主要是因为N—O·中氮原子上的部分孤对电子离域至氧原子上。其中,所有氮氧自由基的N—O键长几乎相同。由此可见,催化剂的几何结构差异不明显。

表1 氮氧自由基催化剂的结构与电子性质
由表1中催化剂的电子参数可知,催化剂SDN值的大小顺序是:NHPI>NHQI>NHCI>HPPDO;催化剂SDO值的大小顺序是:NHCI>NHQI>HPPDO=NHPI。文献[11-12,18,20-23]发现氮氧自由基中氮原子自旋密度越小,氧原子自旋密度越大,该催化剂的取代基具有吸电子取代效应,其催化活性就越高。由此推测,NHQI、NHCI和HPPDO的催化活性均高于NHPI。HCl分子能增大NHCI和NHQI的SDO值,减小SDN值,说明质子酸一定程度上可提高催化剂的催化活性。
2.2 催化剂的热化学性质
根据催化剂与苯酚的等构反应计算催化剂的NO—H键能,结果见表2。大量研究表明,氮氧自由基催化剂在没有自由基引发剂的作用下的催化效率受到催化剂NO—H键能的影响。NO—H键能越大,催化剂的催化活性就越高;NO—H键能过大,催化剂就越难通过与氧化反应中间体过氧自由基反应生成氮氧自由基和过氧化物,那么产生的氮氧自由基数大大降低,从而影响整体的催化效率[26]。因此,氮氧自由基催化剂需要具有合适的键能用以保证高效的催化效率。
从表2中可以看出,NHQI、NHCI和HPPDO的NO—H键能均比NHPI大,但是其相互之间键能相差不大,NO—H键能大小顺序为HPPDO>NHCI>NHQI。这表明对同一个底物而言,他们在热力学上比NHPI更活泼。当NHCI和NHQI的含氮六元杂环氮原子旁存在HCl分子时,催化剂的NO—H键能分别增大约4.1 kJ/mol 和3.6 kJ/mol。由于催化剂与氢键溶剂间的氢键相互作用,NHPI的理论NO—H键能要比其实验值小约29.3 kJ/mol[12,27]。由此推测,这些催化剂的真实NO—H键能均在推荐的合适范围(355.6~397.5 kJ/mol)[5]。因此,这些催化剂均可以在无助催化剂的情况下催化分子氧氧化烃类底物。该结论也得到了文献[28]的支持。在该实验中,NHQI、NHCI和HPPDO均可在无助催化剂存在下催化甲苯氧化,但是苯甲醛的选择性最高,反应的转化率相对较低。

表2 B3LYP/6-311+G(d)水平下氮氧自由基 催化剂的催化相关能量性质 kJ/mol
注:括号内数字为B3LYP/6-311++G(d,p)//B3LYP/6-311+G(d)水平下的能垒。
2.3 催化剂的催化活性
大量研究表明,氮氧自由基夺取底物氢原子的过程是该类催化剂催化氧化底物过程中的关键步骤[2-8]。氮氧自由基夺取甲苯甲基氢原子的能垒及其焓变数据见表2。氮氧自由基夺取甲苯甲基氢原子的过渡态结构图及其虚频数据见图2。

图2 B3LYP/6-311+G(d)水平下氮氧自由基催化剂夺氢反应的过渡态结构及其唯一虚频值
NHPI、NHQI、NHCI和HPPDO的能垒大小顺序均为NHPI>NHQI>NHCI>HPPDO,说明NHQI、NHCI和HPPDO的催化活性优于NHPI,这与前面分析的氮氧自由基氮原子与氧原子自旋密度分布预测的活性规律一致。这些催化剂的夺氢焓变均为正值,说明催化夺氢关键步骤在热力学上是吸热反应。该焓变大小顺序与夺氢能垒顺序一致,这与前面讨论的催化剂NO—H键能规律一致。当然,含氮六元杂环氮氧自由基的夺氢焓变在理论方法误差范围内可以认为是一致的。由此可见,氮原子掺杂在NHPI苯环中的位置与数量对催化剂的活性有一定的影响,其中,氮原子越多,催化剂催化活性越高,这与文献[18]含氮杂环多羟胺催化剂的研究结论一致。HPPDO的夺氢活性与高效的多羟胺催化剂NDHPI[14](在B3LYP/6-311++G(d,p)//B3LYP/6-311+G(d)水平下为43.5 kJ/mol[12])几乎相同。然而,通过总结相关实验,在相似反应条件下,HPPDO的催化活性并没有NDHPI高[28],可能的原因是因为其含氮结构与金属盐助催化剂配位导致催化活性受到影响。特别需要指出的是,在相同计算水平下,含氮六元杂环催化剂的催化活性明显比含氮五元杂环催化剂高[21]。因此,合成含氮六元杂环类催化剂具有一定的实际应用价值。当然,含氮五元杂环类催化剂可以修饰为离子液体支载催化剂[21],其具有良好的可回收套用性能。此外,NHQI和NHCI的含氮杂环氮原子在与质子酸HCl相互作用后,其夺氢能垒分别降低了5.4 kJ/mol和6.4 kJ/mol,这说明质子酸可以提高这类含氮杂环的催化剂的催化活性。由此推测,含氮六元杂环催化剂在催化氧化过程中还会受到反应产物酸或极性溶剂的影响。因此,深入认识质子型物质或氢键物质(溶剂或产物)对这类催化剂的影响有助于更好地在实际反应中使用这类催化剂。
3 结 论
采用理论方法研究了3种含氮六元杂环氮氧自由基催化剂的结构与催化活性,考察了模拟产物/溶剂质子酸HCl对这类催化剂催化活性的影响,研究结果有助于加深对这类催化剂的优点与局限性的认识。研究表明,氮原子掺杂NHPI的苯环结构不会显著改变催化剂的几何结构,但会显著改变其氮氧自由基中活性位点N—O·基团上氮原子与氧原子的自旋密度分布,从而提高了催化剂的催化活性。催化剂的活性大小顺序为HPPDO> NHCI> NHQI> NHPI,其中HPPDO的活性与高效催化剂NDHPI几乎相同。另外,质子型HCl可以提高NHQI和NHCI的催化活性。由此可以推测,增加NHPI苯环中氮原子数量或催化氧化体系中存在质子型物质(溶剂或产物)可在一定程度上提高催化剂的催化活性。当然,金属盐助催化剂对这类含氮杂环催化剂的催化活性的影响也很重要,但比较复杂。由于金属与氮原子之间存在强的配位作用,因此,后续的相关研究应对该作用加以关注。
[1] Ishii Y,Nakayama K,Takeno M,et al. A novel catalysis of N-hydroxyphthalimide in the oxidation of organic substrates by molecular oxygen[J]. J. Org. Chem.,1995,60:3934-3935.
[2] Sheldon R A,Arends I W C E. Organocatalytic oxidations mediated by nitroxyl radicals[J]. Adv. Synth. Catal.,2004,346:1051-1071.
[3] Ishii Y,Sakaguchi S. Recent progress in aerobic oxidation of hydrocarbons by N-hydroxyimides[J]. Catal. Today,2006,117:105-113.
[4] Recupero F,Punta C. Free radical functionalization of organic compounds catalyzed by N-hydroxyphthalimide[J]. Chem. Rev.,2007,107:3800-3842.
[5] Coseri S. Phthalimide-N—Oxyl (PINO) radical, a powerful catalytic agent: Its generation and versatility towards various organic substrates[J]. Catal. Rev.,2009,51:218-292.
[6] Chen K,Zhang P,Wang Y,et al. Metal-free allylic/benzylic oxidation strategies with molecular oxygen: Recent advances and future prospects[J]. Green Chem.,2014,16:2344-2374.
[7] 谢海英,陈可先,姚加,等.N-羟基邻苯二甲酰亚胺类羟胺有机催化剂在分子氧氧化研究中的支载策略[J].化学研究, 2016,27(2):135-143.
[8] Chen K,Xie H. Selective aerobic oxidation promoted by highly efficient multi-nitroxyl organocatalysts[J]. Chin. J. Catal.,2017,38:625-635.
[9] Cai Y,Koshino N,Saha B,et al. Kinetics of self-decomposition and hydrogen atom transfer reactions of substituted phthalimide N—Oxyl radicals in acetic acid[J]. J. Org. Chem.,2005,70:238-243.
[10] Petroselli M,Franchi P,Lucarini M,et al. Aerobic oxidation of alkylaromatics using a lipophilic N-hydroxyphthalimide: Overcoming the industrial limit of catalyst solubility[J]. Chem. Sus. Chem.,2014,7:2695-2703.
[11] Chen K,Jia L,Dao R,et al. Theoretical studies on multi-hydroxyimides as highly efcient catalysts for aerobic oxidation[J]. Chem. Phys. Chem.,2013,14:179-184.
[12] 陈可先. N-羟基亚胺类有机催化剂的设计及其催化氧化机理研究[D]. 杭州:浙江大学,2013.
[13] Hirai N,Sawatari N,Nakamura N,et al. Oxidation of substituted toluenes with molecular oxygen in the presence of N,N′,N′′-trihydroxyisocyanuric acid as a key catalyst[J]. J. Org. Chem.,2003,68:6587-6590.
[14] Shibamoto A,Sakaguchi S,Ishii Y. Aerobic oxidation of ethane to acetic acid catalyzed by N,N-dihydroxypyromellitimide combined with Co species[J]. Tetrahedron Lett.,2002,43:8859-8861.
[15] Petroselli M,Melone L,Cametti M,et al. Lipophilic N-hydroxyphthalimide catalysts for the aerobic oxidation of cumene: Towards solvent-free conditions and back [J]. Chem. Eur. J.,2017,23:10616-10625.
[16] Dhakshinamoorthy A,Alvaro M,Garcia H. Aerobic oxidation of cycloalkenes catalyzed by iron metal organic framework containing N-hydroxyphthalimide[J]. J. Catal.,2012,289:259-265.
[17] Hermans I,Deun J V,Houthoofd K,et al. Silica-immobilized N-hydroxyphthalimide: An efcient heterogeneous autoxidation catalyst[J]. J. Catal.,2007,251:204-212.
[18] 陈可先. 用于空气氧化的羟胺有机催化剂的设计研究[R]. 杭州:浙江大学博士后研究工作报告,2016.
[19] Melone L,Franchi P,Lucarini M,et al. Sunlight induced oxidative photoactivation of N-hydroxyphthalimide mediated by naphthalene imides[J]. Adv. Synth. Catal.,2013,355:3210-3220.
[20] Chen K,Xie H,Mao J,et al. Structure-performance landscape of N-alkoxyphthalimides as organocatalysts in aerobic oxidation[J]. J. Catal.,2016,344:229-235.
[21] Chen K,Xie H,Jiang K,et al. Theoretical study on the catalytic reactivity of N-hydroxyphthalimide tuned by different heterocyclic substitutions on its phenyl ring for aerobic oxidation[J]. Chem. Phys. Lett.,2016,657:135-141.
[22] Du H,Shen Q,Feng L,et al. Structure-reactivity relationships of N-hydroxysaccharin analogues as organocatalysts for aerobic oxidation[J]. Comput. Theor. Chem.,2017,1115:223-228.
[23] Chen K,Mao J,Shen S,et al. Mechanistic elucidation of the origins of the hydrogen-abstraction reactivity of hydroxyimide organocatalysts and its application in catalyst design[J]. Chem. Phys. Lett.,2017,684:225-232.
[24] Frisch M J,Trucks G W,Schlegel H B,et al. Gaussian 09, Revision D.01[CP]. Gaussian, Inc.,Wallingford, CT, 2009.
[25] Gonzalez C,Schlegel H B. An improved algorithm for reaction path following[J]. J. Chem. Phys.,1989,90:2154-2161.
[26] Hermans I,Jacobs P,Peeters J. Autoxidation catalysis with N-hydroxyimides: More-reactive radicals or just more radicals[J].Phys. Chem. Chem. Phys.,2007,9:686-690.
[27] da Silva G,Bozzelli J W. Theoretical study of the oxidation catalyst N-hydroxyphthalimide (NHPI): Thermochemical properties, internal rotor potential, and gas- and liquid-phase bond dissociation energies[J]. J. Phys. Chem. C,2007,111:5760-5765.
[28] Zhang Q,Chen C,Xu J,et al. A complexation promoted organic N-hydroxy catalytic system for selective oxidation of toluene[J]. Adv. Synth. Catal.,2011,353:226-230.
Structure-Activity Relationship of Nitrogenous Six-Membered Heterocyclic Nitroxide Radical Organocatalysts
Chen Kexian1, Yin Lu2, Xie Haiying3
(1.SchoolofFoodScienceandBiotechnology,ZhejiangGongshangUniversity,HangzhouZhejiang310018,China; 2.DepartmentofChemistry,ZhejiangUniversity,HangzhouZhejiang310027,China; 3.ZhejiangNHUCompanyLtd.,ShaoxingZhejiang312500,China)
The catalytic oxidation of molecular oxygen based on nitroxide radical organocatalysts is one of the hot topics in the field of catalysis in recent years. The structures and catalytic activity of the nitrogenous six-membered heterocyclic ring obtained by the pyridine ring and the pyrazine ring substituted for the benzene ring of N-Hydroxyphthalimide (NHPI) were studied by theoretical methods. The effect of protonic acid HCl on the catalytic activity of this kind of catalyst was investigated. The results show that the catalytic activity of nitrogenous six-membered heterocyclic ring catalyst is higher than that of NHPI, even some of the catalyst is comparable to that of N,N′-dihydroxypyromellitimide (NDHPI); pyrazine pyridine ring chain is helpful to improve the catalytic activity of the catalyst; HCl hydrogen bond interaction with the aromatic ring of these catalysts can improve the catalytic activity of the catalyst. This study is helpful to deepen the understanding of the intrinsic activity of this kind of catalyst and also to provide theoretical guidance for the catalytic mechanism and catalytic oxidation experiment of this kind of catalyst.
N-hydroxyphthalimide; Heterocyclic ring; Density functional theory; Catalytic oxidation
2017-09-06
2017-09-26
中国博士后科学基金项目(2014M551746);清洁能源利用国家重点实验室开放基金项目(ZJUCEU2014013)。
陈可先(1983-),男,博士,助理研究员,从事有机催化与空气氧化方面的研究;E-mail:kxchem@zjgsu.edu.cn。
谢海英(1983-),女,硕士,工程师,从事医药化工中的催化氧化技术研究;E-mail:xiehaiying0323@163.com。
1672-6952(2017)06-0001-05
投稿网址:http://journal.lnpu.edu.cn
O634.32
A
10.3969/j.issn.1672-6952.2017.06.001
(编辑 宋官龙)

