菊粉酶基因克隆表达与油脂的组分分析
赵春海,王志鹏,池振明
(1.滨州职业学院 生物工程学院,山东 滨州 256603;2.中国水产科学研究院 黄海水产研究所,山东 青岛 266071;3.中国海洋大学 海洋生命学院,山东 青岛 266000)
菊粉酶基因克隆表达与油脂的组分分析
赵春海1,王志鹏2,池振明3
(1.滨州职业学院 生物工程学院,山东 滨州 256603;2.中国水产科学研究院 黄海水产研究所,山东 青岛 266071;3.中国海洋大学 海洋生命学院,山东 青岛 266000)
为了实现解脂亚罗威亚酵母(Yarrowia lipolytica)直接利用菊粉进行油脂生产,将外切菊粉酶基因INU1与表达质粒pINA1317连接,在解脂亚罗威亚酵母(Y.lipolytica)ACA-DC尿嘧啶缺陷突变菌株中表达。以尿嘧啶缺陷型筛选作为筛选标记获得转化子C37,经过培养菊粉酶酶活达到37.15 U/mL。在2 L发酵罐中,转化子C37以菊粉为底物进行发酵,油脂产量和细胞干质量分别为49%和14 g/L。脂肪酸分析结果显示棕榈酸、⒉脂酸和油酸总和占总脂肪酸的92%以上,其中油酸含量高达59%,表明通过菊粉酶基因在解脂亚罗威亚酵母中的表达,实现了以菊粉为底物一步发酵产单细胞油脂。
解脂亚罗威亚酵母;菊粉酶;单细胞油脂;基因表达
现今环境问题日益严重,尤其是大气污染,因此生物油脂进行柴油的生产备受关注。生物柴油不仅可以降解,而且还可以应用于现存的机车中,产生较少量的有害气体(如二氧化硫),生物柴油产生的二氧化碳净排放量仅为传统化石柴油的22%[1-2]。生物柴油可以通过生物油中的甘油三酯的酯交换反应来生产[3-5],单细胞油脂来源广泛,多种微生物(如酵母、细菌、微藻)都能够积累,单细胞油脂中研究较多的是酵母和霉菌细胞内的油脂,研究表明,酵母和霉菌油脂积累高于其他生物[6],同时酵母具有生长快、积累油脂含量高、与植物油脂十分相似等特点。微生物油脂(如单细胞油脂)可以通过化学和酶的催化转化成生物柴油[7]。目前报道多种酵母都能够积累油脂,如白色隐球酵母(Cryptococcusalbidus)、弯曲隐球菌(Cryptococcuscurvatus)、圆红冬孢酵母菌(Rhodosporidium toruloides)、胶红酵母(Rhodotorula mucilaginosa)、粘红酵母(Rhodotorula glutinis)等,同时CHUN H Z等[8]研究结果表明,解脂亚罗威亚酵母(Yarrowialipolytica)以葡萄糖、木糖、甘露糖、甘油、水解淀粉以及农副产品残留物为原料,可发酵产生单细胞油脂,油脂积累可达40%。
目前高昂的制造成本是生物柴油工业化应用的主要障碍,生物柴油高昂的制造成本与原料密切相关,同时也失去市场竞争力[9]。因此用廉价的原料是制造生物柴油从而减低其成本的一个关键。为了降低酵母生产油脂的成本,必须寻找能替代葡萄糖、谷物为碳源的生产原料,已有报道采用雪莲果[10]、纤维素[11]、半纤维素[12]、甘蔗糖液[13]、甘薯[14]、秸秆[15]、生物工业副产物为原料进行单细胞油脂的发酵生产[16-19]。
菊粉(菊糖)作为一种贮藏性碳水化合物存在于多种植物的根和茎中[20],菊粉可以用于高果糖浆生产,通过微生物发酵生产酒精、油脂,也可以在菊粉酶水解下生产寡菊糖等可再生原料,近来受到越来越多的关注[21-22]。菊粉酶是一种水解酶,它作用于β-2,1糖苷键并将菊粉降解小分子果糖与葡萄糖。目前来源于季也蒙毕赤酵母(Meyerozyma guilliermondii)、马克思克鲁维酵母(Kluyveromyces marxianus),黑曲霉(Aspergillus niger)的菊粉酶基因已经被深入研究并被克隆表达,重组酶被分离、鉴定[21]。
解脂亚罗威亚酵母(Y.lipolytica)ACA-DC是一株油脂酵母,能积累大量单细胞油脂(每克干物质含油脂0.44~0.54 g,干物质达到9~12 g/L)[3-7]。但是解脂亚罗威亚酵母(Y.lipolytica)不含有菊粉酶基因,无法直接利用菊粉进行生长合成油脂,为了简化生产工艺,使解脂亚罗威亚酵母(Y.lipolytica)ACA-DC直接利用菊粉和含有菊粉的物质来积累油脂,降低油脂生产成本,本研究克隆了马克思克鲁维酵母(K.marxianus)CBS6556中的菊粉酶基因,并且与表达载体pINA1317连接转化尿嘧啶缺陷型的Y.lipolytica ACA-DC。以期实现一步发酵生产单细胞油脂,拓宽单细胞油脂合成原料来源,简化发酵工艺,同时为生物柴油的开发奠定油脂基础。
1 材料与方法
1.1 材料与试剂
1.1.1 培养基
无氨基氮培养基:硫酸铵5g/L,无氨基酵母氮源1.79g/L,葡萄糖10 g/L,共同灭菌,固体培养基加入2.5%琼脂。
突变株诱变培养基:5-氟乳清酸(5-fluoro whey acid,5-FOA)0.75 g/L,葡萄糖20 g/L,硫酸铵5 g/L,无氨基氮源1.7 g/L,琼脂25 g/L。
LB液体培养基:胰蛋白胨10 g/L,酵母浸膏5 g/L,NaCl 5 g/L,pH7.0。
筛选培养基:将冷却至50℃的LB液体培养基加入终质量浓度为100.0 μg/mL的氨苄青霉素,琼脂粉2.5%。
发酵培养基:菊糖20g/L,KH2PO40.3g/L,MgSO40.13g/L,NH4Cl 1.3 g/L,酵母粉1.3 g/L,pH6.0。
1.1.2 菌株与载体
pMD18-T、pMD19-T质粒:Takara宝生物工程(大连)有限公司;pINA1317质粒:国际友人Catherine Madzak馈赠,中国海洋大学微生物实验室保存,质粒结构如图1所示;菊粉酶基因的pMD18-T质粒(即pMD18-T-INU1):由本实验室构建,并保存于中国海洋大学微生物实验室;解脂亚罗威亚酵母(Yarrowia lipolytica)ACA-DC:希腊学者Dr.Seraphim Papanikolaou赠㈣[3-5];大肠杆菌(Escherichia coli):本实验室保藏。
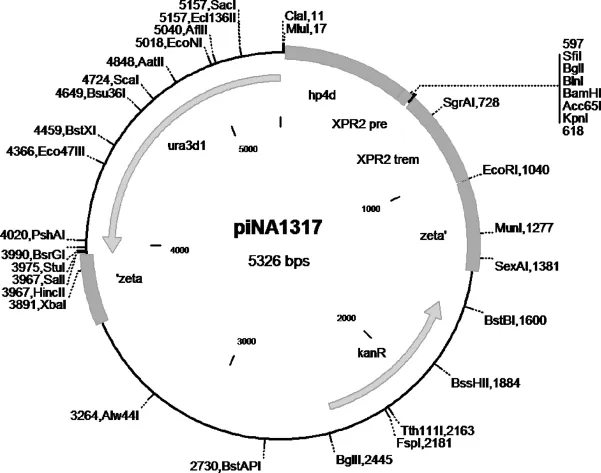
图1 pINA1317质粒结构Fig.1 Structure of pINA1317 plasmid
1.1.3 主要试剂
异丙基硫代-β-D-半乳糖苷(isopropyl-β-D-Thiogalactoside,IPTG)(分析纯):北京百奥莱博科技有限公司;5-溴-4-氯-3-吲哚-β-D半乳糖苷(5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside,X-gal)(分析纯):美国Amresco公司;聚乙二醇4000-醋酸锂(分析纯):国药集团化学试剂有限公司;基因组提取、质粒纯化、聚合酶链反应(polymerase chain reaction,PCR)扩增、切胶回收试剂盒:宝生物工程(大连)有限公司。
1.2 仪器与设备
Microfuge20高速冷冻离心机:德国Sigma公司;FA2204电子精密天平:上海京孚仪器有限公司;BYSXT-04索氏提取器:上海秉越电子仪器有限公司;Olimpus CX23显微镜:上海赖氏电子科技有限公司;UV-2102 C型紫外分光光度计:上海圣科仪器设备有限公司;2720型PCR仪:德国Eppendorf公司;Mastercycler 5333 GC6890A气相色谱仪:山东博科生物产业有限公司。
1.3 方法
1.3.1 尿嘧啶缺陷型的诱变筛选
pINA1317质粒的筛选标记为尿嘧啶缺陷型,为了便于快速对转化子的筛选,方法参照文献[19]对解脂亚罗威亚酵母(Y.lipolytica)ACA-DC进行尿嘧啶缺陷型诱变筛选。
1.3.2 菊糖酶基因的克隆以及表达载体的构建
将实验室保存pMD18-T-INU1中的菊粉酶基因通过PCR方法分离[2],将pINA1317质粒进行SfiI、BamHI双酶切,通过连接酶将含有SfiI、BamHI的菊粉酶基因连接到经双酶切后pINA1317中,设计引物增加SfiI、BamHI限制性酶切位点,上下游引物如下:
上游引物:TCAGTTATCAATTACAAGAGAGATGGTGACAGC
下游引物:TCAATGGTGATGGTGGTGATGAAGGTTAAATTGGGTAACGPCR
反应采用50.0 μL体系;PCR反应条件:94℃预变性8 min,94℃变性30 s,51℃退火1.5 min,72℃延伸3 min,30个循环。PCR产物的回收:经鉴定后的菊粉酶基因在紫外灯下切下目标带,按照基因回收试剂盒的操作步骤进行菊粉酶基因回收。
(1)质粒pMD19-T连接
通过菊粉酶基因体外PCR扩增,在TaqDNA聚合酶作用下,PCR切胶回收产物3′末端A与含有T末端的pMD19-T在20.0 μL反应体系中16℃过夜连接,得到pMD19-T-INU1克隆质粒。
(2)pMD19-T-INU1在大肠杆菌中验证
将过夜连接的pMD19-T-INU1质粒转化进入大肠杆菌DH5α感受态细胞中,将转化后的DH5α细胞培养混合液分别涂布于含有IPTG和X-gal的平板上,37℃培养,观察菌落颜色。初步筛选白色菌落为阳性菌落,并进一步接种于加氨苄抗生素的筛选培养基中,37℃培养24 h[19]。
(3)pINA1317-INU1油脂酵母表达载体的构建
在25 μL反应体系进行BamHI和SfiI双酶切质粒,参照文献 [19]中的方法,进行转化油脂酵母,获得还有pINA1317-INU1的油脂酵母。
1.3.3 单细胞油脂组分分析
将发酵的菌体离心干燥研磨成菌粉,采用索氏提取方法进行油脂提取[22],加入,3 mL15%三氟化硼甲醇溶液混匀,50℃水浴1 h,加入等体积正己烷,加入1/2体积的饱和NaCl溶液,混匀,通过气相色谱仪进行脂肪酸组分分析[22]。
2 结果与分析
2.1 菊粉酶基因的克隆与验证
将pMD18-T-INU1中菊粉酶基因PCR扩增,扩增产物结果和基因验证结果见图2。

图2 pMD18-T-INU1中菊粉酶基因PCR扩增产物结果Fig.2 Results of PCR amplification products of inulinase gene in pMD18-T-INU1
由图2可知,从保存在pMD18-T-INU1中获得菊粉酶基因用于构建表达载体,为了便于与表达载体pINA1317连接,PCR引物设计加入限制性内切酶SfiI和BamHI对应位点,1⒕道扩增产物电⒕结果大小约为1500bp,回收PCR产物,转化大肠杆菌DH5α,测序验证扩增基因的序列,结果见图3。

图3 pMD19-T-INU1的PCR扩增产物结果Fig.3 Results of PCR amplification products of pMD19-T-INU1
由图3可知,1、2⒕道中PCR产物大小约为1 500 bp,与已知菊粉酶基因大小相似,基本判定菊粉酶基因已经被连接到pMD19-T中,为了进一步确定还需进行测序进验证,测序结果与已知基因比对结果一致,可以用于菊粉酶基因重质粒的构建。
切胶回收pMD19-T-INU1中的菊粉酶基因片段,用限制性内切酶SfiI与BamHI对pINA1317进行双酶,T4连接酶将带有粘性末端A的菊粉酶基因与酶切后的pINA1317质粒片段连接,构建表达质粒。将表达质粒转化DH5α,挑取含有菊粉酶基因的阳性转化子,提取质粒后进行SfiI与BamHI双酶切验证,结果见图4。
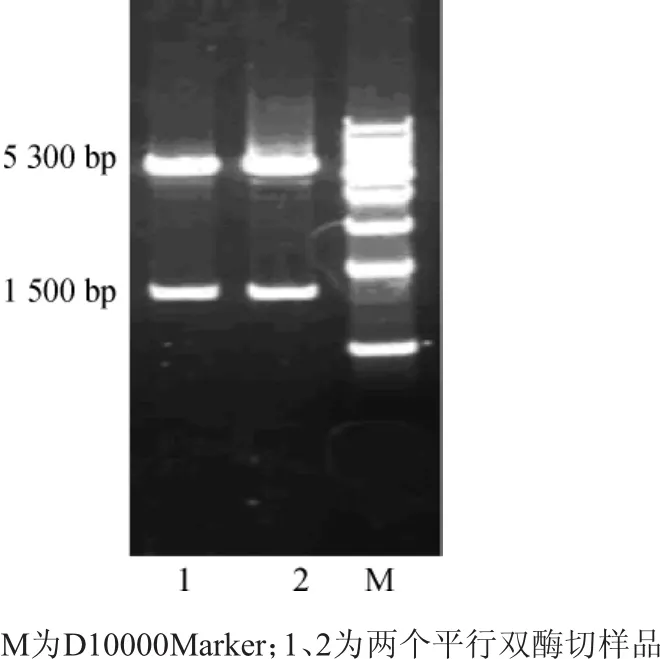
图4 pINA1317-INU1双酶切电⒕条带Fig.4 Double-enzyme cutting electrophoretic bands of pINA1317-INU1
由图4可知,pINA1317-INU1经双酶切结果分为上下两条电⒕带,上面大片段5300bp,为pINA1317,下面小片段大小为1 500 bp,为菊粉酶基因,菊粉酶基因已经在表达质粒pINA1317-INU1中构建成功,可以进行Y.lipolyticaACA-DC酵母转化。
2.2 pINA1317-INU1转化片段制备
用Not I酶切pINA1317-INU1,回收酶切的DNA片段进行电⒕检测,结果见图5。

图5 SfiI和BamHI酶切pINA1317-INU1回收条带Fig.5 Recovered bands fromSfiI andBamHI digestion of pINA1317-INU1
由图5可知,大片段是含有菊粉酶基因的DNA序列,小片段是pINA1317质粒片段,小片段约2 210 bp左右,大片段约4 700 bp,由pINA1317质粒图谱大小和酶切位点可知大片段的是包含INU1基因的待转化片段,回收线性化大片段,用于尿嘧啶油脂突变株的转化。
2.3 Y.lipolyticaACA-DC尿嘧啶突变株的筛选
将菌株Y.lipolyticaACA-DC划线接种到含有尿嘧啶的培养基和不含尿嘧啶的培养基上进行筛选[19],结果如图6所示。

图6 尿嘧啶缺陷型解脂亚罗威亚酵母突变株的筛选结果Fig.6 Screening results of uracil defectiveY.lipolyticawith uracil deficiency
由图6可知,Y.lipolyticaACA-DC经过诱变筛选,突变株能够在含有尿嘧啶的培养基上生长,而在不含尿嘧啶的对照培养基中则不能生长,表明获得尿嘧啶缺陷型的Y.lipolyticaACA-D,可用于菊粉酶基因的表达。
2.4 转化子筛选[19,22]
采用NotI酶切pINA1317-INU1转化质粒,电⒕回收纯化分离大片段转化的尿嘧啶突变菌株Y.lipolytica缺陷型,转化成功的菌株以字母C命名转化子,对菊粉酶酶活超过25 U/mL以上的4菌株进行命名并保存,结果如表1所示。

表1 转化子中菊粉酶酶活测定结果Table 1 Determination results of inulinase activity of the transformants
由表1可知,转化子C37、C95菊粉酶活相对较高,超过30 U/mL,以不含菊粉酶基因的野生菌株为对照,野生型酶活为0,证明菊粉酶基因已经在转化子中成功表达,其中转化子C37酶活最高,达到(37.15±0.40)U/mL。
2.5 2 L发酵罐中菌株发酵产单细胞油脂
在2L发酵罐中,转化子C37生长和产油情况如表2所示。

表2 以菊粉为主要碳源的培养基上菌体生长、油脂产量Table 2 Cells growth and oil yield in the medium with inulin as main carbon source
由表2可知,在2L发酵罐中,以菊粉为主要碳源的培养基上,经过分批发酵80 h,细胞干质量和油脂产量分别为14.12g/L、49.23%。野生型解脂亚罗威亚酵母菌株在甘油和动物油脂为主要营养物质发酵时细胞干质量为9~12g/L[9,22],油脂产量在44%~54%[22],生物量和油脂积累量表明转化子C37与野生型原始菌株相比均有提高,转化子C37能够利用来源更为充足的菊粉、菊糖为碳源进行油脂生产。
2.6 油脂的脂肪酸组分测定
收集转化子C37细胞,105℃干燥恒质量后制备菌粉,通过索氏提取方法进行细胞油脂提取,采用气相色谱仪分析油脂中脂肪酸的组成[22],结果如表3所示。

表3 转化子C37所产油脂中脂肪酸组分分析Table 3 Component analysis of fatty acids in oil produced by transformant C37
由表3可知,棕榈酸、⒉脂酸和油酸3种脂肪酸总和超过92%以上,菌株C37发酵积累合成的油脂中6种脂肪酸与文献[22]中报道的油脂酵母的脂肪酸相似。前期研究发现,在胶红酵母TJY15a在菊Ⅲ的提取物上培养时,棕榈酸、⒉脂酸和油酸3者含量之和超过87.6%[22];另外研究还发现胶红酵母TJY15a在淀粉水解物上生长时,三种脂肪酸超过85.8%,其中油酸占63.5%。本研究结果中油酸产量占59.29%,表明转化子C37与其他油脂酵母含有的脂肪酸非常相似[23-25]。这意味着转化子C37产生油脂是一种很好的生物油脂材料。
3 结论
为了将菊粉酶基因克隆到油脂酵母中,实现解脂亚罗威亚酵母(Yarrowia lipolytica)产酶,产油同时进行,本研究通过对解脂亚罗威亚酵母ACA-DC进行基因改造,获得含有菊粉酶基因的转化子C37,经过培养,菊粉酶酶活达到37.15U/mL。脂肪酸分析显示棕榈酸、亚油酸和油酸占总脂肪酸的92%以上,尤其是油酸含量高达59%,表明通过菊粉酶基因在油脂酵母中的表达,实现了以菊粉为底物一步发酵产单细胞油脂,为综合开发利用单细胞油脂提供了新的途径,也为油脂中多种脂肪酸的开发和利用奠定了原料基础。
[1]HELWANI Z,OTHMAN M R,AZIZ N,et al.Technologies for production of biodiesel focusing on green catalytic techniques:A review[J].Fuel Proc Technol,2009,90(12):1502-1514.
[2]ZHANG X H,ZHANG Q,WANG T J,et al.Efficient upgrading process for production of low quality fuel from bio-oil[J].Fuel,2016,179:312-321.
[3]PAPANIKOLAOU S,KOMAITIS M,AGGELIS G.Single cell oil(SCO)production byMortierella isabellinagrown on high-sugar content media[J].Bioresour Technol,2004,95(3):287-291.
[4]PAPANIKOLAOU S,SARANTOU S,KOMAITIS M,et al.Repression of reserve lipid turn over inCunninghamella echinulataandMortierella isabellinacultivated in multiple limited media[J].Appl Microbiol,2004,97(4):867-875.
[5]PAPANIKOLAOU S,CHEVALOT I,GALIOTOU-PANAYOTOU M,et al.Industrial derivative of tallow:a promising renewable substrate form microbial lipid,single-cell protein and lipase production byYarrowia lipolytica[J].Electron J Biotechnol,2007,10(3):1-11.
[6]MENG X,YANG J,XU X,et al.Biodiesel production from oleaginous microorganisms[J].Renew Energ,2009,34(1):1-5.
[7]PAPANIKOLAOU S,AGGELIS G.Biotechnological valorization of biodiesel derived glycerol waste through production of single cell oil and citric acid byYarrowia lipolytica[J].Lipid Technol,2009,21(4):83-87.
[8]CHUN H Z,CHI Z,ZHANG F,et al.Direct conversion of inulin and extract of tubers ofJerusalem artichokeinto single cell oil by co-cultures of Rhodotorula mucilaginosaTJY15a and immobilized inulinase-producing yeast cells[J].Bioresource Technol,2011,102(10):6128-6133.
[9]CHAO H,CHEN X F,LIAN X,et al.Single cell oil production from low-cost substrates:The possibility and potential of its industrialization[J].Biotechnol Adv,2013,31(2):129-139.
[10]CAZETTA M L,MARTINS P M M,MONTI R,et al.Yacon(Polymnia sanchifolia)extract asa substrate to produce inulinase byKluyveromyces marxianusvar.bulgaricus[J].J Food Eng,2005,66(3):301-305
[11]VIEIRA J P F,IENCZAK J L,COSTA P S,et al.Single cell oil production integrated to a sugarcane-mill:Conceptual design,process specifications and economic analysis using molasses as raw material[J].Ori Ind Crop Prod,2016,89:478-485.
[12]HAO F,CHEN Z,SHAO L C.Single cell oil production byMortierella isabellinafrom steam exploded corn stover degraded by three-stage enzymatic hydrolysis in the context of on-site enzyme production[J].Bioresource Technol,2016,216:988-995.
[13]PROBST K V,VADLANI P V.Production of single cell oil from Lipomyces starkeyiATCC 56304 using biorefinery by-products[J].Bioresource Technol,2015,198:268-275.
[14]QI S,LIN H,WANG Q,et al.Sweetpotato vines hydrolysate promotes single cell oils production ofTrichosporon fermentansin high-density molasses fermentation[J].Bioresource Technol,2015,176:249-256.
[15]DONOT F,FONTANA A,BACCOU J.C,et al.Single cell oils (SCOs)from oleaginous yeasts and moulds:production and genetics[J].Biomass Bioenerg,2014,68(5):135-150.
[16]ZHAN J M,LIN H,QI S,et al.Potential utilization of waste sweet potato vines hydrolysate as a new source for single cell oils production by Trichosporon fermentans[J].Bioresource Technol,2013,135(10):622-629.
[17]ADAM D,PAWEŁ M,WALDEMAR R.Efficient conversion of crude glycerol from various industrial wastes into single cell oil by yeast Yarrowia lipolytica[J].Bioresource Technol,2016,207:237-243.
[18]PIVETTA M R,NOVELLI P K,FLEURI L F.Inulinase activity of soybean and yacon meal fermented withAspergillus niger[J].New Biotechnol,2016,33(3):425.
[19]ZHANG T,GONG F Z,LIU G.Cloning and characterization of the inulinase gene from a marine yeastPichia guilliermondiiand its expression inPichia pastoris[J].Anton Leeuw,2009,95(1):13-22.
[20]WANG C L,LI Y,XIN F H,et al.Evaluation of single cell oil fromAureobasidium pullulansvar.melanogenum P10 isolated from mangrove ecosystems for biodiesel production[J].Process Biochem,2014,49(5):725-731.
[21]ZHANG T,GONG F,CHI Z,et al.Cloning and characterization of the inulinase gene from amarine yeastPichia guilliermondiiand its expression inPichia pastoris[J].Anton Leeuw,2009,95(1):13-22.
[22]ZHAO C H,ZHANG T,LI M,et al.Single cell oil production from hydrolysate of inulin and extract of tubers of Jerusalem artichoke by RhodotorulamucilaginosaTJY15a[J].Proc Biochem,2010,45(7):1121-1126.
[23]CARLOS R S,CARLOS J D,VANETE T S,et al.Pilot scale biodiesel production from microbial oil ofRhodosporidium toruloidesDEBB 5533 using sugarcane juice:Performance in diesel engine and preliminary economic study[J].Bioresource Technol,2017,223:259-268.
[24]CARVALHO A K F,RIVALDI J D,BARBOSA J C,et al.Biosynthesis characterization and enzymatic transesterification of single cell oil of Mucor circinelloides-A sustainable pathway for biofuel production[J].Bioresource Technol,2015,181:47-53.
[25]NEEVA B,JI Q,PATRICKK A,et al.Direct fast pyrolysis bio-oil fuel cell[J].Fuel,2016,185:85-93.
Cloning and expression of inulinase gene and analysis of oil components
ZHAO Chunhai1,WANG Zhipeng2,CHI Zhenming3
(1.College of Bioscience Engineering,Binzhou Polytechnic,Binzhou 256603,China;2.Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China;3.College of Marine Life Sciences,Ocean University of China,Qingdao 266000,China)
In order to realize oil production directly from inulin byYarrowia lipolytica,exoinulinase geneINU1was connected with expression plasmid pINA1317 and expressed in mutant strainY.lipolyticaACA-DC with uracil deficiency.With uracil deficiency as selection marker,transformant C37 was obtained and the inulase activity was up to 37.15 U/ml by culture.In 2 L fermenter,transformant C37 was fermented with inulin as substrate,the oil yield and cell dry mass were 49%and 14 g/L,respectively.The results of fatty acids analysis showed that the total contents of palmitic acid,stearic acid and oleic acid were more than 92%of total fatty acids,and the oleic acid content was up to 59%,which indicated that the one-step fermentation was realized to produce single cell oil with inulin through the expression of the inulinase gene inY.lipolytica.
Yarrowia lipolytica;inulinase;single cell oil;gene expression
Q815
0254-5071(2017)12-0115-05
10.11882/j.issn.0254-5071.2017.12.024
2017-06-15
山东省中青年科学家科研奖励基金(博士基金:BS2012SW001);山东省高等学校科技计划项目(J14LE58,J17KA122);国家自然科学基金(31500032)
赵春海(1979-),男,副教授,博士,研究方向为微生物发酵。

