MALDI-TOF质谱准内标法及其用于rhTPO复杂糖一致性研究
刘悦玫,侯利平,杨 梅,孟晓光,魏开华,*
(1.安徽医科大学 研究生院,安徽 合肥 230032;2.军事医学科学院放射与辐射医学研究所,北京 100850;3.蛋白质药物国家工程研究中心,蛋白质组学国家重点实验室,北京正旦国际科技有限责任公司,北京 102206)
MALDI-TOF质谱准内标法及其用于rhTPO复杂糖一致性研究
刘悦玫1,2,侯利平3,杨 梅3,孟晓光3,魏开华1,2,3*
(1.安徽医科大学 研究生院,安徽 合肥 230032;2.军事医学科学院放射与辐射医学研究所,北京 100850;3.蛋白质药物国家工程研究中心,蛋白质组学国家重点实验室,北京正旦国际科技有限责任公司,北京 102206)
采用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)准内标法准确测定重组人血小板生成素(rhTPO)仿制药和原研药中4类糖修饰的相对含量,并进行样本间和批间一致性比较。结合多种切糖酶逐步切除rhTPO的N-糖、唾液酸和O-糖;以牛血清白蛋白(BSA)为标准品,与样本非混合点靶;采用MALDI-TOF质谱准内标法检测,分别获得各样本完整含糖分子量及不同层次切糖后分子量;通过分子量差值计算4类糖修饰的相对含量;最后比较仿制药与原研药样本间和批间一致性。以BSA多电荷峰对rhTPO切糖前后的MALDI-TOF质谱测定值进行准内标法校正,BSA多电荷峰之间相对标准偏差(RSD)均≤0.075%,批间RSD为0.001%~0.004%,方法误差均<0.01%。rhTPO仿制药N-糖、O-糖唾液酸、O-糖和糖化糖的相对含量分别约为24.6%、2.9%、9.0%和5.1%,批间一致性良好,且总糖含量与文献值一致;rhTPO原研药N-糖、O-糖唾液酸、O-糖和糖化糖的相对含量分别约为25.6%、2.9%、7.9%和3.5%,总糖含量较文献值偏低。与rhTPO原研药相比,仿制药糖基化糖相对含量基本一致,糖化糖含量有差异。rhTPO糖化糖研究未见文献报道,其差异是不同厂家rhTPO之间差异的重要因素,主要由发酵工艺差异导致。
重组人血小板生成素(rhTPO);基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF MS);准内标法;糖含量;糖化
重组人血小板生成素(rhTPO)是利用基因重组技术由中国仓鼠卵巢细胞表达,经提纯制成的全长糖基化血小板生成素,在治疗免疫性血小板减少症方面效果显著[1]。rhTPO氨基酸序列的分子量为35.5 kDa,而实际分子量可达到57.5 kDa,与其序列分子量相比增加62%。rhTPO羧基端结构域(154~332氨基酸)为多聚糖区域,包括6个N-糖基化(N-glycosylation)、若干个O-糖基化(O-glycosylation)修饰潜在位点。根据糖基化类型,羧基端结构域可进一步分为N-糖基化结构域(154~246氨基酸)和O-糖基化结构域(247~332氨基酸)[2]。已报道rhTPO的N-糖糖型以复合型(Complex)为主[3],O-糖糖型以β(1-3)连接型为主,还含有少量其它糖型[4]。此外,rhTPO理论序列中的19个精氨酸(R)和7个赖氨酸(K)的侧链氨基及N-末端氨基可在无酶催化的条件下与醛糖或酮糖发生复杂的化学反应而引入糖化(Glycation)修饰[5-6]。这些糖修饰与rhTPO的生产工艺、特异活性和生物合成等密切相关,也会影响体内代谢和不良事件的发生[7]。rhTPO的糖修饰含量高、位点多、种类多、糖结构复杂,糖修饰研究难度大,但又是其作为新药申报临床批文所必须开展的内容[4,8]。
虽然对TPO的结构[4]和功能[9]已有一定研究,但其糖含量准确测定方面的研究却鲜有报道,尤其是未见关于rhTPO糖化糖含量研究的报道。目前常用的糖含量分析方法有化学法、色谱法和质谱法。化学法样品用量大,灵敏度低且操作繁琐,不适用于微量样品和复杂糖蛋白[10];色谱法需对糖链进行柱前衍生再结合紫外光谱、荧光光谱、质谱进行糖含量分析,操作复杂,多用于多糖中单糖含量的测定[11];随着质谱分辨率(常规检测时的分辨率一般应大于40 000)的飞速提升,高分辨率ESI-MS可以直接获取抗体等糖蛋白完整分子的准确分子量及糖含量,但实践证明,对于rhTPO这类多位点、多糖型的复杂糖蛋白来说,ESI-MS目前还难以进行准确的多电荷峰的去卷积解析,以致不能成功获得完整分子的分子量。图谱简单、灵敏度高、分子量范围宽的MALDI-TOF质谱可快速得到rhTPO等复杂糖蛋白的分子量,但MALDI-TOF质谱分辨率较低,准确度不及ESI-MS,因此,提高MALDI-TOF分子量测定准确度尤为重要。内标法可明显提高MALDI-TOF质谱测定准确度,但标准品的加入可能降低目标样本的灵敏度且可能因为峰重叠而降低结果准确度(图1上)。本文改进了内标法,称其为“准内标法”,又称“类似内标法”(Quasi-internal calibration):在同一靶点中覆盖有样品、标准品互不交叉(或交叉区域小);先采集纯样品信号,再采集纯标准品信号并累加到样品信号;最后用标准品信号校正累加有标准品信号的样品质谱图(图1下)[12],可排除内标物干扰,并获得样本的准确分子量。
本文以BSA为标准品,采用MALDI-TOF质谱准内标法测定rhTPO仿制药(国产)和原研药(国产)切除N-糖、唾液酸和O-糖前后的准确分子量,通过对比完整含糖、不同层次切糖后分子量获得4类糖修饰的相对含量,并进行样本间和批间一致性比较,为rhTPO复杂糖修饰的快速评价提供了可靠结果,首次确定rhTPO糖化糖差异是该品种不同厂家间差异的重要因素。本文为复杂糖蛋白药物的质量控制和糖一致性分析提供了一种快速、可靠和实用的方法。
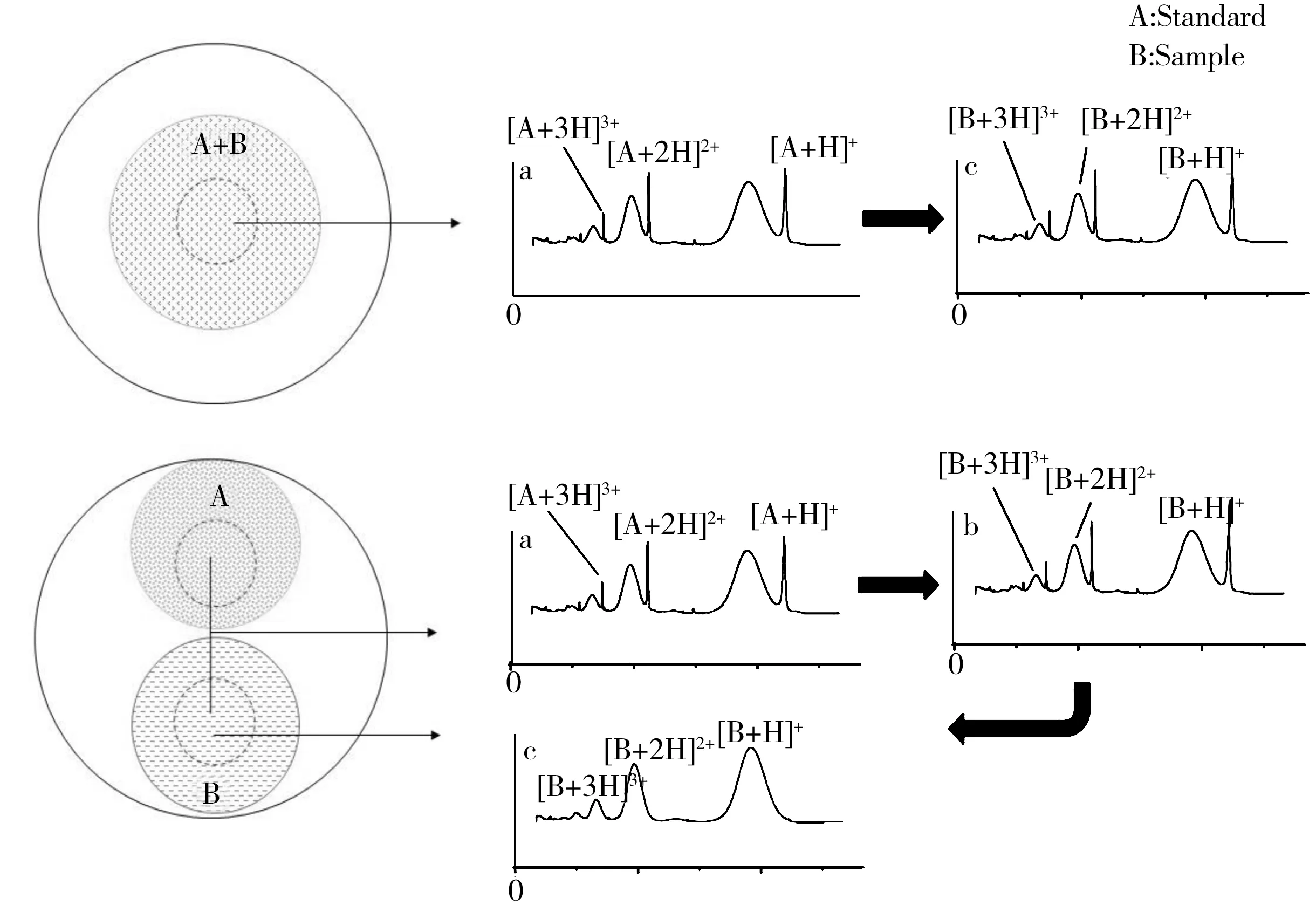
图1 MALDI-TOF质谱内标法(上)和准内标法(下)示意图Fig.1 Schematic diagram of internal(top) and quasi-internal(bottom) calibration of MALDI-TOF MSa,b:correction value;c:corrected value
1 实验部分
1.1 材料与仪器
rhTPO仿制药(批号:A1,A2,A3)为国内药企生产;rhTPO原研药(批号:B)为特比澳制剂(国产)抽提物,由rhTPO仿制药公司提供。N-糖切除酶PNGase-F、唾液酸切除酶Neuraminidase均购自Sigma公司;O-糖切除酶(O-Glycosidase)购自NEB公司;牛血清白蛋白(BSA)购自Roche公司;α-氰基-4-羟基肉桂酸(CHCA)购自Fluka公司。4800型 MALDI TOF/TOF质谱购自AB公司。
1.2 仪器参数
MALDI-TOF质谱线型正离子检测模式检测,加速电压为18.2 kV;离子源电压为20 kV;N2激光器,波长337 nm,能量6 000;延迟提取时间(PIE)480 ns,质谱信号单次扫描累加2 000次,质量扫描范围m/z5 000~80 000。数据分析软件为DE4.5(ABSciex)。
1.3 实验方法
取rhTPO仿制药和原研药各150 μg(1 mg/mL,约150 μL),加入8 mol/L尿素至尿素终浓度为6 mol/L,4 ℃变性30 min后超滤去除尿素,以50 mmol/L碳酸氢铵置换溶剂,按酶与蛋白的质量比为1∶25加入N-糖切除酶,涡旋混匀后37 ℃孵育16 h切除N-糖,取20 μL于-20 ℃保存备用;剩余样本以50 mmol/L磷酸钠溶液(pH 6.0)超滤置换溶剂,按酶与蛋白的质量比为1∶100加入唾液酸切除酶,涡旋混匀后37 ℃孵育12 h去除唾液酸,取20 μL置于-20 ℃保存备用;剩余样品以50 mmol/L磷酸钠溶液(pH 7.5)超滤置换溶剂,按酶体积与蛋白质量的比例为1∶10加入O-糖切除酶,涡旋混匀后37 ℃孵育6 h切除O-糖,样本于-20 ℃保存备用。
各取未切糖、切N-糖、切O-糖唾液酸、切O-糖的各样本和BSA标准品适量,分别与基质(CHCA)按适当比例混匀,按准内标法点靶,用MALDI-TOF质谱分别采集不同处理样品的分子量图并校正。
1.4 糖含量计算公式

(1)

(2)

(3)

(4)

(5)

(6)
2 结果与讨论
2.1 N-糖相对含量
将各样本首先进行MALDI-TOF质谱检测获得完整含糖分子量,以BSA多电荷峰(单电荷、二电荷及三电荷)进行准内标法校正,以A1为例,其校正质谱图见图2,准内标法校正结果见表1。BSA多电荷峰之间相对标准偏差(RSD)≤0.019%,批间RSD为0.002%,与序列分子量的误差(即方法误差)小于0.006%。准内标法校正后测得仿制药(A1、A2、A3)的完整含糖分子量在57 550~57 930 Da之间,3批间的RSD为0.37%,批间一致性良好(表2)。与文献[4]的完整含糖分子量(57 539 Da)相比,rhTPO仿制药与文献值基本一致,rhTPO原研药含糖分子量(56 302.6 Da)则明显偏低。
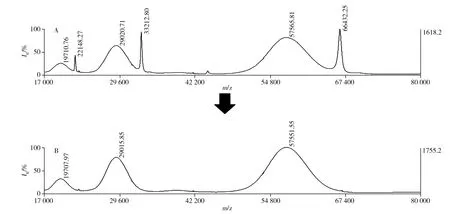
图2 rhTPO完整分子的MALDI-TOF质谱图Fig.2 MALDI-TOF MS of intact rhTPOA:rhTPO(A1) after BSA internal calibration;B: rhTPO(A1) after BSA quasi-internal calibration
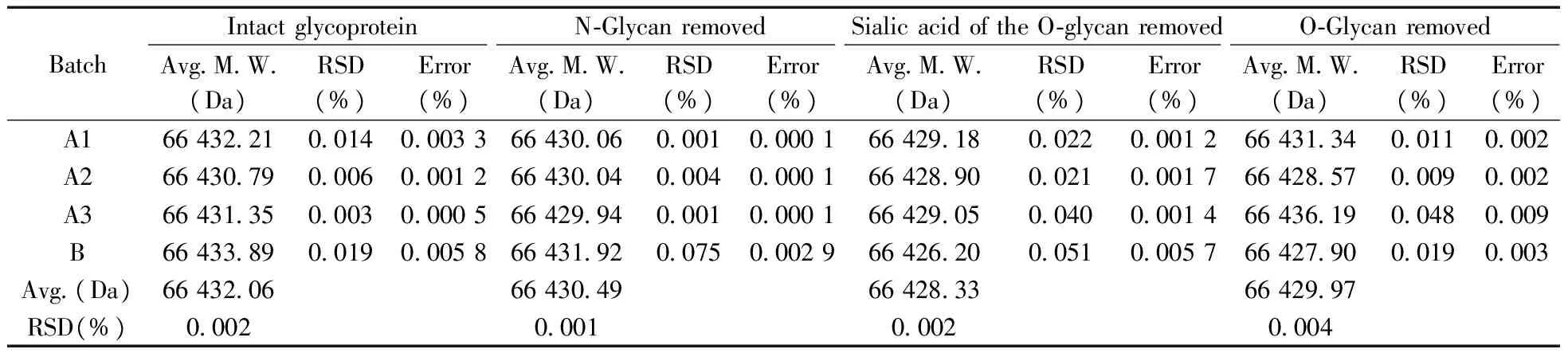
表1 rhTPO切糖前后样本 BSA准内标法的校正结果比较Table 1 Comparison of BSA quasi-internal calibration results of rhTPO before and after glycan removed
*Avg.and RSD were used to evaluate the consistency of 3 batches biosimilar products of rhTPO
切N-糖样本进行准内标法校正后,BSA多电荷峰之间RSD≤0.075%,批间RSD为0.001%,方法误差<0.003%(表1)。rhTPO仿制药切N-糖后的分子量在43 480~43 670 Da之间,批间RSD为0.22%,批间一致性良好,但比原研药(41 876.7 Da)高约1 500 Da(表2),而仿制药的净N-糖量比原研药仅低约1个己糖(表2),两者N-糖修饰基本一致。根据公式(1),rhTPO仿制药N-糖的相对含量为24.4%~24.8%,RSD为0.81%,批间一致性良好,比原研药(25.6%)低1.0%左右,仿制药的相对N-糖量略低于原研药且超出了1个己糖所占N-糖的相对比例,提示原研药完整含糖分子量比预期偏低。
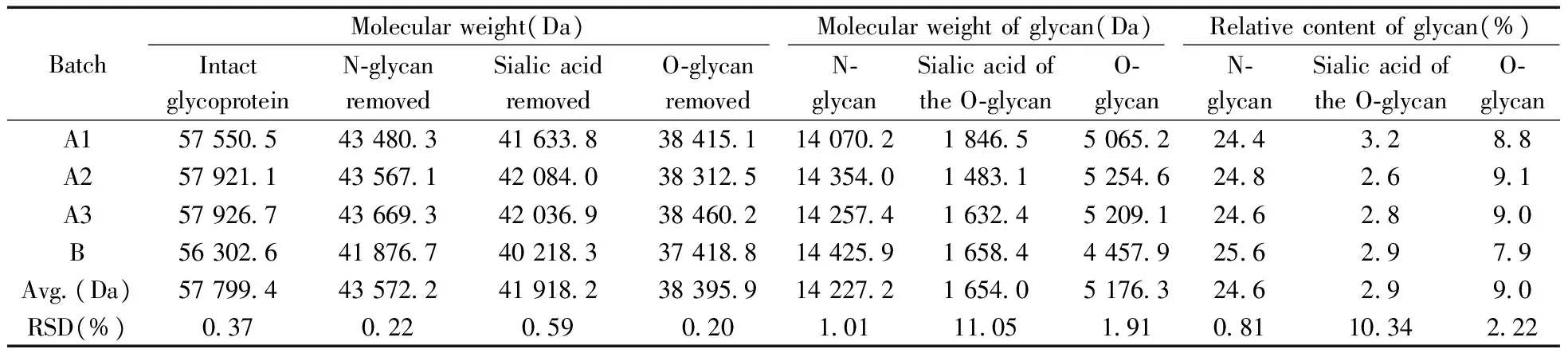
表2 准内标法测定rhTPO含糖、去不同糖修饰分子量及对应糖相对含量Table 2 Determination of the molecular weight and the relative content of glycan of intact and glycan removed rhTPO by quasi-internal calibration
*Avg.and RSD were used to evaluate the consistency of 3 batches biosimilar products of rhTPO
2.2 O-糖唾液酸相对含量
切O-糖唾液酸样本以BSA多电荷峰进行准内标法校正,BSA多电荷峰之间RSD≤0.051%,批间RSD为0.002%,方法误差<0.006%(表1)。rhTPO仿制药切O-糖唾液酸的分子量在41 630~42 090 Da之间(表2),批间RSD为0.59%,比原研药(40 218.3 Da)略高约1 600 Da,但两者净O-糖唾液酸量接近(表2)。根据公式(2),rhTPO仿制药O-糖唾液酸的相对含量在2.6%~3.2%之间,与原研药(2.9%)接近。此外,实验过程中发现3批原研药中有1批发生降解,说明原研药的稳定性不如仿制药。
2.3 O-糖相对含量
切O-糖唾液酸样本再经O-Glycosidase切除O-糖,以BSA多电荷峰进行准内标法校正。BSA多电荷峰之间RSD≤0.048%,批间RSD为0.004%,方法误差小于0.01%(表1)。rhTPO仿制药切O-糖后的分子量为38 300~38 470 Da,批间RSD为0.20%,批间一致性良好,比原研药(37 418.8 Da)高约900 Da(表2),但仿制药的净O-糖量比原研药高约600 Da。根据公式(3),rhTPO仿制药的O-糖相对含量为8.8%~9.1%,批间较一致,比原研药(7.9%)高约1.1%,提示两者O-糖基化修饰有一定差异,原研药的O-糖基化修饰不足。由于O-Glycosidase仅可特异性切除β(1-3)连接型O-糖,因此,O-糖酶解后样本存在极少量其它类型的O-糖残余。此外,实验过程中发现切唾液酸后剩余的2批原研药中又有1批发生降解,再次提示原研药的稳定性不如仿制药。
2.4 总糖、糖基化糖及糖化糖相对含量的一致性比较
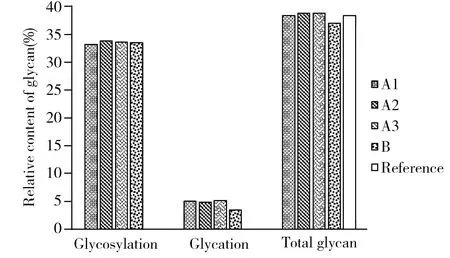
图3 糖基化糖、糖化糖及总糖的相对含量(%) Fig.3 Relative content of glycosylation,glycation and total glycan of rhTPO(%)
本文研究过程中发现,rhTPO除经典的酶促糖基化修饰(Glycosylation)外,还存在化学反应导致的糖化修饰(Glycation),并经nanoLC-MS/MS鉴定了糖化修饰位点和修饰率。rhTPO仿制药的实测总糖含量(公式(6))为38.4%~38.8%,样本间一致性良好,与文献总糖含量(38.4%)[4]基本一致,而rhTPO原研药偏低(图3)。3批rhTPO仿制药与1批原研药的糖基化糖(公式(4))相对含量基本一致,仿制药的糖化糖(公式(5))相对含量为4.9%~5.2%,比原研药高约1.6%,两者糖化糖差异较明显,经nanoLC-MS/MS确认,两者糖化修饰位点分布差异较明显。
值得一提的是,仿制药与文献的总糖含量很接近,原研药与文献及仿制药总糖含量均有差异,提示仿制药的工艺更接近文献,而上市产品(原研药)与文献有一定差异。后续研究表明,原研药与仿制药的糖化位点和相对分布有差异,这种差异是该品种电荷异质性的重要来源。此外,实验过程中发现原研药在切唾液酸和O-糖过程中发生降解,提示原研药稳定性不如仿制药。国产原研药上市较早,当时的蛋白表达技术和质量分析技术有限,或许导致了原研药未能进行充分的工艺优化。
需指出的是,糖化是一种非酶相关的糖修饰,普遍认为是有害、应尽量避免的化学修饰,它与生产工艺相关,工艺差异会引起糖化程度不同,因此会导致糖化糖的含量略有差异。此外,考虑到rhTPO原研药(B)是经过工艺抽提获得,因此不排除抽提工艺会造成其糖基化糖的丢失,但糖化糖基本不受抽提工艺影响。
3 结 论
本文采用BSA作为标准品,运用MALDI-TOF质谱准内标法结合多种酶切对复杂糖蛋白药物rhTPO切糖前后分子进行测定,BSA多电荷峰之间RSD均≤0.075%,批间RSD为0.001%~0.004%,方法误差均<0.01%,说明该检测方法准确性好,可靠性高。准内标法作为一种介于内标法和外标法之间的方法,不但可以排除标准品对样本的干扰,还可以提高测定的准确度,对复杂糖蛋白的解析有明显优势。
本文采用上述方法测定了rhTPO去糖前后的分子量,并得到了N-糖、O-糖唾液酸、O-糖和糖化(Glycation)糖的相对含量,其中,仿制药(国产)分别为24.6%、2.9%、9.0%和5.1%,原研药(国产)分别为25.6%、2.9%、7.9%和3.5%。rhTPO仿制药和原研药的糖基化糖(Glycosylation,包括N-糖基化糖和O-糖基化糖及其末端唾液酸)相对含量基本一致,说明该仿制药所构建的生产用细胞株与上市的原研药基本一致,原研药的抽提工艺并未明显改变原研药的酶相关糖基化修饰。仿制药和原研药的糖化糖含量有一定差异,推测主要是发酵工艺的差异导致。由于文献未报道rhTPO的各级糖含量(包括糖化糖),不能确定国产rhTPO与国外rhTPO的糖含量及批间一致性情况。与文献rhTPO(国外rhTPO)[4]总糖含量相比,仿制药总糖含量与其基本一致,而原研药则偏低,表明仿制药的工艺更接近文献,而上市产品(原研药)与文献有一定差异。
糖蛋白药物的糖含量、糖位点、糖型是质量控制的关键指标,是新药报批的必要内容,本方法对于快速判断多位点、多糖型的复杂糖蛋白的糖含量及其一致性和工艺优化有重要参考价值。
[1] Tao H,He Z M,Shi W T,Zhang Q E,Ding B H,Wang C L.J.Clin.Exp.Med.(陶红,何正梅,史文婷,张权娥,丁邦和,王春玲.临床和实验医学杂志),2017,16(8):780-783.
[2] Wu T,Yang N P.Pract.J.Clin.Med.(吴侗,杨南萍.实用医院临床杂志),2014,11(3):155-159.
[3] Li Y X,Huang P T.J.Med.Mol.Biol.(李越希,黄培堂.国外医学分子生物学分册),2002,24(2):102-105.
[4] Hoffman R,Andersen H,Walker K,Krakover J,Patel S,Stamm M,Osborn S.Biochemistry,1996,35:14849-14861.
[5] Prabhakaram M,Ortwerth B,Smith J.MethodsMol.Biol.,2000,159(2):245-253.
[6] Ahmed N,Thornalley P J.Biochem.Soc.Trans.,2003,31(6):1417-1422.
[7] Liu L,Wang Y,Tian S L,Lu X W,Meng Y,Liu L Z,Xie B S,Leng A J.Immunol.J.(刘丽,王颖,田生礼,芦兴武,孟岩,刘立忠,谢宝树,冷爱军.免疫学杂志),1999,15(2):103-105.
[8] Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China,Part Three.Beijing:Chinese Medical Science and Technology Press(国家药典委员会.中华人民共和国药典 第三部.北京:中国医药科技出版社),2015.
[9] Hitchcock I,Kaushansky K.Br.J.Haematology,2014,165:259-268.
[10] Yang X H,Yu G L,Zhao X,Song L T,Gao H D.PeriodicalofOceanUniversityofChina(杨晓华,于广利,赵峡,宋乐天,高昊东.中国海洋大学学报),2006,36(6):929-931.
[11] Zhang W B,Wang Z C,Zhang L Y,Qian J H.J.Instrum.Anal.(张维冰,王智聪,张凌怡,钱俊红.分析测试学报),2013,32(2):143-149.
[12] Wei K H,Ying T Y.ShortProtocolsinProteomics.Beijing:Chemical Industry Press(魏开华,应天翼.蛋白质组学实验技术精编.北京:化学工业出版社),2010:89-90.
MALDI-TOF MS with Quasi-internal Calibration Method and Its Study on Batch-to-Batch Consistency in Complex Glycan of rhTPO
LIU Yue-mei1,2,HOU Li-ping3,YANG Mei3,MENG Xiao-guang3,WEI Kai-hua1,2,3*
(1.Graduate School,Anhui Medical University,Hefei 230032,China;2.Beijing Institute of Radiation Medicine,Military Medical Science Academy of PLA,Beijing 100850,China;3.State Key Laboratory of Proteomics,National Engineering Research Center for Protein Drugs(Beijing),Beijing C&N International Sci-Tech Co.,Ltd.,Beijing 102206,China)
The relative contents of four kinds of glycan forms in the inovator and biosimilar products of recombinant human thromboplastin(rhTPO) were accurately determined using matrix assisted laser desorption ionization time of flight mass spectrometry(MALDI-TOF MS) with quasi-internal calibration,the consistencies between products and among batches were evaluated.The N-glycan,sialic acid and O-glycan of rhTPO were removed off with different endoglycosidase,respectively.bovine serum albumin(BSA)used as the standard was pointed target separate with the sample.The molecular weights of the intact glycoproteins and the different forms of deglycosylated proteins were determined by MALDI-TOF MS with quasi-internal calibration.The glycan contents in samples were calculated by the molecular weight differences among different deglycosylated samples.Finally,the consistency of the inovator and biosimilar products were evaluated.The multi-charge peaks of BSA were used for the quasi-internal calibration of MALDI-TOF MS.And their calibration relative standard deviations(RSDs) were all no more than 0.075%,and the RSDs among different calibrations were among 0.001%-0.004%.The method deviations away from the sequence molecular weight were less than 0.01%.For the biosimilar drug,the relative contents of N-glycan,sialic acid,O-glycan,and glycation were 24.6%,2.9%,9.0%and 5.1%,respectively,and the batch-to-batch consistency was quite good.The total glycan contents were consistent with those reported in the literature.For the innovator drug,the relative contents of N-glycan,sialic acid,O-glycan and glycation were 25.6%,2.9%,7.9%and 3.5%,respectively.The total glycan content was lower than that reported in the literature.The relative contents of glycosylation between the innoventor products and the biosimilar products were almost the same but the relative contents of glycation showed some differences.Glycation of rhTPO has not been reported up-to-now,the differences of the relative contents of glycation might be the important factors for the different rhTPO manufacturers,the glycation differences were mainly caused by the differences of fermentation process.
recombinant human thrombopoietin(rhTPO);matrix assisted laser desorption ionization time of flight mass spectrometry(MALDI-TOF MS);quasi-internal calibration; glycan contents; glycation
2017-06-24;
2017-10-09
国家高技术研究发展计划863项目(2014AA020906);国家科技部重大仪器专项(2012YQ18011710);蛋白质组学国家重点实验室课题(SKLP-O201412)
*
魏开华,博士,研究员,研究方向:药学,Tel:010-80727777,E-mail:wkh2006@126.com
10.3969/j.issn.1004-4957.2017.12.007
O657.63
A
1004-4957(2017)12-1458-06

