替吉奥胶囊联合奥沙利铂应用于进展期胃癌的有效性和安全性
张 颖 邵玲玲
替吉奥胶囊联合奥沙利铂应用于进展期胃癌的有效性和安全性
张 颖 邵玲玲
目的探讨替吉奥胶囊联合奥沙利铂治疗进展期胃癌的有效性和安全性。方法选取进展期胃癌患者64例,根据化疗方案的不同分为观察组(n=32)和对照组(n=32)。对照组采取全身静脉化疗(FOLFOX6:奥沙利铂+亚叶酸钙+5-氟尿嘧啶),观察组应用奥沙利铂联合替吉奥胶囊治疗,21 d为1周期,共治疗4个周期。观察2组近期疗效及不良反应发生情况,检测并比较2组血清肿瘤标志物水平、外周血T淋巴细胞亚群及NK细胞变化。结果观察组ORR和DCR分别为46.88%、90.63%,对照组分别为43.75%、68.75%,观察组DCR明显高于对照组(P<0.05)。与治疗前比较,治疗后2组CD4+、CD8+及NK细胞比例均显著降低,但观察组CD8+比例低于对照组,CD4+及NK细胞比例高于对照组(P<0.05或P<0.01);治疗后对照组CD4+/CD8+比值降低,观察组CD4+/CD8+比值明显增加,且显著高于对照组(P<0.01)。治疗后2组血清CEA、CA125、SCC-Ag水平均明显降低,且观察组显著低于对照组(P<0.01)。观察组Ⅲ﹢Ⅳ级胃肠道反应及骨髓抑制患者比例低于对照组(P<0.05)。结论替吉奥胶囊联合奥沙利铂治疗进展期胃癌的近期疗效显著,可明显降低血清肿瘤标志分子水平,保护其免疫功能,并具有一定的安全性。
进展期胃癌;替吉奥;奥沙利铂;肿瘤标志物;免疫功能
胃癌是1种恶性程度较高的消化系统肿瘤疾病,目前胃癌发病率及死亡率呈升高趋势[1-3]。胃癌发病隐匿,早期易出现局部浸润或远处转移,确诊难度较大,就诊时50%的患者已进展至中晚期或发生肿瘤的转移[4-5]。手术是早期胃癌患者根治的唯一方法,但其治愈率不足10%,预后较差;对于已发生远处转移的进展期胃癌患者综合化疗是临床主要治疗手段,且具有明显延长胃癌患者生存期的作用,但目前尚缺乏高效、安全性好的化疗方案[6]。
1 资料与方法
1.1 一般资料
将2015年6月至2016年5月我院收治的64例进展期胃癌患者作为研究对象,纳入标准:经组织病理学确诊的胃癌患者;未接受过全身化疗的初治者;治疗前血常规、心电图及肝肾功能基本正常者;据东部肿瘤协作组(ECOG)PS评分为0~2分;预计生存期>3个月,可进行长期随访者。排除标准:合并其他恶性肿瘤者;有急、慢性感染病者;治疗前接受过放/化疗治疗者。本研究经医院伦理委员会同意且所有纳入患者及家属知情同意。
根据化疗方案的不同将患者分为观察组(n=32)和对照组(n=32)。观察组男性19例,女性13例;年龄64~75岁,中位年龄67岁;临床TNM分期:Ⅱ期9例,Ⅲ期18例,Ⅳ期5例;淋巴结转移13例,肝转移3例,肺转移2例,胸腹膜转移3例,盆腔转移2例,胰腺转移1例。对照组男性18例,女性14例;年龄63~76岁,中位年龄66岁;临床TNM分期:Ⅱ期10例,Ⅲ期16例,Ⅳ期6例;淋巴结转移12例,肝转移4例,肺转移3例,胸腹膜转移2例,盆腔转移2例,胰腺转移2例。2组一般资料具有可比性。
1.2 方法
对照组给予FOLFOX6方案治疗:奥沙利铂(OXA)130 mg/m2,静脉滴注2 h,d 1;亚叶酸钙300 mg/m2,静脉滴注2 h,d 1~2;5-氟尿嘧啶(5-FU)1 500 mg/m2,持续静脉滴注36 h。观察组采用替吉奥胶囊联合奥沙利铂治疗,奥沙利铂用药方法同对照组,口服替吉奥胶囊40~60 mg/m2,2次/天,d 1~14,1周期21 d,2组均连续治疗4周期。治疗前后抽取清晨空腹静脉血,复查血常规及生化。
1.3 观察指标及评价标准
(1)比较2组患者治疗后近期临床疗效:治疗后进行腹部薄层CT检测,参照RECIST[7]进行近期临床疗效评价,治疗总有效率(ORR)=[完全缓解(CR)+部分缓解(PR)]/总例数×100%,疾病控制率(DCR)=[CR+PR+稳定(SD)]/总例数×100%。(2)检测2组治疗前后全血中CD4+、CD8+等T淋巴细胞比例及NK细胞比例,计算CD4+/CD8+;检测2组治疗前后肿瘤标志物水平,包括血清癌胚抗原(CAE)、糖类抗原125(CA125)、鳞状细胞癌相关抗原(SCC-Ag)等。(3)治疗安全性评价:参照NCI-CIT统计治疗期间的不良反应。
1.4 统计学方法
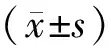
2 结果
2.1 2组近期临床疗效比较
观察组ORR和DCR分别为46.88%、90.63%,对照组分别为43.75%、68.75%,观察组DCR明显高于对照组(χ2=4.730,P<0.05)。见表1。

表1 2组患者近期疗效比较/例
2.2 治疗前后2组T淋巴细胞亚群及NK细胞比较
治疗前2组T淋巴细胞亚群比例、NK细胞比例均无统计学差异(P>0.05);与治疗前比较,治疗后2组CD4+、CD8+比例及NK细胞比例均显著降低,但观察组CD8+比例低于对照组,CD4+及NK细胞比例高于对照组(P<0.05或P<0.01);治疗后对照组CD4+/CD8+比值降低,而观察组CD4+/CD8+比值明显增加,且显著高于对照组(P<0.01)。见表2。
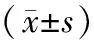
表2 治疗前后2组T淋巴细胞亚群及NK细胞比较
▲为与治疗前比较,P<0.05,▲▲为P<0.01;#为与对照组比较,P<0.05,##为P<0.01。
2.3 治疗前后2组血清肿瘤标志物水平比较
治疗前2组血清肿瘤标志物水平均无统计学差异(P>0.05);与治疗前比较,治疗后2组血清CEA、CA125、SCC-Ag水平均明显降低,且观察组低于对照组(P<0.01)。见表3。
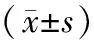
表3 治疗前后2组血清肿瘤标志水平比较
▲为与治疗前比较,P<0.01;#为与对照组比较,P<0.01。
2.4 化疗药物安全性评价
2组均未出现因药物不良反应停止化疗者,与对照组比较,观察组Ⅲ﹢Ⅳ级胃肠道反应及骨髓抑制发生率显著降低(P<0.05)。见表4。

表4 2组不良反应发生情况比较(例,%)
#为与对照组比较,P<0.05。
3 讨论
进展期胃癌通常表现为癌组织浸润到肌层或达浆膜层,常伴淋巴、腹膜、血行或直接浸润扩散。患者确诊时通常已经无法进行手术治疗,化疗属姑息性治疗方案,但研究显示,对于进展期胃癌患者化疗可显著延长患者生存期,并提高其生存质量[8]。替吉奥胶囊主要是由替加氟、奥替拉西、吉美嘧啶组成的复方制剂,具有较高的生物利用度,可选择性拮抗消化道内分布的乳清酸磷酸核糖基转移酶,经肝药酶反应转化为5-Fu,从而达到抗癌功效,且可降低5-Fu所导致的严重胃肠道毒性,另外心脏毒性及神经毒性等不良反应发生率也大大降低[9-10]。奥沙利铂是第3代铂类化合物,作用机制主要是通过铂原子与DNA链形成交联进而阻断DNA的复制与转录,其细胞毒作用较顺铂和卡铂更为强烈[11]。替吉奥和奥沙利铂作用机制和靶点不同,具有较好的协同作用,临床应用效果显著[12-14]。本研究结果显示,观察组ORR和DCR分别为46.88%、90.63%,对照组分别为43.75%、68.75%,2组间ORR无显著性差异,但观察组DCR明显高于对照组,与沈东杰等[15]研究结果一致。
进展期胃癌患者普遍存在免疫功能障碍,机体处于免疫抑制状态,这也是导致肿瘤细胞持续增殖、侵袭的关键因素。在恶性肿瘤免疫监视系统中,T淋巴细胞起关键作用。进展期胃癌患者细胞免疫功能紊乱,表现为CD4+比例及CD4+/CD8+比值下降,T淋巴细胞亚群比例失衡越严重,机体的免疫抑制反应也会随之加重,且以上变化随着肿瘤病情加重而进一步发展[16]。本研究结果显示,与治疗前比较,治疗后2组CD4+、CD8+比例及NK细胞比例均显著降低,但观察组CD8+比例低于对照组,CD4+及NK细胞比例显著高于对照组;治疗后对照组CD4+/CD8+比值降低,而观察组CD4+/CD8+比值明显增加,且显著高于对照组,与傅国平等[17]研究结果相似。血清肿瘤标志物水平在肿瘤疗效评估方面意义重大,其水平升高与肿瘤负荷密切相关,是判断肿瘤恶性程度的首要指标[18]。CEA主要存在于胚胎性肿瘤组织中的糖蛋白抗原,是动态监测反映胃癌治疗效果的公认指标;CA125是一种糖蛋白复合物,在肺癌、胃癌等恶性肿瘤的表达率增高;SCC-Ag为鳞状上皮细胞癌相关抗原,三者均会随着患者病情变化而出现明显波动。本研究结果显示,与治疗前比较,治疗后2组血清CEA、CA125、SCC-Ag水平均明显降低,且观察组显著低于对照组,表明替吉奥和奥沙利铂治疗进展期胃癌对其细胞免疫功能影响小,可降低机体肿瘤标志物水平,有效抑制肿瘤进展,减轻肿瘤的恶性程度。
化疗在进展期胃癌的治疗中具有极其重要的作用,也是临床常规治疗方式,但在抑制肿瘤细胞增殖的同时,化疗药物也会严重影响人体正常细胞,造成一系列化疗不良反应,进一步损害机体自身免疫功能[19]。加之,进展期胃癌患者体质虚弱,受化疗毒副作用影响,机体免疫功能进一步受损,细胞因子水平紊乱,大多数患者因不能耐受而影响治疗[20]。本研究结果显示,2组均未出现因药物不良反应停止化疗者,观察组Ⅲ﹢Ⅳ级胃肠道反应及骨髓抑制患者比例低于对照组。表明替吉奥和奥沙利铂治疗方案较FOLFOX6方案具有更好的安全性,可能是由于替吉奥胶囊中奥替拉西在胃肠组织中有浓度较高,通过干扰5-Fu在胃肠组织中的分布,明显减轻胃肠道等不良反应。
综上所述,替吉奥胶囊联合奥沙利铂治疗进展期胃癌的近期疗效显著,可降低血清肿瘤标志分子水平,保护患者免疫功能,并具有一定的安全性。
[1] Wang TS,Ding QQ,Guo RH,et al.Expression of livin in gastric cancer and induction of apoptosis in SGC-7901 cells by shRNA-mediated silencing of livin gene〔J〕.Biomed Pharmacother,2010,64(5):333-338.
[2] Li H,Yu B,Li J,et al.Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer〔J〕.Oncotarget,2014,5(8):2318.
[3] Ford AC,Forman D,Hunt RH,et al.Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals:systematic review and meta-analysis of randomised controlled trials〔J〕.Bmj,2014,348(10):g3174.
[4] Schwarz RE,Smith DD.Clinical impact of lymphadenectomy extent in resectable gastric cancer of advanced stage〔J〕.Ann Surg Oncol,2007,14(2):317-328.
[5] Choi MG,Sung CO,Noh JH,et al.Mucinous gastric cancer presents with more advanced tumor stage and weaker β-catenin expression than nonmucinous cancer〔J〕.Ann Surg Oncol,2010,17(11):3053-3058.
[6] Wagner AD,Grothe W,Haerting J,et al.Chemotherapy in advanced gastric cancer:a systematic review and meta-analysis based on aggregate data〔J〕.J Clin Oncol,2006,24(18):2903.
[7] Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid TUMORs:revised RECIST guideline (version 1.1)〔J〕.Eur J Cancer,2009,45(2):228-247.
[8] 王 燕.多西他赛联合卡培他滨化疗治疗进展期胃癌术后的研究〔J〕.航空航天医学杂志,2015,26(11):1041-1043.
[9] 吴梅青,周旭坤,李 平,等.新辅助化疗对进展期胃癌根治术的影响〔J〕.中华普通外科杂志,2014,29(2):98-101.
[10] 韩龙才,韩 娜,闫金银,等.改良FOLFOX6新辅助化疗与术后化疗治疗进展期胃癌的临床疗效比较〔J〕.实用癌症杂志,2014,29(9):1158-1160.
[11] 张 可.替吉奥与奥沙利铂联合多西紫杉醇治疗晚期胃癌临床观察〔J〕.中国卫生标准管理,2016,7(13):96-97.
[12] 王大鹏.替吉奥胶囊单药治疗晚期胃癌的临床观察〔J〕.实用癌症杂志,2014,28(5):566-567.
[13] 仲立新,张 莉,贺利民.替吉奥胶囊联合奥沙利铂治疗晚期结直肠癌的临床观察〔J〕.肿瘤基础与临床,2014,27(1):20-22.
[14] Zhou Y,Wan G,Spizzo R,et al.MiR-203 induces oxaliplatin resistance in colorectal cancer cells by negatively regulating ATM kinase〔J〕.Mol Oncol,2014,8(1):83-92.
[15] 沈东杰,刘 涛,赵恩昊,等.替吉奥联合奥沙利铂治疗进展期胃癌的疗效及对癌组织中MMP-9和VEGF表达的影响〔J〕.实用临床医药杂志,2015,19(5):41-43.
[16] 张建斌.新辅助化疗联合腹腔镜手术治疗进展期胃癌的临床疗效及对患者围手术期免疫功能的影响〔J〕.河北医药,2015,37(19):2904-2907.
[17] 傅国平,王 薇,裘哲君,等.替吉奥联合奥沙利铂或顺铂治疗进展期胃癌的临床观察〔J〕.中国癌症杂志,2012,22(4):291-294.
[18] Kong W,Wang Q,Wei J,et al.Prognostic value of carbohydrate tumor markers and inflammation-based markers in Chinese advanced gastric cancer patients〔J〕.Cad Saúde Colet,2015,21(3):289-295.
[19] Tanabe K,Fujii M,Nishikawa K,et al.Phase Ⅱ/Ⅲ study of second-line chemotherapy comparing irinotecan-alone with S-1 plus irinotecan in advanced gastric cancer refractory to first-line treatment with S-1 (JACCRO GC-05)〔J〕.Annals of Oncology,2015,26(9):1916.
[20] Ock CY,Oh DY,Lee J,et al.Weight loss at the first month of palliative chemotherapy predicts survival outcomes in patients with advanced gastric cancer〔J〕.Gastric Cancer,2016,19(2):597-606.
StudyontheEfficacyandSafetyofTegafurCapsulesCombinedwithOxaliplatinforAdvancedGastricCancer
ZHANGYing,SHAOLingling.
QingdaoCommercialStaffHospital,Qingdao,266011
ObjectiveTo investigate the efficacy and safety of tegafur capsules combined with oxaliplatin in the treatment of advanced gastric cancer.Methods64 patients with advanced gastric cancer were selected,according to the different chemotherapy regimens were divided into the observation group (n=32) and the control group (n=32).The control group
systemic intravenous chemotherapy (FOLFOX6:oxaliplatin+leucovorin+5-fluorouracil),the observation group was treated with oxaliplatin plus and tegafur capsules.21 d for 1 cycle,a total of 4 cycles of treatment.The short-term curative effect and adverse reactions were observed,The levels of serum tumor markers,peripheral blood T lymphocyte subsets and NK cells were detected and compared.ResultsORR and DCR of the observation group were 46.88% and 90.63% respectively,and the control group were 43.75% and 68.75% respectively.DCR of the observation group was significantly higher than that of the control group (P<0.05).Compared with the control group,the proportion of CD4+,CD8+and NK cells in the 2 groups was significantly lower than that of the control group,but the proportion of CD4+and NK cells in the observation group was lower than that of the control group (P<0.05 orP<0.01);After treatment,the ratio of CD4+/CD8+in the control group decreased,and the ratio of CD4+/CD8+in the observation group was significantly higher than that of the control group (P<0.01).The levels of serum CEA,CA125 and SCC-Ag in the 2 groups were significantly lower than those of the control group (P<0.01).The proportion of patients with Ⅲ+Ⅳgrade gastrointestinal tract reaction and myelosuppression was lower than that of the control group (P<0.05).ConclusionThe short-term efficacy of tegafur capsules combined with oxaliplatin in the treatment of advanced gastric cancer can significantly reduce the molecular level of serum tumor markers,protect the immune function,and has certain safety.
Advanced gastric cancer;Tegafur;Oxaliplatin;Tumor markers;Immune function
(ThePracticalJournalofCancer,2017,32:2020~2023)
266011 山东省青岛市商业职工医院
10.3969/j.issn.1001-5930.2017.12.033
R735.2
A
1001-5930(2017)12-2020-04
2017-05-05
2017-10-16)
(编辑:甘艳)

