埃克替尼对表皮生长因子受体突变型晚期非小细胞肺癌的临床疗效观察
朱永东 解 华 舒桂君 王 永
埃克替尼对表皮生长因子受体突变型晚期非小细胞肺癌的临床疗效观察
朱永东 解 华 舒桂君 王 永
目的探讨埃克替尼对化疗后表皮生长因子受体(EGFR)突变型晚期非小细胞肺癌的临床疗效。方法选取60例EGFR突变型晚期非小细胞肺癌患者,随机分为对照组和试验组,对照组采用常规化疗干预,试验组在一线化疗基础上口服盐酸埃克替尼片,125 mg,3次/d,观察比较临床总有效率、生存质量评分及不良反应差异,观察血浆血管内皮生长因子(VEGF)、细胞间黏附分子-1(ICAM-1)及肿瘤标志物[鳞状细胞癌相关抗原(SCC-Ag)、癌胚抗原(CEA)、癌抗原125(CA125)]含量差异。结果试验组总有效率(60.00%)及总控制率(86.67%)显著高于对照组(P<0.01);生存质量评分(123.84±32.63)明显低于对照组(P<0.05);VEGF水平(21.27±1.76)及ICAM-1水平(328.23±28.81)明显低于对照组(P<0.05);肿瘤标志物SCC-Ag(2.56±0.32)、CEA(5.49±1.55)、CA125(21.37±1.87)明显低于对照组(P<0.05);不良反应皮疹(16.67%)、骨髓抑制(3.33%)、腹泻(16.28%)、口腔溃疡(13.33%)发生率明显低于对照组(P<0.01)。结论埃克替尼能有效治疗EGFR突变型晚期非小细胞肺癌,降低不良反应,提高患者的生存质量,值得临床推广。
埃克替尼;非小细胞肺癌;EGFR;VEGF;ICAM-1
非小细胞肺癌约占晚期肺癌发生率的80%,是目前发病率和致死率最高的恶性肿瘤,其发病具有隐蔽性,往往一经发现就已经是中晚期,错过最佳的手术治疗时间[1]。但是关于血管内皮生长因子(vascular endothelial growth factor,VEGF)、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)及相关肿瘤标志物的研究报道较少,本课题采用前瞻性研究设计方法,从就诊于我院的EGFR状态下的晚期非小细胞肺癌患者中,筛选出60例符合条件的患者,取得珍贵的临床数据,现将结果报告如下。
1 资料与方法
1.1 临床资料
入选病例为2014年1月至2017年1月就诊于我院的60例EGFR过度表达状态的晚期非小细胞肺癌患者,研究方案进过伦理委员会批准,所有参与试验的患者皆签署知情同意书。
纳入标准:参照《非小细胞肺癌》[2]的诊断标准将符合以下条件的纳入研究标准,①通过X射线或者CT确诊为非小细胞肺癌中晚期;②病理组织学检测EGFR呈现阳性突变;③胸外无合并其他原发性肿瘤;④血细胞分析、肝肾功能及心电图未见明显异常;⑤患者依从性好,不脱失,积极配合定期回访。排除标准:①合并严重感染;②合并三级高血压;③合并不稳定性心脏病;④合并胃肠溃疡;⑤合并血糖不稳定的糖尿病;⑥骨髓造血功能异常。
将符合条件的60例试验对象,随机均分成对照组和试验组,一般资料数据见表1。

表1 两组患者的一般资料对比分析(例,%)
1.2 治疗干预方法
对照组给予化疗药物干预:培美曲塞(批号:20140312,厂家:Eli Lilly and Company),500 mg/m2,静脉滴注,使用前配合肌肉注射维生素B12(批号:20150127,厂家:江苏四环生物制药有限公司),1天1次,每21天为1个周期重复,直至疾病进展或出现不可耐受的毒副作用。在应用培美曲塞7 d前口服叶酸400 μg/d,持续到末次给药后3周。
试验组在一线化疗的基础上给予口服盐酸埃克替尼片(批号:20140913;厂家:贝达药业股份有限公司),125 mg,1次/片,3次/d,直到出现疾病进展或者无法耐受时停药,观察30天后两组用药治疗差异。
1.3 疗效评价
依据《中国埃克替尼治疗非小细胞肺癌专家共识》[3]对临床疗效进行判断,分为完全缓解(CR);部分缓解(PR);疾病稳定(SD);疾病进展(PD)。有效率=CR+PR,控制率=CR+PR+SD。体力状况评分按照PS标准(0~2分、3~5分)操作。
1.4 观察指标
比较两组干预治疗前后总效率、总控制率、体力状态评分、肺癌治疗状态评价量表评分及肺癌患者生存质量量表评分的差异,观察两组患者VEGF、ICAM-1、肿瘤标志物[鳞状细胞癌相关抗原(squamous cell carcinoma antigen,SCC-Ag)、癌胚抗原(carcinoembryonic antigen,CEA)、癌抗原125(cancer antigen 125,CA125)]的含量变化。
1.5 统计学方法
2 结果
2.1 两组患者疗效对比
两组经过治疗干预后,对照组和试验组总有效率分别为33.33%和60.00%,差异具有统计学意义(P<0.01);总控制率分别为63.33%和86.67%,差异具有统计学意义(P<0.01),见表2。

表2 两组患者疗效对比(例,%)
注:与对照组相比较,*为P<0.05,**为P<0.01。
2.2 两组患者体力状态评分、肺癌治疗状态评分及肺癌患者生存质量评分对比
两组患者治疗干预前在体力状态评分、肺癌治疗状态评分及肺癌患者生存质量评分方面无显著差异,分别干预后,试验组和对照组的体力状态评分分别为(74.53±11.62)和(86.27±9.25),差异具有统计学意义(P<0.05);肺癌治疗状态评分分别为(111.77±32.62)和(137.13±21.58),差异具有统计学意义(P<0.01);肺癌患者生存质量评分分别为(123.84±32.63)和(131.58±18.83),差异具有统计学意义(P<0.05),见表3。
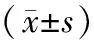
表3 两组患者体力状态评分、肺癌治疗状态评分及肺癌患者生存质量评分差异
注:与治疗后对照组相比较,*为P<0.05,**为P<0.01。
2.3 两组患者血浆VEGF、ICAM-1含量差异对比
两组患者干预治疗前,血浆VEGF、ICAM-1含量无显著差异。干预后试验组与对照组血浆VEGF含量比较差异具有统计学意义(P<0.05);试验组与对照组血浆ICAM-1含量比较差异也具有统计学意义(P<0.01),见表4。
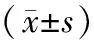
表4 两组患者血浆VEGF、ICAM-1含量比较
注:与对照组相比较,*为P<0.05,**为P<0.01。
2.4 两组肿瘤标志物水平差异对比
两组患者治疗干预前肿瘤标志物(SCC-Ag、CEA、CA125)水平无显著差异。分别干预后,试验组和对照组的SCC-Ag水平比较差异具有统计学意义(P<0.05);CEA水平比较差异也具有统计学意义(P<0.01);CA125水平比较差异也具有统计学意义(P<0.05),见表5。

表5 两组患者肿瘤标志物SCC-Ag、CEA、CA125的差异变化
注:与对照组相比较,*为P<0.05,**为P<0.01。
2.5 两组患者不良反应比较
两种干预治疗后,患者均出现一定程度的不良反应,其中试验组和对照组在皮疹方面的不良反应率分别为16.67%和36.67%,差异具有统计学意义(P<0.01);在骨髓抑制方面的不良反应率分别为3.33%和10.00%,差异具有统计学意义(P<0.01);在腹泻方面的不良反应率分别为16.28%和26.67%,差异具有统计学意义(P<0.05);在口腔溃疡方面的不良反应率分别为13.33%和36.67%,差异具有统计学意义(P<0.01),见表6。
3 讨论
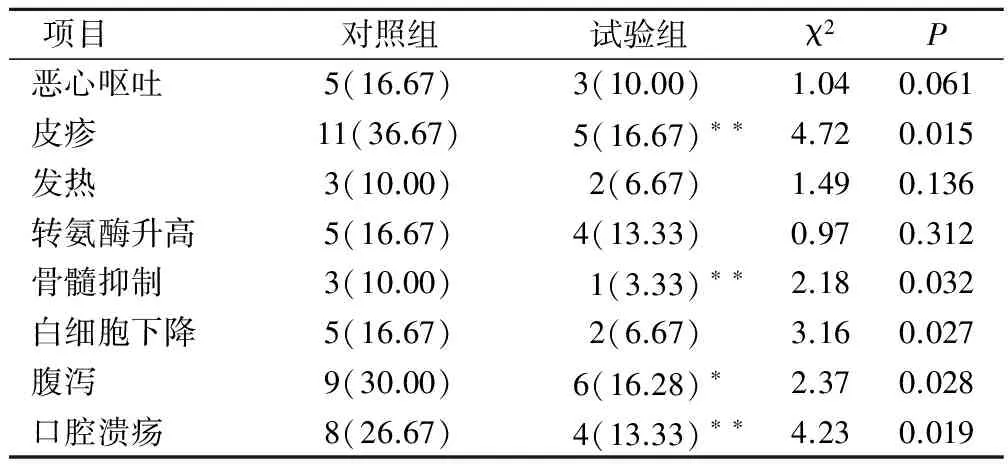
表6 两组患者出现不良反应的差异变化(例,%)
注:与对照组相比较,*为P<0.05,**为P<0.01。
非小细胞肺癌是临床常见的恶性肿瘤,致死率高,术后5年存活率低,约有80%的非小细胞肺癌一经发现就已经是中晚期,错过最佳手术切除治疗,通常只能采用放化疗、靶向制剂及保守治疗的方法[4]。放化疗的治疗手段,在有效杀伤肿瘤细胞的同时,对自身伤害很大,而且副作用多,生存期短等缺点,积极寻找新的治疗手段是当下迫在眉睫的事情。靶向制剂是近些年来有效治疗肺癌的一种方法[5]。通过对非小细胞肺癌的临床病理检测发现,其病理组织中的EGFR基因突变呈现过度表达状态,在癌症发生后敏感性升高,通过抑制EGFR基因的敏感性可以有效治疗非小细胞肺癌,延长患者的术后的生存期,降低放化疗的不良反应,是目前临床上的标准一线药物[6]。埃克替尼是我国自主研发的1种抑制EGFR基因敏感性的抗非小细胞肺癌的药物,具有不良反应低,患者耐受性良好的特征,可以有效延长患者的术后生存期,而且价格低廉,更容易被患者接受[7]。
血管内皮生长因子(VEGF)具有强效促进血管生成作用,能够直接参与肿瘤细胞的血管侧支循环的建立,尤其是在肝癌细胞缺氧及炎症的微环境中,致使VEGF的受体表达增多,促进肝癌细胞对周围组织的浸润和转移。细胞间黏附因子-1(ICAM-1)是位于细胞膜表面的跨膜糖蛋白,能够抑制肿瘤细胞的侵袭和转移[8-10]。试验结果表明,两组患者的血浆VEGF和ICAM-1水平均显著下降,加用埃克替尼后,试验组的下降幅度明显高于对照组。非小细胞肺癌的相关肿瘤标志物为SCC-Ag、CEA、CA125等,SCC-Ag存在于癌细胞的细胞浆中,具有诊断恶性肿瘤的作用;CEA是癌组织细胞产生的一种具有抗原特异性糖蛋白,是肿瘤广谱性的标志物;CA125最先在卵巢癌组织中分泌克隆的一类抗体,但是最近的研究表明SCC-Ag、CEA、CA125等标志物均在肺癌中呈现高表达状态[11]。试验表明,试验组和对照组的比较分析,积极治疗后,SCC-Ag、CEA、CA125均明显下降,在加用埃克替尼的试验组中,SCC-Ag、CEA、CA125的降低明显高于对照组。两组的随访结果显示,治疗干预后,患者的体力状态评分、肺癌治疗状态评分及肺癌患者生存质量评分都有所下降,表明患者体力、生命情况在一定范围内逐步得以恢复,试验组的恢复效果优于对照组。治疗后,安全性的评价显示,两组患者都存在一定程度的不良反应,表现在恶心呕吐、皮疹、发热、转氨酶升高、骨髓抑制、白细胞下降、腹泻、口腔溃疡等方面,尤其是在皮疹、骨髓抑制、腹泻、口腔溃疡方面,试验组优于对照组,明显低于化疗所致的不良反应。
综上,临床上加用盐酸埃克替尼治疗化疗后中晚期非小细胞肺癌,具有良好疗效,能够显著降低血浆中VEGF和ICAM-1含量水平,降低肿瘤标志物SCC-Ag、CEA、CA125的含量水平,改善患者化疗后的生命状态和体力状态,提高化疗后的生存期,降低其毒副作用,具有较高的临床价值,值得推广使用。课题组选择的小样本、随机、单盲、单中心的研究方法,未能客观深入的探究机理,将会在以后的工作中进一步细化研究方案,做出更多更高层次分析。
[1] Shi B,Zhang XB,Xu J,et al.Systematic analysis of icotinib treat-ment for patients with non-small cell lung cancer〔J〕.Asian Pac J Cancer Prev,2015,16(13):5521-5524.
[2] 陆 舜.非小细胞肺癌〔M〕.北京:人民卫生出版社,2016:24-26.
[3] 石远凯,孙 燕,丁翠敏,等.中国埃克替尼治疗非小细胞肺癌专家共识(2016年版)〔J〕.中国肺癌杂志,2016,19(7):489-493.
[4] 魏枫璐,陈佳磊,王秋实,等.埃克替尼靶向治疗非小细胞肺癌疗效分析〔J〕.哈尔滨医科大学学报,2015,49(4):364-366.
[5] 张琳琳,白维君.盐酸埃克替尼治疗非小细胞肺癌合并EGFR突变临床疗效〔J〕.临床军医杂志,2016,44(8):841-843.
[6] Chen X,Zhu Q,Liu Y,et al.Icotinib is an active treatment ofnon-small-cell lung cancer:a retrospective study〔J〕.PLoS One,2014,9(5):e95897.
[7] 余花艳,任统伟.肺癌化疗前后增强能谱CT成像中碘含量变化与疗效的关系〔J〕.实用癌症杂志,2017,32(1):64-66.
[8] 刘孝民,李 玮,张伟民.miR-31在肺癌患者血清和单个核细胞中的表达水平及临床意义〔J〕.实用医学杂志,2014,30(1):93-95.
[9] 肖怀清,倪一鸣.DC-CIK 联合化疗对肺癌患者Toll样受体4及肿瘤标志物的影响〔J〕.中国老年学杂志,2017,37(1):123-125.
[10] 卢天龙,杨启英.150 例青海地区非小细胞肺癌患者表皮生长因子受体突变状态分〔J〕.检验医学与临床,2016,13(1):31-32.
[11] 唐艳萍,谭晓玉,蔡政民,等.非小细胞肺癌表皮生长因子受体基因突变和EML4-ALK 融合基因表达的研究倡〔J〕.检验医学与临床,2016,13(24):3458-3460.
ClinicalEfficacyofIcotinibforEGFRMutantAdvancedNon-smallCellLungCancer
ZHUYongdong,XIEHua,SHUGuijun,etal.
XuanchengPeople'sHospital,Xuancheng,242000
ObjectiveTo investigate the clinical efficacy of icotinib for epidermal growth factor receptor (EGFR) mutant advanced non-small cell lung cancer after chemotherapy.Methods60 patients with EGFR mutant advanced non -small cell lung cancer were randomly divided into the control group and the experimental group.The control group was treated with conventional chemotherapy,the experimental group on the basis of the control group
icotinib hydrochloride tablets,125mg,3 times/d,the clinical total effective rate,quality of life score and adverse reaction were observed,The VEGF level,intercellular adhesion molecule-1 (ICAM-1) and tumor markers [SCC-Ag),carcinoembryonic antigen (CEA),cancer antigen 125 (CA125)] were observed.ResultsThe total effective rate (60.00%) and the total control rate (86.67%) were significantly higher than those of the control group (P<0.01).The quality of life score (123.84±32.63) was significantly lower than that of the control group (P<0.05).VEGF levels (21.27±1.76) and ICAM-1 levels (328.23±28.81) were significantly lower than those of the control group (P<0.05).The levels of SCC-Ag (2.56±0.32),CEA (5.49±1.55) and CA125 (21.37±1.87) were significantly lower than those of the control group (P<0.05) Adverse reactions rash (16.67%),bone marrow suppression (3.33%),diarrhea (16.28%) and oral ulcer (13.33%) were significantly lower than those of the control group (P<0.01).ConclusionIcotinib can effectively treat EGFR mutant advanced non-small cell lung cancer,reduce adverse reactions and improve the quality of life of patients,it is worthy of clinical promotion.
Icotinib;Non-small cell lung cancer;Epidermal growth factor receptor (EGFR);VEGF;ICAM-1
(ThePracticalJournalofCancer,2017,32:1974~1977)
242000 安徽省宣城市人民医院
10.3969/j.issn.1001-5930.2017.12.018
R734.2
A
1001-5930(2017)12-1974-04
2017-06-09
2017-10-26)
(编辑:吴小红)

