乙醇法提取鱼腥草总黄酮提取工艺研究*
阎 红,雒江菡,关桦楠,王宏宇,吕 明,姜 珊
(哈尔滨商业大学 细胞与分子生物学研究所,黑龙江 哈尔滨150076)
乙醇法提取鱼腥草总黄酮提取工艺研究*
阎 红,雒江菡*,关桦楠,王宏宇,吕 明,姜 珊
(哈尔滨商业大学 细胞与分子生物学研究所,黑龙江 哈尔滨150076)
鱼腥草作为一种常见的植物,广泛分布在中国的东南、中部和西南地区。它不仅可以作为食物,还可作为治疗各种疾病的药物。本论文以鱼腥草为原料,进行总黄酮的提取,筛选并优化其最佳工艺条件,并对其进行抑菌作用研究。鱼腥草总黄酮含量通过紫外可见分光光度法测定。最佳条件为:提取温度为80℃,料液比为1∶10,乙醇体积分数为60%,提取时间为90min,提取率为1.868%。该研究为鱼腥草资源的合理利用和天然抗菌剂的开发提供了依据。
鱼腥草;总黄酮;提取
鱼腥草(学名:Houttuynia cordata)在分类学上属双子叶植物三白草科蕺菜属,原名蕺菜,又名折耳根、蕺儿根、截儿根、猪鼻孔、九节莲等。由于其干茎和叶子经过粉碎后有鱼的腥味,所以将其命名为鱼腥草。鱼腥草广泛分布于我国的中部地区、西南地区及长江流域以南各地。鱼腥草具备很多的药理功效,可以提高人体免疫力,有抗菌、抗病毒及抗肿瘤等作用,有清热解毒、化痰、消肿排脓、利尿通淋等功能[1,2],是卫生部确认的一种药食两用的植物。
鱼腥草的主要成分之一是黄酮,大部分是以糖苷形式存在的苷类,主要是芦丁、槲皮甙、异槲皮苷、瑞诺苷、金丝桃甙等槲皮素和以槲皮素为甙元的黄酮类化合物。研究表明,它的花、叶、果实中均含有黄酮类物质,尤其是鱼腥草叶,其总黄酮含量是鱼腥草根茎的2至5倍。黄酮类物质只能从植物中提取得到,无法在人体中合成[3],鱼腥草就是一种黄酮类化合物的主要来源。
本试验考察单因素提取时间、提取温度、乙醇体积分数和固液比对鱼腥草中总黄酮提取效果的影响,在单因素试验的基础上用正交设计法优化醇提法提取鱼腥草中总黄酮的工艺,为扩大鱼腥草的经济价值,扩大使用范围具有重要的指导意义[4,5]。
1 实验部分
1.1 仪器设备及药品
本实验的原料为鱼腥草叶,呈棕色,有特异腥味,产地为江苏,由黑龙江蔺氏盛泰药业有限公司提供。
本次实验所用试剂:芦丁标准品(上海昕明生物科技有限公司);无水乙醇,NaNO2,NaOH,Al(NO3)3等购自重庆化学试剂总厂。
索氏提取器;旋转蒸发仪;紫外可见分光光度计。
1.2 标准曲线的制作
将芦丁标准品置于105℃常压干燥至质量恒定,精密量取芦丁标准品5mg于50mL容量瓶,用70%乙醇定容至50mL,摇匀,备用。
取6个25mL容量瓶,分别标号为1至6号,精确吸取芦丁标准溶液 0,1.0,2.0,3.0,4.0 和 5.0mL,依次放入1至6号容量瓶中,用70%乙醇补足10mL后加入5%NaNO2溶液0.8mL,摇匀,放置6min,加入 10%Al(NO3)3溶液 0.8mL,摇匀,放置6min,再加入 4%NaOH溶液10mL,摇匀,显色,用70%乙醇定容至刻度,放置15min后于510nm处测定其吸光度。以不同浓度的芦丁标准溶液的质量浓度(C)为横坐标,510nm下的吸光度(A)为纵坐标,绘制标准曲线[6]。
1.3 总黄酮的提取和含量测定
取适量鱼腥草粉末,以一定比例加入一定体积分数乙醇,置于50mL提取罐中,在一定温度下回流提取一定时间,待提取液冷却后,抽滤,取滤液置离心机中离心20min,离心后取上清液置50mL容量瓶中,用70%乙醇定容后按2.1方法待测[7]。
1.4 单因素试验
1.4.1 乙醇体积分数 操作同1.3部分,料液比为1∶10,温度为70℃,提取时间为120min,考察乙醇体积分数50%、60%、70%、80%、90%对鱼腥草总黄酮提取率的影响。
1.4.2 提取时间 操作同1.3部分,料液比为1∶10,温度为70℃,乙醇体积分数为70%,考察提取时间60、90、120、150、180min 对鱼腥草总黄酮提取率的影响。
1.4.3 提取温度 操作同1.3部分,料液比为1∶10,乙醇体积分数为70%,提取时间为120min,考察提取温度 50、60、70、80、90℃对鱼腥草总黄酮提取率的影响。
1.4.4 料液比 操作同1.3部分,温度为70℃,提取时间为120min,乙醇体积分数为70%,考察料液比1∶10、1∶20、1∶30、1∶40、1∶50 对鱼腥草总黄酮提取率的影响。
1.5 正交试验
以上单因素实验的结果为参考,考虑各因素对实验结果影响的大小,进行L9(34)正交试验,确定提取鱼腥草总黄酮的最佳工艺。
1.6 最优提取方案含量测定
根据1.5节正交试验结果,确定鱼腥草提取总黄酮的最佳工艺,在最佳工艺下按照1.3节方法提取总黄酮并测定其吸光度[8]。
1.7 方法学考察
1.7.1 精密度 取2mL芦丁标准溶液至50mL容量瓶中,加70%乙醇补足10.0mL,按2.1方法测其510nm下的吸光度(以不加芦丁的空白管为对照调零),重复测定6次,根据吸光度值计算相对标准偏差判断其精密度。
1.7.2 稳定性 取最优提取方案提取液2mL于50mL容量瓶中,加70%乙醇补足10.0mL,按2.1方法测其510nm下的吸光度,在180min内,每隔30min,于510nm处测一次吸光度。根据吸光度值计算相对标准偏差,判断吸光度是否稳定。
1.7.3 重复性 按最优方案以统一的条件提取鱼腥草中的总黄酮,重复5份,分别取提取液2mL,置于5个50mL容量瓶中,分别加70%乙醇补足10.0mL,按2.1方法测其510nm下的吸光度。根据吸光度值计算相对标准偏差,判断重复性是否良好。
2 结果与讨论
2.1 标准曲线
标准曲线见图1,得回归方程A=9.9429C-0.0041,R2=0.9976。
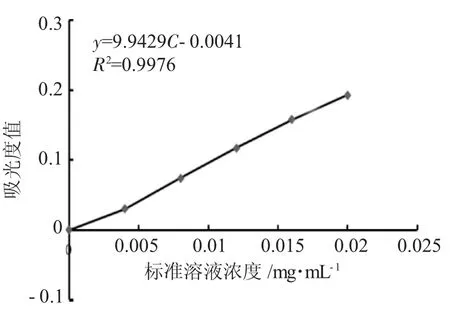
图1 标准曲线Fig.1 Standard curve
2.2 单因素试验结果
2.2.1 乙醇体积分数对总黄酮含量的影响 如图2所示,乙醇体积分数对提取液总黄酮含量影响明显,随乙醇体积分数的增加,提取液中总黄酮含量呈现先上升后下降的趋势。当乙醇体积分数为60%时,提取液总黄酮含量最高,为0.0292mg·mL-1。由此确定,提取鱼腥草总黄酮时最佳乙醇体积分数为60%。

图2 乙醇体积分数对总黄酮含量的影响Fig.2 Effect of alcohol volume on extraction efficiency of total flavonoids
2.2.2 提取时间对总黄酮含量的影响 如图3所示,提取时间对提取液总黄酮含量影响明显,随提取时间的延长,提取液中总黄酮含量呈现先上升后下降趋势。当提取时间为120min时,提取液中总黄酮含量最高,为0.0243mg·mL-1。由此确定,提取鱼腥草总黄酮最佳时间为120min。

图3 时间对总黄酮含量的影响Fig.3 Effect of extraction time on total flavonoids content
2.2.3 提取温度对总黄酮含量的影响 如图4所示,提取温度对提取液总黄酮含量影响明显,随提取温度的提高,提取液中总黄酮含量先上升后下降。当提取温度为70℃时,提取液总黄酮含量最高,为0.0334mg·mL-1。由此确定,提取鱼腥草总黄酮最佳温度为70℃。

图4 提取温度对总黄酮含量的影响Fig.4 Effect of extraction temperature on total flavonoids content
2.2.2.4 料液比对总黄酮含量的影响 如图5所示,料液比对提取液总黄酮含量影响明显,随着溶剂体积的增加,总黄酮含量先上升后下降。当料液比为1∶20时,提取液总黄酮含量最高,为 0.0208mg·mL-1。由此确定,提取鱼腥草总黄酮最佳料液比为1∶20。

图5 料液比对总黄酮含量的影响Fig.5 Effect of solid-liquid ratio on total flavonoids content
2.3 正交试验结果
在上述单因素实验的基础上,根据实验结果,进行四因素三水平实验,具体正交试验因素及水平见表1。

表1 L9(34)鱼腥草总黄酮提取工艺正交试验Tab.1 Orthogonal experiment of extracting total flavonoids from Houttuynia cordata
由表2可见,影响鱼腥草中总黄酮提取率的因素依次为D>A>B>C,即料液比>乙醇体积分数>提取时间>提取温度;最佳工艺为A1B2C3D1,即乙醇体积分数为60%、料液比为1∶10(g·mL-1)、提取温度为80℃,提取时间为90min。在此条件下鱼腥草的提取率为1.868%。

表2 L9(34)鱼腥草总黄酮提取工艺正交试验结果Tab.2 Orthogonal experiment results of extracting total flavonoids from Houttuynia cordata
2.4 方法学考察结果
2.4.1 精密度
试验结果见表3。吸光度RSD(n=6)为0.34%,表明此方法精密度良好。

表3 精密度试验结果Tabl.3 Accuracy test results
2.4.2 稳定性 试验结果见表4。吸光度RSD(n=6)为0.06%,表明供试品在3h内稳定。

表4 稳定性试验结果Tab.4 Stability test results
2.4.3 重复性 试验结果见表5。吸光度RSD(n=5)为0.73%,表明此方法重复性良好,方案可行。
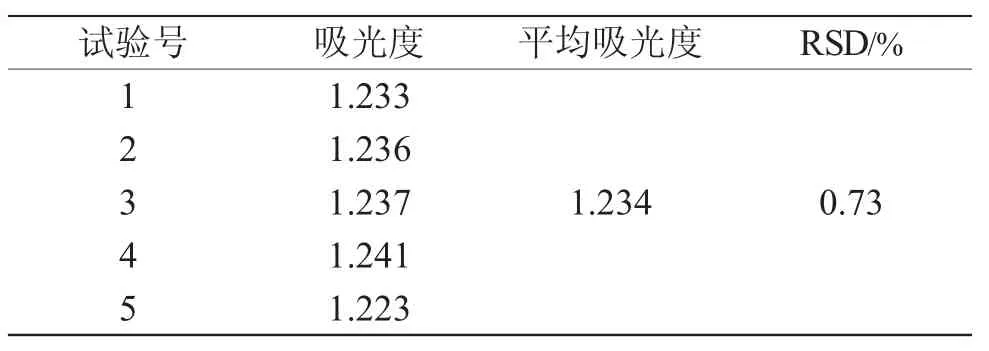
表5 重复性试验结果Tab.5 Repetitive test results
3 结论
本研究是从鱼腥草中提取具有抑菌作用的黄酮,选用醇提法提取黄酮,由于影响醇提法的主要因素是乙醇体积分数、料液比、提取温度和提取时间,因此,对这4个因素分别进行单因素试验,并根据所得结果确定较好的三水平进行正交试验,通过正交试验结果可知,提取黄酮的最优条件为乙醇体积分数60%,料液比1∶10,提取温度80℃,提取时间90min,总黄酮得率为1.868%。
[1] 陈婧,方建国,吴方建,等.鱼腥草抗炎药理作用机制的研究进展[J].中草药,2014,(2):284-289.
[2] 陈琴.鱼腥草多糖提取、纯化与抗氧化活性研究[D].西南科技大学,2016.
[3] 潘姝.马齿苋中多糖和总黄酮的分离纯化及其抑菌作用的研究[D].吉林:吉林农业大学,2015.
[4] 丁建海,常辉,张方娟.葫芦巴中总黄酮回流提取工艺研究[J].应用化工,2017,(11):1-7.
[5] Chen A,Xiang W,Liu D,et al.Determination of Total Flavonoids and Its Antioxidant Ability in Houttuynia cordata[J].Journal of Materials Science and Chemical Engineering,2016,(4):131-136.
[6] 方兰,邱树毅,周鸿翔,等.金线草主根总黄酮的提取工艺优化[J].中国酿造,2017,36(8):149-152.
[7] 杨申明,王波,陈靖,等.乙醇回流法提取甜菜树总黄酮及其抗氧化性评价[J].保鲜与加工,2016,16(4):61-66.
[8] 千春录,侯顺超,殷健东,等.响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性[J].食品科学,2016,37(10):76-81.
Study on extraction technology of total flavonoids from Houttuynia cordata thunb by alcohol*
YAN Hong,LUO Jiang-han*,GUAN Hua-nan,WANG Hong-yu,LV Ming,JIANG Shan
(Institute of Cell and Molecular Biology,Harbin University of Commerce,Harbin 150076,China)
As a common plant,Houttuynia cordata is widely distributed in the area of southeast,central region and southwest of China.It is not only used as great food material,but also a medicine for curing various diseases.This paper used Houttuynia cordata as a raw material to extract total flavonoids,screen and optimize the best process conditions,and in vitro antibacterial test.The total flavonoids quality of Houttuynia cordata are determined by UV-V spectrophotometry.The results showed that the best extraction condition of flavonoids from Houttuynia cordata includes:the extraction temperature is 80℃,solid-liquid ratio is 1∶10,solvent is 60%ethanol,extraction time is 90 min.The extraction efficiency was 1.868%.This study provided a basis for the reasonable utility of the resource and the development of natural antimicrobials.
Houttuynia cordata;Total flavonoids;extraction
R932
A
10.16247/j.cnki.23-1171/tq.20171218
2017-09-19
大学生创新创业训练计划项目(No.201610240007)
阎 红(1993-),女,哈尔滨,汉,在读本科生,从事制药工程研究。
导师简介:雒江菡(1980-),女,汉,讲师,博士,主要从事中药学研究。

