一株海藻多糖降解菌的分离鉴定及产酶条件优化
朱大玲, 唐啸龙, 张宝玉, 杨振芳, 王乐普, 秦乐宁, 张 蕾
一株海藻多糖降解菌的分离鉴定及产酶条件优化
朱大玲1, 唐啸龙2, 张宝玉3, 杨振芳2, 王乐普1, 秦乐宁1, 张 蕾1
(1. 天津市海洋化学与资源重点实验室, 天津科技大学 化工与材料学院, 天津 300457; 2. 天津科技大学 海洋与环境学院, 天津 300457; 3. 中国科学院 海洋研究所, 山东 青岛 266071)
从大型褐藻藻体分离获得一株具有高效降解琼胶和褐藻胶能力的革兰氏阴性菌菌株ST-6。16S rDNA序列分析结果表明, 该菌株与海绵假单胞菌的相似度达到99%, NJ法构建系统进化树也与海绵假单胞菌归为一类, 鉴定为海绵假单胞菌ST-6。在2216E培养基、30℃培养条件下, 海绵假单胞菌ST-6的生长曲线表明, 接种10~48 h为菌株的指数生长期, 48~72 h为生长稳定期。产酶结果表明, 菌株ST-6在指数生长期时菌液的胞外琼胶酶相对酶活力较高, 在接种48 h时, 菌液的琼胶酶相对酶活力最高为249.15 U/mL。此外, 发现菌株ST-6的琼胶酶和褐藻胶酶的分泌类型分别为非诱导型和诱导型。采用单因素分析法对其生长和产酶条件进行分析, 结果表明, 海绵假单胞菌ST-6最适生长条件为: 温度25~35℃, pH值5~9; 最适产琼胶酶条件为: 温度30℃, pH值为7, 琼胶浓度0.3%。最适产褐藻胶酶条件为: 温度35℃, pH值为9。在温度30℃、pH9和褐藻酸钠浓度0.15%的培养条件下, 海绵假单胞菌ST-6获得最高胞外褐藻胶酶相对酶活力为135.54 U/mL。
海绵假单胞菌; 琼胶酶酶活; 褐藻胶酶酶活; 3,5-二硝基水杨酸比色法; 产酶条件优化
大型海藻是重要的海洋资源, 具有广泛的开发前景。近年来, 随着化石燃料短缺和环境保护需要, 海藻作为生物燃料和化工产品生产原料的应用越来越受到关注[1]。大型海藻海带和江蓠的养殖技术成熟, 使得其作为生物燃料和化工产品生产原料的应用可行性大大提高。目前我国海带和江蓠养殖已经遍布沿海地区, 其中海带产量居世界首位[2]。因此, 在我国开展利用大型海藻生产生物燃料和化工产品的开发应用具有得天独厚的条件。大型海藻具有生长环境要求宽泛, 生长速度快, 不含木质素, 易于养殖和收获等特点, 使其作为生物质原料利用的成本大大降低。同时, 大型海藻的光合速率高, 规模化养殖大型海藻吸收环境中的CO2, 具有一定的环境效益[3]。然而, 海藻多糖的降解是限制大型海藻作为生物质原料开发利用的瓶颈问题。
大型海藻海带和江蓠的主要成分为褐藻胶和琼胶, 两者分别是褐藻和红藻细胞壁结构的重要多糖。褐藻胶由1,4---甘露糖醛酸和1,4---古罗糖醛酸两种单体组成, 褐藻胶以多聚甘露糖醛酸、多聚古罗糖醛酸或两者交替排列的线性无分支长链形式存在[4]。琼胶以1,3-O---吡喃半乳糖和1,4--3,6-内醚---吡喃半乳糖交替连接组成的链状分子形式存在[5]。因结构组成的特殊性和复杂性使得褐藻胶和琼胶难以被普通微生物降解, 常被用于实验室中微生物培养的基质或是固定化培养的基质[6]。与化学方法相比, 海藻多糖的生物酶解法温和、高效及环境友好, 是海藻多糖降解的首选方法[7]。微生物酶解法因其生长速度快, 产酶量高, 较海洋动物产酶的成本低, 是海藻多糖降解的研究热点。
已报道的褐藻胶和琼胶降解菌株大多分离自海洋环境, 其中包括弧菌属[8]、链霉菌属[9]、交替单胞菌属[10]、假别单胞菌属[11]、假单胞菌属[12]、嗜琼胶菌属[13]等微生物菌株。不同菌株所产降解酶的种类多样, 不同降解酶的酶解位点具有专一性, 这也使得不同菌株所产酶的降解产物呈现多样性。例如: Li等[14]从假单胞菌sp.HJZ216的发酵液中纯化的褐藻胶裂解酶能将褐藻胶裂解成六种寡糖, 其中包括二糖和三糖。Kim等[15]从韩国釜山附近的沿海沼泽中分离到菌株所产降解酶既能降解褐藻胶又能降解昆布多糖。弧菌属菌株sp. PO-303所产酶可降解琼胶生成5种新琼寡糖[16]。白色噬琼胶菌OAY2可产两种琼胶酶, 分别可降解琼胶生成三种新琼寡糖(NA2、NA4和NA6)和二种新琼寡糖(NA4和NA6)[17]。然而, 不同降解菌株所产降解酶的多样性及其降解产物的多样性使得大型海藻作为生物质原料的开发利用成本升高。目前利用大型海藻制备生物燃料和化工产品的研究报道仍停留在实验阶段或是小试阶段。因此, 降解底物宽泛、降解产物单一等高效微生物菌株的获得仍是解决大型海藻开发利用的重要途径之一。
本研究从褐藻藻体中分离鉴定了一株既能降解褐藻胶又能降解琼胶的高效菌株, 对其性能及其产酶条件进行分析, 以期为大型海藻多糖的高值化和能源化利用提供前提条件。
1 材料与方法
1.1 样品和培养基
样品为深圳汕头海滨潮间带采集野生大型褐藻鼠尾藻藻体。褐藻胶分离培养基(g/L): 褐藻酸纳3, NaCl 30, KH2PO43, K2HPO47, (NH4)2SO42, MgSO40.1, FeSO40. 1, pH 6.0。固体培养基加入1.5%的琼脂。纯化培养基是在2216E海水细菌培养基中添加了褐藻酸钠, 具体组分如下(g/L): 蛋白胨5, 酵母粉1, 柠檬酸铁0.011, 褐藻酸钠15, 陈海水定容至1 L, pH7.6。
1.2 菌株的筛选
将样品组织经研磨后加入褐藻胶分离培养基, 30℃振荡培养72 h。取菌液稀释后涂布在褐藻胶分离培养基平板上, 用封口膜将平板密封, 置30℃培养箱中静置培养3 d, 挑取使培养基明显液化的单菌落, 进一步在纯化培养基平板上划线纯化, 重复进行3次, 直至获得纯化菌株。纯化菌株–80℃保存备用。
1.3 菌株的鉴定
1.3.1 菌株的形态学观察
通过光镜(Olympus, 日本)对菌体的形态进行观察。革兰氏鉴定采用KOH法。
1.3.2 16S rDNA序列分析
细菌基因组DNA提取用酚–氯仿抽提法。根据Pitcher等[18]的描述稍作改动: 纯菌株接种于2216E培养基, 30℃振荡养48 h, 5 000 r/min离心10 min后, 弃上清取沉淀, 加入TE缓冲液洗涤2次; 菌体重悬在200 µL TE缓冲液, 加入溶菌酶(25 µg/mL)混匀, 65℃孵育1 h; 加入蛋白酶K(250 µg/mL)和10% SDS 10 µL混匀, 55℃孵育30 min, 溶菌产物暂时置于冰上。加入抽提液(酚︰氯仿︰异戊醇=25︰24︰1), 轻轻混匀, 此过程进行2次, 取水相。加入2.5倍体积的预冷无水乙醇沉淀。沉淀DNA重溶在无菌水中, –20℃保存备用。
以基因组DNA为模板PCR扩增16S rRNA基因, 引物按文献报道[19], 在上海生工生物工程技术服务有限公司合成, 序列如下: 27F(5′-AGAGTTTGATCC TGGCTCAG-3′)和1492R(5′-GGCTACCTTGTTACGA CTT-3′)。以94℃预变性2 min; 94℃ 30 s, 55℃30 s, 72℃ 2 min, 35个循环; 72℃延伸10 min 程序步骤进行PCR扩增。
取5 μL PCR扩增产物经1.2%琼脂糖凝胶(含适量的EB)电泳, 用Gene-Genius凝胶成像系统拍照、记录分析。扩增产物直接进行测序, 由上海生工生物工程技术服务有限公司完成。
根据获得16S rDNA序列在GenBank数据库中进行Blast搜索同源序列, 并以BioEdit软件进行多重序列比对。通过MEGA 4.0等软件, 以邻接法建立系统进化树, Bootstrap置信值估算重复次数1 000次。
1.4 菌株的生长曲线及产酶情况分析
无菌操作将5 μL菌液接种到250 mL 2216E培养基(250 mL锥形瓶)中, 30℃, 120 r/min振荡条件下培养, 10、12、16、20、24、34、36、40、48、58、60、64、68、72 h分别取菌液, 测定菌液的生物量积聚和菌液上清中的琼胶酶和褐藻胶酶相对酶活力。生物量积聚测定采用分光光度计法, 即测定菌液在600 nm处的吸光值。琼胶酶和褐藻胶酶相对酶活力测定采用3,5-二硝基水杨酸比色法(DNS法)。
1.5 产酶条件优化
以2216E海水培养基为基础培养基, 分别对温度、起始pH、琼脂粉浓度、褐藻酸钠浓度四个主要产酶条件进行单因素实验, 其中对温度、起始pH、琼脂粉浓度进行单因素实验时都加入了体积分数为0.15%的褐藻酸钠, 其他条件相同。其中温度实验组为5个水平, 分别为10、20、25、30、35℃; 起始pH值实验组为6个水平, 分别为5、6、7、8、9、10; 琼脂粉浓度实验组为6个水平, 分别为0.10%、0.15%、0.20%、0.25%、0.30%、0.35%; 褐藻酸钠浓度实验组为5个水平, 分别为0.1%、0.2%、0.3%、0.4%、0.5%。每个实验组设置三个平行, 无菌操作将5 μL菌液接种到50 mL 2216E培养基(100 mL锥形瓶)中, 分别在30℃, 120 r/min条件下振荡培养48 h后取样, 测定菌液的生物量积聚和菌液上清的琼胶酶和褐藻胶酶相对酶活力。生物量积聚测定采用分光光度计法。琼胶酶和褐藻胶酶相对酶活力测定采用DNS法。
1.6 酶活测定方法
分别以半乳糖和葡萄糖作为标准品, 测定OD520 nm值分别制作标准曲线。菌液在4℃、5 000 r/min条件下离心15 min后, 取上清作为粗酶液分别测定菌株胞外琼胶酶相对酶活力和褐藻胶相对酶活力。相对酶活力测定在Miller(1959)操作的基础上稍作改进[20], 具体步骤如下: 100 μL的粗酶液分别与100 μL的琼胶底物溶液/褐藻酸钠底物溶液(用pH7.6的0.1 mol/L K2HPO4-KH2PO4缓冲液配置)混合均匀, 40℃水浴条件下反应30 min, 然后在反应体系中加入150 μL DNS混匀, 煮沸5 min后用蒸馏水定容至2.5 mL。以煮沸灭活的上清液做空白对照测其在520 nm处的吸光值。根据标准曲线确定相对酶活力大小。在上述反应条件下每分钟产生1 μg还原糖的酶量作为一个酶活力单位, 相对酶活力为每毫升细菌培养液的酶活力单位。相对酶活力(U/mL)=/×1000×/×10,为在波长为520 nm条件下的吸光值,为标准曲线斜率,为粗酶液稀释倍数,为反应时间。
2 结果与分析
2.1 菌株的分离与鉴定
从汕头野生褐藻鼠尾藻藻体中分离获得一株具有降解琼胶和褐藻胶能力的高效菌株ST-6。光镜下形态学观察发现该菌株为椭球状。经KOH法鉴别该菌为革兰氏阴性菌。经PCR扩增和序列测定获得菌株ST-6的16S rRNA基因序列片度, 长度为1 399 bp, 该序列的NCBI登录号为KY327836。16S rRNA基因相似性分析发现菌株ST-6的16S rRNA基因与海绵假单胞菌()相似性最高。其中EU603457(EU419930)和AB125367(NR040991)等菌株的相似性为99%, 与NR044415和DQ288951的相似度为97%, 采用NJ法构建系统进化树, 结果表明菌株ST-6与海绵假单胞菌归为一类(图1)。因此, 菌株ST-6鉴定为海绵假单胞菌ST-6。

图1 菌株ST-6的16S rRNA基因序列构建的NJ系统进化树
2.2 菌株的生长曲线及产酶情况分析
2.2.1 标准曲线制作
以半乳糖为标准品, 测得的标准曲线如图2a所示, 标准曲线方程为=3.919 2–0.022 2,2=0.976 8,线性关系良好, 标准曲线可信度高。因此, 菌株的胞外琼胶酶相对酶活力(U/mL) =(+0.022 2)/3.919 2× 1 000×/×10, 式中:为波长520 nm条件下的吸光值; 0.0222为截距; 3.919 2为标准曲线的斜率;为酶液的稀释倍数;为反应时间。
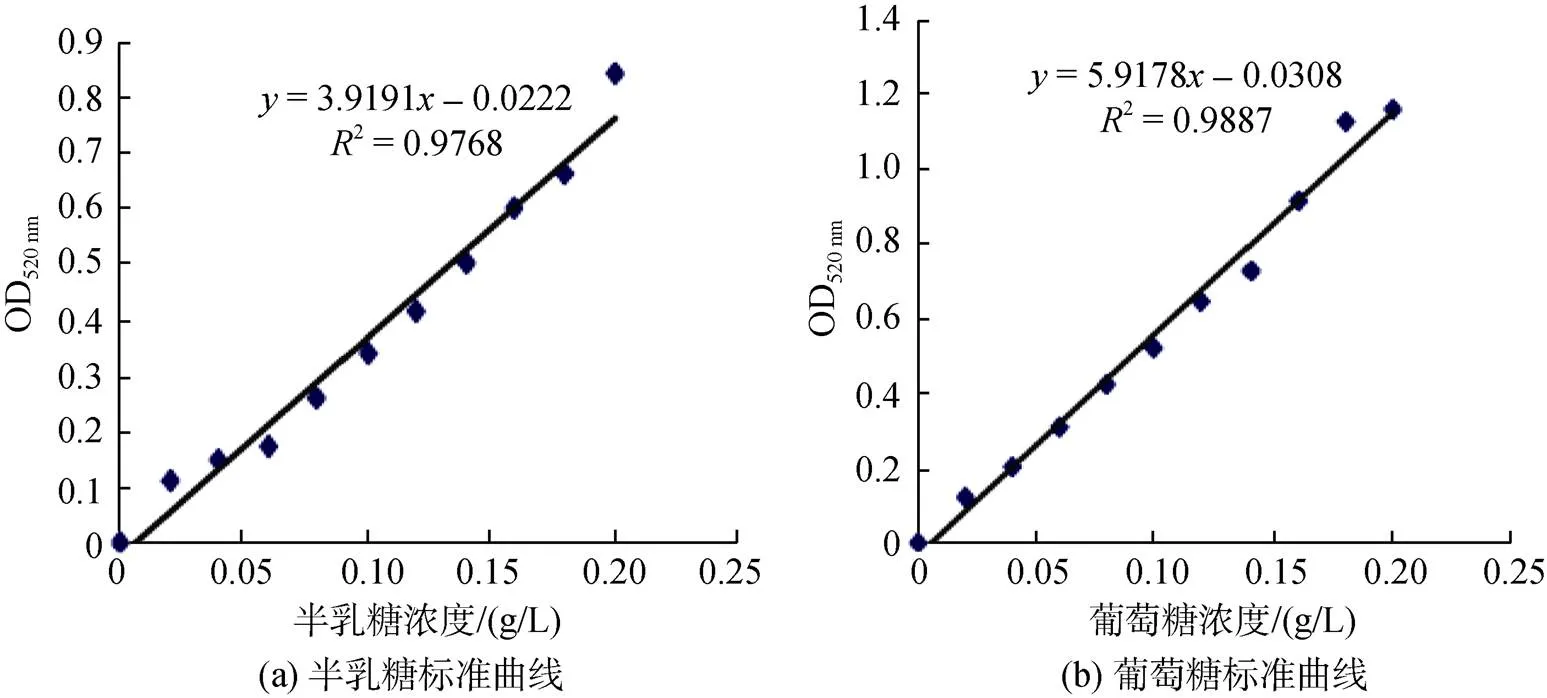
图2 标准曲线图
以葡萄糖为标准品, 测得的标准曲线如图2b所示, 标准曲线方程为=5.917 8-0.030 8,2=0.988 7, 线性关系良好, 标准曲线可信度高。因此, 菌株的胞外褐藻胶酶相对酶活力(U/mL) =(+0.030 8)/ 5.917 8× 1 000×/×10, 式中:为520 nm下的吸光值; 0.0308为截距; 5.917 8为标准曲线的斜率;为酶液的稀释倍数;为反应时间。
2.2.2 生长曲线及产酶情况分析
海绵假单胞菌ST-6的生长曲线如图3所示, 结果表明在2216E培养基、30℃、120 r/min振荡培养条件下, 接种后10~48 h为菌株的对数生长期, 48 h时后菌株生物量达到稳定, 48~72 h为生长平稳期, 期间OD600 nm值维持在2.02。在海绵假单胞菌ST-6菌株生长监测的同时, 对其所产胞外酶进行分析, 结果表明在生长指数期早期, 即接种后20~36 h菌株胞外琼胶酶相对酶活力随时间延长呈上升趋势, 在接种后36 h达到最高值为243.51 U/mL。在指数生长期后期, 即36~48 h菌株ST-6的胞外琼胶酶相对酶活力先下降后上升, 48 h时达到最高值为249.15 U/mL。进入生长平稳期, 菌株的胞外琼胶酶相对酶活力呈下降趋势, 72 h时胞外琼胶酶相对酶活力有所回升, 为216.38 U/mL。另外, 菌液的褐藻胶酶活也进行了测定, 结果表明尽管该菌株是以降解褐藻酸钠进行富集筛选获得的, 但是在以2216E为培养基, 不含褐藻酸钠的培养条件下, 海绵假单胞菌菌株ST-6不产胞外褐藻胶酶。因在生长指数期时, 菌株的胞外琼胶酶相对酶活力较高, 故选择培养时间为48 h进行取样进行下一步产酶条件优化研究。

图3 菌株ST-6生长曲线及产酶情况分析
2.3 不同培养条件对海绵假单胞菌ST-6生长情况的影响
温度对海绵假单胞菌ST-6生长的影响如图4A, 结果表明不同温度对菌株ST-6的生长影响显著, 在25~35℃时, 菌株生长良好, OD600 nm值为2.00左右。生长最适温度为25℃和35℃。10℃时菌株生长速度较慢, OD600 nm值仅为1.09。起始pH值对菌株ST-6生长的影响如图4B, 结果表明不同pH值对菌株的生长影响不显著, 在pH6~9之间菌株的生长速度快且相近, 分别在1.52~1.75之间。在pH10碱性条件下, 生长受到抑制, 生长速度变慢, OD600 nm值仅为1.25。琼脂粉浓度对菌株ST-6生长的影响如图4C, 琼脂粉浓度对菌株的生长影响不显著, 琼脂粉浓度为0.1%~ –0.4%时, 菌株ST-6的生长状态皆较好, OD600 nm值为1.60左右。海藻酸钠浓度对菌株ST-6生长的影响如图4D, 结果表明不同起始海藻酸钠浓度对菌株的生长影响不显著, 在海藻酸钠质量分数0.1%~0.5%之间菌株的生物积聚量相近, OD600 nm值为1.60左右。因此, 海绵假单胞菌ST-6的生长条件要求宽泛, 温度为25~ 35℃、pH6-9条件下生长速度较快, 海藻多糖浓度对该菌株的生长影响不显著。
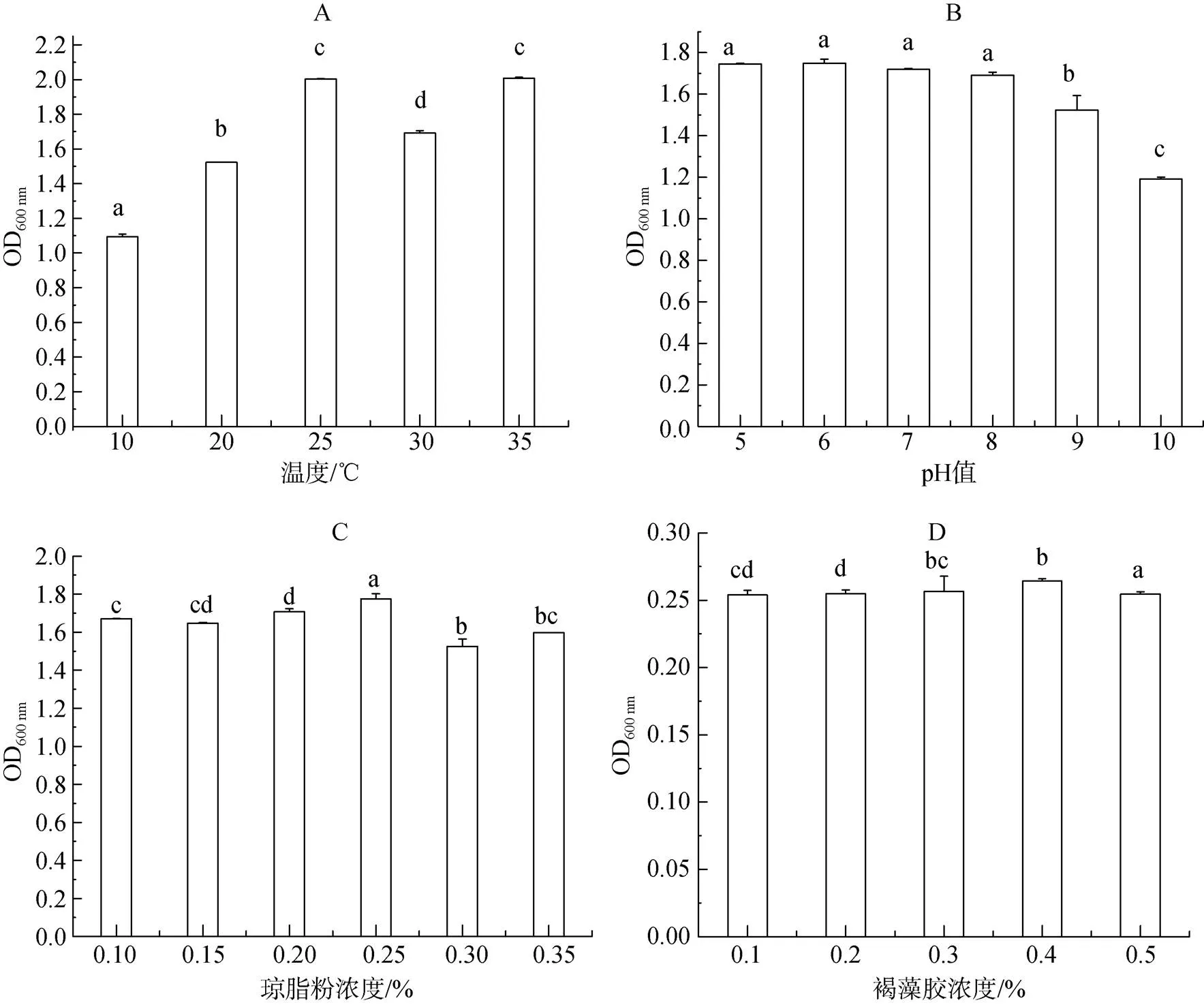
图4 不同培养条件对菌株ST-6生长情况的影响
图中不同字母代表在=0.05水平差异显著, 下同
Different letters in figure represent significant difference at the level of= 0.05. The same as below
2.4 不同培养条件对菌株ST-6产胞外琼胶酶的影响
温度对菌株ST-6产胞外琼胶酶的影响如图5A, 结果表明不同温度对菌株的胞外琼胶酶相对酶活力的影响显著。温度为30℃时, 菌液的胞外琼胶酶相对酶活力最高为179.68 U/mL。其次为温度20℃时菌液的胞外琼胶酶相对酶活力为152.98 U/mL。起始pH值对菌株ST-6的产胞外琼胶酶情况影响如图5B, 结果表明不同pH值对菌株的产酶影响显著, pH7时菌液的琼胶酶相对酶活力最高为203.40 U/mL, pH8时为170.00 U/mL。中性pH值利于该菌株产胞外琼胶酶, 弱酸或弱碱pH值条件都不利于菌株产胞外琼胶酶。琼脂粉浓度对菌株ST-6产酶情况的影响如图5C, 琼脂粉浓度对菌株ST-6的产胞外琼胶酶的影响显著, 低浓度的琼脂粉浓度条件下, 菌液的胞外琼胶酶相对酶活力较低。琼脂粉浓度为0.3%时, 菌液的琼胶酶相对酶活力最高为205.96 U/mL。这可能是由于菌株所产的胞外琼胶酶与琼脂粉作用, 降解生成单糖或寡糖用于细菌生长所需。海藻酸钠浓度对菌株ST-6的产琼胶酶情况影响如图5D, 结果表明不同海藻酸钠浓度对菌株的产酶影响显著。当海藻酸钠浓度为0.1%时, 菌液的琼胶酶相对酶活力最高为189.36 U/mL; 其次, 当海藻酸钠浓度为0.3%时, 菌液的琼胶酶相对酶活力为187.09 U/mL。
2.5 不同培养条件对菌株ST-6产胞外褐藻胶酶的影响
温度对菌株ST-6产胞外褐藻胶酶的影响如图6A, 结果表明温度对菌株ST-6产胞外褐藻胶酶的影响显著。最适的产褐藻胶酶温度为35℃, 菌液的褐藻胶酶相对酶活力最高为108.43 U/mL。此外, 相对较低的温度利于菌株产褐藻胶酶, 在温度为10~ 20℃时, 菌株ST-6的胞外褐藻胶酶相对酶活力为是25~30℃酶活的2倍。起始pH值对菌株ST-6产胞外褐藻胶酶情况影响显著如图6B, 结果表明pH9时菌液的褐藻胶酶相对酶活力最高为135.54 U/mL, 其次, pH7时菌液的褐藻胶酶相对酶活力为130.67 U/mL。然而, pH8时菌液的褐藻胶酶相对酶活力最低为63.72 U/mL。琼脂粉浓度和褐藻酸钠浓度对菌株ST-6产胞外褐藻胶酶情况的影响分别如图6C和6D, 结果表明琼脂粉浓度对菌液的褐藻胶酶相对酶活力有影响, 较低的琼脂粉浓度时, 菌液的褐藻胶酶相对酶活力较高, 但是最高也仅为26.40 U/mL。褐藻酸钠浓度对菌液的褐藻胶酶相对酶活力影响不显著, 当褐藻酸钠浓度为0.1%~0.4%时, 菌液的褐藻胶酶相对酶活力为80.26~85.40 U/mL。

图5 不同培养条件对菌株ST-6产胞外琼胶酶的影响
3 讨论
从大型海藻藻体中分离获得一株具有分泌胞外琼胶酶和褐藻胶酶的高效细菌菌株ST-6, 经16S rRNA 基因序列分析, 该菌株鉴定为海绵假单胞菌。海绵假单胞菌隶属于假单胞菌科(Pseudomonadaceae)假单胞菌属()该菌种菌株多分离自海洋环境, 有关该菌种的研究报道较少[21]。有报道该菌种的菌株具有降解石油的能力, 尚未见该菌种菌株具有降解海藻多糖的能力[22]。海绵假单胞菌ST-6具有同时降解琼胶和褐藻胶的能力, 具有较好的应用前景。
通过分析海绵假单胞菌ST-6的生长曲线及产酶情况监测分析, 发现该菌株在不添加琼胶和褐藻胶的2216E培养基中生长良好, 分泌琼胶酶, 不产褐藻胶酶, 这表明该菌株的琼胶酶分泌类型为非诱导型, 而褐藻胶酶分泌类型为诱导型。此外, 菌株在生长对数期后期和生长平稳期早期生物量较高, 而相应时期菌株的胞外琼胶酶相对酶活力却较低, 这可能是由于菌株分泌的琼胶酶在胞外与底物发生酶解反应生成琼胶寡糖, 琼胶寡糖的浓度达到较高水平反馈抑制了琼胶酶的分泌, 菌株的代谢机制及反馈机制有待深入的研究进行阐明。
综合比较不同培养条件下菌株的生长及产酶情况, 结果表明在不同温度、起始pH、琼脂粉浓度和褐藻酸钠浓度条件下, 菌株的生物量和胞外酶相对酶活力的变化趋势无明显相关性。当温度35℃时, 菌株的生长速度、胞外琼胶酶相对酶活力和胞外褐藻胶酶相对酶活力最高。起始pH为7时菌株的生长速度、胞外琼胶酶相对酶活力和胞外褐藻胶酶相对酶活力皆较高。琼脂粉浓度为0.30%时, 菌株的生长速度和胞外琼胶酶相对酶活力高。褐藻酸钠浓度为0.1%时, 菌株生长、胞外琼胶酶相对酶活力和胞外褐藻胶酶相对酶活力较高。在琼脂粉和褐藻酸钠两种多糖皆存在的条件下, 细胞分泌琼胶酶量高而褐藻胶酶量较低, 这可能是由于在琼胶酶和褐藻胶酶分泌及相应的寡糖吸收利用的代谢过程中存在竞争关系, 琼胶酶为非诱导型分泌, 琼胶寡糖可能是菌株的首选碳源底物。

图6 不同培养条件对菌株ST-6产胞外褐藻胶酶的影响
在温度30℃、pH7.6、2216E培养基培养条件下, 海绵假单胞菌ST-6获得最高胞外琼胶酶相对酶活力为249.15 U/mL。在温度30℃、pH9和褐藻酸钠浓度0.15%的培养条件下, 海绵假单胞菌ST-6获得最高胞外褐藻胶酶相对酶活力为135.54 U/mL。与报道的琼胶降解菌和褐藻胶降解菌相比, 海绵假单胞菌ST-6的产酶能力较高, 该菌株适合作为大型海藻开发利用的候选菌株进行深入研究。
[1] Wei N, Quarterman J, Jin Y S. Marine macroalgae: an untapped resource for producing fuels and chemicals[J]. Trends Biotechnol, 2013, 31(2): 70-77.
[2] 金振辉, 刘岩, 张静, 等. 中国海带养殖现状与发展趋势[J]. 海洋湖沼通报, 2009, 1: 141-150. Jin Zhenhui, Liu yan, Zhang Jing, et al. Breeding actuality and developing direction ofin China[J]. Transactions of Oceanology and Limnology, 2009, 1: 141-150.
[3] Goh C H, Lee K T. A visionary and conceptual macroalgae- based third-generation bioethanol (CGB) biorefinery in Sabah, Malaysia as an underlay for renewable and sustainable development[J]. Renew Sust Energ Rev, 2010, 14 (2): 842-848.
[4] Rioux L E, Turgeon S L, Beaulieu M. Characterization of polysaccharides extracted from brown seaweeds[J]. Carbohydr Polym, 2007, 69: 530-537.
[5] Duckworth M, Yaphe W. The structure of agar. Part 1. fractionation of a complex mixture of polysaccharides[J]. Carbohydr Res, 1971, 16(1): 189-197.
[6] Bixler H J, Porse H. A decade of change in the seaweed hydrocolloids industry[J]. J Appl Phycol, 2011, 23(3): 321-335.
[7] Chi W J, Chang Y K, Hong S K. Agar degradation by microorganisms and agar-degrading enzymes[J]. Appl Microbiol Biotechnol, 2012, 94: 17-30.
[8] Liao L, Xu X W, Jiang X W, et al. Cloning, expression, and characterization of a new β-agarase fromsp. strain CN41[J]. Appl Environ Microbiol, 2011, 77(19): 7077-7079.
[9] Temuujin U, Chi W J, Chang Y K, et al. Identification and biochemical characterization of Sco3487 fromA3 (2), an exo- and endo-type-agarase-producing neoagarobiose[J]. J bacteriol, 2012, 194(1): 142-149.
[10] Akagawa M, Matsuo M, Koga Y, et al.sp. Nov. andsp. Nov. bacteria that decompose algal polysaccharides[J]. Int J System Bacteriol, 1992, 42(4): 621-627.
[11] Oh C, Nikapitiya C, Lee Y, et al. Cloning, purification and biochemical characterization of beta agarase from the marine bacteriumsp. AG4[J]. J Ind Microbiol Biotechnol, 2010, 37(5): 483-494.
[12] Fujiyama K, Maki H, Kinoshita S, et al. Purification and characterization of the recombinant alginate lyase fromsp. leaked byupon addition of glycine[J]. FEMS Microbiol Lett, 1995, 126(1): 19-23.
[13] Kobayashi T, Uchimura K, Miyazaki M, et al. A new high-alkaline alginate lyase from a deep-sea bacteriumsp[J].Extremophiles, 2009, 13(1): 121- 129.
[14] Li L, Jiang X, Guan H, et al. Three alginate lyases from marine bacteriumHZJ216: purification and characterization[J]. Appl Biochem Biotechnol, 2011, 164(3): 305-317.
[15] Kim E J, Fathoni A, Jeong G T, et al., a novel alginate- and laminarin-degrading bacterium for the reutilization of brown-seaweed waste[J]. J Environ Management, 2013, 130: 153-159.
[16] Araki T. Hayakawa M, Lu Z, et al. Purification and characterization of agarases from a marine bacterium,sp. PO-303[J]. J Mar Biotechnol, 1998, 6(4): 260-265.
[17] Yang M, Mao X Z, Liu N, et al. Purification and characterization of two agarases fromOAY02[J]. Process Biochem, 2014, 49(5): 905-912.
[18] Pitcher D G, Saunders N A, Owen R J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate[J]. Lett Appl Microbiol, 1989, 8: 151-156.
[19] 闵怀, 黄备, 刘小宇, 等. 一株海洋细菌MZ0306A1的16S rDNA扩增及序列分析[J]. 海洋科学, 2008, 32(10): 13-17.Min Huai, Huang Bei, Liu Xiaoyu, et al. The 16S rDNA amplification and sequence analysis of a marine bacterium MZ0306A1[J]. Marine Science, 2008, 32(10): 13-17.
[20] Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Anal Chem, 1959, 31(3): 426-428.
[21] Romanenko L A, Uchino M, Falsen E, et al.sp nov., isolated from a marine sponge[J]. Int J Syst Evol Microbiol , 2005, 55(2): 919-924.
[22] Kostka J E, Prakash O, Overholt W A, et al. Hydrocarbon- degrading bacteria and the bacterial community responsein Gulf of Mexico beach sands impacted by the DeepwaterHorizon oil spill[J]. Appl Environ Microbiol, 2011, 77(22): 7962-7974.
Isolation identification and enzyme-producing conditions analysis of a seaweed polysaccharides-degrading bacteria
ZHU Da-ling1, TANG Xiao-long2, ZHANG Bao-yu3, YANG Zhen-fang2, WANG Le-pu1, QIN Le-ning1, ZHANG Lei1
(1. Tianjin Key Laboratory of Marine Resources and Chemistry, College of Chemical Engineering and Materials Science, Tianjin University of Science and Technology, Tianjin 300457, China; 2. College of Marine and Environmental Science, Tianjin University of Science and Technology, Tianjin 300457, China; 3. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
In this study, we isolated a marine agar and alginate-degrading Gram-negative bacterial strain ST-6 from brown seaweed. The results of our 16S rDNA sequence analysis indicate that the similarity was 99% between the strain ST-6 and the strains ofWe classified these strains as a class in phylogenetic trees using the NJ method and identified the strain asST-6. After culturing in a 2216E medium at 30℃, we simultaneously analyzed the biomass accumulation and enzyme production ofST-6. The growth curve results indicate the exponential and stationary growth phases to be 10–48 h and 48–72 h after inoculation, respectively. The enzyme production results indicate that the enzyme activity was higher in the exponential growth phase and that the highest extracelluar agarase relative activity was 249.15 U/mL 48 h after inoculation. In addition, the secretion types of agarase and alginate lyase ofST-6 were non-inducible and inducible, respectively. The optimum growth conditions were a culture temperature of 25–35℃ and initial pH values of 5 and 9, respectively. The optimum agarase-producing conditions were a culture temperature of 30℃, an initial pH value of 7, and an initial agar concentration of 0.30%. The optimum alginate lyase-producing conditions were a culture temperature of 35℃, an initial pH value of 9, and an alginate concentration of 0.30%. We obtained a maximum relative extracelluar alginate lyase activity of 135.54 U/mL in culture conditions with a temperature of 30℃, a pH value of 7, and an alginate concentration of 0.30%.
; agarase activity; alginate lyase activity; 3, 5-Dinitrosalicylic acid colorimetry method; condition optimization of enzyme production.
(本文编辑: 康亦兼)
[the Open Fund of Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, No. 0F2015N015; the Youth Innovation Foundation of Tianjin University of Science and Technology, No. 2015LG10; the Key Technologies R & D Program of Tianjin, No. 15ZXCXSF00040; National Nature Science Foundation, No. 21406169]
Dec. 22, 2016
S944
A
1000-3096(2017)08-0099-09
10.11759/hykx20161222001
2016-12-22;
2017-02-26
青岛海洋科学与技术国家实验室开放基金项目(0F2015N015); 天津科技大学青年教师创新基金项目(2015LG10); 天津市科技支撑计划项目(15ZXCXSF00040); 国家自然科学基金项目(21406169)
朱大玲(1978-), 山东省蓬莱人, 副研究员, 硕士生导师, E-mail: zhudaling@tust.edu.cn

