支气管肺癌组织中包含氧化还原酶的WW域还原蛋白、同源性磷酸酶-张力蛋白的表达及临床意义
张竞 董周寰 赵明 薛志强 王钰琦 田晓东 王云喜
·论著·
支气管肺癌组织中包含氧化还原酶的WW域还原蛋白、同源性磷酸酶-张力蛋白的表达及临床意义
张竞1董周寰2赵明1薛志强1王钰琦1田晓东1王云喜1
目的探讨包含氧化还原酶的WW域抗原(WWOX)蛋白与同源性磷酸酶-张力蛋白(PTEN)在支气管肺癌组织中的表达及临床意义。方法应用免疫组化法检测WWOX与PTEN蛋白在87例支气管肺癌组织标本与23例正常肺组织标本中的表达,分析WWOX与PTEN蛋白表达与支气管肺癌患者临床病理特征之间的关系,并探讨两者在支气管肺癌组织中的表达相关性。结果WWOX与PTEN蛋白在支气管肺癌组织中的的阳性表达均显著低于正常组织中的表达(χ2=14.810,P<0.001;χ2=17.363,P<0.001)。WWOX蛋白表达与患者的性别、癌组织分化程度、临床分期、是否发生淋巴结转移均有关(P<0.05),但与年龄、肿瘤大小无关(P>0.05);而PTEN蛋白则只与是否发生淋巴结转移有关(P<0.05),与其他临床病理参数均无关(P>0.05)。WWOX与PTEN蛋白的表达之间不存在关联性(χ2=2.098,P=0.147)。结论WWOX与PTEN蛋白可能都参与了支气管肺癌的发生与恶性发展,但两者是通过不同的途径发生作用。
氧化还原酶的WW域抗原; 同源性磷酸酶-张力蛋白; 支气管肺癌; 相关性分析
支气管肺癌是一种常见的恶性肿瘤,起源于支气管黏膜或者腺体。支气管肺癌的致死率目前居于所有肿瘤之首,其发病率仍在逐年上升[1-2]。部分基因表达的改变,包括上调与下调,被目前科学界认为能够影响肿瘤的发生、发展。因此对抑癌与促癌基因的研究是近期的一个热点。
包含氧化还原酶的WW域抗原(WW domain containing oxidoreductase, WWOX)是2000年鉴定出的一个候选抑癌基因,也被称为WOX1[3]。WWOX基因横跨常染色体上的脆弱基因位点FRA16D,目前已被证明与抑癌基因P53和促癌基因Ack1在体内存在相互作用,但目前尚无其与抑癌基因同源性磷酸酶-张力蛋白(phosphatase and tension homology deleted on chromosome ten, PTEN)是否存在关联性的研究[4-5]。PTEN是1997年被鉴定出的一个抑癌基因,位于10号常染色体上,因已被证实在许多肿瘤中发生表达改变,是目前最具有诊断意义的抑癌基因之一[6]。PTEN基因在细胞的生长、发育、迁移、凋亡等方面具有重要作用。目前,PTEN基因已经被证实与P53和PI3K/Akt信号通路存在关联性[7-8]。本实验利用免疫组化法检测WWOX与PTEN蛋白在87例支气管肺癌组织中的表达情况,旨在探究它们在支气管肺癌的发生、发展过程中是否起到较为重大的作用,并且利用统计分析法比较两者间的关系。
材料与方法
一、研究对象
收集解放军总医院2015年8月至2017年6月肿瘤科手术切除的支气管肺癌患者的肺癌组织标本87例,其中男65例,女22例,年龄为33~71岁,平均(58.75±11.56)岁。另取因其他疾病而切除的正常肺组织标本23例,其中男性15例,女性6例,年龄41~69岁,平均(59.63±5.75)岁。所有病例术前均未接受放疗、化疗等其他抗肿瘤手段治疗。
二、研究方法
1. 试剂仪器: 兔抗人WWOX多克隆抗体(genetex@)、兔抗人PTEN多克隆抗体(epitomics@)购于北京泰泽瑞达科技有限公司,即用型SP免疫组化试剂盒购自上海研卉生物科技有限公司。其他试剂均为分析纯。
2. 免疫组化法: 将所有标本用常规石蜡包埋,5μm连续切片,脱蜡,高压热抗原修复,严格按照SP免疫组化试剂盒说明书操作。阴性对照组的一抗使用PBS代替。镜下取4个不同视野,每个视野200个细胞观察,取平均值。细胞染色强度的判断标准为:WWOX染色以细胞质内出现黄棕色颗粒为阳性,PTEN染色以细胞核中出现棕黄色颗粒为阳性;大多数细胞无染色计0分,浅黄色颗粒计1分,黄色颗粒计2分,深黄色至褐色计3分。阳性细胞所占百分比计分规则为:阳性细胞数小于5%计0分,5%~30%计1分,30%~55%计2分,55%~80%计3分,≥80%计4分。两项积分相加之和,0分为阴性(-),1~3分为弱阳性(+),4~5分为阳性(++),≥6分为强阳性(+++)。
三、统计学方法
利用SPSS22.0软件进行统计学处理。组间比较采用χ2检验、Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
一、WWOX、PTEN蛋白在不同肺组织中的表达
肺癌组中WWOX、PTEN蛋白表达阳性率为29.9%与42.5%,均显著低于正常肺组织中的73.9%与93.3%(χ2=14.810,P<0.001;χ2=17.363,P<0.001),见表1。
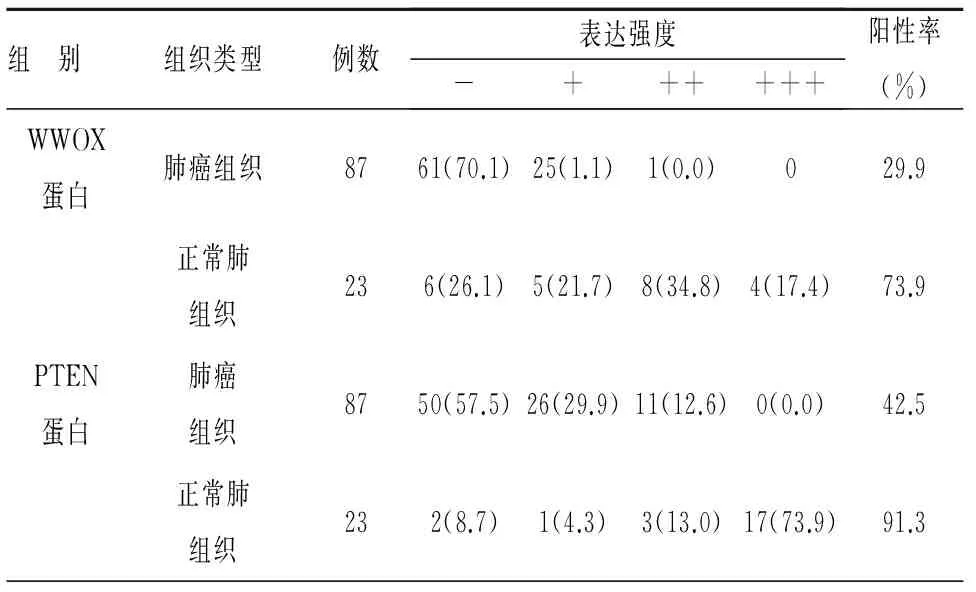
表1 WWOX、PTEN蛋白在肺癌与正常肺组织中的表达
二、WWOX、PTEN蛋白阳性表达与支气管肺癌临床病理特征的关系
在支气管肺癌组织中, WWOX蛋白是否发生阳性表达与性别、癌组织分化程度、临床分期、是否发生淋巴结转移均有关(P<0.05),但与年龄、肿瘤大小无关(P>0.05)。而PTEN蛋白则只与是否发生淋巴结转移有关(P<0.05),与其他临床病理特征均无统计学上的关系(P>0.05),见表2。
三、WWOX与PTEN蛋白表达之间的关系
WWOX与PTEN蛋白表达情况,见表3,由表3可知,WWOX与PTEN蛋白的表达无关,即两者并无统计学上的关联性(P>0.05)。
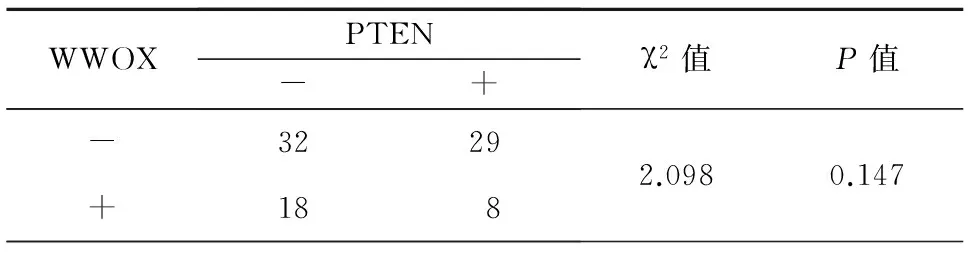
表3 WWOX与PTEN蛋白表达之间的关系

表2 WWOX、PTEN蛋白表达与支气管肺癌临床病理特征的关系(n=87)
讨 论
支气管肺癌的发病率和病死率目前均居于所有恶性肿瘤之首,常常表现为咳嗽、咳痰、咯血、胸闷、胸痛等,给患者带来极大痛苦,是严重威胁人类健康与生活质量的恶性肿瘤[9]。支气管肺癌的异型性、扩散和转移性等生物学行为性相差很大,因而难以快速制定合适的临床诊疗方案,从而造成临床诊疗方案的疗效较差。因此早期诊断、明确诊断对于提高支气管肺癌的临床诊疗效果有极其重要的意义。随着人们在肿瘤学的研究深入,目前普遍认为肿瘤的发生、发展与一些特定基因的表达异常紧密相关。
WWOX基因是由Bednarek等[3]于2000年克隆出的候选抑癌基因,是一条长链基因,具有长达1.2MB的开放阅读框,和相对短小的、仅仅2.2 kb的剪切体,编码414个氨基酸组成的蛋白。WWOX定位于染色体16q 23.3~24.1,横跨常染色体的脆弱基因位点FRA16D,因FRA16D研究日益增多,WWOX/FRA16D成为肿瘤基因通路研究的热点之一[10]。WWOX蛋白参与生物体内多种信号通路,易受许多因素的影响。当生物体暴露于亚砷酸盐、紫外线、二羟环氧苯并芘(PBDE)等致癌物中时,WWOX的表达将被下调,甚至缺失,从而诱发肿瘤。而在与体内其他肿瘤相关基因作用方面,WWOX能够与P53形成免疫复合物,从而共同参与细胞凋亡的过程[11-13]。此外,Nowakowska等[14]发现,WWOX与BCL2、HER4 JM-a呈正相关,与细胞周期蛋白D1、E1的表达呈负相关。在肿瘤诊疗方面,WWOX蛋白的表达降低见于结肠癌、乳腺癌、前列腺癌、膀胱癌等肿瘤细胞、肿瘤组织中[15-18]。
本实验结果显示,WWOX在支气管肺癌中的表达(28.7%)较正常肺组织中的表达显著降低(χ2=14.810,P<0.001),这与其在其他肿瘤组织中的表达异常方向相一致。因其表达下调的程度非常显著,进一步提示其可能在支气管肺癌的发生、发展中起到重要的作用。同时,WWOX蛋白的表达与患者的年龄、临床分期无关,但与性别、肿瘤组织分化程度、是否发生淋巴结转移等临床病理因素相关。研究显示WWOX蛋白的表达与机体内雌激素受体有关,并且一般而言女性接触烟草等环境致癌物质的概率较男性低,这可能是WWOX蛋白在女性患者体内表达降低程度较少的原因[19]。肿瘤组织分化程度、是否发生淋巴结转移的差异,则提示WWOX蛋白的表达很可能影响支气管肺癌患者体内肿瘤细胞的发生、发展过程。
PTEN基因,即TEP1或MMAC1,定位于常染色体10q23,是一种重要的抑癌基因[20]。PTEN基因编码是一条由403个氨基酸组成的多肽链,即蛋白酪氨酸磷酸酶,其能够使一部分磷酸化的基因去磷酸化,从而抑制许多抑癌基因的磷酸化刺激细胞生长路径,是肿瘤细胞生长、发育的重要参与物。同时PTEN基因在生物体内,能够负向调节PI3K/AKT信号通路,从而参与肿瘤细胞周期的调控,抑制肿瘤细胞的生长、发育。目前已经发现PTEN蛋白的表达在口腔癌、脑胶质瘤、胃癌等肿瘤细胞、组织中发生下调[21-24]。
本实验结果表明,PTEN蛋白的表达下调同样发生在支气管肺癌组织中(χ2=17.363,P<0.001)。这与它在其他肿瘤细胞、组织中的调控方向相符。而PTEN蛋白的表达仅仅与是否发生淋巴结转移相关,与其他临床病理特征均不具有统计学相关性。这一现象可能因为PTEN主要参与调节肿瘤细胞的侵袭性,而与其他的肿瘤生物学行为性相关度较低所致。进一步分析WWOX与PTEN蛋白表达的关系之后,我们发现两者仍无统计学上的相关性。
综上所述,WWOX、PTEN蛋白在支气管肺癌组织中表达明显降低,而两者之间并无明显联系。提示WWOX、PTEN基因可能是支气管肺癌发生的分子基础,但两者的影响途径并不相同或相关。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 Strassen U, Hofauer B, Matsuba Y, et al. Bronchogenic cancer: It still exists[J]. Laryngoscope, 2016, 126(3): 638-642.
3 Bednarek AK, Keck-Waggoner CL, Daniel RL, et al. WWOX, the FRA16D gene, behaves as a suppressor of tumor growth[J]. Cancer Res, 2001, 61(22): 8068-8073.
4 Mahajan NP, Whang YE, Mohler JL, et al. Activated tyrosine kinase Ack1 promotes prostate tumorigenesis: role of Ack1 in polyubiquitination of tumor suppressor Wwox[J]. Cancer Res, 2005, 65(22): 10514-10523.
5 Chang NS, Pratt N, Heath J, et al. Hyaluronidase induction of a WW domain-containing oxidoreductase that enhances tumor necrosis factor cytotoxicity[J]. J Biol Chem, 2001, 276(5): 3361-3370.
6 Kremer EJ, Pritchard M, Lynch M, et al. Mapping of DNA instability at the fragile X to a trinucleotide repeat sequence p(CCG)n[J]. Science, 1991, 252(5013): 1711-1714.
7 Chen Z, Trotman LC, Shaffer D, et al. Crucial role of p53-dependent cellular senescence in suppression of Pten-deficient tumorigenesis[J]. Nature, 2005, 436(7051): 725-730.
8 Heavey S, O′Byrne KJ, Gately K. Strategies for co-targeting the PI3K/AKT/mTOR pathway in NSCLC[J]. Cancer Treat Rev, 2014, 40(3): 445-456.
9 Printz C. Lung cancer new leading cause of death for women in developed countries: Data reflects increased rates of smoking[J]. Cancer, 2015, 121(12): 1911-1912.
10 Schrock MS, Huebner K. WWOX: a fragile tumor suppressor[J]. Exp Biol Med (Maywood), 2015, 240(3): 296-304.
12 Huang YC, Hung WC, Chen WT, et al. Expression of WWOX and FHIT is downregulated by exposure to arsenite in human uroepithelial cells[J]. Toxicol Lett, 2013, 220(2): 118-125.
13 Del MS, Husanie H, Iancu O, et al. WWOX and p53 dysregulation synergize to drive the development of osteosarcoma[J]. Cancer Res, 2016, 76(20): 6107-6117.
14 Nowakowska M, Puciennik E, Wujcicka WI, et al. The correlation analysis of WWOX expression and cancer related genes in neuroblastoma-a real time RT-PCR study[J]. Acta Biochim Pol, 2014, 61(1): 91-97.
15 Nowakowska M, Pospiech K, Lewandowska U, et al. Diverse effect of WWOX overexpression in HT29 and SW480 colon cancer cell lines[J]. Tumour Biol, 2014, 35(9): 9291-9301.
16 Guler G, Uner A, Guler N, et al. The fragile genes FHIT and WWOX are inactivated coordinately in invasive breast carcinoma[J]. Cancer, 2004, 100(8): 1605-1614.
17 Lin JT, Li HY, Chang NS, et al. WWOX suppresses prostate cancer cell progression through cyclin D1-mediated cell cycle arrest in the G1 phase[J]. Cell Cycle, 2015, 14(3): 408-416.
18 Li G, Sun L, Mu Z, et al. Ectopic WWOX expression inhibits growth of 5 637 bladder cancer cell in vitro and in vivo[J]. Cell Biochem Biophys, 2015, 73(2): 417-425.
19 Ekizoglu S, Bulut P, Karaman E, et al. Epigenetic and genetic alterations affect the WWOX gene in head and neck squamous cell carcinoma[J]. PLoS One, 2015, 10(1): e0115353.
20 Dahia PL. PTEN, a unique tumor suppressor gene[J]. Endocr Relat Cancer, 2000, 7(2): 115-129.
21 Carnero A, Blanco-Aparicio C, Renner O, et al. The PTEN/PI3K/AKT signalling pathway in cancer, therapeutic implications[J]. Curr Cancer Drug Targets, 2008, 8(3): 187-198.
22 Sushma PS, Jamil K, Kumar PU, et al. PTEN and p16 genes as epigenetic biomarkers in oral squamous cell carcinoma (OSCC): a study on south Indian population[J]. Tumour Biol, 2016, 37(6): 7625-7632.
23 Xiao WZ, Han DH, Wang F, et al. Relationships between PTEN gene mutations and prognosis in glioma: a meta-analysis[J]. Tumour Biol, 2014, 35(7): 6687-6693.
24 Zhang X, Park JS, Park KH, et al. PTEN deficiency as a predictive biomarker of resistance to HER2-targeted therapy in advanced gastric cancer[J]. Oncology, 2015, 88(2): 76-85.
ExpressionandclinicalsignificanceofWWOXandPTENproteininbronchogeniccarcinoma
ZhangJin1,DongZhouhuan2,ZhaoMing1,XueZhiqiang1,WangYuqi1,TianXiaodong1,WangYunxi1.
1DepartmentofThoracicSurgery,2Departmentofpathology,GeneralHospitalofthePLA,Beijing100853China
WangYunxi,Email:wydc1991@yeah.net
ObjectiveTo investigate the expression of WW domain containing oxidoreductase (WWOX) and phosphatase and tension homology deleted on chromosome ten(PTEN) in bronchogenic carcinoma and their clinical significance, as well as their relationship.MethodsIt was detected that the expression of WWOX and PTEN in lung tissues from 87 patients with bronchogenic carcinoma and 23 healthy lung tissues by immunohistochemical analysis.ResultsThe positive expression rates of both WWOX and PTEN were lower in cancer tissues than in normal lung tissues (χ2=14.810,P=0.000; χ2=17.363,P<0.001). Also, the expression of WWOX was related with gender, differentiation, clinical stages, lymph node metastasis (P<0.05), not related with age and the tumor size (P>0.05); the expression of PTEN was only related with lymph node metastasis (P<0.05), but not related with other clinical significance (χ2=2.098,P<0.001). There was no significant relationship between the expression of WWOX and PTEN.ConclusionsBoth WWOX and PTEN proteins may be able to influence the occurrence and development of bronchogenic carcinoma, but it is more likely that they function through different pathways.
WW domain containing oxidoreductase; Phosphatase and tension homology deleted on chromosome ten; Bronchogenic carcinoma; Correlativity analysis
10.3877/cma.j.issn.1674-6902.2017.06.016
100853 北京,解放军总医院胸外科1、病理科2
王云喜,Email: wydc1991@yeah.net
R563
A
2017-10-29)
黄红稷)
张竞,董周寰,赵明,等. 支气管肺癌组织中包含氧化还原酶的WW域还原蛋白、同源性磷酸酶-张力蛋白的表达及临床意义[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 709-712.

