BIM基因多态性与铂类药物治疗晚期非小细胞肺癌疗效的相关性分析
朱江红 刘勇 程俊 孟令占 艾亮 刘娜 邹文娟
·论著·
BIM基因多态性与铂类药物治疗晚期非小细胞肺癌疗效的相关性分析
朱江红 刘勇 程俊 孟令占 艾亮 刘娜 邹文娟
目的通过检测BIM基因多态性,探讨其与晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)铂类药物治疗疗效的关系。方法根据纳入及排除标准,选择2013年7月至2016年7月就诊于重庆市中医院肿瘤科的100例晚期NSCLC患者,所有患者均接受铂类药物治疗,采用多聚酶链反应方法检测患者外周血中BIM基因多态性,并定期随访获得临床资料,采用SPSS 13.0统计软件分析统计结果。结果在客观缓解率上,BIM基因无缺失多态性患者优于BIM基因缺失多态性的患者(ORR:48.8%vs. 11.1%,χ2=8.598,P=0.003),差异有统计学意义;而疾病控制率 (78.0%vs. 61.1%,χ2=2.258,P=0.133)差异无统计学意义。Cox比例风险回归模型分析发现仅BIM基因多态性对无进展生存期(progressing-free survival, PFS)的影响有统计学意义(P=0.003),BIM基因无多态性的患者中位PFS长于BIM基因缺失多态性的患者(14.0个月vs. 10.0个月,P=0.001),差异有统计学意义;BIM基因型多态性与不良反应的关系差异无统计学意义(χ2=1.62,P>0.1)。结论BIM基因缺失多态性为影响晚期NSCLC铂类药物治疗PFS的独立预后因素,检测患者BIM基因多态性对晚期NSCLC铂类药物治疗疗效的预后评估有重要意义。
非小细胞肺癌; BIM基因多态性; 铂类药物
非小细胞肺癌(non-small cell lung cancer, NSCLC)是世界范围内主要的癌症死亡原因之一,大约80%的肺癌是NSCLC[1]。NSCLC在最初诊断时多属于中晚期,且有60%的患者出现远处转移,此时首选的治疗为全身化疗[2]。自20世纪70年代以来,铂类在治疗晚期NSCLC中占有非常重要的地位,以铂类为基础的化疗已成为晚期NSCLC一线和二线治疗的标准方案。但其治疗有效率仅为25%~30%,且随着化疗次数的增加,耐药性亦逐渐显现。最近有研究发现细胞凋亡相关基因多态性与NSCLC及其他恶性肿瘤治疗的疗效及预后密切相关。BCL-2基因家族是细胞凋亡的进程中重要的死亡决策者。目前已发现的BCL-2基因家族成员超过20余种,根据其结构和功能分为3类:第1类具有抗凋亡作用,包括BCL-2等;第2类具有促凋亡作用,包含3个同源结构域,包括BAX、BAK等;第3类具有促凋亡作用且只含有BH3结构域,以BIM为代表[3]。本文对BIM基因多态性与晚期NSCLC铂类药物治疗疗效的相关性进行研究。
资料与方法
一、研究对象
选择重庆市中医院肿瘤科2013年7月至2016年7月收治的接受铂类药物化疗的100例晚期NSCLC患者,均经细胞病理学或组织病理学确诊为ⅢB期或Ⅳ期NSCLC,有完整的临床资料以及随访资料。其中男性65例,女性35例,平均年龄59岁,TNMⅢb期32例,TNMⅣ期68例;病理类型为腺癌46例,其他54例。
纳入标准:①年龄:18~70岁;②经组织学和/或细胞学证实的NSCLC;③预计生存期大于3个月;④患者必须具备理解并自愿签署知情同意书的能力;⑤ECOG体力状态评分为0~2;⑥受试者无主要器官功能受损,实验室化验指标必须符合下列要求,血液学:白细胞≥3.5×109/L、中性粒细胞≥2.0×109/L、血小板计数≥100×109/L、血红蛋白≥95 g/L。肝功能:血清胆红素低于最大正常值的1.5倍;ALT和AST低于最大正常值的1.5倍。肾功能:肌酐清除率≥45 ml/min;心功能:基本正常。
排除标准:①有症状的或不能控制的脑转移患者;②患者合并任何急性或慢性疾病或精神障碍或实验室检查异常,例如:不能控制的高血压、不稳定心绞痛、心肌梗塞史或在过去12个月内出现过有症状的充血性心力衰竭或不能控制的心律失常,活动性缺血性黏膜疾病等;③细菌,真菌或病毒感染的疾病活动期;④妊娠或哺乳期妇女;⑤有不易控制的精神病史者;⑥过去的6周内体质量下降≥10%;⑦入组前除NSCLC外有其他活动性恶性肿瘤病史的患者,非黑色素瘤的皮肤癌、原位宫颈癌、治愈的早期前列腺癌除外;⑧有过敏体质和已知或怀疑对任何研究药物过敏的患者;⑨依从性差及研究者认为不宜参加本试验者。
二、研究方法
1. 试剂与仪器: Maxwell全血DNA提取试剂盒(promega公司)、多重PCR引物、BIM扩增混合液、扩增酶、BIM磁珠混合液(后四种均为益善生物自配研发试剂)。Maxwell核酸提取仪(promega公司)、PCR仪(珠海黑马医学仪器有限公司)、Lunminex 200(路明克斯公司)。
2. BIM基因多态性检测: BIM基因多态性的分析委托广州益善医学检验所有限公司完成。采用Maxwell全血DNA提取试剂盒提取样本DNA,进行多重PCR获得含有突变位点的BIM基因片段(野生型或突变型片段),向多重PCR产物中加入BIM磁珠混合液,52 ℃条件下进行杂交,加入SAPE反应5 min,形成了“磁珠-Anti-Tag+Product-Biotin+SAPE”复合物,复合物采用Lunminex 200进行磁珠的编号及SAPE的荧光值判读。
3. 化疗方案: 采用顺铂或奈达铂联合紫杉醇 (TP)、顺铂或奈达铂联合吉西他滨 (GP)或顺铂或奈达铂联合长春瑞滨(NP)方案为主,其中顺铂或奈达铂按照60 mg/m2计算剂量,分2 d给药,紫杉醇注射液150 mg/m2于第1天给药,吉西他滨注射液1 000 mg/m2于化疗第1天及第8天给药,长春瑞滨注射液25 mg/m2于化疗第1天及第8天给药。化疗的同时给予托烷司琼注射液预防止吐,泮托拉唑注射液护胃等对症处理。
4. 评价标准: 根据野生型、突变型荧光信号强度比例进行判断,突变型/野生型比例为0~24%判断为野生型纯合子;比例为42%~83%判断为突变型杂合子;比例为84%~100%判断为突变型纯合子。对比值在24%~42%的样本采用突变位点引物扩增后测序以验证。
化疗疗效评定采用2009版实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST),分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)和进展(progressive disease, PD)。客观缓解率(objective response rate, ORR)=(CR+PR)/(CR+PR+SD+PD)×100%。疾病控制率(disease control rate, DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。不良反应按照NCI-CTC3.0,抗癌药物常见不良反应分级标准评定,分为0~4度。
5. 随访: 以患者接受铂类药物治疗的时间为观察起点,以患者死亡、疾病进展或不良反应不可耐受做为观察终点,将其定义为无进展生存期(progressing-free survival, PFS)。对于在随访截止日期无进展的病例,在统计时作截尾数据处理。随访截止时间为2016年12月31日。采用定期门诊复查及电话随访等方式进行随访,建立数据资料库。
三、统计学方法
不同基因型间的化疗疗效差异显著性采用χ2检验;用Cox比例风险回归模型检验BIM基因多态性对预后的影响,用Kaplan-Meier法绘制生存曲线,并用Log-rank检验比较差异。采用SPSS13.0统计软件包进行统计处理,P<0.05为差异有统计学意义。
结 果
一、BIM基因多态性与铂类药物治疗疗效的关系
100例患者,其中BIM基因无多态性(即野生型)82例,疗效评价CR 3例,PR 37例,SD 24例,PD 18例,ORR为48.8%,DCR为78.0%;BIM有多态性(缺失型及混合型)的患者18例,其中缺失型3例,混合型15例,疗效评价无CR患者,PR 2例,SD 9例,PD 7例,ORR为11.1%,DCR为61.1%。在客观缓解率上,BIM基因野生型对比BIM基因缺失型及混合型的患者(ORR:48.8%vs. 11.1%,χ2=8.598,P=0.003),差异有统计学意义;在疾病控制率上,BIM基因野生型对比BIM基因缺失型及混合型的患者(DCR:78.0%vs. 61.1%,χ2=2.258,P=0.133),差异无统计学意义。
二、BIM基因多态性与中位PFS的关系
对年龄、性别、TNM分期、病理类型及BIM基因多态性逐一进行Cox比例风险回归模型检验,发现仅BIM基因多态性对PFS的影响有统计学意义(P=0.003),见表1,其总体无进展生存曲线,见图1;BIM基因野生型的患者中位PFS长于BIM基因缺失型及混合型的患者(14.0个月vs. 10.0个月,P=0.001),差异有统计学意义,见图2。
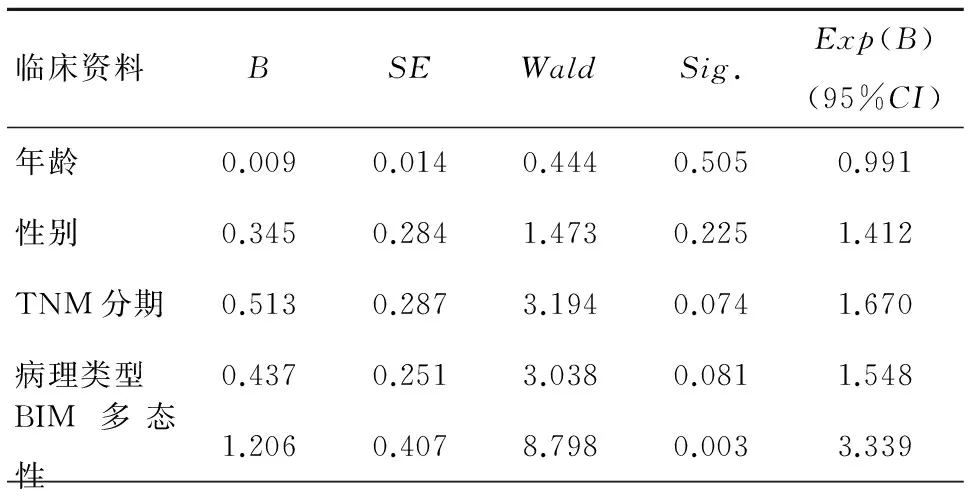
表1 单因素Cox比例风险回归模型检验结果
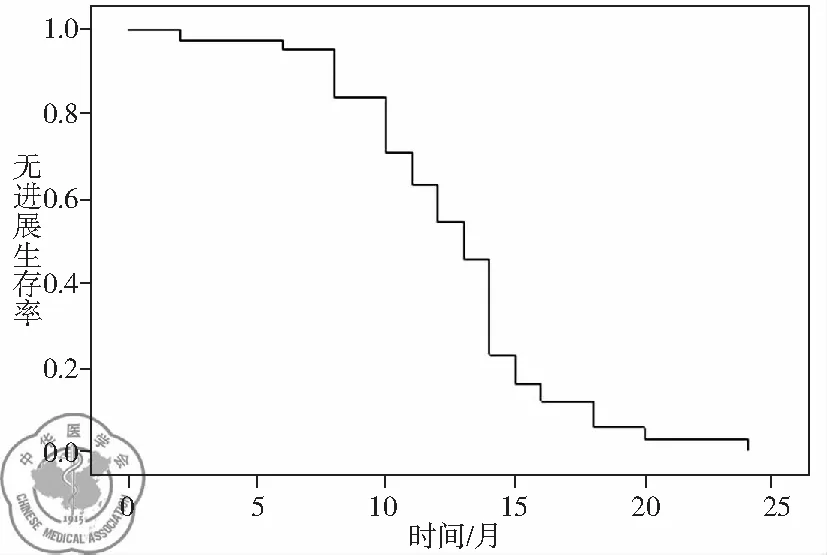
图1 总体无进展生存曲线
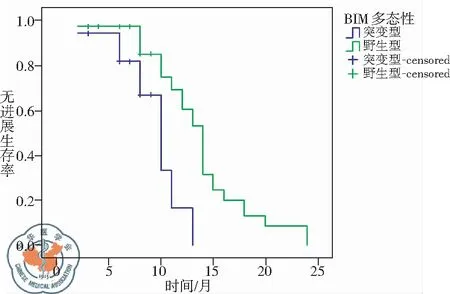
图2 BIM基因多态性与PFS的关系
三、BIM基因多态性与铂类药物不良反应的关系
服用铂类药物后产生不良反应的临床表现及实验室检查结果包括血液毒性、胃肠道毒性、肾功能损伤、心肺功能损伤及肝功能损伤。根据患者的基因型及是否出现药物不良反应进行独立样本四格表卡方检验,发现BIM基因型与药物不良反应发生的差异无统计学意义(χ2=1.62,P>0.1),见表2。
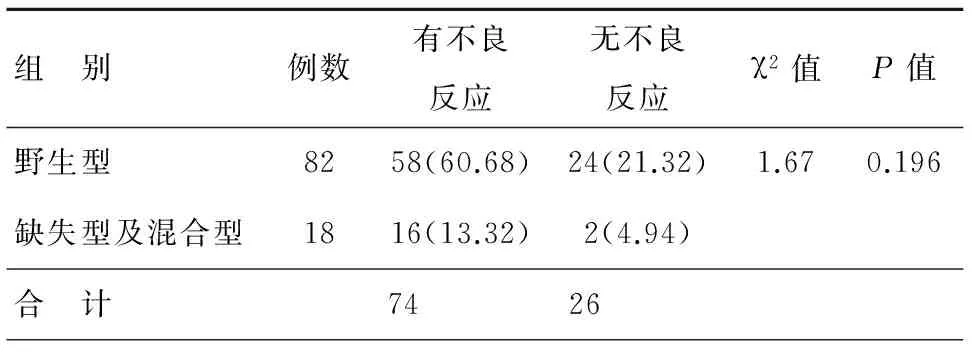
表2 BIM基因多态性与铂类药物不良反应的关系 [n(%)]
讨 论
铂类药物在治疗晚期NSCLC中占有非常重要的地位,但其治疗随着化疗次数的增加,耐药性亦逐渐显现。铂类药物的主要作用机制是与DNA形成铂类-DNA复合物,导致DNA交联并引起DNA损伤,从而导致肿瘤细胞死亡。因此,DNA修复能力的不同将直接导致肿瘤细胞对铂类药物敏感性的差异,影响铂类药物疗效。建立基于DNA修复基因多态性(single nucleotide polymorphism, SNP)的疗效预测系统不仅可以提高铂类疗效、预测耐药发生,还可以最大程度地降低药物的不良反应和机体毒性,具有重要的临床意义。
BIM基因作为BCL-2家族的重要成员之一,能够拮抗BCL-2等抗凋亡因子的作用或直接与BAX等促凋亡因子的相互作用来实现凋亡过程。研究显示BIM基因参与了肿瘤药物EGFR TKI 和伊马替尼诱导细胞凋亡过程[4],EGFR TKI与伊马替尼的疗效与BIM基因的的表达水平呈正相关[5-6]。BIM基因的缺失多态性会导致编码的BIM异构体蛋白缺少介导细胞凋亡的BH3区域,从而失去促进细胞凋亡的能力,导致NSCLC患者对TKI耐药,以及慢性骨髓白血病患者对伊马替尼耐药。
BIM基因除了与EGFR TKI和伊马替尼疗效相关外,还与化疗药物的敏感性相关。Richter-Larrea等[7]研究发现BIM基因甲基化导致BIM表达缺失,从而影响淋巴瘤患者的化疗效果。Wang等[8]研究则显示与BIM正常表达相比,BIM低表达会导致卵巢癌细胞对顺铂不敏感,表明BIM低表达是顺铂耐药的机制之一。
研究显示东亚人群中BIM基因缺失突变的概率为12.9%,中国人群为15.5%[6,9]。NSCLC是最常见的恶性肿瘤,每年的发病率和病死率高居首位,携带BIM基因缺失的肺癌患者数量巨大。研究NSCLC BIM基因缺失多态性与铂类药物疗效的关系,对于临床筛选出适合使用铂类化疗的患者、实现个体化治疗具有重要的意义[10-12]。
在人类基因组中位于2q12-q13,其编码的蛋白BIM属于促凋亡蛋白质,是参与细胞死亡的重要介质[13]。其最初是由Hsu等[14]在用酵母二元杂交的方法筛选与MCL-l相互作用的蛋白质时,从卵巢cDNA文库中发现的一种蛋白,只含有BH3结构域,并且和MCL-l、BCL-2及BCL-XL等抗凋亡因子相互作用而诱导细胞凋亡。BIM可促进许多肿瘤细胞的死亡,如肺癌、乳腺癌、骨肉瘤和黑素瘤等,而BIM基因的BH3域缺失,则容易引起凋亡受阻[15-19]。BIM基因的低表达或功能缺陷可以抑制肿瘤细胞凋亡,为肿瘤细胞生长提供便利条件。在晚期NSCLC及其它恶性肿瘤的靶向治疗中,研究表明BIM基因与靶向治疗的疗效密切相关[20-22]。
BIM含有BH3结构域,该结构域是它的核心功能区,主要通过线粒体途径激活Bax/Bak,诱导细胞凋亡,从而调节肿瘤细胞对药物的敏感性[23]。很多化疗药物通过调节BIM表达来发挥杀灭肿瘤细胞的功能。如Ng等[6]针对BIM基因多态性缺失和TKIs疗效反应的相关性进行了研究,指出BIM多态性是NSCLC EGFR-TKIs疗效的潜在预测因子,BIM缺失多态性是TKIs原发性耐药的分子机制之一。BIM缺失多态性指其基因外显子2和外显子3之间的内含子DNA序列有一段2 903 bp的缺失,导致外显子3和外显子4拼接错误,使促凋亡BH3结构域的表达缺失,从而使BIM不能行使其促凋亡功能[24]。有研究表明BIM编码的唯BH3域蛋白在由表皮生长因子酪氨酸激酶抑制剂激发的细胞凋亡中起关键调节因子的作用[25-26]。在NSCLC中BIM基因表达水平的降低或BIM缺失多态性的存在会降低化疗和TKIs治疗的疗效并影响术后患者的预后,可成为治疗失败的重要原因[27]。铂类药物的主要作用机制是与DNA形成铂类-DNA复合物,导致DNA交联并引起DNA损伤,从而导致肿瘤细胞死亡。有研究报道,BIM的表达和顺铂的耐药相关。在卵巢癌顺铂敏感细胞株中BIM蛋白的降解可诱导细胞对顺铂产生耐药[28]。Wang等[8]研究也显示与BIM正常表达相比,BIM低表达会导致卵巢癌细胞对顺铂不敏感,表明BIM低表达是顺铂耐药的机制之一。
因此,本研究从BIM基因多态性的角度,探讨其与铂类药物治疗的晚期NSCLC患者的耐药、预后及不良反应发生之间的相互关系。本研究入组样本共100例,均为给予铂类药物治疗的晚期NSCLC患者,其中BIM基因无多态性(即野生型)的患者共82例,ORR为48.8%,DCR为78.0%;BIM有多态性(缺失型及混合型)的患者共18例,其中缺失型3例,混合型15例,ORR为11.1%,DCR为61.1%。在客观缓解率的比较上,差异有统计学意义,即BIM基因无多态性的患者ORR优于BIM基因缺失多态性的患者,而两组DCR的差异无统计学意义。在对年龄、性别、TNM分期、病理类型及BIM基因多态性逐一进行Cox比例风险回归模型检验后,发现仅BIM基因多态性对PFS的影响有统计学意义,BIM基因多态性为PFS的独立预后因素。而如国外IPASS及OPITIMAL等大型临床研究结果显示TNM分期及病理类型(腺癌及非腺癌)等与预后密切相关[29-30]。本研究中上述两项指标虽然差异无统计学意义,但其P值都接近0.05(0.074、0.081),考虑与入组样本量有限相关,还有待后续大样本研究更进一步提供证据支持。本研究也表明BIM基因无多态性的患者中位PFS长于BIM基因缺失多态性的患者(14.0个月vs. 10.0个月,P=0.001),差异有统计学意义,进一步在临床上证实BIM基因多态性能够作为预测晚期NSCLC铂类药物治疗疗效的指标之一。BIM基因有多态性的患者因缺失了BH3结构域,影响了细胞凋亡通路,对铂类药物疗效欠佳。虽然有研究对铂类药物所致的不良反应的回顾性分析结果表明BIM缺失多态性与化疗所致血小板减少症明显相关,但是本研究发现BIM基因型与不良反应的发生率无明显的影响(χ2=1.62,P>0.1)[31-34]。
本研究为单中心研究,样本量有限,相关结果仍有待多中心大样本的大型临床前瞻性研究为NSCLC的治疗提供更高级别的循证医学证据。本研究组前期实验表明DNA修复能力的不同将直接导致肿瘤细胞对铂类药物敏感性的差异,影响铂类药物疗效,也正在进行基于DNA修复基因多态性的相关研究,以期对NSCLC患者的基因表达谱进行全面高通量分析,联合相关基因准确预测患者抗肿瘤药物的疗效,更好地指导个体化治疗。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 Santarpia M, Liguori A, Karachaliou N, et al. Osimertinib in the treatment of non-small-cell lung cancer: design, development and place in therapy[J]. Lung Cancer (Auckl), 2017, 8: 109-125.
3 Wu H, Medeiros LJ, Young KH. Apoptosis signaling and BCL-2 pathways provide opportunities for novel targeted therapeutic strategies in hematologic malignances[J]. Blood Rev, 2017, doi: 10.1016/j.blre.2017.08.004.
4 Karachaliou N, Rosell R, Molina MA, et al. Predicting resistance by selection of signaling pathways[J]. Transl Lung Cancer Res, 2014, 3(2): 107-115.
5 Katagiri S, Umezu T, Ohyashiki JH, et al. The BCL2L11 (BIM) deletion polymorphism is a possible criterion for discontinuation of imatinib in chronic myeloid leukaemia patients[J]. Br J Haematol, 2013, 160(2): 269-271.
6 Ng KP, Hillmer AM, Chuah CT, et al. A common BIM deletion polymorphism mediates intrinsic resistance and inferior responses to tyrosine kinase inhibitors in cancer[J]. Nat Med, 2012, 18(4): 521-528.
7 Richter-Larrea JA, Robles EF, Fresquet V, et al. Reversion of epigenetically mediated BIM silencing overcomes chemoresistance in Burkitt lymphoma[J]. Blood, 2010,116(14): 2531-2542.
8 Wang J, Zhou JY, Wu GS. Bim protein degradation contributes to cisplatin resistance[J]. J Biol Chem, 2011, 286(25): 22384-22392.
9 Zhong J, Li ZX, Zhao J, et al. Analysis of BIM (BCL-2 like 11 gene) deletion polymorphism in Chinese Non-small cell lung cancer patients[J]. Thoracic Cancer, 2014, 5(6): 509-516.
10 Eisenhauer EA, Thersasse P, Bogaerts J, et al. New respongse evaluation criteria in solid tumors: revised RECIST guideline [J]. Eur J Cancer, 2009, 45(2): 228-247.
11 Trotti A, Bentzen SM. The need for adverse effects reporting standards in oncology clinical trials[J]. J Clin Oncol, 2004, 22(1): 19-22.
12 吕洋, 苗立云. 非小细胞肺癌分子靶向药物耐药机制的研究进展[J/CD]. 中华肺部疾病杂志(电子版), 2015, 8(1): 82-84.
13 Bouillet P, Zhang LC, Huang DC, et al. Gene structure alternative splicing, and chromosomal localization of pro-apoptotic Bcl-2 relative Bim[J]. Mamm Genome, 2001, 12(2): 163-168.
14 Hsu SY, Lin P, Hsueh AJ. BOD(Bcl-2-related ovarian death gene) is an ovarian BH3 domain-containing proapoptotic Bcl-2 protein capable of dimerization with diverse antiapoptotic Bcl-2 members[J]. Mol Endocrinol, 1998, 12(9): 1432-1440.
15 Qian K, Zhang Y, Zhi X. Retrospective Study of Efficacy in BIM Gene Polymorphism on First-line EGFR-TKIs Treatment for Advanced Lung Adenocarcinoma[J]. Zhongguo Fei Ai Za Zhi, 2017, 20(8): 543-548.
16 Cheng F, Pan Y, Lu YM, et al. RNA-Binding Protein Dnd1 Promotes Breast Cancer Apoptosis by Stabilizing the Bim mRNA in a miR-221 Binding Site[J]. Biomed Res Int, 2017, 2017: e9596152.
17 Kim KO, Hsu AC, Lee HG, et al. Proteomic identification of 14-3-3∈ as a linker protein between pERK1/2 inhibition and BIM upregulation in human osteosarcoma cells[J]. J Orthop Res, 2014, 32(6): 848-854.
18 Gambichler T, Rooms I, Scholl L, et al. BH3-only protein Bim predicts advanced stage of cutaneous melanoma[J]. J Eur Acad Dermatol Venereol, 2016, 30(11): 1926-1929.
19 Faber AC, Ebi H, Costa C, et al. Apoptotic in targeted therapy responses: the role of BIM[J]. Adv Pharmacol, 2012, 65: 519-542.
20 Zou Q, Zhan P, Lv T, et al. The relationship between BIM deletion polymorphism and clinical significance of epidermal growth factor receptor-mutated non-small cell lung cancer patients with epidermal growth factor receptor-tyrosine kinase inhibitor therapy: a meta-analysis[J]. Transl Lung Cancer Res, 2015, 4(6): 792-796.
21 Lee HY, Kim IK, Lee HI, et al. The apoptotic effect of simvastatin via the upregulation of BIM in nonsmall cell lung cancer cells[J]. Exp Lung Res, 2016, 42(1): 14-23.
22 Ying HQ, Chen J, He BS, et al. The effect of BIM deletion polymorphism on intrinsic resistance and clinical outcome of cancer patient with kinase inhibitor therapy[J]. Sci Rep, 2015, 5: doi: 10.1038/srep11348.
23 Kaufmann T, Jost PJ, Pellegrini M, et al. Fatal hepatitis mediated by tumor necrosis factor TNFalpha requires caspase-8 and involves the BH3-only proteins Bid and Bim[J]. Immunity, 2009, 30(1): 56-66.
24 Willis SN, Adams JM. Life in the balance: how BH3-only proteins induce apoptosis[J]. Curr Opin Cell Biol, 2005, 17(6): 617-625.
25 Costa DB, Halmos B, Kumar A, et al. BIM mediates EGFR tyrosine kinase inhibitor-induced apoptosis in lung cancers with oncogenic EGFR mutations[J]. PLoS Med, 2007, 4(10): 1669-1679.
26 Gong Y, Somwar R, Politi K, et al. Induction of BIM is essential for apoptosis triggered by EGFR kinase inhibitors in mutant EGFR dependent lung adenocarcinomas[J]. PLoS Med, 2007, 4: e294.
27 Lee JH, Lin YL, Hsu WH, et al. BCL-2-like protein 11 deletion polymorphism predicts survival in advanced non-small-cell lung cance[J]J Thorac Oncol, 2014, 9(9): 1385-1392.
28 Akiyama T, Dass CR, Choong PF. Bim-targeted cancer therapy:a link between drug action and unde rlying molecular changes[J]. Mol Cancer Ther, 2009, 8(12): 3173-3180.
29 Wu YL, Saijo N, Thongprasert S, et al. Efficacy according to blind independent central review: Post-hoc analyses from the phase Ⅲ, randomized, multicenter, IPASS study of first-line gefitinib versus carboplatin/paclitaxel in Asian patients with EGFR mutation-positive advanced NSCLC[J]. Lung Cancer, 2017, 104: 119-125.
30 Wu YL, Fukuoka M, Mok TS, et al. Tumor response and health-related quality of life in clinically selected patients from Asia with advanced non-small-cell lung cancer treated with first-line gefitinib: post hoc analyses from the IPASS study[J]. Lung Cancer, 2013, 81(2): 280-287.
31 Xia JJ, Xiong LW, Chu TQ, et al. Association between BIM deletion polymorphism and the risk of non-small cell lung cancer in Chinese[J]. Int J Clin Exp Pathol, 2016, 9(5): 5647-5655.
32 Sun S, Yu H, Wang H, et al. Exploratory cohort study and meta-analysis of deletion polymorphism in patients with epidermal growth factor receptor-mutant non-small-cell lung cancer treated with epidermal growth factor receptor tyrosine kinase inhibitors[J]. Onco Targets Ther, 2017, 10: 1955-1967.
33 Ma JY, Yan HJ, Gu W. Association between BIM deletion polymorphism and clinical outcome of EGFR-mutated NSCLC patient with EGFR-TKI therapy: A meta-analysis[J]. J Cancer Res Ther, 2015, 11(2): 397-402.
34 Lee JH, Lin YL, Hsu WH, et al. Bcl-2-like protein 11 deletion polymorphism predicts survival in advanced non-small-cell lung cancer[J]. J Thorac Oncol, 2014, 9(9): 1385-1392.
RelationshipbetweenBIMgenepolymorphismandtherapeuticefficacyinplatinumdrugstreatedadvancednon-smallcelllungcancer
ZhuJianghong,LiuYong,ChengJun,MengLingzhan,AiLiang,LiuNa,ZouWenjuan.
DepartmentofOncology,TraditionalChineseMedicineHospitalofChongqing,Chongqing400021,China
LiuYong,Email:liu-yong@csco.org.cn
ObjectiveTo explore the relationship between BIM gene polymorphism and therapeutic efficacy in the advanced non-small cell lung cancer (NSCLC) with platinum drugs.MethodsIt was collected that 100 patients who were diagnosed with advanced NSCLC and
therapy with platinum drugs in oncology department of Chongqing Traditional Chinese Medicine Hospital from July 2012 to July 2015. The peripheral blood of patients was collected and genotype of BIM gene polymorphism was detected by polymerase chain reaction (PCR). Statistical analysis was performed by SPSS version 13.0.ResultsOn the objective response rate(ORR), BIM gene with no polymorphism type was significantly better trend than polymorphism types in ORR(48.8%vs. 11.1%, χ2=8.598,P=0.003). The BIM gene polymorphism was the independent prognostic factors for progressin-free survival (PFS) by univariate Cox analysis. The median PFS in BIM gene with no polymorphism type were significantly longer than with polymorphism type(14.0 monthsvs. 10.0 months,P=0.001). However, BIM gene polymorphism did not have significant influence on adverse drug reaction (χ2=1.62,P>0.1).ConclusionsThe BIM gene polymorphism is the independent prognostic factor for PFS in patients of NSCLC, and detection of BIM gene polymorphism is important for prognostic evaluation of therapeutic efficacy in the advanced NSCLC with platinum drugs.
Non-small cell lung cancer; BIM gene polymorphism; Platinum drugs
10.3877/cma.j.issn.1674-6902.2017.06.014
重庆市卫生计生委医学科研课题(20143007)
400021 重庆市中医院
刘勇, Email: liu-yong@csco.org.cn
R563
A
2017-09-24)
张大春)
朱江红,刘勇,程俊,等. BIM基因多态性与铂类药物治疗晚期非小细胞肺癌疗效的相关性分析[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(6): 698-703.

