伪狂犬病毒的分离鉴定
姚 红 (山东省东平县畜牧兽医局 271500)
伪狂犬病毒的分离鉴定
姚 红 (山东省东平县畜牧兽医局 271500)
本研究对疑似伪狂犬病猪的病料进行分离鉴定,通过细菌学鉴定、病毒提取培养、电镜观察、动物试验和中和试验。结果表明,所取病料分离鉴定出伪狂犬病毒。
伪狂犬病毒 分离 鉴定
猪的伪狂犬病是由狂犬病病毒(PRV)引起的一种危害严重的急性败血性传染病,主要以新生仔猪的急性死亡及4周龄以上的仔猪表现神经病状为特征。
1 材料及方法
1.1 材料
1.1.1 病料 在周边猪场采集临床表现有发热、昏迷、神经症状等症状的疑似伪狂犬病的死猪中,在脑部取样。细胞株 猪肾传代细胞(PK-15),由吉林大学畜牧兽医学院病理实验室保存。
1.1.2 主要试剂 健康猪的经脉血液,采自附近猪场;葡萄糖、氯化钠、枸橼酸钠、枸橼酸、氯化钾、碳酸氢钠、氢氧化钠、无水乙醇、青霉素、链霉素、酚红、DMEM(Dulbecco’s Modified Eagle Medium)粉剂;胰蛋白酶,购自长春宝泰克生物制品有限责任公司;胎牛血清(FCS),购自中国医学科学院血液学研究所。
1.1.3 主要器材 各型微量可调移液器、生物显微镜、96孔培养板、WZ-2A微量振荡器、DK-8D型电热恒温箱、PCR扩增仪(Gene Amp PCR System 9600,Biometra)、TY600C型电泳仪、电泳槽,凝胶成像系统,70P-72型超速离心机,DW-40L262型立式医用冰箱,GZX-9070 MBE数显鼓风干燥箱,BS124S型电子分析天平,DL-CJ-IN型超净工作台,MCO-17AI型CO2培养箱,JEM-1200EXII投射电子显微镜,数码照相机,一次性滤器(仪器精密度为0.22µm)。
1.1.4 各种溶液的配制 DMEM营养液的配制、D-Hanks液的配制、0.25%的胰酶的配制、PBS液的配制、革兰氏染色液的配制(结晶紫溶液、(路)卢戈碘液、脱色剂、番红花红染色液),以上液体由试验组配制完成。
1.2 方法
1.2.1 细菌学鉴定 将病猪脑部病料触片在显微镜下观察。首先将触片固定,用草酸铵结晶紫染色1min。然后自来水冲洗,加碘液覆盖涂面染色1min。水洗,用吸水纸吸去水分加95%酒精数滴,并轻轻摇动进行脱色,30s后水洗,吸去水分。番红染色液染10s钟后,自来水冲洗。最后干燥镜检。
1.2.2 病毒的粗提 取脑部病料用Hanks液配制成1:10的乳剂,离心10min,取上清,经0.22μm微孔滤膜无菌滤过后准备接种。
1.2.3 细胞培养 把PK-15细胞接入100ml的细胞瓶内并加入细胞培养液进行培养,把细胞瓶置于培养箱中(37℃,5%CO2)培养,观察细胞的生长状态,待到细胞基本长满单层时进行传代,具体方法是倾弃细胞旧液,用Hanks液洗涤2~3次,之后加入0.25%的胰酶(以浸没细胞单层为佳)进行消化,待细胞将要分离而呈圆粒时,加入细胞维持液终止消化,用刻度吸管反复吹打细胞,直至完全分散,重新悬浮细胞,按一传而接入新的细胞瓶中,置于培养箱(37℃,5%CO2)培养。
1.2.4 电镜观察 在长成单层新鲜的PK-15细胞上按1/100剂量分别接种病毒株,37℃吸附1h,(中间轻轻摇晃两次使充分接触),弃上清,用Hanks液轻轻润洗一次,然后加入细胞维持液。于37 ℃ 5%CO2培养箱中培养,接毒12h后开始,每6h观察细胞病变(CPE),培养96h。盲传3代至CPE出现80%以上时收获病毒液。
1.2.5 蔗糖梯度离心的方法提纯病毒 (1)将上述经过病毒增殖的细胞培养液,用玻璃匀浆器充分研磨后制成悬液,经反复冻融3次后,置-20℃冰箱中,备用。(2)先以5000g离心15min后,获取上清夜,然后再20000g高速离心30min后取上清夜。(3)接着100,000 g超速离心2h,将沉淀用少量STE溶解。(4)先在超速离心管中加入5~8ml的第3步所获取的含病毒样品的溶解液,然后在离心管中依次加入30%、45%、60%的蔗糖,加的时候是用长针头从底部往上加的。110000g离心2.5h,发现在30%与45%以及45%与60%之间都有一条明亮的带,用长针头将两条不同部位的带都吸取出来,分别收集到不同的瓶内。(5)去蔗糖:用STE缓冲液适量稀释纯化的病毒,然后110000g离心3h,用少量STE(根据沉淀的量决定加入多少)缓冲液把沉淀悬起,即最后获得了纯化的病毒。-20℃冻纯备用,用时可用分光光度计测定其病毒含量。
1.2.6 TCID50测定 在长成单层新鲜的PK-15细胞上按1/100剂量分别接种病毒株,37℃吸附1h,(中间轻轻摇晃两次使充分接触),弃上清,用Hanks液轻轻润洗一次,然后加入细胞维持液。于37 ℃ 5%CO2培养箱中培养,待CPE达80%时收获病毒液,-70℃冻存。采用微量法测定病毒在PK-15细胞上的感染力。病毒液做10倍系列稀释(从101~1010)后,分别接种于长满单层细胞的96孔微量细胞培养板上,每个稀释度接种8孔,每孔(1~11孔)100µl,12孔加维持液作为阴性对照,于37 5%CO℃2培养箱中培养,接毒12h后开始,每6h观察CPE,培养96h后判定结果。按照Reed-Muench氏法计算病毒的TCID50。
1.2.7 动物试验 选取易感动物家兔做动物试验,将提纯的病毒注入家兔体内,饲养观察,用健康家兔作对照。
1.2.8 中和试验 采用固定病毒稀释血清法,将PRV Min-A标准阳性血清做10倍系列稀释,使其稀释度为10-1-10-9,然后分别与等量200TCID50混匀,置于37℃作用1h,分别接种96孔细胞板,每个稀释度8孔,每孔0.1ml,同时设PRV Min-A株与标准阳性血清、阴性血清及只加维持液的细胞对照,置5%CO2培养箱37℃培养,连续3日观察细胞病变并记录结果。按Reed-Muench氏法计算血清中和指数。判定标准为待检血清的中和指数大于50,即可判定为阳性,10~49为可疑,小于10为阴性。
2 结果
2.1 细菌学鉴定结果
经过革兰氏染色后,将触片在电镜下观察,没有发现细菌感染。
2.2 电镜观察结果
将提纯的病毒接种于长成单层的PK-15细胞,在第1代观察到CPE,接种病毒后48h:感染细胞变性圆缩,相邻感染细胞迅速聚集,融合成“葡萄状”,形成分散的轮廓不明显的合胞体病灶。有的细胞圆缩、集聚,脱落,细胞层形成大小不等的空洞状病变,有的呈拉网状。而未接种的细胞界限明显,大小均一,呈均匀致密的单层。随着在相应细胞中传代次数的增多,规律性CPE出现时间缩短。经PK-15连传10代,则于接种后约18~24h即可见细胞病变,80%的CPE稳定在20h。
2.3 TCID50测定结果
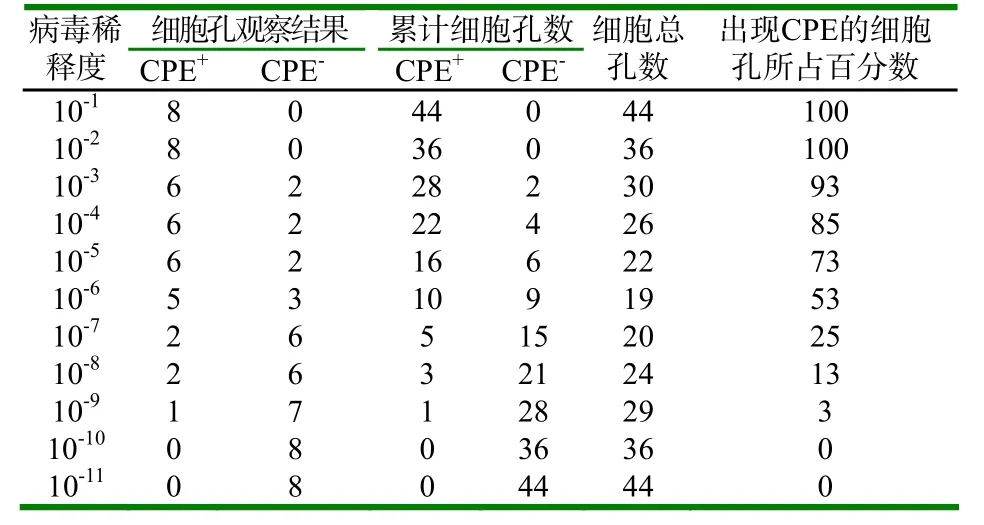
表1 TCID50测定结果
由上表可以看出该分离毒的TCID50应在10-6~10-7之间,其确切稀释倍数可按下列公式计算,确切稀释倍数=(高于50%的百分数—50)/(高于50%的百分数—低于于50%的百分数)=0.11。由上式获得的0.11加在高于50%死亡的稀释度的对数(6)上,因此该病毒的TCID50应是20µl10-6.11稀释的病毒液。
2.4 动物试验结果
注射提纯的病毒后,饲养观察一段时间,家兔开始表现兴奋不安,食欲下降,后来出现不断低头用舌舔、嘴啃或用爪抓接种部位,明显出现瘙痒症状,接种部位被毛脱落、皮肤潮红、出血,暴露出红色肌肉,体温升高,呼吸急促,最后四肢麻痹,角弓反张,后抽搐而死。
2.5 血清中和试验结果

表2 血清中和结果
3 讨论
本试验从急性死亡病猪脑部分离出的病毒,经过细胞接种试验以及对其毒价进行滴定初步判断其为伪狂犬病毒;经过中和试验阳性血清能够特异中和分离毒,抑制细胞病变;根据PRV gD基因设计的引物对分离毒进行反应,可扩增出特异性条带。以上结果可鉴定分离毒为伪狂犬病毒。
4 结论
(1)在电镜下观察,根据其形态和病理变化确定其为伪狂犬病毒。(2)成功通过血清中和试验、PCR扩增的方法对分离的毒株进行鉴定,确定其为伪狂犬病毒。
[1] 范伟兴等. PRVLA株ED基因的序列测定及其重复高变区的发现[J].中国预防兽医学报. 2003, 25(4): 294-298.
[2] 范伟兴, 刘文强等. 三种PCR方法诊断猪伪狂犬病毒的比较研究
[J]. 中国兽医学报. 2003, 25(4): 295-297.
[3] 周斌, 苏鑫铭, 张素芳等. PCR快速检测伪狂犬病病毒野毒感染[J].中国病毒学, 2004, 19(6): 612-615.
[4] 姜焱, 汪海建, 祁贤等. 伪狂犬病病毒上海株gE基因克隆及其含GFP基因质粒载体的构建[J]. 中国兽医科技, 2001, 31(10): 5-7.
S852.65+5
A
1007-1733(2017)12-0016-02
2017-09-05)

