糖肟三甲基硅醚化衍生法分析中药多糖单糖组成研究
夏永刚,孙慧敏,王天龙,梁军,杨炳友,匡海学
(黑龙江中医药大学 北药基础与应用研究教育部重点实验室,黑龙江省中药及天然药物药效物质基础研究重点实验室,黑龙江 哈尔滨 150040)
中药研究
糖肟三甲基硅醚化衍生法分析中药多糖单糖组成研究
夏永刚,孙慧敏,王天龙,梁军,杨炳友,匡海学*
(黑龙江中医药大学 北药基础与应用研究教育部重点实验室,黑龙江省中药及天然药物药效物质基础研究重点实验室,黑龙江 哈尔滨 150040)
目的:建立糖肟三甲基硅醚化衍生法分析中药多糖单糖组成。方法:样品经糖肟三甲基硅醚化衍生,采用气相色谱法测定麻黄根多糖的单糖组成。色谱柱:DB-5 毛细管柱(60 m×0.25 mm×0.25 μm),载气:He,进样量:1 μL,分流比20∶1,柱流速1.2 mL/min,程序升温,柱温150℃,以3℃/min至230℃,以20℃/min至300℃。质谱条件:EI(70 eV),离子源温度230℃,接口温度250℃,扫描范围:m/z 50~550,扫描率:2.5 scan/s。结果:9 种单糖标准品均得到很好的分离。麻黄根纯化多糖Ⅱ中主要含阿拉伯糖、半乳糖和鼠李糖,其摩尔比为16.96∶5.03∶1.01,还有痕量的葡萄糖、岩藻糖和甘露糖。结论:该方法可以准确测定中药多糖中单糖的种类和比例,并成功用于检测麻黄根纯化多糖中的单糖组分。
糖肟三甲基硅醚化衍生法;麻黄根多糖;GC-MS;单糖组成
多糖是中药活性成分之一,是所有生命有机体的重要组成部分,在生物体内作为能量物质,参与细胞的各种生理活动[1-3]。中药中含有较多的多糖,随着糖化学的不断发展,人们认识到多糖具多方面的生物活性及功能,具有抗肿瘤、抗凝血、抗衰老、抗病毒、降血糖和血脂等多种生物活性[4-6]。近年来,随着糖类结构和生物学功能检测技术的飞速发展,以糖类为基础的药物研究有了长足的发展[7-8]。
在分析方法上,由于糖类化合物异构体复杂多变,其成分分离较为困难。虽然课题组前期发展了HPLC-UV、HPLC-FLD、HPCE-UV和GC-MS检测法已经成功应用于中药多糖单糖组成研究[9-12],但液相色谱法对色谱柱要求比较严格,而GC-MS检测硅醚化衍生又会产生多个异构色谱峰。因此,本论文采用糖肟三甲基硅醚化法进行衍生,GC-MS检测,并通过单因素考察试验对糖肟衍生试剂反应温度以及时间进行了优化。并将该方法应用于麻黄根纯化多糖Ⅱ的单糖组成研究,通过气质联用技术对麻黄根多糖类化合物进行定量与定性分析,为麻黄根多糖类化合物的进一步深入研究奠定理论基础。
1 仪器与试剂
Agilent7890A-5975C气质联用仪;标准单糖:阿拉伯糖、木糖、鼠李糖、核糖、岩藻糖、果糖、葡萄糖、半乳糖、甘露糖(sigma公司);麻黄根纯化多糖Ⅱ(本实验室提取纯化);六甲基二硅胺烷(上海试一化学试剂有限公司);三氟乙酸(天津市光复精细化工研究所);吡啶(天津市光复科技发展有限公司);盐酸羟胺(天津市光复科技发展有限公司);肌醇(上海蓝季科技发展有限公司)。
2 实验方法与结果
2.1 糖肟硅醚化衍生原理
根据文献研究显示[13],采用糖肟三甲基硅醚化衍生方法,称取10 mg固体糖样,另外称取5 mg盐酸羟胺,加上0.5 mL吡啶,再加 1.0 mL六甲基二硅胺烷和1 mL三氟乙酸,振荡30 s,在室温下放置15 min,过滤,滤液加到固体糖样中,70~75℃水浴中振荡反应15 min,反应产物可直接进行气相色谱分析。文献中仅对3种中性糖进行了衍生,得到单一并完全分离的色谱峰。
图1为糖肟三甲基硅醚化衍生反应原理。由于此方法直接称取固体糖样进行实验,操作复杂。所以本研究在该文献数据的基础上,对8种醛糖和1种酮糖进行糖肟硅醚化衍生,将固体单糖标准品先溶于吡啶后进行糖肟衍生,简化操作。考虑到使用吡啶溶解是否会对结果产生影响,对其衍生反应温度和时间进行优化。

图1 糖肟三甲基硅醚化衍生反应原理
2.2 GC-MS分析
采用Agilent 7890A-5975C气质联用仪,色谱柱:DB-5细管柱(60 m×0.25 mm×0.25 μm),载气:He,进样量∶1 μL,分流比20∶1,柱流速1.2 mL/min,程序升温,柱温150 ℃,以3 ℃/min至230 ℃,以20 ℃/min至300 ℃。质谱条件:EI(70 eV),离子源温度230 ℃,接口温度250 ℃,扫描范围:m/z 50~550,扫描率:2.5 scan/s。
2.3 单因素糖肟硅醚化衍生优化试验
2.3.1 糖肟硅醚化衍生试剂反应温度对丰度的影响
按照2.1项的具体步骤准确配制一定浓度的9标准单糖吡啶混合溶液,衍生试剂反应时间固定15 min,反应温度分别为50、60、70、80、90和100 ℃。
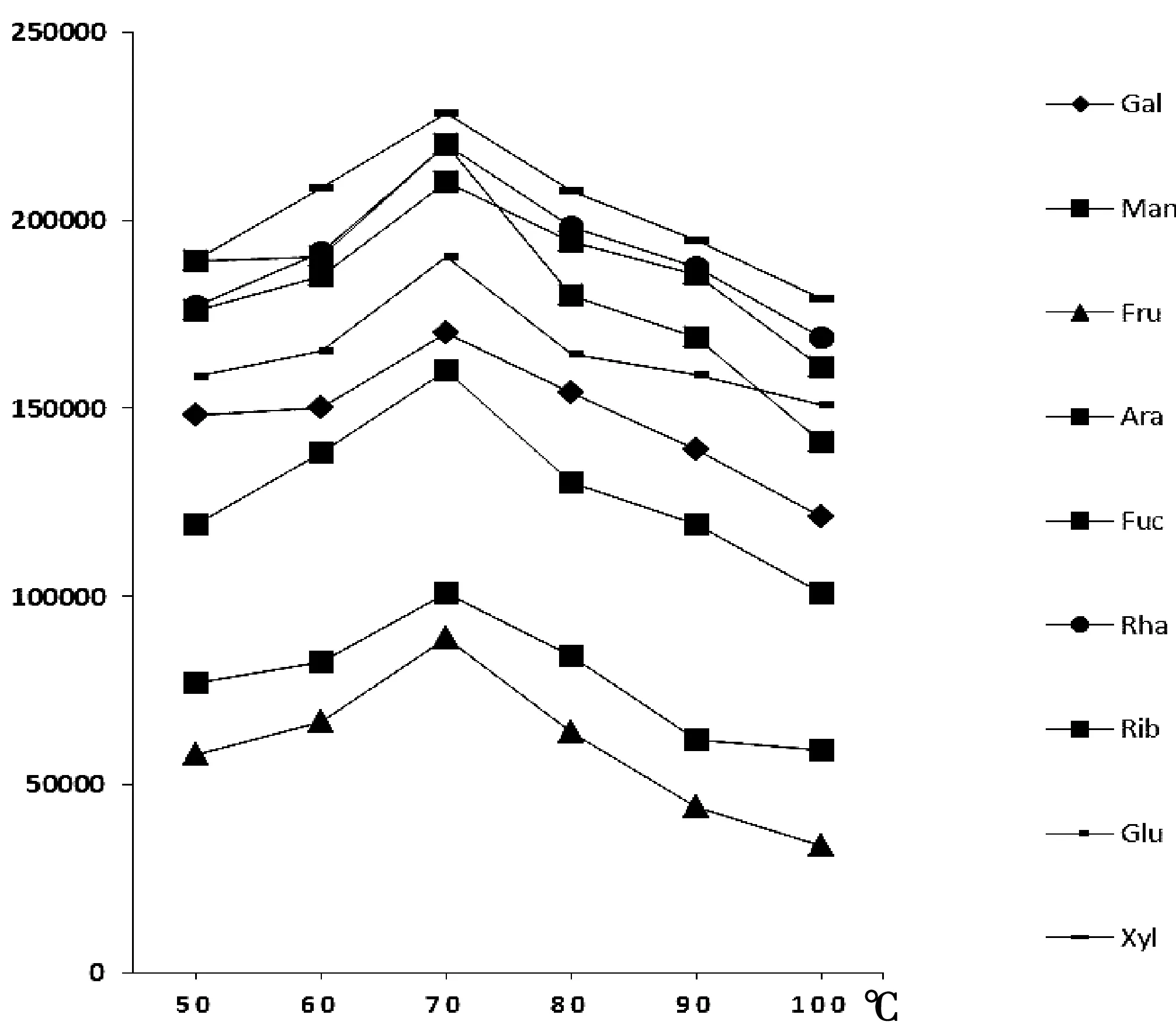
图2 衍生化反应温度对峰面积的影响
由图2可知,单糖样品加入糖肟硅醚化衍生试剂后,随着反应温度的升高,峰响应强度增大趋势,反应温度到达70 ℃时最高,当温度继续升高时丰度有所下降趋势。因此,本文选取70 ℃水浴衍生样品。
2.3.2 糖肟硅醚化衍生试剂反应时间对响应强度的影响
按照2.1项的具体步骤准确配制一定浓度的9标准单糖吡啶混合溶液,衍生试剂反应温度为70 ℃,衍生反应时间分别为5、10、15、20、25和30 min。

图3 反应时间对峰面积的影响
由图3可知,单糖样品加入糖肟硅醚化衍生试剂后,反应15 min时,峰响应强度呈现增大趋势,当反应时间继续增加时峰面积呈下降趋势。因此,确定样品衍生时间为15 min。
综上所述,糖肟三甲基硅醚化最佳的衍生化条件为:样品预先配制为适当浓度的吡啶溶液,加入预先配制好的衍生试剂(盐酸羟胺:吡啶:六甲基二硅胺烷:三氟乙酸=5∶0.5∶1∶1,振荡30 s,在室温下放置15 min,过滤,得滤液),70℃水浴衍生,衍生时间为15 min,说明用吡啶溶解固体标准单糖得到的结果与文献一致[13],并且改进原有方法制备标准曲线操作复杂这一缺点。
2.4 标准单糖的衍生化制备
精密量取浓度为0.15 mg/mL的9种标准样品吡啶溶液,加入预先配制好的衍生试剂1.6 mL,70 ℃水浴中振荡反应15 min。反应产物可直接进行气相色谱分析。
2.5 样品的衍生化制备
2.5.1 样品水解
称取5 mg麻黄根多糖Ⅱ样品,置于安瓿瓶中,加入2 mol/L TFA 2 mL,充入氮气,密封后于110 ℃水解2 h。水解完毕待冷却后,反应液减压浓缩蒸干,加入适量甲醇,重复蒸干多次,除去其中残留的TFA(无酸味)。
2.5.2 糖肟硅醚化衍生物的制备
向完全水解后的样品加入100 μL吡啶溶解。加入预先配制好的衍生试剂共1.6 mL,在70 ℃水浴中振荡反应15 min,反应产物可直接进行气相色谱分析。
2.6 标准曲线的建立
配制9单糖标准品葡萄糖(Glu)、半乳糖(Gal)、甘露糖(Man)、岩藻糖(Fuc)、核糖(Rib)、阿拉伯糖(Ara)、木糖(Xyl)、鼠李糖(Rha)和果糖(Fru) 的吡啶混合溶液,浓度依次为0.05、0.1、0.25、0.5、1、1.5、3.0和6.0 mg/mL。内标物为肌醇,其浓度为3.0 mg/mL的吡啶溶液。依次量取吡啶混合溶液100 μL和内标物50 μL,横坐标和纵坐标分别为每种单糖的浓度和不同浓度时的单糖对照品峰面积与内标峰面积之比,进行线性回归分析,以信噪比(Signal/Noise, S/N)为3∶1和10∶1为标准确定被测物的最低检出限(LOD)和最低定量限(LOQ)。根据最低定量限和实际样品浓度范围选择标准曲线范围,结果见表1。

表1 9种单糖的标准曲线方程及相关系数
2.7 方法学考察
2.7.1 精密度试验
取硅醚化衍生后的混合单糖标准溶液,按照实验条件连续进样 5 次,计算各单糖衍生物峰面积与内标峰面积的比值,结果9种标准单糖Glu、Gal、Man、Ara、Xyl、Rha、Fuc、Rib和Fru的RSD值分别为1.88%、2.02%、1.56%、1.39%、2.16%、1.97%、1.28%、1.46%和1.12% ,表明精密度良好。
2.7.2 重复性试验
平行制备5份麻黄根多糖水解后的供试品溶液,按色谱条件进行测定。求出供试品中Ara、Glu、Gal、Rha、Man和Fuc的浓度后,计算RSD值分别为1.75%、1.23%、1.86%、2.02%、1.47%和1.39% ,表明该方法稳定可行。
2.7.3 稳定性试验
取硅醚化衍生后的样品溶液,常温放置0、4、8、12、16、20和24 h后分别予以测定,RSD为2.05%(以半乳糖计)表明衍生产物在24 h之内稳定性较好。
2.8 回收率试验
取适量单糖混合标准溶液,分别加入已知各单糖含量的麻黄根多糖(5 mg),平行5份,按照实验方法操作和测定,样品中阿拉伯糖(Ara)、葡萄糖(Glu)、半乳糖(Gal)、鼠李糖(Rha)、岩藻糖(Fuc)和甘露糖(Man)平均回收率分别为97.5%、98.7%、100.1%、99.4%和102.3%,RSD均小于3%。表明该方法回收率较高。
2.9 样品的测定
9种单糖标准品及样品的糖肟硅醚化衍生产物GC-MS图谱如图4所示,各个单糖标准品均可得到单一的色谱主峰。各个单糖标准品的保留时间及特征离子见表2。

图4 GC-MS色谱图(A:单糖标准品糖肟硅醚化衍生 B:样品糖肟硅醚化衍生1:Ara;2:Rha;3:Rib;4:Fuc;5:Xyl;6:Man;7:Fru;8:Gal;9:Glc;10:Inositol)
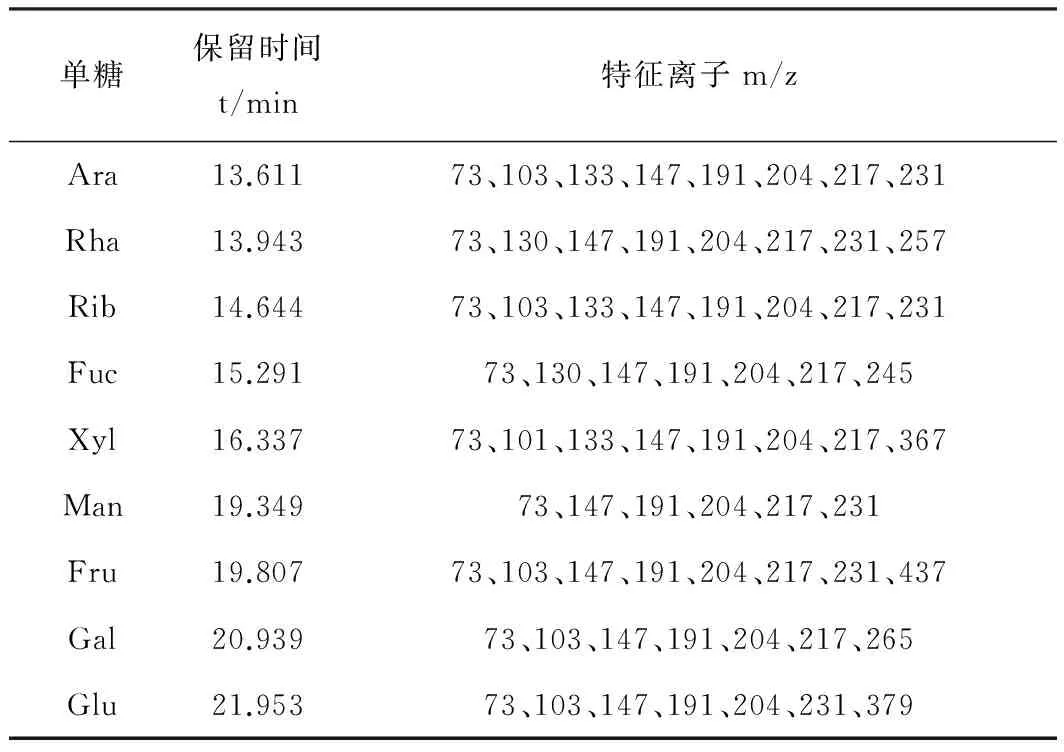
单糖保留时间t/min特征离子m/zAra13.61173、103、133、147、191、204、217、231Rha13.94373、130、147、191、204、217、231、257Rib14.64473、103、133、147、191、204、217、231Fuc15.29173、130、147、191、204、217、245Xyl16.33773、101、133、147、191、204、217、367Man19.34973、147、191、204、217、231Fru19.80773、103、147、191、204、217、231、437Gal20.93973、103、147、191、204、217、265Glu21.95373、103、147、191、204、231、379
3 讨论
本文采用GC-MS 分析多糖单糖组成,样品先用吡啶溶解,通过盐酸羟胺肟化,再利用三甲基硅醚化试剂进行衍生测定,并对糖肟衍生条件进行了单因素的优化。先用吡啶溶解固体标准糖样后取适量进行糖肟衍生,解决了常用多糖衍生方法(硅烷化和乙酰化)易产生异构体而造成多峰、重叠峰等一些为中药多糖组成分析带来困难的问题。
该方法具有快速有效、实用性强、节省时间等优点,每种单糖均为单一高响应的色谱主峰,通过气质联用技术可以对中药多糖进行定量与定性分析。由于衍生试剂混合后外界条件对C1-C2上是否形成单肟,导致该方法的糖肟三甲基硅醚化衍生试剂稳定性较差,我们后期将会对其衍生物形成单双糖肟的问题进行深入的探究。
[1] 李绍平,吴定涛,赵静.糖谱及其在中药多糖质量控制中的应用[J].中国中药杂志,2015,40(17):3505-3513.
[2] 贺百花,吴玉红.中药多糖的药理研究进展[J].神经药理学报,2010,27(6):77-79.
[3] 郭新华,佟建明,章世元,等.中药多糖的免癌调节作用及机制的研究进展[J].广东饲料,2007(6):24-26.
[4] 王蓉,吴剑波.多糖生物活性的研究进展[J].国外医药抗生素分册,2001,22(3):97-100.
[5] 王玉华,袁久荣.中药多糖的化学研究概况[J].中成药,2004,26(6):496-498.
[6] 吴伟,樊丽.中药多糖分析方法的研究进展[J].时珍国医国药,2007,18(3):699-700.
[7] 贾秀娟,刘有军,杨焕,等.利用质谱技术解析糖类结构的研究进展[J].质谱学报,2014,35(5):397-404.
[8] 黄伟.糖类分析的研究进展[J].安徽农学通报,2010,16(10):31-32.
[9] 梁军,王迪,夏永刚,等.麻黄根多糖中单糖组成的GC-MS分析[J].中医药学报,2014,42(4):17-18.
[10] Kuang H X, Xia Y G, Liang J, et al. Fast classification and compositional analysis of polysaccharides from TCMs by ultra-performance liquid chromatography coupled with multivariate analysis[J].Carbohydrate Polymers,2011,84(4):1258-1266.
[11] 梁军,孙黎明,夏永刚,等.亲水作用色谱-质谱法测定麻黄根多糖单糖的组成[J].中国实验方剂学杂志,2017,23(7):73-78.
[12] 梁军,夏永刚,杨炳友,等.基于氨基苯甲酸衍生化HPLC-FLD分析中药多糖单糖组成[J].中医药学报,2016,44(6):13-15.
[13] 李筱华,常凤眉.糖肟三甲基硅醚衍生物制备方法的改进——气相色谱法分离甘露糖、半乳糖、葡萄糖[J].色谱,1988,6(3):171-173.
AnalysisofMonosaccharideCompositionofPolysaccharideinChineseHerbsbySugarOximeTrimethylsilylationDerivatization
XIA Yong-gang, SUN Hui-min, WANG Tian-long, LIANG Jun, YANG Bing-you, KUANG Hai-xue
(KeyLaboratoryofChineseMateriaMedica,MinistryofEducation,HeilongjiangKeyLaboratoryofTraditionalChineseMedicineandNaturalMedicinePharmacodynamicMaterialBases,HeilongjiangUniversityofChineseMedicine,Harbin150040,China)
Objective: To determine monosaccarides composition of polysaccaride in Chinese herbs with oxime trimethy silylation. Methods: The samples were derived from oxime trimethy silylation, and monosaccharide composition in Ephedra root was determinated by gas chromatography. DB-5 capillary column(60 m×0.25 mm×0.25 μm) was applied, nitrogen was served as carrier gas, sample volume was 1uL, split ratio was 20∶1, column flow rate was 1.2 ml/min, column temperature was 150℃; the temperature rose to 230℃ at the speed of 3℃/min; then to 300℃ at 20℃/min; 250℃ inlet temperature, 20∶1 split ratio, flow rate was 1.2 mL/min. MS condition: EI(70eV), ion source temperature was 230℃, interface temperature was 250℃; scanning range was 50~550 m/z, with scanning rate of 2.5scan/s. Results: 9 kinds of monosaccharides got a good separation. Polysaccharide of Ephedra root mainly contained arabinose, galactose and rhamnose, the mole proportion of them was 16.96∶5.03∶1.01, there was also a small amount of glucose, fucose and mannose. Conclusion: This method can obtain a single peak, which can be used for determination of monosaccharides composition in polysaccharide of Chinese herbs, and it has been successfully tested in Ephedra root.
Oxime trimethy silylation; Polysaccharide of Ephedra root; GC-MS; Monosaccharide composition
R284.1
A
1002-2392(2017)06-0017-04
2017-06-10
2017-07-21
全国百篇优秀博士学位论文作者专项资金项目(201367);中国博士后第61批科学基金面上项目(2017M611409);哈尔滨市科技创新人才研究专项资金项目(2017RAXXJ059)
夏永刚(1980-),男,博士,教授,主要研究方向:中药及复方药效物质基础研究。
*通讯作者:匡海学(1955-),男,博士,教授,博士研究生导师,主要研究方向:中药及复方药效物质基础研究,中药性味理论研究。

