SerpinA1在大肠癌中的表达及意义
乔 璐,张晓静,王 海,高 申*,何成彦,黄丽红
(吉林大学中日联谊医院 1.检验科;2.老年病科,吉林 长春130033)
SerpinA1在大肠癌中的表达及意义
乔 璐1,张晓静1,王 海1,高 申1*,何成彦1,黄丽红2
(吉林大学中日联谊医院 1.检验科;2.老年病科,吉林 长春130033)
目的探究SerpinA1蛋白在大肠癌及癌旁健康组织的表达差异,评估其作为大肠癌生物标志物的潜力和应用价值。方法将20例DukesB期大肠癌患者的肿瘤标本经二维液相色谱-质谱联用法分析,得到大肠癌组织及癌旁健康组织表达差异显著的25个蛋白,并用免疫印迹验证SerpinA1蛋白的准确性。结果质谱鉴定后显示,SerpinA1蛋白的表达水平在癌组织中明显高于癌旁健康组织,并在免疫印迹实验中得到证实。结论SerpinA1有可能成为新的大肠癌候选肿瘤标志物。
SerpinA1;大肠癌;二维液相色谱-质谱联用法;免疫印迹
(ChinJLabDiagn,2017,21:2053)
大肠癌(CRC)是指产生于回盲部至肛门的恶性病变,包括结直肠癌和肛管癌,是目前癌症死亡的第二大原因[1]。人口老龄化以及高脂低纤饮食是大肠癌发病的主要原因。大肠癌初期起病隐匿,多数无临床症状,常有不同程度的延误诊断。其死亡率与初步诊断大肠癌的分期呈正相关,若早期确诊可通过手术切除使生存率显著提高。转移患者的5年生存率<10%,局部腺瘤息肉患者的生存率大于90%。目前公认的在结直肠癌诊断和术后监测有意义的肿瘤标志物是癌胚抗原(CEA)和CA19-9[2]。但认为CEA和CA19-9在早期大肠癌中缺乏诊断价值,且仅有45%病人升高。因此开发更敏感和特异性的标志物来检测所有阶段的大肠癌是至关重要的。SerpinA1(丝氨酸蛋白酶抑制剂A1)是具有高度保守结构的蛋白质,是人类最主要的蛋白酶抑制物,抑制能力占血浆总蛋白酶的90%以上[3]。它能不可逆的自杀性抑制多种丝氨酸内切肽酶(serineendopeptidase),如胰蛋白酶、弹性蛋白酶、金属蛋白酶等,保护细胞外基质免受丝氨酸蛋白酶的损伤,在维持细胞稳态方面发挥关键作用。同时也涉及一些非抑制作用如血液凝固,组织重塑,血管生成,炎症反应,细胞凋亡和肿瘤转移等。SerpinA1是一种急相时性反应蛋白,大部分由肝细胞合成,在单核巨噬细胞、肠上皮细胞、肾实质等肝外组织及某些肿瘤细胞中也可以产生[4]。国外研究显示,很多恶性肿瘤如肝癌、肺癌、膀脱癌患者的肿瘤中SerpinA1表达水平均增高,但迄今为止对于其在大肠癌中的研究较少,因此本实验采用二维液相色谱法-质谱联用技术及免疫印迹技术,旨在探讨SerpinA1在DukesB期大肠癌及癌旁健康组织中的表达情况及临床意义,为大肠癌临床诊断及发病机制提供新的检验指标。
1 材料与方法
1.1 组织来源
收集来自吉林大学中日联谊医院2015至2016年经病理学检查证实为结直肠癌DukesB期腺癌的20例标本,排除了多发肿瘤患者及术中发现已发生转移患者。手术前均签署知情同意书且确定没有接受任何治疗。手术中取得的癌旁健康组织距肿瘤边缘大于10 cm,且均取于肿瘤组织上端。待标本离体后,立即取材,生理盐水冲洗,液氮冻存备用。
1.2 仪器及试剂
Bio-Rad公司的2-碘乙酰胺(IAM)、BCA蛋白质定量试剂盒、尿素(Urea),Sigma公司的DNA酶和RNA酶,美国GE 公司的二硫苏糖醇(DTT)、TMED、PMSF、TPCK 修饰的测序级胰酶,Beyotime公司的考马斯亮蓝G250,Milli-Q Integral超纯水发生装置,Agilent公司的1200纳升级液相色谱分析仪和ThermoFisher公司的LTQXL线性离子阱质谱仪、UV-2000型分光光度计。
1.3 实验方法
1.3.1样本总蛋白提取并测定浓度 分别取出液氮冻存的50 mg大肠癌组织及癌旁健康组织,放入液氮中研磨成粉末。加入裂解缓冲液(30 mmol/LTris-HCL,9 mol/LUrea,65 mmol/LDTT,2 mmol/LPMSF),室温振荡1 h,使混合物充分溶解,用RNA酶和DNA酶去除RNA和DNA,离心后留取上清即为总蛋白质。采用Bradford法检测蛋白浓度,考马斯亮蓝G250染色,用UV-2000型分光光度计在595 nm处比色,以蛋白质浓度为横坐标,光吸收值为纵坐标绘制标准曲线,从而计算出样品的蛋白质浓度(mg/ml)。
1.3.2制备组织蛋白水解多肽混合物 用25 mmol/LNH4HCO3溶解稀释提取的组织蛋白以降低尿素浓度,使其低于2 mol/L。加入一定体积1 mol/L的DTT,使其终浓度为20 mmol/L,56℃室温避光放置1 h,使蛋白质中被氧化失活的-SH基团被还原。将反应物降至室温,再加入1 mol/L的2-碘乙酰胺(IAM),调定终浓度为50 mmol/L,室温下避光反应30 mins。按1∶50(胰酶:蛋白质)的比例向反应体系中加入TPCK修饰的测序级胰蛋白酶,在37℃水浴箱中酶切孵育过夜,产物用真空抽干后分装,-80℃保存。
1.3.3液质联用技术分析分离鉴定多肽混合物 将上述样本用0.1%FA溶解,取50 μg样品色谱上样,样品依次通过串联的强阳离子柱和C18反相柱进行洗脱分离。将洗脱的多肽用LTQXL质谱仪进行串联质谱分析,质谱扫描方式为数据依赖方式。将质谱分析得到的MS/MS图谱整合到Bioworks3.3.1SP1软件包中的SEQUEST软件,对强度为10个单位以上或有10个以上离子信号的谱图进行数据库检索,对相关的蛋白及多肽进行鉴定。
1.3.4免疫印迹试验 对选定的目标蛋白SerpinAl进行免疫印迹试验,进一步验证该蛋白在大肠癌组织是高表达的。SerpinAl单克隆抗体购自的美国Abgent公司,内参抗体为β-Actin。
1.4 统计学分析

2 结果
2.1 大肠癌组织及癌旁健康组织蛋白酶解混合产物的二维液相色谱-质谱联用分析
采集、整理多肽质谱数据,其中肿瘤组织酶解混合物共鉴定了29795个多肽序列,得出854个蛋白质鉴定资料;癌旁健康组织共鉴定了4120个多肽序列,得出534个蛋白质鉴定资料。
2.2 大肠癌组织与癌旁健康组织差异蛋白质的质谱分析
在这项研究中,两组样品中同一个蛋白质的丰度用谱图数进行评价。对于满足两个样品中的比值≥1同时两个样品中的差值≥72的蛋白质谱数,我们将其定义为蛋白丰度发生变化。本文主要探讨显著差异SerpinAl蛋白是明显上调的,SerpinAl质谱结果见图1。
2.3 免疫印迹验证SerpinAl在大肠癌组织与癌旁组织的表达情况
用Westernblot检测大肠癌及癌旁组织中SerpinAl蛋白的表达情况。结果证明SerpinAl蛋白在大肠癌中的表达水平明显高于配对的癌旁健康组织,此结果进一步的验证了二维液相色谱与质谱联用鉴定的SerpinAl在大肠癌组织中的高表达,结果见图2。
3 讨论
大肠癌是全球癌症死亡的主要原因之一。在全世界,大肠癌的发病率位居第三,仅次于肺癌和乳腺癌。提高无症状人群的筛查,检出早期癌及癌前病变并进行干预治疗,是提高治愈率和生存率的关键。蛋白组包括一种细胞乃至一种生物所表达的全部蛋白质,蛋白质组学技术是指高通量、大规模研究蛋白质的特征,包括蛋白质的表达水平、翻译后的修饰,蛋白与蛋白相互作用等。因此,利用蛋白组学技术探究肿瘤组织蛋白与癌旁组织蛋白表达水平上的差异,从而筛选出与肿瘤发生与发展密切相关的蛋白质,成为大肠癌防治研究中重要工具[5-7]。高表达的SerpinAl则可能成为肿瘤早期诊断新的潜在蛋白标记。
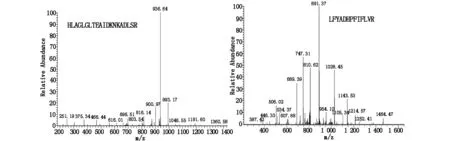
图1 SerpinAl质谱图

图2 SerpinAl免疫印迹图
研究表明,SerpinAl在多种癌症中均呈高表达,如:肝癌、胃癌、胰腺癌、膀胱癌、宫颈癌、甲状腺乳头状癌、乳腺癌、卵巢癌、肺癌等[8]。AroraPK等研究认为在肿瘤发展时细胞大量増殖、组织细胞坏死刺激了溶酶体蛋白酶类释放,从而导致SerpinAl代偿性増高[9]。也有人认为肿瘤细胞浸润和转移过程中,产生较多的IV型胶原酶可造成基膜崩解,从而有利于肿瘤的转移扩散,为了防止弹性蛋白和胶原分解过度,抑制癌组织中多种溶组织酶活性,抵御癌细胞侵袭周围组织,也可导致SerpinAl代偿性増高[10]。Primhak等则认为癌细胞内SerpinAl的蓄积可能是肿瘤细胞原始蛋白的合成,是一种胎性基因产物的体现[11]。还有人将胰蛋白酶等视为一种淋巴细胞刺激原,其抑制剂SerpinAl便具有免疫抑制作用,当SerpinAl增高,机体就失去对突变细胞的免疫监视作用而诱生肿瘤[12]。SerpinA1高表达可使纤连蛋白上调,纤连蛋白又通过激活多种致癌途径(如Akt,细胞外信号调节激酶,信号转导和转录激活因子3)促进肿瘤的进展[13]。国外学者研究显示,SerpinAl表达随分期的升高以及淋巴结的转移而升高,各分期患者之间SerpinAl表达有明显差异,表明SerpinAl参与了肿瘤生长、侵袭和转移等多个过程,是大肠癌的新型预后生物标志物和候选治疗靶标[14]。
本实验采用液质联用及蛋白质印迹技术分别验证了SerpinAl在大肠癌组织中表达蛋白量明显高于癌旁健康组织。因此,检测大肠癌组织中SerpinAl水平可以作为一种辅助标志物来早期筛查癌变,为大肠癌的初筛和研究提供了新途径。但是SerpinA1在肿瘤进展中的机制尚未完全阐明,须进一步深入和完善。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69.
[2]Chen CC,Yang SH,Lin JK,et al.Is it reasonable to add preoperative serum level of CEA and CA19-9 to staging for colorectal cancer?[J].J Surg Res,2005,124(2):169.
[3]Kloth JN,Gorter A,Fleuren GJ,et al.Elevated expression of SerpinA1 and SerpinA3 in HLA-positive cervical carcinoma[J].J Pathol,2008,215(3): 231.
[4]Normandin K,Péant B,Le Page C,et al.Protease inhibitor SERPINA1 expression in epithelial ovarian cancer[J].Clin Exp Metastasis,2010,27(1):55.
[5]Motzer RJ,Hutson TE,Cella D,et al.Pazopanib versus sunitinib in metastatic renal-cell carcinoma[J].N Engl J Med,2013,369(8):722.
[6]Wang Q,Zhang Y,Yang C,et al.Acetylation of metabolic enzymes coordinates carbon source utilization and metabolic flux[J].Science,2010,327(5968):1004.
[7]LIU Y,LI Z X,TAN B B,et al.Identification and screening of proteins associated with gastric adenocarcinoma by proteomics based on liquid chromatography-mass spectrometry [J].Chinise General Practice,2017,20(9):1088.
[8]Pérez-Holanda S,Blanco I,Menéndez M,et al.Serum concentration of alpha-1 antitrypsin is significantly higher in colorectal cancer patients than in healthy controls[J].BMC Cancer,2014,14:355.
[9]Arora PK,Miller HC,Aronson LD.alphal-Antitrypsin is an effector of immunological stasis[J].Nature,1978,274(5671): 90.
[10]Karashima S,Kataoka H,Itoh H,et al.Prognostic significance of alpha-1-antitrypsin in early stage of colorectal carcinomas[J].Int J Cancer,1990,45(2):244.
[11]Primhak RA,TannerMS.Alpha-1 antitrypsin deficiency[J].Arch Dis Child,2001,85: 2.
[12]Kwon CH,Park HJ,Choi JH,et al.Snail and serpinA1 promote tumor progression and predict prognosis in colorectal cancer[J].Oncotarget,2015,6(24): 20312.
[13]Ljujic M,Mijatovic S,Bulatovic MZ,et al.ALPHA-1 Antitrypsin Affects U0126-Induced Cytotoxicity in Colon Cancer Cell Line (HCT116)[J].Mol Biol (Mosk),2016,50(1):174.
[14]Peltier J,Roperch JP,Audebert S,et al.Quantitative proteomic analysis exploring progression of colorectal cancer:Modulation of the serpin family[J].J Proteomics,2016,148: 139.
ExpressionandSignificanceofSerpinA1incolorectalcancer
QIAOLu,ZHANGXiao-jing,WANGHai,etal.
(DepartmentofClinicalLaboratory,China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
ObjectiveTo research the expression status of SerpinA1 in colorectal cancer tissues and adjacent normal tissues.MethodsTwo-dimensional Liquid Chromatography-Mass Spectrometry analyzes samples of 20 patients with colorectal carcinoma,finding differentially expressed protein and selected SerpinA1.Then the result of SerpinA1 was identified by Westernblot.ResultsVerification by mass spectrometer reveals that SerpinA1 express importantly higher in colorectal cancer tissues than adjacent normal tissues,with result verified the accurateness by westernblot.ConclusionThe increase of SerpinA1 expression may well have a closely relationship with colorectal cancer.
SerpinA1;colorectal cancer;LC-MS;Westernblot
国家自然科学基金资助(81572082);吉林省科技厅资助(20140311092YY,20150101153,20150414015)
*通讯作者
1007-4287(2017)12-2053-04
R735.3
A
2017-02-21)

