miR-130a-3p通过抑制CXCL12抑制鼻咽癌细胞增殖与侵袭
刘春丽,张 洁,齐志伟,梁 媛,黄跃雁,张淑君
(承德医学院附属医院 耳鼻喉科, 河北 承德067000)
miR-130a-3p通过抑制CXCL12抑制鼻咽癌细胞增殖与侵袭
刘春丽,张 洁,齐志伟,梁 媛,黄跃雁,张淑君*
(承德医学院附属医院 耳鼻喉科, 河北 承德067000)
目的探讨miR-130a-3p 对人鼻咽癌细胞CNE-1功能的影响及其可能的靶向基因。方法采用脂质体介导方法将miR-130a-3p 模拟物(实验组)或对照模拟物(对照组)转染CNE-1细胞,分别用CCK-8 法和Transwell 试验检测细胞增殖侵袭和迁移能力变化,Western Blot检测趋化因子CXCL12蛋白表达。结果相较对照组,实验组CNE-1 细胞的增殖,侵袭和迁移能力增强(P<0.05),细胞中CXCL12蛋白表达水平明显下调(P<0.05)。结论miR-130a-3p 可能通过调节CXCL12蛋白表达抑制人鼻咽癌细胞CNE-1细胞的增殖、侵袭和迁移。
鼻咽癌;趋化因子;CXCL12; miR-130a-3p; CNE-1 细胞
(ChinJLabDiagn,2017,21:2168)
鼻咽癌原发于鼻咽黏膜上皮,常发于咽隐窝和顶前壁,常常起病隐蔽,淋巴结转移早。目前鼻咽癌治疗以放疗为主要手段,但因肿瘤容易复发和早期转移,预后往往不佳。因此,特异性分子标记物及基因治疗靶位的发现及相关作用机制的研究,对降低鼻咽癌患者死亡率,提高预后具有重大意义。
本研究借助细胞转染技术,采用脂质2000介导使得miRNA-130a-3p 模拟物转染入鼻咽癌CNE-1细胞中,从而观察并检测其对CNE-1细胞增殖、侵袭以及CXCL12蛋白的表达情况的影响,对其在人鼻咽癌中可能的调节机制进行初步的探究。
1 材料与方法
1.1细胞培养人鼻咽癌细胞株 CNE-1,从中国科学院上海生命科学研究院细胞资源中心获得。CNE-1细胞接种于含10%FBS的 H1640 培养基中,置于37 ℃、5% CO2的培养箱中培养。细胞贴壁生长后胰酶消化处理后传代培养,选择对数生长期的细胞进行后续实验。
1.2miR-130a-3p转染鼻咽癌细胞miR-130a-3p 模拟物(miR-130a-3p mimics)和阴性对照模拟物miRNA-NC,miR-130a-3p NC inhibitor均由上海吉玛制药技术有限公司合成。当培养瓶中的CNE-1细胞密度增长到80%-90% 时,用胰酶消化后收集细胞以2.5×105个细胞/孔接种到6 孔板中,继续培养至细胞单层密度达40%-50% 时,分别将miR-130a-3p摸拟物(实验组)或miRNA-NC及miR-130a-3p NC inhibitor(对照组)转染入CNE-1细胞。
1.3CCK-8法检测细胞增殖将miR-130a-3p mimics和miRNA-NC两组转染后的CNE-1细胞经胰酶消化并收集细胞吹散稀释,调节浓度至3×105/ml,以3 000/孔均匀接种在96 孔板,每板2组,每组4个复孔。将孔板放置在培养箱中孵育,培养条件为37℃,5%CO2,分别于24,48,72 h取出孔板,加入CCK-8 溶液10 μl/孔37℃,5%CO2温箱中继续孵育 2 h。用酶标仪测定每孔细胞溶液在450 nm 波长处的光吸收值。重复3次。
1.4Transwell试验检测细胞的侵袭能力预先将Matrigel放置在4℃冰箱中24 h。 用H1640 培养基按 3:1 稀释Matrigel胶,加入Transwell 小室上室(30 μl/孔),37℃、5%CO2下培养箱内孵育5 h。吸出小室中残留的液体,加入无血清H1640 培养基(50 μl/孔)后在37℃下孵育 30 min ,弃去培养基。向每个Transwell小室中接种200 μl 5×105/ml的细胞悬液,小室下方加入600 μl 含 20%血清的 H1640 培养基,将小室置于孔板中,37℃、5%CO2条件下培养箱中孵育36 h,弃培养液, PBS洗涤3次,吸出残留液,固定,染色,再次PBS洗涤。拭去上室面细胞后使用倒置显微镜下进行拍照计数,每次随机选取5个视野,每组进行3 次实验。
1.5预测miR-130a-3p的靶基因利用 Target Scan、Pic Tar、mi Randa 生物信息学分析工具,预测hsa-miR-130a-3p可能的靶基因。预测结果显示,hsa-miR-130a-3p 可以靶向结合CXCL12 -3'UTR。
1.6WesternBlot检测CXCL12蛋白表达在冰上用预冷的PBS对转染后的细胞洗涤2 次,离心,取上清液,裂解细胞。取少量蛋白样用BCA 法测定蛋白浓度。将蛋白溶液以30 μg/孔加样到孔板中, 10% SDS-PAGE上电泳分离,转膜; 5% 脱脂奶粉溶液封闭孵育1 h,加入一抗PBST稀释液4℃孵育过夜; 再次PBST洗膜3次,每次10 min。加入二抗PBST稀释液,密封,室温下摇床缓慢震荡孵育2 h ; PBST洗膜3 次,每次10 min。在暗室中应用双色红外激光成像系统检测蛋白条带。实验重复3 次。

2 结果
2.1miR-130a-3p可抑制鼻咽癌细胞增殖相较对照组,CNE-1 细胞株转染miR-130a-3p mimics后,细胞增殖减慢,而转染 miR-130a-3p inhibitor后的细胞增殖加快。说明miR-130a-3p mimics可以抑制鼻咽癌细胞增殖,见图1。

图1 miR-130a-3p抑制CNE-1细胞增殖(P<0.001)
2.2miR-130a-3p抑制鼻咽癌细胞的侵袭能力相较对照组,CNE-1 细胞株转染miR-130a-3p mimics后,穿膜细胞数减少,而转染miR-130a-3p inhibitor后细胞穿膜数增加,见图2。证明miR-130a-3p抑制CNE-1细胞的侵袭能力。
2.3miR-130a-3p抑制鼻咽癌细胞上CXCL12蛋白的表达相较对照组,CNE-1 细胞株转染miR-130a-3p mimics后,细胞的CXCL12表达水平下降,说明miR-130a-3p可下调CXCL12蛋白的表达水平(t=4.256,P<0.05),见图3。

图2 Transwell实验提示: miR-130a-3p mimics可明显减少CNE-1的侵袭细胞数(P<0.001)
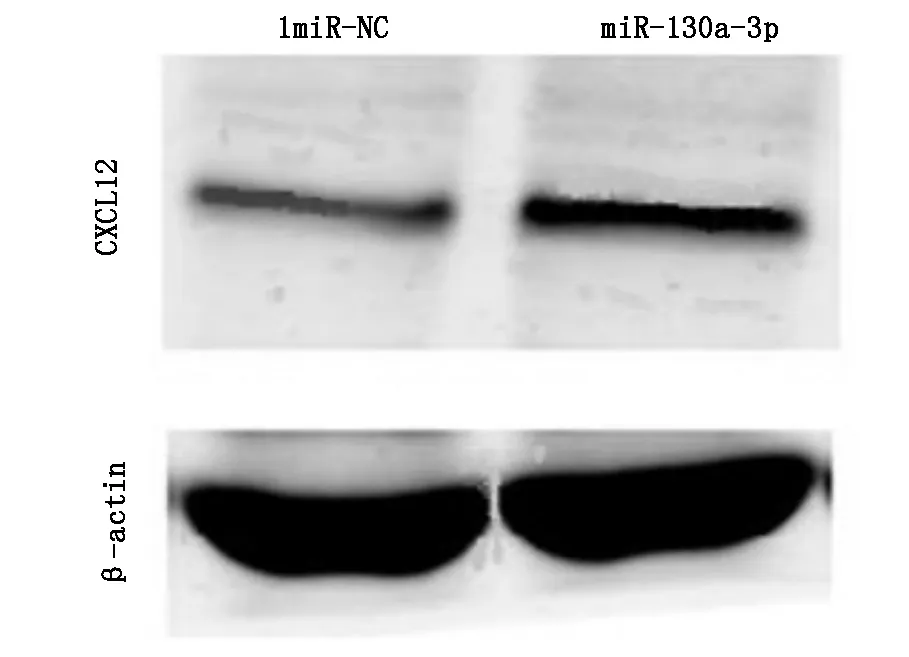
图3 miR-130a-3p 对CNE-1细胞CXCL12 蛋白表达的影响
3 讨论
鼻咽癌是耳鼻喉科常见的头颈部恶性肿瘤,其治疗失败的因素常常归结为肿瘤复发和转移。Micro RNA 是一类仅占基因组序列1%-3%的进化上高度保守的非编码小分子单链RNA,可通过与特定的mRNA完全或不完全碱基互补引导沉默体降解靶mRNA或阻碍其翻译,在转录水平上对基因活动的各个层面进行调节,并调控靶基因的蛋白表达。近年研究发现,多数miRNA处于染色体上与肿瘤相关的区域,越来越多的研究证实,在恶性肿瘤的发生发展的各个阶段都有miRNA的参与,可在各种肿瘤中发挥抑制肿瘤或引起肿瘤的生物学作用[6]。目前,已有研究显示miR-130a-3p 在肝胰岛素敏感性和肝脂肪变中发挥重要作用,并且在尿道膀胱癌中与肿瘤的发生和发展也密切相关[1]。Chen HC等[2]研究显示,miR-130a-3p在鼻咽癌中低度表达,但其与鼻咽癌侵袭和转移的关系及作用机制尚未完全阐明。
趋化因子(CXCL12)是一类在多种肿瘤中高度表达的控制免疫细胞向炎症定向迁移的细胞因子,与肿瘤的生长,侵袭和转移相关[3-5]。已有研究显示CXCL12的表达在鼻咽癌组织中存在与该肿瘤TNM分期呈正相关的现象,提示CXCL12可能与鼻咽癌细胞的生长、侵袭和转移有关联[5]。
在我们的实验中,采用CCK-8 法检测观察到过表达miR-130a-3p后鼻咽癌细胞增殖能力降低,说明miR-130a-3p在鼻咽癌中可有效抑制鼻咽癌细胞增殖,应用Transwell 试验表明过表达miR-130a-3p 对鼻咽癌细胞的侵袭和迁移具有显著抑制作用。综合我们的实验结果证明了 miR-130a-3p可在鼻咽癌中作为一种抑癌基因发挥抑制肿瘤的作用。 很多研究证实miR-130a-3p经多种生物信息学软件可以预测 microRNA靶位点[7-9],因此我们在上百种靶基因中选取与肿瘤细胞侵袭转移密切相关的CXCL12进行后续实验。在本研究中,miR-130a-3p模拟物转染的鼻咽癌细胞CXCL12蛋白的表达量明显地下降,提示过表达miR-130a-3p后可以下调CXCL12蛋白的表达水平,所以CXCL12是miR-130a-3p发挥抑制鼻咽癌细胞增殖、侵袭和迁移的作用的相关因子。本研究仍需要后续实验证实,miR-130a-3p与CXCL12间具体关联机制有待进一步研究,为增加鼻咽癌生物学标记物及鼻咽癌的诊治提供新思路。
[1]Raganoonan C,Fairbairn JK,Williams S,et al.Giant breast tumours of adolescence[J].Aust N Z J Surg, 1987 ,57(4):243.
[2]Chen HC,Chen GH,Chen YH.MicroRNA deregulation and pathway alterations in nasopharyngeal carcinoma[J].British Journal of Cancer,2009,100:1002.
[3]王文斌.CXCL12-CXCR4在肝外胆管癌组织中的表达及其意义的研究[D].河北医科大学,2008.
[4]蒋玉萍,吴小华.趋化因子CXCL12及其受体与肿瘤转移的关系[J].癌症,2007,(2):220.
[5]罗庆丰,李金高,张小芳,等.CXCL12蛋白表达在鼻咽癌组织中的临床意义[J].实用癌症杂志,2014,23(11):1396.
[6]P Bartel-David.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):97.
[7]卞 峰.CXCL12/CXCR4生物轴调控骨肉瘤类肿瘤干细胞侵袭与转移及其机制研究[D].华中科技大学,2013.
[8]罗 君,吴小翎.趋化因子CXCL12及其受体CXCR4与肿瘤的关系[J].生命的化学,2007,32(2):177.
[9]金 栋,王 琦.趋化因子CXCL12及其受体CXCR4、CXCR7与肿瘤的生物学行为[J].宁夏医科大学学报,2010,8:936.
[10]张 烨.淫羊藿素对人鼻咽癌细胞CNE-2抑制增殖、诱导凋亡及放射增敏作用的实验研究[D].中南大学,2012.
[11]罗朝辉.鼻咽癌的miRNA组学动态表达特征及miR-18a通过Dicer1介导的致癌机制研究[D].中南大学,2012.
[12]张文玲,周艳宏,肖岚,等.鼻咽癌分子标志物研究[J].生物化学与生物物理进展,2008,12 (1):7.
[13]李 刚.miR-10b在鼻咽癌转移中的功能和调控机制研究[D].南方医科大学,2009.
[14]姜润德,张立新,岳 文,等.人鼻咽癌顺铂耐药细胞系(CNE2/DDP)的建立及耐药相关基因的筛选[J].癌症,2003,4:337.
[15]黄 琛,武明花,李桂源.鼻咽癌转录组学研究的现状与进展[J].生物化学与生物物理进展,2007,4(11):1129.
[16]李国萍.不同侵袭迁移能力鼻咽癌细胞蛋白组学及转移相关基因功能研究[D].昆明医科大学,2012.
[17]陈月红.TrKB、VEGF在鼻咽癌中的表达及其调控肿瘤侵袭转移的体内体外研究[D].中南大学,2012.
[18]俞海波.EB病毒感染对microRNA-203的表达影响及其相互作用是鼻咽癌发病学的重要机制[D].中南大学,2012.
TheeffectofmiR-130a-3ponfunctionofhumannasopharyngealcarcinomacells
CNE-1bydown-regulatingtheexpressionofCXCL12LIUChun-li,ZHANGJie,QIZhi-wei,etal.
(AffiliatedHospitalofChengdeMedicalCollege,Chengde067000,China)
Objectiveto investigate the effect of miR-130a-3p on the function of human nasopharyngeal carcinoma cell CNE-1 and its possible target genes.Methodsusing liposome mediated method,analogue of miR-130a-3p (experimental group) or analogue control (control group) were transfected into CNE-1 cells,respectively using CCK-8 method and Transwell test for cell proliferation migration and invasion changes,Western Blot detection of chemokine CXCL12 protein expression.Resultscompared with the control group,the proliferation,invasion and migration ability of CNE-1 cells in the experimental group were increased (P<0.05),and the expression level of CXCL12 protein in the cells was significantly lower(P<0.05).ConclusionmiR-130a-3p may inhibit the proliferation,invasion and migration of human nasopharyngeal carcinoma cell line CNE-1 by regulating the expression of CXCL12 protein.
nasopharyngeal carcinoma;chemokines;CXCL12;miR-130a-3p;CNE-1 cells
*通讯作者
1007-4287(2017)12-2168-03
R739.6
A
2017-01-12)

