MicroRNA调控神经突触囊泡循环的研究进展
唐小林 袁伟
第三军医大学西南医院耳鼻咽喉-头颈外科(重庆400038)
MicroRNA调控神经突触囊泡循环的研究进展
唐小林 袁伟
第三军医大学西南医院耳鼻咽喉-头颈外科(重庆400038)
microRNAs(miRNAs)是一类大约含有22个核苷酸的单链非编码小分子RNA,通过对mRNA转录及稳定性的负向调控对基因表达具有重要作用。miRNAs在脑组织中大量表达,对神经元的生长发育以及神经功能的调节均发挥重要作用。神经信号传递始于神经递质从突触囊泡的释放。突触囊泡需要经历释放-回收的动态过程以维持突触前终末的结构和功能的完整性,此过程称之为囊泡循环。随着研究的深入,发现miRNA在神经突触中起着重要的作用。本文将对miRNA对神经突触囊泡循环的调节作用做一综述。
microRNA;突触;带状突触;囊泡循环
1 MicroRNA的概述
miRNA是一类广泛存在于真核系统中的非编码小RNA,在从基因表达到基因调控的整个过程中具有重要作用[1]。miRNA是由基因组转录而成,编码miRNA的基因在细胞核内经RNA聚合酶Ⅱ转录成pri-miRNA,再在Drosha酶的作用下,剪切为约70个核苷酸长度的miRNA前体(Pre-miRNA)。在Exportin5作用下,从核内运输到胞质中,在Dicer酶的作用下,被剪切成双链miRNA。随后双链miRNA中的一条miRNA结合到RNA诱导基因沉默复合物(RNA-induced silencing complex,RISC)中,形成非对称RISC复合物(asymetric RISC assembley),称为miRNP。此复合物通过miRNA与靶mRNA的3UTRs完全或不完全配对结合以使miRNP抑制mRNA翻译或降解mRNA[2-6],从而在转录后水平调控蛋白表达,起到精确调节目的基因实时表达的作用,为基因表达调控提供了最新的线索和空前有效的手段[7]。miRNA的形成和作用机制如图1所示[8]。
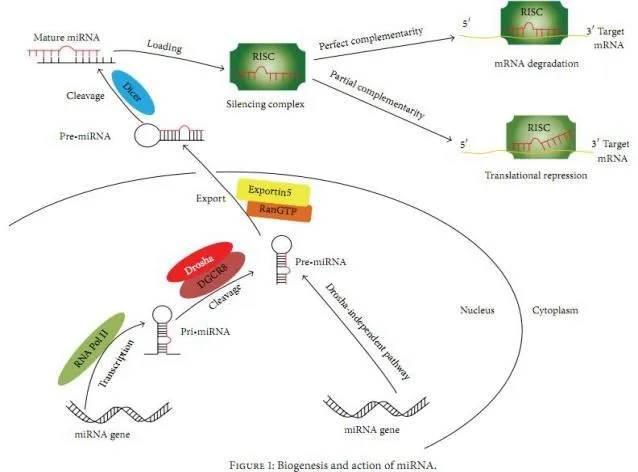
图1 miRNA的形成和作用机制Fig.1 biogenesis and action of miRNA
2 突触囊泡循环概述
突触囊泡循环是突触事件中最核心的部分,突触囊泡通过胞吐和内吞作用完成一次突触囊泡循环。当突触囊泡膜与突触前膜融合时,递质释放,即为胞吐;囊泡膜与质膜分离重新内陷,称为胞吞。突触囊泡循环主要包括以下九个步骤(如图2):锚靠、激活、融合/出胞、入胞、移位、内质体融合、出芽、神经递质摄取、囊泡移回突触前膜的活化区[9]。
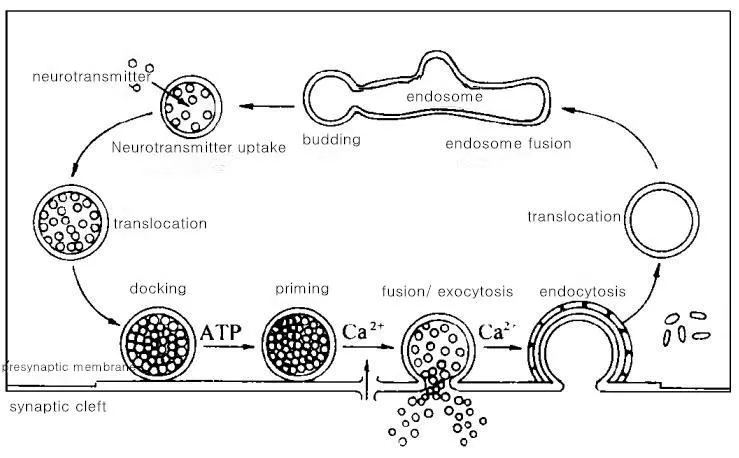
图2 突触囊泡循环Fig.2 Synaptic vesicle cycle
与经典神经-肌肉接头突触和中枢神经元常型突触相比较,还存在一种特殊的神经突触——缎带突触或称带状突触(ribbon synapse)。带状突触被发现存在于视网膜的感光细胞和双极细胞[10],以及内耳前庭毛细胞和耳蜗内毛细胞[11]。视网膜及内耳的带状突触通过紧张性释放神经递质传导不同强度的光和声音信息。与中枢神经系统突触的胞吐机制相似,带状突触囊泡释放也分为两种:快速释放池(readily releasable pool,RRP)和慢速释放池(slowly releasable pool,SRP),但是带状突触递质释放较经典海马神经元突触囊泡释放速率明显增快[12],这种释放速率上的差异可以有两种解释:(1)带状突触使突触前膜的递质释放部位聚集了更多的(约110个)可释放囊泡(RRP)[13]。而中枢神经系统的常型突触,每个活性区部位大约有100~200个突触囊泡,其中只有10~20个停靠在突触前膜的可释放部位,其余的囊泡则聚集在距突触前膜约500 nm的部位[14]。(2)带状突触终末特有的突触带结构加速了突触囊泡向递质释放部位的转运[13,15]。细胞胞吐的发生速率极快,并且保持恒定的速率在数秒内即可完成,这使得带状突触能够快速、持续地释放神经递质,这种特性保证了带状突触对刺激能够发生持续性的反应[16]。
突触囊泡循环是神经元间信息传递的桥梁,是神经系统中信息交流的一种重要方式,胞吞作用与胞吐作用的平衡对避免突触囊泡耗竭具有重要意义[17],突触循环中的任何一环出现问题,均可能会导致疾病的发生[18]。
3 microRNA调控突触囊泡循环
脑组织是miRNA的高表达区域,而Weston等人发现在已知的213种前体miRNA中,有62种在内耳中表达;在已知的344种成熟miRNA中,有102种在内耳中表达,即大概占全身miRNA总量的1/3也在内耳中有表达[19]。越来越多的证据提示miRNA介导的基因调控网络参与了早期神经系统发育到神经元功能成熟的整个过程,如MiR-124可通过调节PTBP1、SCP1及sox9等基因的表达促进神经元的分化[9];MiR-124还参与调节细胞骨架重建进而促进神经突生长[20];MiR-9可以抑制TLX的表达因而负调节神经干细胞的增殖和加速神经元的分化[21]。同样,在突触结构中存在多种miRNAs以及与miRNA分子作用机制密切相关的Ago蛋白和Dicer酶等,提示miRNA在突触囊泡循环中可能发挥重要作用[22]。
3.1 microRNA参与调节囊泡胞吐
SNARE复合体的形成为囊泡激活过程所必须,SNAP-25是三聚SNARE复合体的核心组成部分,在神经递质传递过程中,介导突触囊泡的胞吐过程。Wei,C等人[23]在斑马鱼中证实:通过苯乙烯基染料FM1-43标记突触后乙酰胆碱受体(AChR),MiR-153调控SNAP-25的表达影响运动神经元的发育、神经递质的分泌及突触的活性以此调节神经肌肉接头突触活动。MiR-153过表达显著抑制突触前末梢吸收FM1-43,囊泡循环明显减慢;相反,MiR-53下调会导致囊泡循环速率提高,这足以说明MiR-153在控制囊泡循环速率中起着重要作用。Agostini,M[24]等人证实P53家族成员Tap73在小鼠皮层神经元中能够引起MiR-34a的表达,而MiR-34a能够负性调节突触靶点蛋白包括突触结合蛋白-1(synaptotagmin-1)和突触融合蛋白-1A(syntaxin-1A)的表达,因此,MiR-34a可调节囊泡胞吐相关蛋白影响突触囊泡循环。
3.2 microRNA参与调节囊泡内吞
神经细胞进行着快速的囊泡传递而没有耗尽囊泡,主要依赖于突触囊泡在神经末梢进行着精确而快速的内吞作用。目前主要存在以下四种囊泡回收机制[25]:网格蛋白介导的内吞作用、kiss and run、bulk endocytosis以及超速内吞,其中网格蛋白介导的内吞作用是突触囊泡膜回收利用的经典途径。
网格蛋白重链(clathrin heavy chain,CLTC)、小窝蛋白1(caveolin-1)以及Rab5A蛋白都是囊泡内吞过程所必须的。MiR-199a和MiR-199b可调控网格蛋白重链、小窝蛋白1(caveolin-1)以及Rab5A蛋白的表达从而调控受体介导的内吞过程。MiR-199a-5p和MiR-199b-5p通过调节CLTC,Rab5A,Rab21的表达抑制网格蛋白介导的内吞作用,影响质膜上低密度脂蛋白受体、转铁蛋白受体的正常功能。抑制MiR-199a-5p、MiR-199b-5可增加靶基因表达和受体介导的内吞作用[26]。树突的微管相关蛋白1B(microtubule-associated protein 1B,MAP1B)是调节I型代谢型谷氨酸受体(AMPARs)内吞作用的重要物质。Chen,Y.L[27]等人证实MiR-146a-5p通过调节MAP1B蛋白质的合成,抑制AMPARs的内吞,导致突触传递的下降,揭示了MiR-146a-5p通过抑制MAP1B蛋白合成调节突触传递过程。
3.3 microRNA参与调节囊泡传递
树突棘是神经元之间形成突触的主要部位,是神经元接受其他细胞信号传入的部位。树突棘的形态、数量、大小与突触功能密切相关[28]。Dicer酶是miRNA合成所需的重要RNA酶,且主要存在于树突棘中,尤其是突触后致密体中[29]。研究表明[30],将小鼠前脑Dicer基因敲除,可以导致小鼠海马MiR-124,MiR-132,MiR-137,MiR-138,MiR-29a等多个miRNA表达量下降,与此同时小鼠表现出学习记忆等功能的明显改善。其机制可能是下调的miRNA通过上调其突触靶蛋白的表达,影响了海马突触传递过程。MiR-134是被发现的第一个在哺乳类动物树突上调节局部蛋白合成的miRNA,Schratt,G.M[31,32]的研究表明MiR-134的靶基因是LIM区域激酶1(LIM-domain kinase 1,Limk1)的mRNA,它编码一种激酶,通过抑制肌动蛋白解聚因子来调控肌动蛋白丝的动态平衡,以此影响树突棘的形态。当MiR-134抑制Limkl的mRNA翻译时,树突棘变小[33],对突触传递起负性调节作用。而脑源性神经营养因子(brain-derive netrophic factor,BDNF)信号通路可以解除Limk l的抑制,诱导树突棘生长[32],从而对突触传递起到正向调节作用。Smrt,R.D等人的研究也证实MiR-137可以通过影响在神经发育过程中发挥重要作用的泛素连接酶MIB1(Mind bomb one),调节神经元的成熟和树突的形态发生,从而影响突触传递的过程[33]。
神经纤维毛蛋白2(neuropilin-2,Nrp-2)是脑信号蛋白3F的受体,是突触结构和树突棘发育的负性调节因子。MiR-188在小鼠海马神经元长时程电位发生时出现表达上调,Nrp-2的表达受抑制且导致兴奋性突触后电流频率和树突密度减少,因此,MiR-188通过抑制Nrp-2的表达而调控基础突触传递及对神经元树突可塑性的调控[34]。MiR-132/212被认为在免疫和神经功能中起着重要作用,在MiR-132/212双敲出小鼠模型证实,MiR-132/212的敲出使小鼠海马和皮层基底部的突触传递减少,导致兴奋性突触后电位振幅改变,这一改变很可能与突触后AMPA受体数量减少有关。MiR-132/212可能通过影响突触后AMPA受体数量而调节突触的功能[35]。
4 microRNA与内耳疾病
近些年来,miRNA在许多内耳疾病的发生与发展中的重要作用已逐渐明确[36,37],而miRNA作为治疗因子的潜在作用也在内耳疾病模型中逐步被证明[38]。miRNA参与胚胎发育时期内耳的形成与出生后内耳功能的维持。GUO等人[39]用Two Class Diff法检测发现18种miRNAs在新生小鼠和成年小鼠差异性表达,KERSIGO等人[40]构建的Foxg1-Cre介导的Dicer1敲除模型揭示内耳的正常发育强烈依赖miRNA的正常成熟,干扰miRNA的产生,会导致内耳结构缺失以及听功能障碍。MiR-124调控内耳螺旋器上细胞类型的分化[41],MiR-96种子序列的点突变导致非综合征型进行性听力损失[42];MiR-34a/SIRT1/p53信号通路的激活促使耳蜗毛细胞凋亡[43],MiR-34a和MiR-34c在抗生素诱导的耳毒性中与耳蜗毛细胞呈剂量依赖性[44];噪声暴露下血浆MiR-16-5p,MiR-24-3p,MiR-185-5p,和MiR-451a水平上升[45],而噪声诱导的耳聋动物模型中MiR-183家族表达明显上调,这表明miR-183家族或许在噪声性听力损失的发生和发展中起着重要作用[46]。保护螺旋神经元免于退化是预防渐进性听力损失的关键步骤,以miRNA为基础的措施可以用来防止或者逆转螺旋神经元的损害。过表达MiR-204下调TMPRSS3(跨膜蛋白酶丝氨酸3)已经被报道对螺旋神经元的发育必不可少。因此,改变MiR-204或许可以作为感音神经性耳聋潜在的治疗靶点[47]。目前,miRNAs用于乳腺癌、风湿性疾病、丙型肝炎病毒感染的治疗已进入Ⅱ期临床试验[38],内耳毛细胞突触囊泡循环障碍是感音神经性耳聋发病机制中的重要一环,明确microRNA调控突触囊泡的循环过程也必将会为感音神经性耳聋的治疗提供更多靶点。
5 小结
突触传递是研究神经信息处理、传递的神经生物学的中心问题。近几年的研究表明miRNA的表达及功能异常与突触囊泡循环过程密切相关。miRNA可以影响突触囊泡运输、胞吐和胞吞的任何一个过程。然而,目前miRNA对突触囊泡循环的调节还只停留在生理机制的研究,在未来的研究中仍然还有许多问题需要深入探讨,需要发现更多的对突触囊泡循环具有调节作用的潜在miRNA,揭露更多的作用机制,进一步完善其调控网络,为一些神经系统的疾病的诊断治疗开辟新的途径。
1Ambros V.The Functions of Animal MicroRNAs[J].Nature,2004.431(7006):350-5.
2Berezikov E,Thuemmler F,Van Laake L,et al.Diversity of MicroRNAs in Human and Chimpanzee Brain[J].Nat Genet,2006.38(12):1375-7.
3Wulczyn FG,Smirnova L,Rybak A,et al.Post-transcriptional Regulation of the let-7 MicroRNA during Neural Cell Specification[J].FASEB J,2007.21(2):415-26.
4Cui Q,Yu Z,Pan Y.MicroRNAs Preferentially Target the Genes with High Transcriptional Regulation Complexity[J].Biochem Biophys Res Commun,2007.352(3):733-8.
5Kosik,KS.The Neuronal MicroRNA System[J].Nat Rev Neurosci,2006.7(12):911-20.
6Lee EJ,Baek M,Gusev Y.Systematic Evaluation of MicroRNA Processing Patterns in Tissues,Cell Lines,and Tumors[J].RNA,2008.14(1):35-42.
7Cao X,Yeo G,Muotri AR,et al.Noncoding RNAs in the Mammalian Central Nervous System[J].Annu Rev Neurosci,2006.29:77-103.
8Ye Y,Xu H,Su X.Role of MicroRNA in Governing Synaptic Plasticity[J].Neural Plasticity,2016.2016:1-13.
9李云,张志文,神经元突触囊泡循环的分子机理[J].生理科学进展,1997(04):第31-35页.Li Y,Zhang ZW,Molecular Mechanism of Neuronal Synaptic VesicleCycling[J].AdvancesinPhysiologicalSciences,1997(04):31-35.
10Tom Dieck S,Brandstätter JH.Ribbon Synapses of the Retina[J].Cell and Tissue Research,2006.326(2):339-346.
11Wichmann C,Moser T.Relating Structure and Function of Inner Hair Cell Ribbon Synapses[J].Cell Tissue Res,2015.361(1):95-114.
12Gomis A,Burrone J,Lagnado L.Two Actions of Calcium Regulate the Supply of Releasable Vesicles at the Ribbon Synapse of Retinal Bipolar Cells[J].J Neurosci,1999.19(15):6309-17.
13Von Gersdor ff H,Vardi E,Matthews G,et al.Evidence that Vesicles on the Synaptic Ribbon of Retinal Bipolar Neuron can be Rapidly Released[J].Neuron,1996,16:1221~1227.
14Burns ME,Augustine GJ.Synaptic Structure and Function:Dynamic Organization Yields Arthitectural Precision[J].Cell,1995,83:187~194.
15Von Gersdorff H,Matt hews G.Electrophysiology of Synaptic Versicle Cycling[J].Annu Rev Physiol,1999,61:725~752
16Parsons TD,Sterling P.Synaptic Ribbon.Conveyor Belt or Safety Belt?[J].Neuron,2003.37(3):379-82.
17Wu LG,Ryan TA,Lagnado L.Modes of Vesicle Retrieval at Ribbon Synapses,Calyx-type Synapses,and Small Central Synapses[J].J Neurosci,2007.27(44):11793-802.
18Luo Z.Synapse Formation and Remodeling[J].Sci China Life Sci,2010.53(3):315-21.
19李新新,刑光前,郭维维等,MicroRNA与哺乳动物内耳发育[J].中华耳科学杂志,2013,11(1):138-144.Li XX,Xing GQ,Guo WW,et al.MicroRNAs and Mammalian Inner Ear Development[J].Chinese Journal of Otology,2013,11(1):138-144.
20Yu JY,Chung KH,Deo M.MicroRNA miR-124 Regulates Neurite Outgrowth during Neuronal Differentiation[J].Exp Cell Res,2008.314(14):2618-33.
21Zhao C,Sun G,Li S.A Feedback Regulatory loop Involving MicroRNA-9 and Nuclear Receptor TLX in Neural Stem Cell Fate Determination[J].Nat Struct Mol Biol,2009.16(4):365-71.
22金雪峰,微小RNA在药物成瘾中的作用研究进展[J].国际药学研究杂志,2013(5),519-524.Jin XF,The Progress of MicroRNA in Drug Addiction.Journal of International Pharmaceutical Research[J],2013(5),519-524.
23Wei C,Thatcher EJ,Olena AF.MiR-153 Regulates SNAP-25,Synaptic Transmission,and Neuronal Development[J].PLoS One,2013.8(2):e57080.
24Agostini M,Tucci P,Steinert JR.MicroRNA-34a Regulates Neurite Outgrowth,Spinal Morphology,and Function[J].Proc Natl Acad Sci U S A,2011.108(52):21099-104.
25张妮,王世伟,苟兴春,突触囊泡内吞的分子机制[J].海南医学,2014(16):2404-2407.Zhang N,Wang SW,Xun XC,Molecular Mechanism of Synaptic VesicleEndocytosis[J].HainanMedicalJournal,2014(16):2404-2407.
26Aranda JF,Canfran-Duque A,Goedeke L.The miR-199-dynamin Regulatory Axis Controls Receptor-mediated Endocytosis[J].J Cell Sci,2015.128(17):3197-209.
27Chen YL,Shen CK.Modulation of mGluR-dependent MAP1B Translation and AMPA Receptor Endocytosis byMicroRNA miR-146a-5p[J].J Neurosci,2013.33(21):9013-20.
28Lee KF,Soares C,Beique JC.Examining Form and Function of Dendritic Spines[J].Neural Plast,2012.2012:704103.
29Lugli G,Larson J,Martone ME.Dicer and eIF2c are Enriched at Postsynaptic Densities in Adult Mouse Brain and are Modified by Neuronal Activity in a Calpain-dependent Manner[J].J Neurochem,2005.94(4):896-905.
30Konopka W,Kiryk A,Novak M.MicroRNA Loss Enhances Learning and Memory in Mice[J].J Neurosci,2010.30(44):14835-42.
31Schratt GM,Tuebing F,Nigh EA.A Brain-specific MicroRNA Regulates Dendritic Spine Development[J].Nature,2006.439(7074):283-9.
32Schratt GM,Nigh EA,Chen WG.BDNF Regulates the Translation of a Select group of mRNAs by a Mammalian Target of Rapamycin-phosphatidylinositol3-kinase-dependentPathwayduring Neuronal Development[J].J Neurosci,2004.24(33):7366-77.
33Smrt RD,Szulwach KE,Pfeiffer RL.MicroRNA miR-137 Regulates Neuronal Maturation by Targeting Ubiquitin Ligase Mind Bomb-1[J].Stem Cells,2010.28(6):1060-70.
34Lee K,Kim JH,Kwon OB.An Activity-regulated MicroRNA,miR-188,Controls Dendritic Plasticity and Synaptic Transmission by Downregulating Neuropilin-2[J].J Neurosci,2012.32(16):5678-87.
35Remenyi J,Van den Bosch MW,Palygin O.MiR-132/212 Knockout Mice Reveal Roles for these miRNAs in Regulating Cortical Synaptic Transmission and Plasticity[J].PLoS One,2013.8(4):e62509.
36Mahmoudian-Sani MR,Mehri-Ghahfarrokhi A,Ahmadinejad F.MicroRNAs:Effective Elements in Ear-related Diseases and Hearing Loss[J].Eur Arch Otorhinolaryngol,2017.
37Doetzlhofer A,Avraham KB.Insights into Inner Ear-specific Gene Regulation:Epigenetics and Non-coding RNAs in Inner Ear Development and Regeneration[J].Semin Cell Dev Biol,2016.
38Ushakov KA,Rudnicki,Avraham KB.MicroRNAs in Sensorineural Diseases of the Ear[J].Front Mol Neurosci,2013.6:52.
39Guo WW,Yuan YY,Hou ZH,et al.Profiles of the Auditory Epithelia Related MicroRNA Expression in Neonatal and Adult Rats[J].Eur J Med Res,2014.19:48
40Kersigo J,D'Angelo A,Gray BD.The Role of Sensory Organs and the Forebrain for the Development of the Craniofacial Shape as Revealed by Foxg1-cre-mediated MicroRNA Loss[J].Genesis,2011.49(4):326-41.
41Friedman LM,Avraham KB.MicroRNAs and Epigenetic Regulation in the Mammalian Inner Ear:Implications for Deafness[J].Mamm Genome,2009.20(9-10):581-603.
42Mencia A,Modamio-Hoybjor S,Redshaw N.Mutations in the Seed Region of Human miR-96 are Responsible for Nonsyndromic Progressive Hearing Loss[J].Nat Genet,2009.41(5):609-13.
43Xiong H,Pang J,Yang H.Activation of miR-34a/SIRT1/p53 Signaling Contributes to Cochlear Hair Cell Apoptosis:Implications for Age-related Hearing Loss[J].Neurobiol Aging,2015.36(4):1692-701.
44Yu L,Tang H,Jiang XH.Involvement of Calpain-I and MicroRNA34 in Kanamycin-induced Apoptosis of Inner Ear Cells[J].Cell Biol Int,2010.34(12):1219-25.
45Ryan AF,Harris JP,Keithley EM.Immune-mediated Hearing Loss:Basic Mechanisms and Options for Therapy[J].Acta Otolaryngol Suppl,2002(548):38-43.
46Zhang Z,Liu K,Chen Y,et al.The Expression of miR-183 Family in the Pathogenesis and Development of Noise-induced Deafness[J].J Clin Otorhinolaryngol Head Neck Surg,2014.28(7):468-472
47Li Y,Peng A,Ge S.MiR-204 Suppresses Cochlear Spiral Ganglion Neuron Survival in Vitro by Targeting TMPRSS3[J].Hear Res,2014.314:60-4
Progress of Research on MicroRNAin Regulating Synaptic Vesicle Recycling
TANG Xiaolin,YUAN Wei
Department of Otolaryngology Head and Neck Surgery,Southwest Hospital,
Third Military Medical University,Chongqing,400038
Corresponding author:YUAN WeiEmail:weiyuan175@sina.com
MicroRNAs(miRNAs)are a class of small22 nucleotides noncoding RNAs that regulate the expression of genes based on the transcription of mRNA and the negative control of stability.miRNAs are abundant in the brain,where they play key roles in neuron growth and development and in regulation of neural function.Neurotransmission begins with the release of neurotransmitters from synaptic vesicles.Synaptic vesicles endure the dynamic"release-recycle"process to maintain the function and structure of presynaptic terminal.Advancing research has found that miRNA plays an significant role in neural synapsing.This review focuses on miRNAs in regulating synaptic vesicle recycling.
MicroRNA;Synapse;Ribbon Synapse;Vesicle Cycle Declaration of interest:The authors report no conflicts of interest.
This study was supported by the National Natural Science Foundation of China(81470694、81271080),Chongqing Municipal Science and Technology Commission of the people's livelihood special funding(cstc2016shmszx130058),and the project of Southwest Hospital(JCZD-39).
R764
A
1672-2922(2017)05-575-5
10.3969/j.issn.1672-2922.2017.015.
国家自然基金资助,项目编号:81470694、81271080;重庆市科委民生专项资助,项目编号:cstc2016shmszx130058;西南医院院管课题,项目编号:JCZD-39.
唐小林,硕士研究生在读,研究方向:耳科学
袁伟,Email:weiyuan175@sina.com
2017-01-10审核人:郭维维)

