EGB761对脉冲所致噪声性聋大鼠内耳形态及功能影响的研究
董颖婕 吴玮, 王刚 韩浩伦 张弛 刘旭 屈昌北 刘钢
1北京大学解放军306医院教学医院(北京100101)
2解放军306医院耳鼻咽喉头颈外科(北京100101)
3中国航天员科研训练中心(北京100101)
EGB761对脉冲所致噪声性聋大鼠内耳形态及功能影响的研究
董颖婕1吴玮1,2王刚2韩浩伦2张弛2刘旭2屈昌北2刘钢3
1北京大学解放军306医院教学医院(北京100101)
2解放军306医院耳鼻咽喉头颈外科(北京100101)
3中国航天员科研训练中心(北京100101)
目的探究银杏叶提取物(Ginkgo biloba extract,EGB761)对脉冲所致噪声性聋的大鼠内耳ABR阈值、毛细胞核染色、及锰超氧化物歧化酶(Manganese superoxide dismutase,Mn-SOD)活性的影响。方法80只SD大鼠随机分为2组:空白对照组20只、实验组60只。实验组大鼠均给予声压级为150dB脉冲噪声,脉宽为30ms,重复率为1/min,连续3发。脉冲噪声暴露后随机分成暴露即刻组、生理盐水组和EGB761组。EGB761组腹腔注射金纳多4ml/kg,2/日,连续注射7天;生理盐水组腹腔注射生理盐水4ml/kg,2/日,连续注射7天。结果听觉脑干反应(Auditory Brain-Stem Response,ABR)结果显示噪声暴露后实验组大鼠ABR阈值显著高于暴露前,差异有统计学意义(P<0.01),各实验组大鼠间无统计学差异(P>0.05)。治疗7天后,生理盐水组及EGB761组大鼠ABR阈值均下调,EGB761组大鼠ABR阈移明显高于生理盐水组,差异有统计学意义(P<0.05)。免疫荧光结果显示空白对照组大鼠内耳底回外毛细胞细胞核排列整齐;噪声暴露即刻组大鼠内耳底回外毛细胞核排列稀疏,较正常对照组缺失明显增多,但仍以点状缺失为主;生理盐水组底回外毛细胞核缺失明显,且出现片状缺失,较暴露即刻组损伤严重;EGB761组较生理盐水组底回外毛细胞核排列稀疏散乱,但缺失明显减少,以点状缺失为主。Mn-SOD结果显示噪声暴露即刻组内耳Mn-SOD活性与空白对照组无统计学差异(P>0.05);生理盐水组Mn-SOD活性显著低于暴露即刻组,差异有统计学意义(P<0.01),EGB761组Mn-SOD活性明显高于生理盐水组,差异有统计学意义(P<0.05)。结论EGB761能明显改善脉冲所致噪声性聋的听功能下降、减少毛细胞消失及氧化应激反应,对脉冲所致噪声性聋的预后意义显著。
噪声性聋;听性脑干反应;锰超氧化物歧化酶;银杏叶提取物
噪声污染已位列世界七大公害之首,噪声危害已成为现代社会最主要的危害之一,严重影响人类的身心健康,尤其特异性的损伤听觉系统。噪声所致的感音神经性聋已成为耳鼻喉科最常见的疾病之一,高频听力易损是其最显著的特点。以往研究显示,感音神经性聋的发生与内耳感觉神经细胞的氧化应激损伤关系密切。[1]脉冲所致噪声性聋是一种暴露于多次突发性的强烈噪声后所引起的一种不可逆的听力损伤,为感音神经性聋的一种,目前仍无确切的治疗方案。金纳多作为临床常规治疗突发性耳聋的特效药,不仅可降低血管张力,拮抗血小板活化因子(platelet activating factor,PAF),减少红细胞及血小板聚集,增加红细胞变形性,从而改善内耳血液循环,还可以增加组织细胞对缺氧的耐受,稳定脂质膜,保护线粒体氧化呼吸等,从而改善组织代谢,促进神经功能恢复。[2]其成分银杏黄酮甙萜类内酯还具有清除自由基的作用,能有效地抑制细胞膜脂质的过氧化损伤。[3-4]因此,本研究着眼于观察EGB761对脉冲所致噪声性聋大鼠耳蜗内耳Mn-SOD活性的影响来探讨其临床疗效及作用机制。
1 材料与方法
1.1 实验动物及分组选取健康雄性SD大鼠80只,体重180~200g,(由北京市海淀区兴隆实验动物养殖场提供),耳廓反射灵敏,鼓膜标志清晰,无强噪声暴露及耳毒性药物使用史。实验前对所有大鼠进行听性脑干反应(ABR)阈值检测,未见明显差异。将80只大鼠随机分成两组,空白对照组20只,实验组60只,实验组大鼠给予噪声暴露后随机分成暴露即刻组、生理盐水对照组和EGB761组各20只,并检测ABR阈值。暴露即刻组检测ABR阈值后立即取材;EGB761组腹腔注射金纳多4ml/kg,2/日,连续注射7天,所用金纳多为台湾济生化学制药厂股份有限公司生产,批号为K8082,每支5ml,含有银杏叶提取物17.5mg,其中银杏黄酮苷4.2mg。;生理盐水组腹腔注射生理盐水4ml/kg,2/日,连续注射7天。注射结束后,两组大鼠分别检测ABR阈值后取材。
1.2 噪声暴露方法
脉冲噪声为猝发声,即刻便达到最大峰值,经一系列振荡波动至静压力,实验中,脉冲噪声由气动激波管产生,测量传声器为BK4136(丹麦Bruel&Kjaer公司),声级计为精密脉冲声级计BK2209(丹麦Bruel&Kjaer公司)测量,采用数字示波器TDS2022(泰克公司)记录脉冲波形,测量得到峰值声压级为150dBpeak,有效持续时间为30ms,总计为3发,重复间隔为1min。大鼠置于气动激波管管口正前方1米。
1.3 ABR阈值测试
所有大鼠在实验前均进行ABR阈值检测。噪声暴露后即刻进行ABR阈值测试。采用咪唑安定(80mg/kg)和盐酸赛拉嗪注射液(200mg/kg)肌肉注射麻醉(麻醉深度为角膜反射消失,必要时给予总量的20%-30%维持),应用听性脑干反应仪在隔声静电屏蔽室内双耳分别检测短声诱发(滤波带宽80~3000Hz,叠加次数1024次,扫描10ms)的ABR阈值。刺激强度是5~97dB SPL。间隔5dB,以“重复性好,比较稳定的Ⅲ波”为标准判定反应阈值。电极设置为:颅顶为记录极,测试耳为参考极,鼻尖处为地线。测试及麻醉复苏过程中保持环境温度为38℃左右并保持大鼠体温恒定。
1.4 动物取材
鼠断头迅速取耳蜗,在解剖显微镜下于4%多聚甲醛液中摘除镫骨,用游丝镊于蜗顶钻一小孔,进行灌流并固定,4℃冰箱过夜。用PBS(Phosphate buffer saline)漂洗3次,每次5分钟。10%EDTA(Ethylene diaminetetraacetic acid)脱钙2周,物理法测定脱钙终点。以备免疫荧光检测。鼠断头取耳蜗后,在解剖显微镜下于生理盐水(0.9%NaCl,含有0.16mg/ml肝素钠)中摘除镫骨,进行灌流。两对耳蜗为一个单位,加入4℃PBS在4℃进行匀浆。随后匀浆液4℃离心,取上清。用于Mn-SOD的检测。
1.5 免疫荧光检测方法及观察
将脱钙后的耳蜗在解剖显微镜下用游丝镊于PBS溶液中剥出基底膜置于EP管中。PBS溶液漂洗3次,每次5分钟;用1ml注射器吸出PBS溶液,加入5%BSA溶液,常温封闭30分钟。PBS溶液漂洗3次,每次5分钟,置于4℃冰箱过夜。次日,PBS溶液漂洗3次,每次5分钟;避光条件下进行后续试验,吸出PBS溶液,加入DAPI溶液10分钟,PBS溶液漂洗3次,每次5分钟;结束后,基底膜平铺于载玻片上,进行封片,标本制作完毕。
将载玻片置于PALM荧光显微镜Apo Tome模式下,40倍观察DAPI,激发波长为405 nm,410-490 nm接收。对所观察区域的毛细胞进行Z-stack扫描,扫描层距为2.0 μm。
1.6 Mn-SOD检测方法
用碧云天试剂盒SOD检测缓冲液将上清液稀释20倍。将Cu/Zn-SOD(Copper zinc superoxide dismutase)抑制剂A和稀释后的上清液按1:24的体积比,在离心管内或96孔板中混合好,37℃孵育1小时;取20微升Cu/Zn-SOD抑制剂B加入到780微升水中,混匀,即进行40倍稀释。然后将已经40倍稀释的Cu/Zn-SOD抑制剂B和上述混合物再按1:25的体积比混合均匀,37℃再孵育15分钟。使用96孔板设置样品孔和各种空白对照孔。并依次加入待测样品和其它各种溶液。加入反应启动工作液后充分混匀。37℃孵育30分钟。在450nm测定吸光度。计算上清液中Mn-SOD活力。
实验过程严格根据碧云天试剂盒说明说进行,实验步骤详见说明书。
1.6 统计学方法
数据采用SPSS 19.0统计学软件处理,暴露前、后组间ABR阈值比较采用方差分析,组内自身比较采用配对样本T检验,给药后组间ABR阈移比较采用独立样本T检验比较,组间Mn-SOD活性两两比较采用独立样本T检验,P<0.05差异有统计学意义。

表1 各组大鼠暴露前后ABR阈值(dB SPL)Table 1ABR threshold of rats in each group before and after exposure(dB SPL)
2 结果
2.1 各组大鼠ABR反应阈值及阈移比较(见表1、2)
两组ABR阈移以均值±标准差的方式表示。实验前测ABR阈值各组大鼠均无异常,组间无统计学差异(F=1.22,P=0.12)。脉冲噪声暴露即刻后实验组大鼠ABR阈值显著高于噪声暴露前,差异有统计学意义(T=-17.52,P<0.01),各实验组大鼠间无统计学差异(F=1.01,P=0.37)。治疗7天后,生理盐水组及EGB761组ABR阈值均下调,EGB761组大鼠ABR阈移明显高于生理盐水组(T=0.24,P=0.02)。
2.2 各组大鼠底回外毛细胞免疫荧光结果
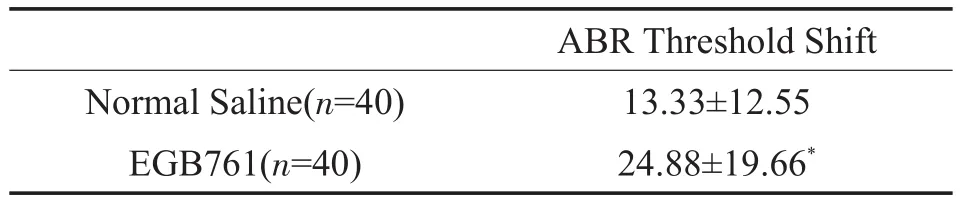
表2 各实验组大鼠给药前后ABR阈移(dB SPL)Table 2 Threshold shift ofABR in rats in experience groupsbefore and after injection(dB SPL)

图1 为各组大鼠耳蜗底回外毛细胞核形态学变化(DAPI染色,200x)(a)空白对照组,外毛细胞核排列整齐,偶见细胞核缺失;(b)暴露即刻组,外毛细胞核排列稍稀疏,细胞核缺失增多,仍以散在点状缺失为主(c)生理盐水组,外毛细胞核排列稀疏,出现大面积片状缺失;(d)EGB761组,外毛细胞排列稀疏散乱,有散在的点状缺失。Fig.1 is the morphological changes of the outer hair nuclei of the basal body(DAPI staining,200X)in each group of rats.(a)blank control group,the outer hair nuclei were arranged regularly and the nucleus was absent occasionally;(b)noise exposed immediate group,the outer hair nuclei were slightly sparse and the nuclei were absent,mainly scattered,punctate deletion.(c)normal saline group,the outer hair nuclei were sparse and large patchy deletion occurred.(d)EGB761 group,the outer hair cells are sparse and scattered,scattered punctate deletion.
以往研究表明,脉冲噪声对大鼠内耳毛细胞损伤主要以外毛细胞缺失为主,且以底回损伤最为严重,顶回损伤最轻。主要表现为外毛细胞的细胞核缺失。因此本实验主要针对大鼠内耳外毛细胞作为研究对象,观察其细胞核的损伤情况。可见,空白对照组大鼠内耳外毛细胞底回细胞核排列整齐,偶见细胞核缺失;噪声暴露即刻组大鼠内耳外毛细胞核排列稍显稀疏,较正常对照组缺失明显增多,但仍以点状缺失为主;生理盐水组外毛细胞核缺失明显,且出现大片状缺失,较暴露即刻组损伤严重,EGB761组外毛细胞核排列稀疏散乱,有散在缺失,为点状缺失,较生理盐水组缺失少。
2.3 各组大鼠内耳Mn-SOD活性结果

表3 各组大鼠Mn-SOD活性情况Table 3 Activity of Mn-SOD in rats of each group
各组Mn-SOD活性均以均值±标准差的方式表示。噪声暴露即刻组内耳Mn-SOD活性与空白对照组无统计学差异(T=-0.68,P=0.51);生理盐水组Mn-SOD活性显著低于暴露即刻组,差异有统计学意义(T=-9.27,P<0.01),EGB761组Mn-SOD活性明显高于生理盐水组,差异有统计学意义(T=-3.53,P=0.01)。
3 讨论
抗氧化酶类自由基清除剂是体内最的抗自由基机体保护剂,主要包括超氧化物歧化酶(super-oxide dismutases,SODs)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)。其中,SODs是体内抗氧化防御系统的第一道防线[5],目前在哺乳动物中己发现3种不同的SOD亚单位:Cu/Zu-SOD和Mn-SOD。Cu/Zn-SOD,也可称为SODI,位于细胞质区内,分子量为32,000Da,有两个蛋白质亚单位,存在于哺乳动物的细胞质、细胞核和溶酶体中。Mn-SOD,也称为SOD2,主要存在于原核生物和真核生物线粒体内,分子量为40,000Da(1D=1u),含有4个蛋白质亚单位,其活性中心含有Mn离子[5-7]。其中,Mn-SOD在体内外抗氧化损伤保护中发挥重要作用,是最重要的抗氧化酶[8],其紧靠线粒体电子传递链,是线粒体内唯一能把超氧阴离子(O2-)转化为H2O2的酶。而GSH-Px和CAT分解为水和氧气,最终使细胞无毒化[6,9-10]。
活性氧自由基(Reactive oxygen species,ROS)是细胞凋亡的信使分子和效应分子,是细胞氧化损伤的首先表现。ROS直接引起脂质过氧化反应和DNA过氧化反应,对细胞持续造成伤害[11],严重的可导致毛细胞凋亡并引起感音神经性聋[12],同时,也显著降低Mn-SOD活性。细胞产生ROS的主要部位是线粒体,耳蜗由于氧代谢旺盛,极易遭受ROS的损伤[13]。耳蜗线粒体ROS过表达,血流量减少是造成噪声暴露后耳蜗损伤的最重要的原因[14]。噪声暴露过程中,除机械损伤外,强烈的氧化代谢活动也引起耳蜗感觉神经细胞损伤。此过程中,内耳听毛细胞过度驱动、耳蜗血流量减少增加了细胞内无氧酵解,过多的ROS直接引起脂质和DNA过氧化反应,对细胞持续造成损害[11],严重的可导致兴奋性神经细胞肿胀、毛细胞发生坏死和凋亡,引起感音神经性听力损失[12,15]。
本实验结果显示,暴露即刻组Mn-SOD活性较正常组没有统计学差异(P>0.05)。即刻组ABR阈值暴露前ABR阈值显著升高,差异有统计学意义(P<0.01),可能噪声暴露即刻内耳损伤主要以机械性损伤为主,冲击力借助听骨链、前庭窗使内淋巴剧烈波动,造成蜗窗膜破裂,螺旋器、毛细胞和听神经损伤。以往研究表明,噪声对大鼠内耳底回损伤最早且最严重,因此,本实验主要观察耳蜗底回毛细胞损伤情况。可见耳蜗底转外毛细胞核排列稀疏、散乱,核缺失较正常对照组明显增多,但仍以点状缺失为主。暴露即刻大鼠内耳ROS虽开始增多,由于时间短暂,并未打破ROS/SOD的平衡,Mn-SOD活性未受影响。随着时间的推移,内耳机械性损伤的同时,代谢性损伤也逐渐加重,内耳ROS不断堆积,内生性SOD不足以清除过多的过氧化物,导致其大量积蓄,从而打破原有的ROS/SOD平衡,使线粒体膜性物质受损,致功能障碍,同时,又进一步增加ROS的蓄积以及抗氧化酶系生成减少和消耗增多。过多的ROS降低Mn-SOD活性,进一步诱导毛细胞的凋亡坏死,导致外毛细胞出现片状缺失,尤以底回外毛细胞损伤最早且最重,此与前人的研究一致。治疗7天后,生理盐水组较暴露即刻组Mn-SOD活性显著下降,差异有统计学意义(P<0.01)。并可见该组大鼠ABR阈值下调,但较暴露即刻组没有恢复的趋势,差异无统计学意义(P>0.05),大鼠内耳底回生理盐水组外毛细胞核缺失明显,且出现片状缺失,较暴露即刻组损伤明显严重。
EGb761(金纳多)为银杏叶提取物,其主要有效成分为银杏黄酮苷(flavonoid-glycoside)、银杏内酯(ginkgolides)和白果内酯(bilobalide)[16]。以往研究表明,EGB761具有广泛的生物学效应[2]。其主要成分银杏黄酮甙萜类内酯是有效的自由基清除剂,能够清除体内过多的ROS,降低内耳氧化应激反应,有效的抑制细胞膜脂质的过氧化损伤,保护细胞膜[3-4],从而保护内外毛细胞、支持细胞及神经细胞,增强内耳神经细胞代偿功能和代谢活性[17],同时,其成分银杏内酯可拮抗血小板活化因子,抑制血小板的聚集[18],可降低血管张力,降低血管壁通透性,增加组织血流量,预防内耳微血栓的形成,显著改善耳蜗内血液循环以及前庭系统血供,减轻内耳缺血、缺氧状态,同时可减轻毛细血管通透性,改善内耳组织水肿,并且可以提高内耳组织细胞葡萄糖和氧气的利用率,提高内耳生存能力。本次实验显示,腹腔注射7天后,EGB761组较生理盐水Mn-SOD活性明显升高,差异有统计学意义(P=0.01),可以表明,EGB761在增强Mn-SOD的活性方面效果显著。该组大鼠ABR阈值下调较生理盐水组明显,阈移明显高于生理盐水组,差异有统计学意义(P=0.02),免疫荧光显示其底回外毛细胞缺失明显轻于生理盐水组,可见Mn-SOD活性的增强,有效清除了毛细胞内外的ROS,减少氧化应激对外毛细胞的损伤,从而提高了外毛细胞的存活率,使听力得以恢复,此与前人的研究结果一致。但其底回外毛细胞排列仍显稀疏,散乱,可能EGB761给药后仍需要更长时间的恢复。EGB761作为治疗耳聋耳鸣的药物在临床治疗中已经引起广泛的共识,应用中未发现严重的不良反应,其在内耳氧化应激反应中明显增强Mn-SOD活性,有效的提高了内耳外毛细胞的存活率,对听力恢复作用效果显著。
1崔勇,何亚,武瑾等.Mn-SOD在螺旋神经节区域分布差异与噪声性听力损伤的关系[J].中华耳科学杂志,2013,11(01):107-111.[2017-08-15].Cui Y,He Y,Wu J,et al.Differential Distribution of Mn-SOD in Spiral Qanglion Region and Its Relation to Noise Induced Hearing Loss[J].Chinese Journal of Otology,2013,11(01):107-111.[2017-08-15].
2Hoyer S.Damaged Neuronal Energy Metabolism and Behavior are Improved by Ginkgo Biloba Extract(Egb761)[J].J Neural T Ransm,1999,106(11-12):1171-1188[11-13]
3高树玲,赵海霞.胞二磷胆碱与依达拉奉联合治疗急性脑梗塞的疗效观察[J].内蒙古中医药,2014,33(7):4-5.Gao SL,Zhao HX.Clinical Observation of Combined Treatment of Two Citicoline and Edaravone in Acute Cerebral Infarction[J].Nei Mongol Journal of Traditional Chinese Medicine,2014,33(7):4-5.
4徐光华.中西医结合治疗脑梗塞临床疗效观察[J].内蒙古中医药,2014,33(6):77.Xu GH.Clinical Observation on Treatment of Cerebral Infarction with Integrated Traditional Chinese and Western Medicine[J].Nei Mongol Journal of Traditional Chinese Medicine,2014,33(6):4-5.
5Zelko IN,Mariani TJ,Folz RJ.Superoxide Dismutase Multigene Family:acomparisonoftheCu/Zn-SOD(SOD1),Mn-SOD(SOD2),and EC-SOD(SOD3)Genestructures,Evolution,and Expression[J].Free Radic Biol Med,2002,33(3):337-349
6Warner BB,Stuart L,Gebb S,et al.Redox Regulation of Man-ganese Superoxide Dismutase[J].Am J Physiol,1996,271(1 Pt1):L150-158
7Young IS,Woodside JV,Antioxidants in Health and Disease.J Clin Pathol 2001 Mars;54(3):176-86
8White J A,Burgess B J,Hall R D,et al.Pattern of Degeneration of The Spiral Ganglion Cell and Its Processes in The C57BL/6J Mouse.Hear Res,2000,141(1-2):12-18.
9吴雄辉,孙红.超氧化物歧化酶与氧化应激相关内耳疾病的研究进展.现代生物医学进展.2010.(15).2982-2985 Wu XH,Sun H.Research Progress of Superoxide Dismutase and Oxidative Stress Related Inner Ear Diseases.Progress in Modern Biomedicine.2010.(15).2982-2985
10孙国贵,胡万宁,王雅棣等.MnSOD表达特性与食管癌细胞放射敏感性的关系.癌变.突变.2012.24(2).100-107 Sun GG,Hu WN,Wang YD,et al.The relationship Between The Expression of Mn-SOD and Radiosensitivity of Esophageal Cancer Cells.2012.24(2).100-107
11Rewska A,Pawelczyk M,Rajkowska E,et al,Evaluating Demthionine Does to Attenuate Oxidative Stess-mediated Hearing Loss Following over Exposure to Noise[J].Eur Arch Otorhinolaryngol,2013,270:1513
12Teru K,Chisato F,Tatsuya Y.Reactive Oxygen Species,Apoptosis,and Mitochondrial Dysfunction in Hearing Loss[J].Bio Med Res Int,2015,617207
13Lamarre C.,LeMay J.D.,deslauriers N.,Bourbonnais Y.Candida Albic Ans Expresses an Unusual Cytoplasmic Mang an Ese-containing superoxide dismutase(SOD3 gene product)upon the entry andduringtheStationaryPhase.JBiolChem.2001.276(47).4378-43791
14Liwei C,Ning Y,Yan L,et al.Hydrogen-saturated Saline Protects Intensive Narrow Band Noise-induced Hearing Loss in Guinea Pigs through an Antioxidant Effect[J].PLoS One,2014,9:e100774
15Lefebvre P.P.,Malgrange B.,Lallemend F.,Staecker H.,Moonen G.,Van De Water T.R.Mechanisms of Cell Death in The Injured AuditorySystem:otoprotectivestrategies.AudiolNeurootol.2002.7(3).165-170
16Krcssmrnn S,Muller WE,Blume HH,et a1.Pharmaceutical Quality of Diferent Ginkgo Biloba Brands[J].Pharm pharmacol,2002,54(5):661.
17董杰,金纳多治疗突发性耳聋的疗效分析,中国实用医药2011,10(6):29 Dong J,Analysis of Curative Effect of Ginaton Treatment of Sudden Deafness,Chinese Practal Medicine,Oct 2011,Vol.6,No-29
18何铁龙.蒙药珍宝丸治疗急性脑梗塞的临床观察[J].中国民族医药杂志,2014,20(1):10.He TL.Clinical Observation on Treatment of Acute Cerebral Infarction with Mongolian Medicine Treasure Pill[J].Journal of Medicine&Pharmacy of Chinese Minorities,2014,20(1):10.
Effects of EGB761 on Inner Ear Mn-SODActivity in Rats with Noise Induced Deafness
DONG Yingjie1,WU Wei1,2,WANG Gang2,HAN Haolun2,ZHANG Chi2,LIU Xu2,QU Changbei2,LIU Chang3
1 PLA 306th Hospital/Teaching Hospital of Peking University Health Science Center
2 Department of Otolaryngology Head and Neck Surgery,PLA 306th Hospital
3 China Astronaut Training and Research Center
Corresponding author:WU WeiEmail:entwuwei@126.com
ObjectiveTo investigate effects of EGB761 on ABR threshold,hair cell nucleus staining and manganese superoxide dismutase(Mn-SOD)activity in the inner ear in rats with by impulse noise induced deafness.MethodsSD rats(n=80)were randomly divided into a blank control(n=20)and an experiment(n=60)group.Rats in the experiment group
impulse noise exposure(150 dB SPL,pulse width=30 ms,repetition rate=1/min,total=3),and were then randomly selected to be examined immediate,or to receive intraperitoneal injection of EGB761(Ginaton 4 ml/kg)or equivalent volume of saline,bid for 7 consecutive days before being examined.ResultsABR thresholds in the experiment group were significantly elevated following impulse noise exposure(P<0.01),regardless of timing or treatment(P>0.05).After 7 days,ABRs thresholds improved in both saline and EGB761 treated animals,but more so in those treated with EGB761 than in those treated with saline(P=0.02).Immunofluorescence showed normal arrangement of outer hair cells nuclei in rats without noise exposure.Immediately following noise exposure,punctate deletion of outer hair cell nuclei was noticed in the basal turn.On Day 7,significant lamellar deletion of outer hair cell nuclei was recorded in rats treated with saline,more severe than immediately following exposure and than in those treated with EGB761 whose loss of outer hair cells nuclei was sparse and scattered.Mn-SOD results showed no statistically significant difference between noise exposed and non-exposed animals immediately following exposure(P>0.05);whereas on Day 7,inner ear Mn-SOD activity in rats treated with normal saline was significantly lower than immediately following exposure(P<0.01)and then in EGB761 treated rats(P=0.01).ConclusionsEGB761 appears to mitigate auditory function decline,hair cell loss and oxidative stress reaction,and improve the prognosis in pulse noise induced deafness.
Noise Induced Hearing Loss;Auditory Brainstem Response;Mn-SOD;EG761 Supported by the Major project of 12 th Five-Year for PLA(AWS11J003) Declaration of interest:The authors report no conflicts of interest
R764
A
1672-2922(2017)05-555-6
10.3969/j.issn.1672-2922.2017.011.
全军“十二五”重大课题(AWS11J003)资助Supported by the Major project of 12 th Five-Year for PLA(AWS11J003)
董颖婕,研究生在读,住院医师,研究方向:航天耳科学及耳显微外科
吴玮,Email:entwuwei@126.com
2017-07-17审核人:翟所强)

