AIFM1基因突变对Harlequin小鼠年龄相关耳蜗听觉功能的影响
熊彬彬 胡博华 赵晓明 刘钊 赵立东 孙伟
1暨南大学附属珠海医院耳鼻咽喉头颈外科(广东519000)
2听力与聋病中心,纽约州立布法罗大学(布法罗14214)
3中国人民解放军总医院耳鼻咽喉头颈外科(北京100853)
·基础研究·
AIFM1基因突变对Harlequin小鼠年龄相关耳蜗听觉功能的影响
熊彬彬1,2胡博华2赵晓明1刘钊1赵立东3孙伟2
1暨南大学附属珠海医院耳鼻咽喉头颈外科(广东519000)
2听力与聋病中心,纽约州立布法罗大学(布法罗14214)
3中国人民解放军总医院耳鼻咽喉头颈外科(北京100853)
目的研究AIFM1基因突变对Harlequin小鼠年龄相关耳蜗听觉功能的影响。方法用圆窗记录耳蜗电图来评价2月龄和6月龄野生型(WT)和AIFM1基因突变型(KO)Harlequin小鼠的耳蜗外周听觉功能,通过Phalloidin荧光标记耳蜗基底膜外毛细胞的表皮板来评估毛细胞的损失程度。结果(1)2月龄组WT型和KO型小鼠的复合动作电位阈值分别为18.6±1.6 dB SPL(n=6)和22.2±2.2 dB SPL(n=6),两组之间没有统计学差异(t=1.282,P>0.05);6个月组WT型和KO型复合动作电位阈值分别为25.7±1.7 dB SPL(n=6)和42.1±3.6 dB SPL(n=6),两组之间差异有统计学意义t=4.129,P<0.01)。(2)2月龄组WT型和KO型小鼠CAP的幅值没有统计学差异(P>0.01),而6个月组的CAP的幅值在高频段(30,35和40 kHz)有统计学差异(Two-way ANOVA,P<0.05),在低频和中频则没有明显差异。2月龄组和6月龄组WT型和KO型小鼠10 kHz以下CM的幅值的差异没有统计学意义(P>0.05)。(3)耳蜗外毛细胞计数的结果显示,2月龄组的WT型(n=5)和KO型小鼠(n=5)之间没有统计学差异,而6月龄组的KO型小鼠的耳蜗外毛细胞个数在底回较WT型小鼠明显受损(t=15.1,P<0.0001)。结论AIFM1基因突变导致Harlequin小鼠耳蜗基底膜底回末端外毛细胞受损,从而导致耳蜗外周听觉功能高频段受损。
AIFM1;耳蜗电图;毛细胞;听力损失
AIFM1基因是编码凋亡诱发因子(Apoptosis inducing factor,AIF)的一种基因,该基因产物诱导线粒体释放促细胞凋亡蛋白的细胞色素C和caspase-9。内耳免疫染色发现,AIF在小鼠内外毛细胞、螺旋神经节、血管纹及壶腹嵴均有广泛表达,提示其在听觉系统可能具有重要功能[1]。已有研究报道,噪声暴露后,AIFM1在凋亡损伤时启动caspase非依赖性细胞凋亡途径,由线粒体转运至细胞核,诱导细胞程序性死亡,而AIFM1基因对年龄相关的耳蜗听觉功能的影响的研究并不多见。为了探讨AIFM1基因对耳蜗听觉功能的影响,我们选用了AIFM1基因KO Harlequin小鼠(其AIF的表达量只有正常小鼠的10~20%[3])作为实验组,比较了2月龄和6月龄WT和KO型小鼠单侧耳tone burst刺激同时通过同侧圆窗记录耳蜗电图评价耳蜗外周听觉功能,并对耳蜗基底膜外毛细胞(Outer hair cell,OHCs)采用鬼笔环肽(FITC)免疫荧光染色评估耳蜗OHC的损失程度。
1 材料与方法
1.1 实验动物及分组
本实验采用2月龄组WT型(B6CBACaAW-J)和KO型Harlequin小鼠各6只,6月龄组的WT型和KO型Harlequin小鼠各5只。所有小鼠均为雄性。动物的使用和手术得到纽约州立布法罗大学动物实验管理委员会批准。
1.2 实验方法和步骤
1.2.1 手术方法和耳蜗电图的记录
腹腔注射氯胺酮(50 mg/kg)和甲苯噻嗪(10 mg/kg)麻醉小鼠后,放置于手术台保温垫上,并用固定支架固定小鼠头部,调整右侧耳至合适手术位置。取耳屏前方路径,剪去耳屏前方及其周围颈部毛发及其皮肤并消毒,分离筋膜及其肌肉软组织,暴露听泡后,打开听泡暴露镫骨动脉前下方的圆窗并将银环电极置入圆窗龛(如图1)。切开外耳道暴露鼓膜,扬声器靠近鼓膜给声刺激。采用TDT系统和编辑的软件记录,前置放大器为DAM-50放大器(WPI,滤波设定为0.1Hz到10 kHz)。声刺激为10毫秒的短纯音(Tone bursts,4,6,8,12,16,20,24,35和40kHz,上升/下降的时间为1毫秒,平台期10毫秒)。刺激速率为50次/秒,叠加次数为100次,声压级从80 dB SPL开始递减。能引出复合动作电位(compound action potential,CAP)的最小声强为该频率的阈值,总和电位(summating potential,SP)的幅值以直流电位与基线的差距来测量,耳蜗微音电位(cochlear microphonics,CM)的幅值为滤过交流成分的峰峰值来测量。图2显示由12 kHz 80 dB的短纯音诱发的典型的CAP和SP波形。声刺激后2ms左右诱发一个典型的峰谷-峰顶的CAP,随后可见约8ms的一个平台期为SP,从基线到平台期的高度为SP的振幅。
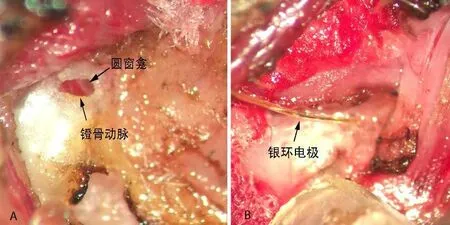
图1 经小鼠耳前切口后鼓室手术径路暴露圆窗龛Fig.1Electrode placement on the round window.The view of the round window through posterior tympanum of the auditory bulla exposed via preauricular incision.

图2 圆窗记录到的复合动作电位(CAP)和总和电位(SP)和耳蜗微音电位(CM)Fig.2Compound action potential,summating potential and cochlear microphonics recorded from the round window
1.2.2 免疫荧光染色样本处理
耳蜗电图记录完毕后,动物断头处死,取出双侧耳蜗,剔除镫骨底板,圆窗10%福尔马林磷酸缓冲液灌流并固定标本24小时后,取出基底膜,用FITC荧光(Alexa Fluor 488)标记的phalloidin对毛细胞表皮板进行绿色荧光标记。在荧光显微镜(Z6 APO复消色差变焦系统)下观察染色的毛细胞表皮板,并通过DFC3000显微数字照相机和莱卡Suite V4计算机软件采集从顶回到底回末端全长基底膜图像。
1.3 统计学分析
所有采集数据输入到GraphPad Prism5软件系统,应用t检验,二元方差检验(Two-way ANOVA)等对数据进行统计学分析和比较,P<0.05被确定为具有统计学意义的显著性差异。
2 结果
2.1 耳蜗电图的结果
2.1.1 CAP阈值
2月龄组WT型(n=6)和KO型小鼠(n=6)的CAP阈值分别为18.6±3.9 dB SPL,22.25±4.81 dB SPL,两组之间差异没有统计学意义(t=0.57,P>0.05);6月龄组WT型(n=6)和KO型(n=6)CAP阈值分别为25.70±4.63dB SPL,42.10±5.59dB SPL,两组之间有统计学差异(t=2.26,P<0.05)。进一步对6月龄组不同频率之间的差异进行T检验比较,3个高频频率(30、35和40kHz)WT和KO组之间差异有统计学意义(P均<0.001),而其他频率之间的差异没有统计学意义(P均>0.05,如图3)。
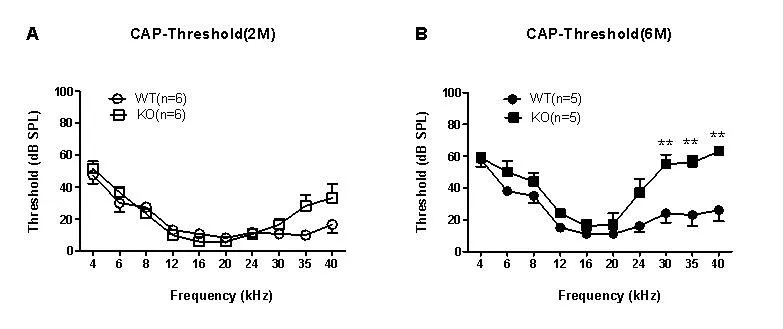
图3 2月龄组WT和KO的阈值和6月龄组WT和KO的阈值Fig.3 Comparisons of the CAP thresholds between the WT and the KO mice at two time points(2 and 6 months).
2.1.2 CAP输入输出(input/output,I/O)曲线变化
2月龄组WT型(n=6)和KO型(n=6)高频段(30、35和40kHz)CAP的幅值随着刺激声强度的增加呈非线性增加(如图4,40 kHz的I/O曲线),两组之间没有统计学差异(Two-way ANOVA,P>0.05);6月龄组WT型(n=5)高频段CAP的幅值随着刺激强度的增强呈非线性增加,而KO型(n=5)高频段CAP的幅值低强度刺激没有反应,高强度刺激时幅值明显降低,且输入输出曲线呈线性或接近线性增长,两组之间的差异有统计学意义(Two-way ANOVA,P<0.05)。
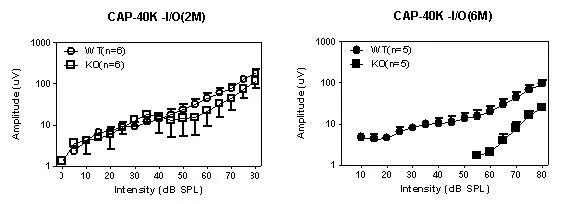
图42 月龄组和6月龄组WT型和KO型40 kHz CAP的I/O曲线Fig.4The I/O curves of CAP amplitudes at 40 kHz in the WT and KO mice at the ages of 2 and 6 months.
2月龄和6月龄组的WT型和KO型小鼠在中频段(12-24 kHz),CAP的幅值均随着刺激声强度的增加呈非线性增加,两组之间没有统计学差异(Two-way ANOVA,P>0.05,如图5)。
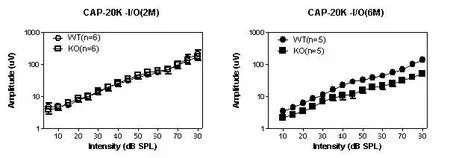
图5 2月龄组和6月龄组WT和KO 20 kHz CAP的I/O曲线中频段以20 kHz CAP的I/O曲线为例。2月龄和6月龄组的WT型和KO型CAP的幅值均随着刺激声强度的增加呈非线性增加,两组之间没有统计学差异(Two-way ANOVA,P>0.05)。Fig.5 The I/O curves of the CAP amplitudes at 20 kHz in the WT and KO mice at the ages of 2 and 6 months.The I/O functions are non-linear in both WT and KO mice.There is no significant difference between the two groups at the examined time points(Two-wayANOVA,P>0.05).
在低频段(4-8 kHz),2月龄组的WT型和KO型小鼠的CAP的幅值随着刺激声强度的增加呈非线性增加,两组之间的差异有统计学意义(Two-way ANOVA,P<0.05),6月龄组WT和KO的CAP阈值均增加,KO组的反应幅值随着强度的增加小于WT组,但两者之间的差异没有统计学意义(Two-way ANOVA,P>0.05,如图6)。
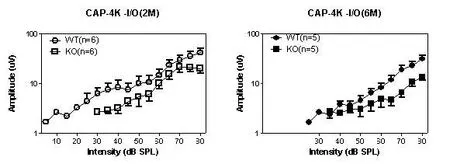
图6 2月龄组和6月龄组WT和KO 4 kHz CAP的I/O曲线Fig.6 The I/O curves of the CAP amplitudes at 4 kHz examined in the WT and KO mice at the ages of 2 and 6 months.
2.1.3 CM输入输出(input/output,I/O)曲线变化
前置放大器滤波的设定为0.1Hz~10 KHz,仅比较10 kHz以下的CM的输入输出的曲线变化。2月龄和6月龄组的WT型和KO型10 kHz以下的频率CM的幅值均随着刺激声强度的增加呈非线性增加,两组之间没有统计学差异(Two-way ANOVA,P>0.05,如图7)。

图7 2月龄组和6月龄组WT和KO 4 kHz和8 kHz CM的I/O曲线Fig.7 The I/O curves of the CM amplitudes at 4 kHz and 8 kHz examined in the WT and KO mice at the ages of 2 and 6 months.
2.2 外毛细胞形态学结果
用FITC荧光(Alexa Fluor 488)标记的phalloidin对毛细胞表皮板进行绿色荧光免疫染色后,对缺失的外毛细胞计数进行比较。2月龄组WT和KO的外毛细胞计数比较没有统计学差异(T检验,t=3.18,P>0.05)。6个月组,KO组的近底回(70-100%)外毛细胞缺失明显(图8),和WT组比较有统计学差异(T检验,t=15.11,P<0.0001,图9A-B)。
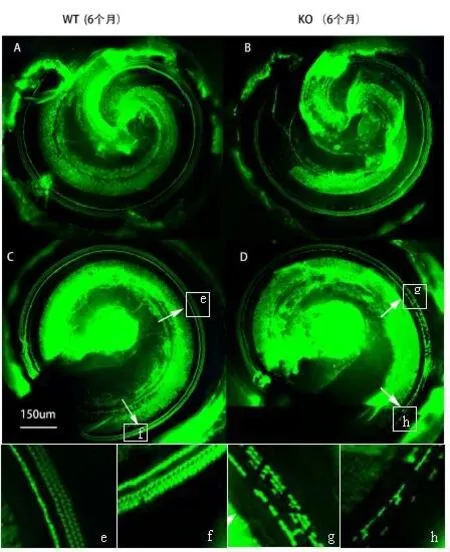
图8 6个月组WT和KO耳蜗基底膜FITC荧光(Alexa Fluor 488)标记的phalloidin外毛细胞绿色荧光染色示例.Fig.8 Typical images of F-actin staining using Alexa 488-labeled phalloidin in outer hair cells of the cochleae of WT and KO mice at the age of 6months.
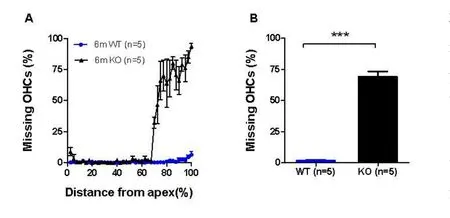
图9 6个月组WT和KO耳蜗基底膜全长外毛细胞缺失计数和分布Fig.9Comparisons of the magnitudes of OHC loss between the WT and KO mice at the age of 6months.
3 讨论
近年来的研究表明,编码凋亡诱导因子(AIF)是一种在人类,啮齿类动物和无脊椎动物广泛表达并高度保守的蛋白质。AIFM1基因突变可引起AIF蛋白功能异常,通过不同机制导致遗传性周围神经病、线粒体脑肌病、胚胎期巨脑室和Cowchock综合征等多种遗传疾病表型[4-6]。最近的研究亦发现,AIFM1突变还可导致X-连锁隐性遗传性听神经病(AUNX1)[1]。在我们探讨AIFM1基因突变对Harlequin小鼠动物模型听觉功能作用中,发现AIFM1基因突变对年龄相关的外周听觉功能有损伤作用。
在我们的实验中发现,2月龄AIFM1基因突变的Harlequin小鼠外周听力和WT小鼠之间没有明显的差异,而6月龄的KO小鼠出现高频段外周听力受损。数据显示6个月的KO小鼠和WT的CAP阈值在低频和中频段没有没有明显差异,而高频段(30-和40kHz)KO组比WT组小鼠明显抬升,而WT组的高频段阈值同2个月相比没有明显差异。CAP的I/O曲线的异常也表现在6个月KO小鼠的高频段,尤其是40kHz的反应阈值明显抬高,I/O曲线也由非线性增长变成线性增长,说明外毛细胞的功能严重受损。因此,我们认为AIFM1基因突变在早期对外周听觉功能的影响不明显,而随着年龄的增加,基因缺陷对耳蜗高频段的听觉功能作用开始表达,表现出高频外周听力受损。而我们的形态学免疫荧光染色亦证实6月龄KO小鼠耳蜗基底膜距离顶回70~100%的外毛细胞大量或散在缺失(如图8)。这与Zong等[1]报导的AIFM1突变引起的AIF蛋白不会影响OHC的功能不一致。AIFM1基因突变导致AIF的功能缺陷导致的Harlequin小鼠的听力障碍随着年龄的增长而表达,和临床上发现的一些AIFM1突变的病人听力问题开始出现在青春期一致[7-8]。我们推测这种形态和功能受损同AIF缺陷诱导OHC的线粒体功能障碍有关。AIF缺陷导致氧化磷酸化功能障碍,影响细胞凋亡过程。由于Harlequin小鼠AIF的表达量只有正常小鼠的10~20%,导致各种组织中氧化磷酸化的水平降低,3-6个月龄的Hq小鼠会出现骨骼肌萎缩,进行性视网膜和小脑神经变性等症状[3,9,10]。而近年来临床研究确认人类表现出的严重线粒体功能缺陷的疾病,如母系遗传的外周神经病,产前脑室扩张,致死性和渐进性脑肌病和严重的肌肉萎缩均由几种AIFM1基因突变所导致,且严重程度和线粒体功能缺陷程度相关[11-13]。
AIF诱导的线粒体功能障碍的分子机制目前并不是很清楚,早期的研究认为AIF是一种caspase-非依赖性凋亡分子,在凋亡损伤时由线粒体转运至细胞核,诱导细胞程序性死亡[14-16]。有学者在研究噪声暴露对耳蜗毛细胞的损伤中发现,在正常的毛细胞中,AIF分布在毛细胞膜内面的线粒体中,噪声暴露后,AIF从线粒体特定核酸酶异位释放到受损伤的细胞质中然后进入细胞核,和DNA发生作用,导致染色质浓缩,激活caspase-3,诱导内毛细胞和外毛细胞的的凋亡和坏死[2,17]。但最新的研究认为,AIF具有的NADH-氧化酶结构域是调节线粒体氧化呼吸链复合物I的主要片段,AIF在生理上和氧化还原酶CHCHD4/MIA40相关[11,18]。Harlequin突变小鼠的纤维母细胞和AIFM1基因突变病人的神经胶质细胞中,MIA40蛋白水平的降低导致AIF对氧化磷酸化系统作用缺陷,呼吸复合物缺失,影响呼吸链亚单位的组装和维持,但并没有影响mRNA的转录[19]。更重要的是,Meyer[11]等发现MIA40的过渡表达可以抵消Harlequin细胞生物电子呼吸链中亚单位的损失。因此,他们认为AIF可能是MIA40的对接蛋白,两者之间的分子结合将影响呼吸电子传递链的正确组装和维护,这有可能为AIF功能缺陷个体的治疗提供一个新的干预途径。
总之,AIFM1基因突变不仅导致听神经的病变,同样可以引起迟发性耳蜗功能的损伤导致外周听觉病变。虽然潜藏的分子机制到目前为止了解的并不是十分清楚,但是目前的研究认为同该基因突变导致了线粒体内膜的稳定性改变,损害氧化呼吸链的结构和活性,致使线粒体介导的细胞凋亡失控有关。因此进一步探索AIF的线粒体功能信号通路和特异性调控将成为未来临床干预的研究方向。
1Zong L,Guan J,Ealy M,et al.Mutations in Apoptosis-inducing Factor Cause X-linked Recessive Auditory Neuropathy Spectrum Disorder.J Med Genet.2015;52(8):523-531.
2Han W,Shi X,Nuttall AL.AIF and EndoG Translocation in Noise Exposure Induced Hair Cell Death.Hear Res.2006;211(1-2):85-95.
3Klein JA,Longo-Guess CM,Rossmann MP,et al.The Harlequin Mouse Mutation Downregulates Apoptosis-Inducing Factor.Nature.2002;419(6905):367-374.
4Rinaldi C,Grunseich C,Sevrioukova IF,et al.Cowchock Syndrome is Associated with A Mutation in Apoptosis-Inducing Factor.Am J Hum Genet.2012;91(6):1095-1102.
5Ghezzi D,Sevrioukova I,Invernizzi F,et al.Severe X-Linked Mitochondrial Encephalomyopathy Associated with A Mutation in Apoptosis-Inducing Factor.Am J Hum Genet.2010;86(4):639-649.
6Berger I,Ben-Neriah Z,Dor-Wolman T,et al.Early Prenatal Ventriculomegaly Due to An AIFM1 Mutation Identified by Linkage Analysis and Whole Exome Sequencing.Mol Genet Metab.2011;104(4):517-520.
7Roche JP,Huang BY,Castillo M,et al.Imaging Characteristics of Children with Auditory Neuropathy Spectrum Disorder.Otol Neurotol.2010;31(5):780-788.
8Young NM,Kim FM,Ryan ME,et al.Pediatric Cochlear Implantation of Children with Eighth Nerve Deficiency.Int J Pediatr Otorhinolaryngol.2012;76(10):1442-1448.
9Bouaita A,Augustin S,Lechauve C,et al.Downregulation of Apoptosis-Inducing Factor in Harlequin Mice Induces Progressive and Severe Optic Atrophy Which is Durably Prevented by AAV2-AIF1 Gene Therapy.Brain.2012;135(Pt 1):35-52.
10Lechauve C,Augustin S,Cwerman-Thibault H,et al.Neuroglobin Gene Therapy Prevents Optic Atrophy and Preserves Durably VisualFunctioninHarlequinMice.MolTher.2014;22(6):1096-1109.
11Meyer K,Buettner S,Ghezzi D,et al.Loss of Apoptosis-Inducing Factor Critically Affects MIA40 Function.Cell Death Dis.2015;6:e1814.
12Kettwig M,Schubach M,Zimmermann FA,et al.From Ventriculomegaly to Severe Muscular Atrophy:Expansion of the Clinical Spectrum Related to Mutations in Aifm1.Mitochondrion.2015;21:12-18.
13Ardissone A,Piscosquito G,Legati A,et al.A Slowly Progressive MitochondrialEncephalomyopathyWidenstheSpectrumof AIFM1 Disorders.Neurology.2015;84(21):2193-2195.
14Susin SA,Lorenzo HK,Zamzami N,et al.Molecular Characterization of Mitochondrial Apoptosis-Inducing Factor.Nature.1999;397(6718):441-446.
15Norberg E,Orrenius S,Zhivotovsky B.Mitochondrial Regulation of Cell Death:Processing of Apoptosis-Inducing Factor(AIF).Biochem Biophys Res Commun.2010;396(1):95-100.
16Polster BM.AIF,Reactive Oxygen Species,and Neurodegeneration:A"Complex"Problem.Neurochem Int.2013;62(5):695-702.
17Yang WP,Henderson D,Hu BH,et al.Quantitative Analysis of Apoptotic and Necrotic Outer Hair Cells after Exposure to Different Levels of Continuous Noise.Hear Res.2004;196(1-2):69-76.
18Joza N,Pospisilik JA,Hangen E,et al.AIF:Not Just an Apoptosis-Inducing Factor.Ann N Y Acad Sci.2009;1171:2-11.
19Pospisilik JA,Knauf C,Joza N,et al.Targeted Deletion of AIF Decreases Mitochondrial Oxidative Phosphorylation and Protects from Obesity and Diabetes.Cell.2007;131(3):476-491.
The Effect ofApoptosis Inducing Factor Gene on Peripheral Hearing Function DuringAging
XIONG Binbin1,2,HU Bohua2,ZHAO Xiaoming1,LIU Zhao1,ZHAO Lidong3,SUN Wei2
1 Department of Otolaryngology,Zhuhai Hospital Affiliated with Jinan University,Zhuhai,Guangdong,519000
2 Center for Hearing and Deafness,Department of Communicative Disorders and Sciences,University of New York at Buffalo,Buffalo New York,14214,United States
3 Department of Otolaryngology Head and Neck Surgery,Chinese PLA General Hospital,Beijing 100853,China
Corresponding author:SUN WeiEmail:weisun@buffalo.edu
ObjectiveTo study the functional role of apoptosis inducing factor gene(AIF)in cochlear homeostasis during aging.MethodsHarlequin mice(2 and 6 months old)that were lack of the AIFM1 gene were used.Compound action potentials(CAP)and cochlear microphonics(CM)elicited by tone-bursts were recorded from the round window.The level of cochlear outer hair cell damage was evaluated using phalloidin staining.ResultsIn the 2-months age group,the average compound action potentials threshold was 18.6±1.6 dB SPL for wild-type(WT)mice(n=6)and 22.2 2.2 dB SPL for knockout(KO)mice(n=6),respectively(Student’s t-test,P>0.05).However,for the 6 months agegroup,the average CAP threshold was 25.70±1.69 dB SPL for WT mice(n=5),which was significantly lower than that for KO mice(42.10±3.59 dB SPL,n=5)(Student’s t-test,t=4.129,P<0.01).Comparisons of CAP amplitudes between the WT and KO mice revealed a significant difference at higher frequencies(30,35 and 40 kHz;two-way ANOVA,P<0.05),but not at middle and low frequencies.The CM amplitude I/O functions were non-linear in both WT and KO mice at both 2 months and 6 months of age,with no significant difference between the WT and KO mice(Two-way ANOVA,P>0.05).Consistent with this functional assessment,comparison of missing OHCs revealed a significant difference at basal turn of cochlea between the WT and KO groups at the age of 6 months(Student t-test,t=15.11,P<0.0001).ConclusionsLoss of AIFM1 gene function accelerates age-related outer hair cell degeneration and high frequency hearing loss.
AIFM1;ECochG;Hair Cells;Hearing Loss Science and Technology Planning Project of Zhuhai City(20171009E030055) Decaration of interest:The authors report no conflicts of interests.
R764
A
1672-2922(2017)05-546-6
10.3969/j.issn.1672-2922.2017.009.
及编号:珠海市科技计划项目(20171009E030055)
熊彬彬,硕士,副主任医师,研究方向:耳鸣中枢化机制和听觉过敏
孙伟,Email:weisun@buffalo.edu
2017-05-14审核人:郭维维)

