磷酸钠水溶液中氧化还原循环制备三维银电极还原CO2生成CO
何志桥,魏榕飞,严婷婷,许旭杨,陈建孟,宋爽
(浙江工业大学环境学院,浙江 杭州 310032)
磷酸钠水溶液中氧化还原循环制备三维银电极还原CO2生成CO
何志桥,魏榕飞,严婷婷,许旭杨,陈建孟,宋爽
(浙江工业大学环境学院,浙江 杭州 310032)
通过氧化还原循环制备了具有三维表面的纳米银电极(3D-Ag)。采用X射线衍射(XRD),场发射扫描电子显微镜(FE-SEM),高分辨透射电子显微镜(HRTEM)和双电位阶跃等方法研究了电极的结构和性能。制备的3D-Ag电极表面均匀分布了(100)和(111)晶面暴露的纳米Ag颗粒,颗粒直径为30~150 nm。通过CO2的电催化还原实验考察了电极的催化活性和寿命,结果显示,相比未改性Ag片,改性3D-Ag电极具有更高的活性、选择性和稳定性。此外,3D-Ag电极在3组连续的2 h电还原CO2实验中能保持较高活性,而未改性Ag电极随时间逐渐失去活性。3D-Ag电极表现出的高活性可归因于Ag纳米颗粒有利于*COOH的稳定化和吸附态还原中间体*CO的脱附。
Ag电极;电化学;纳米结构;二氧化碳;还原;一氧化碳;循环伏安
引 言
化石燃料的大量燃烧导致大气中 CO2浓度递增,从而与其他温室气体共同导致温室效应,引发全球性环境问题[1-2]。CO2作为一种潜在的含碳原材料可以被还原生成可利用的含碳有机物[3-5],高效电化学转换是其中一种主要方式[6-9]。在电化学还原过程中许多金属都可作为电催化剂,其中Ag能有效地还原CO2生成主产物CO和次产物甲酸、甲烷和甲醇等[10-13]。未经改性的多晶 Ag电极由于电活性面积小导致其催化活性位少,催化性能不高;此外在还原 CO2进程中,Ag催化剂易于失去活性,是限制其有效使用的另一瓶颈[14-16]。为进一步提高Ag电极在电还原CO2生成CO过程中的活性、选择性和寿命,在平板电极表面形成三维(3D)纳米表面结构或沉积纳米颗粒是有效途径之一[17-18]。3D银电极(3D-Ag)与多晶Ag电极(P-Ag)相比电化学表面积更大,催化活性更高,通过适当控制,还可延长电极寿命[19]。在电化学还原CO2过程中,制备 3D-Ag电极的方法主要包括合金/去合金化、氧化/还原和电化学法[15,19-21]。然而,采用电化学氧化还原循环技术(ORC)在磷酸钠水溶液中制备3D-Ag电极尚未见报道。ORC可原位形成3D表面结构电极并有效提高其催化活性,该技术是在一定扫描速度下使电极交替发生氧化还原反应,从而在电极表面形成纳米层,主要应用于Au、Ag和Cu等金属[14,22-24]。
本研究利用 ORC技术在磷酸钠电解液中于P-Ag表面原位形成纳米银层制备3D-Ag电极,提高电极表面粗糙因子,改变Ag的晶面组成,以有效提高Ag电极电催化还原CO2生成CO的活性、选择性和寿命。
1 实验部分
1.1 3D-Ag电极的制备
Ag片(2.5 cm×2.5 cm,0.3 mm,>99.99%)经7.5 μm砂纸打磨后依次在丙酮、去离子水中超声10 min,后用N2吹干备用。
在0.1 mol·L-1Na3PO4溶液中将预处理后的Ag片、Pt片(2.5 cm×2.5 cm,0.5 mm,>99.99%)和饱和甘汞电极(SCE)分别作为工作电极、对电极和参比电极。采用循环伏安法于Ag片表面原位合成纳米银。电化学工作站(CHI-660D,上海辰华仪器公司,美国)控制电位区间为-0.5~+0.5 V,扫描速率为10 mV·s-1,扫描圈数为5圈。
1.2 电极表征
使用场发射扫描电子显微镜(FE-SEM,S-4800,Hitachi,日本)观察电极表面形貌。X射线衍射仪(XRD,X’Pert PRO,PANlytical,荷兰)确定电极的晶相结构。透射电子显微镜(TEM,FEI Tecnai G2F30,FEI,荷兰)分析电极的晶格条纹和形貌结构。采用双电位阶跃法于0.5 mol·L-1NaClO4溶液中确定粗糙因子(ρ),控制电解液温度25℃,电位从0.1 V(vsSCE)反应10 s后阶跃至0.095 V(vsSCE),并用式(1)计算。
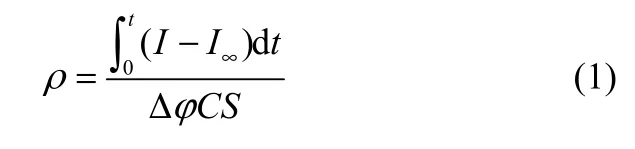
式中,I和I∞分别表示反应电流和阶跃后稳定电流,A;S为电极几何面积(4 cm2);C为理想双电层间电容(20 μF·cm-2);t为阶跃后时间(10 s);Δφ为阶跃电位差(5 mV)。
生成CO的比活性(SACO)可通过还原CO2生成CO时的分电流密度(PCD)与粗糙因子之比进行计算。
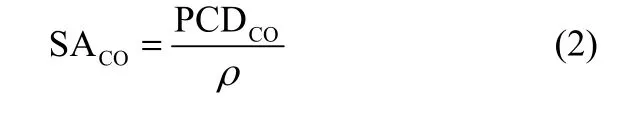
式中,PCDCO为CO2生成CO时的分电流密度,mA·cm-2。
1.3 电催化还原CO2
电催化还原 CO2在 H型电解池中进行,采用CHI-660D型电化学工作站控制进行恒电位电解。Ag电极作为工作电极,SCE为参比电极,Pt电极(2.5 cm×2.5 cm)为对电极。阴极液和阳极液分别为 CO2饱和的 100 ml 0.1 mol·L-1KHCO3水溶液和0.5 mol·L-1NaOH水溶液。阳极液和阴极液之间采用质子交换膜(Nafion 117,杜邦,美国)分隔。电解液温度用低温恒温槽(THD-2015,天恒,中国)控制在 25℃,在预设的时间取样进行气相色谱(7890B,Agilent,美国)和离子色谱(ICS2000,Dionex,美国)检测分析。实验中所有饱和甘汞电极电位(vsSCE)用式(3)转化为可逆氢电极电位(vsRHE)。
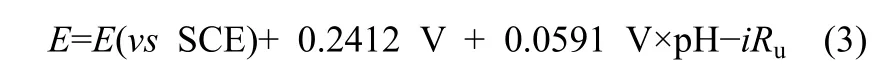
式中,E为可逆氢电极电位,V;i为平均电流,A;Ru为溶液欧姆降,Ω。
2 结果与讨论
2.1 电极表征
2.1.1 XRD 图1为P-Ag电极、3D-Ag电极和ORC处理至第9段(ORC停止在氧化段)的Ag电极的XRD谱图。由图可知,P-Ag和 3D-Ag电极均在38.1°、44.37°、64.18°、77.55°出现衍射峰,分别对应于 Ag(111)、(200)、(220)、(311)晶面(JCPDS No.00-001-1167)。而ORC处理至第9段氧化段的Ag 片在 20.79°、29.56°、33.41°、36.65°出现新的衍射峰,分别对应于 Ag3PO4(110)、(200)、(210)、(211)晶面(JCPDS No.00-006-0505)。XRD表征结果表明,3D-Ag电极表面原位生成的Ag纳米颗粒是Ag在Na3PO4溶液通过氧化段形成Ag3PO4,再通过还原段形成单质Ag合成得到的。
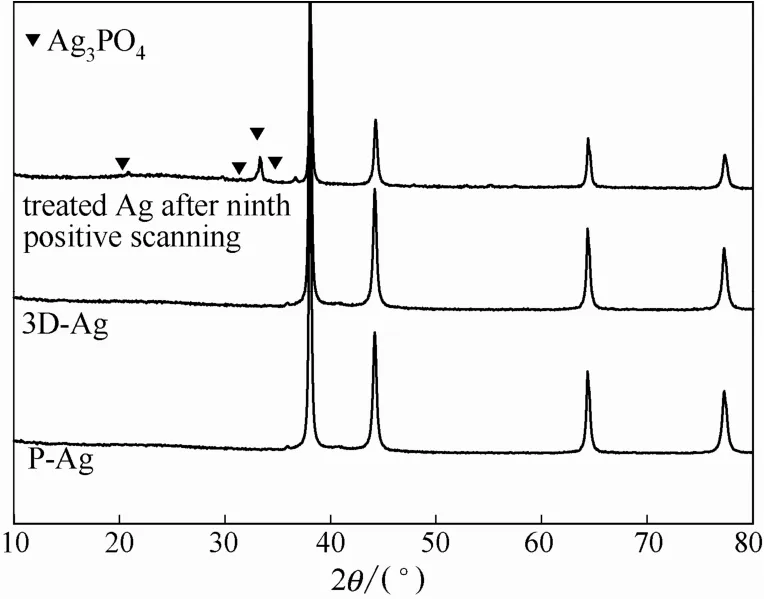
图1 P-Ag电极、3D-Ag电极和ORC处理Ag至第9段(氧化段)的XRD谱图Fig.1 XRD patterns of P-Ag,3D-Ag and treated Ag after ninth positive scanning
2.1.2 FE-SEM 采用SEM对电极表观形貌进行表征。由图2(a)可知,P-Ag电极表面未呈现明显的形貌特征,而在 Na3PO4溶液中经过氧化-还原扫描 5圈后得到的3D-Ag电极,其表面可观察到明显纳米Ag颗粒[图2(b)],粒径在30~150 nm之间。
2.1.3 HRTEM TEM 表征可更直观地观察电极表面纳米 Ag的晶体结构,图 3为纳米 Ag颗粒的HRTEM图,晶格条纹0.206和0.230 nm分别对应Ag(200)和 Ag(111)晶面,未发现 Ag(110)晶面。因此,较之多晶 Ag(主要由(111)、(100)、(110)等低指数晶面组成),所制备的3D-Ag是仅由(111)和(100)晶面组成。
2.1.4 粗糙因子 电极表面粗糙因子可表征电极的电化学表面积。所测得的3D-Ag电极的粗糙因子为161.3 cm2·cm-2,较之 P-Ag 电极 33.7 cm2·cm-2的粗糙因子[19],3D-Ag电极是P-Ag电极的4.8倍。

图2 P-Ag电极和3D-Ag电极的FE-SEM图Fig.2 FE-SEM images of P-Ag and 3D-Ag
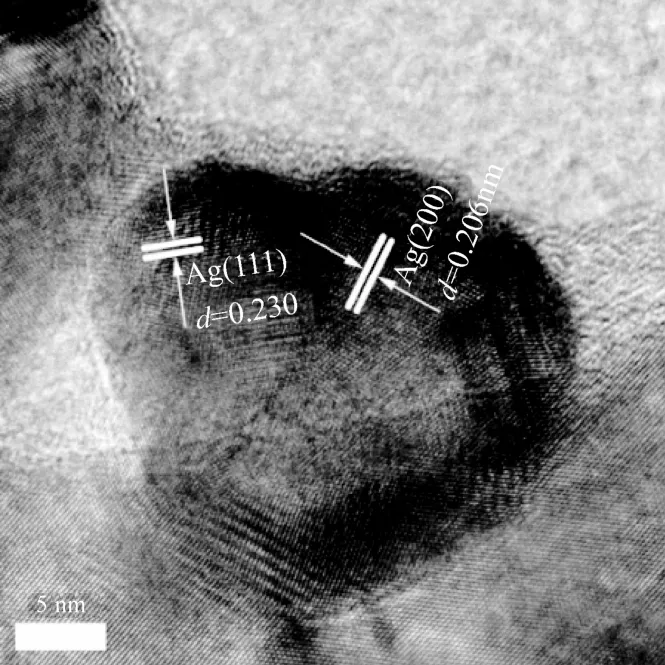
图3 3D-Ag电极的HRTEM图Fig.3 HRTEM image of 3D-Ag
2.2 CO2在银电极上的电还原行为
2.2.1 电极活性和选择性评价 Faraday电流效率(FE)能反映还原CO2各产物的选择性。图4表明在不同电位下,3D-Ag电极和P-Ag电极还原CO2生成各产物的Faraday效率,包括主产物CO和析氢反应得到的H2。在整个电位范围内均检测到H2,因为在电化学还原CO2过程中,析氢反应是难以避免的竞争反应。总Faraday电流效率保持在100%左右,证明所有的主产物均被检测到。
3D-Ag电极和P-Ag电极的产CO Faraday效率(FECO)均随电位呈现先增后减的趋势,且3D-Ag电极的 FECO在整个电位范围均高于 P-Ag电极。P-Ag电极在-0.55~-1.84 V之间还原CO2时,在-1.07 V时FECO达到最高值79.95%,仅在-0.97~-1.20 V,FECO达到 70%以上,与之对比,3D-Ag电极在-0.78~-1.28 V范围内FECO均高于70%,且于-1.02 V达到最高值84.07%,证明3D-Ag电极能在更宽的电位窗口高效生成CO。此外,P-Ag电极检测到HCOOH、CH4和CH3OH的起始电位分别为-0.81、-1.13和-1.51 V。生成CH4和CH3OH的起始电位更负是由于生成该产物所需的电子数分别为8个和6个,而生成一分子CO和HCOOH只需转移2个电子。对于3D-Ag电极而言,在-0.70 V开始检测到HCOOH,且在-1.22 V时FEHCOOH达到最大值,并且在整个电位范围没有检测到 CH4和CH3OH,生成CO的选择性更高。
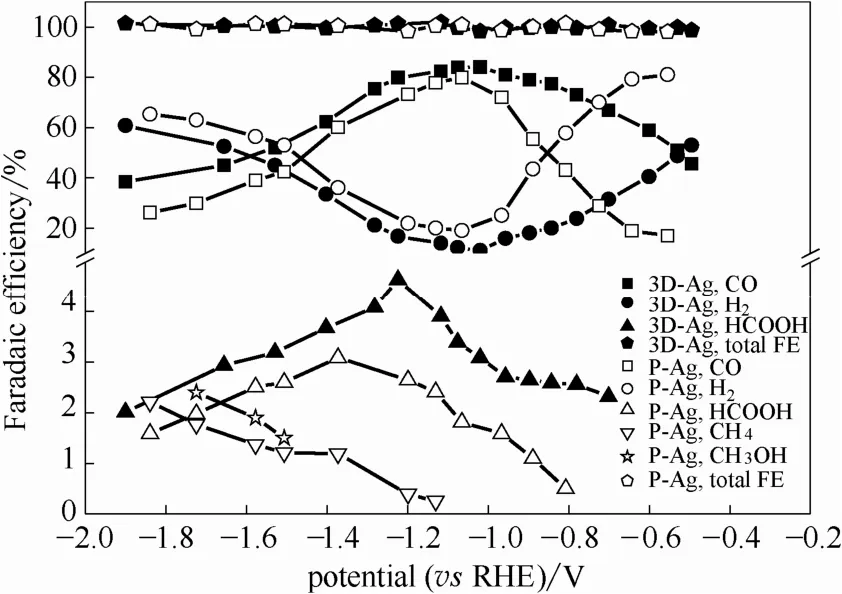
图4 3D-Ag与P-Ag电极还原CO2生成各产物FE与电位的关系Fig.4 FE of CO2 reduction products for 3D-Ag and P-Ag electrodes as function of electrode potential
图5为3D-Ag电极在-1.02 V电位下电化学还原CO2的FECO随扫描圈数的变化。由图5可知,反应1 h后,当扫描圈数由1圈增至5圈时,FECO从75.1%增加至84.07%,增加扫描圈数有利于提高3D-Ag电极还原CO2的选择性。但在扫描次数由5圈增至9圈时,FECO变化幅度不大,因此扫描圈数确定为5圈。
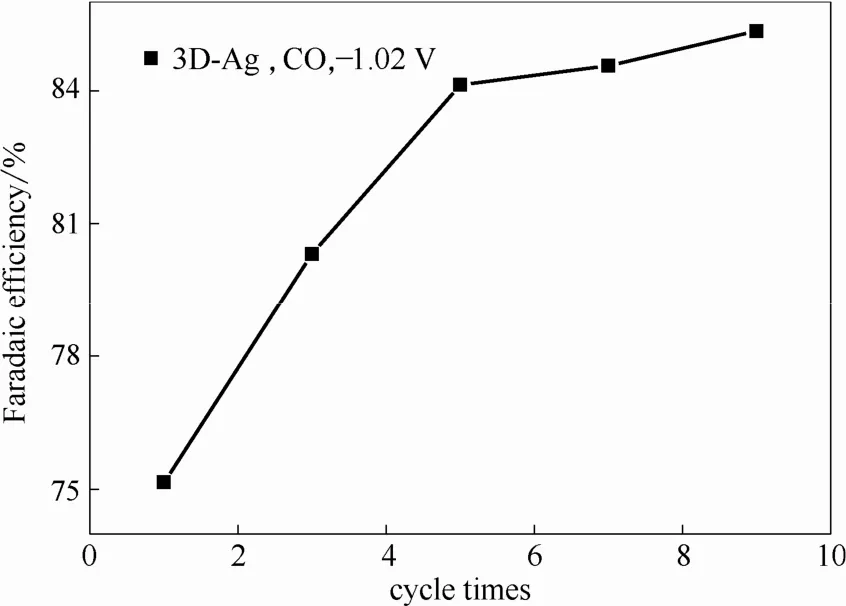
图5 扫描圈数对3D-Ag电极性能的影响Fig.5 Influence of cycle times on performance of 3D-Ag electrode
析氢反应(HER)作为主要的副反应与还原CO2同时发生,两种电极生成H2的Faraday效率(FEH2)随电压均呈现先减后增的趋势。用 FECO/FEH2的比率表征电极还原CO2生成CO的选择性。P-Ag电极在-0.89~-1.37 V之间以还原CO2生成CO为主反应,在-1.07 V时FECO/FEH2最大为4.19(81%选择性);而对于3D-Ag电极,还原CO2生成CO为主反应的电势范围为-0.53~-1.53 V,且在-1.02 V时FECO/FEH2达到最高 7.51(88%选择性)。因此,3D-Ag能在较宽的电势范围内抑制析氢反应从而还原CO2生成CO。
图6为3D-Ag与P-Ag电极在最佳电位时FECO和FEH2随时间的变化。由图6可知,3D-Ag与P-Ag电极的FECO均在还原1 h后达到最高,表明反应1 h后达到稳态。3D-Ag电极和P-Ag电极FECO最高值分别为84.07%和79.95%,1 h后3D-Ag和P-Ag电极的 FECO均随反应时间的延长而减少。图7为3D-Ag与P-Ag电极分别在最佳电位还原CO2时,根据产物浓度反算的体系CO2浓度随时间的变化。由图7可知,1 h后3D-Ag电极和P-Ag电极中CO2浓度分别降低19.4%和12.6%,因此FECO降低可能源于序批反应过程中溶解CO2浓度减少而导致的传质限定,或源于Ag催化剂表面吸附了反应中间产物而导致的中毒,以下将详细讨论。
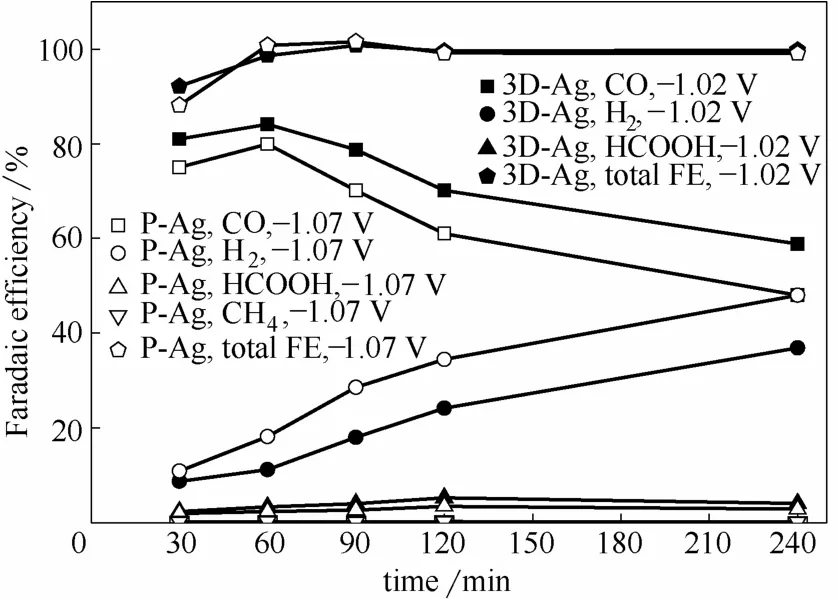
图6 3D-Ag与P-Ag电极最佳电位还原CO2生成各产物FE随时间的变化Fig.6 FE of each CO2 reduction product as function of electrolyzing time
电流密度(PCD)可反映电极的催化活性。图8为3D-Ag电极和P-Ag电极还原CO2各产物的PCD与电解电位的关系。由图8可知,在整个电势范围内,3D-Ag电极的总电流密度和 CO分电流密度(PCDCO)均高于P-Ag电极。生成产物CO的比活性SACO可通过式(2)计算,在电位-0.53 V时,3D-Ag电极的 SACO为 1.86×10-6A·cm-2,远高于-0.55 V 时 P-Ag电极的 0.36×10-6A·cm-2,表明3D-Ag电极还原CO2生成CO活性比P-Ag电极高不是由于电极表面积的提高而引起的,ORC处理后Ag催化剂的晶面变化起到了关键作用。
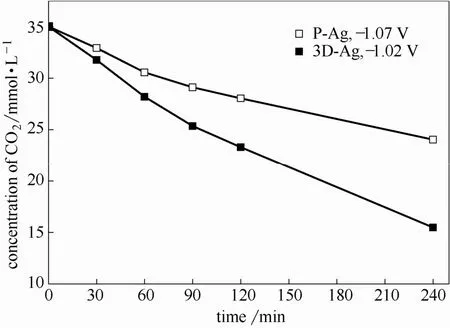
图7 3D-Ag与P-Ag电极最佳电位还原时体系CO2浓度随时间的变化Fig.7 Variation of CO2 concentration as function of electrolyzing time
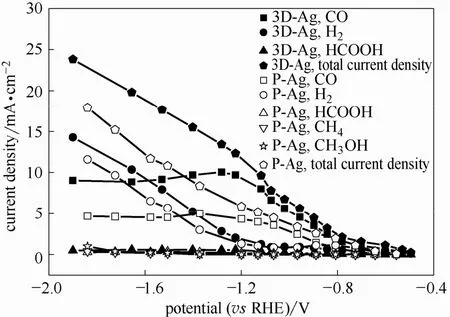
图8 3D-Ag和P-Ag电极还原CO2生成各产物PCD与电解电位的关系Fig.8 PCD of each reduction product for 3D-Ag and P-Ag electrodes as function of cathode potential
2.2.2 3D-Ag电极稳定性评价 图9为3D-Ag电极和P-Ag电极的稳定性实验结果。图9结果表明,第2组和第3组序批实验在原阴极液CO2再饱和后,3D-Ag电极均能恢复原催化活性,表明在每 1组CO2还原实验中,FECO降低的原因源于反应过程中溶解CO2浓度减少而导致的传质限定,3D-Ag电极不易失活。P-Ag电极在CO2再饱和阴极液中FECO仍持续下降直至失活,证明电解过程中 P-Ag电极失活与 CO2传质无关,Ag电极中毒是其失活的主要原因。P-Ag电极失活的原因是吸附的*CO继续还原生成*CHO和*COH等产物[19],而电极吸附*CO强弱与晶面组成有关,ORC处理后的3D-Ag电极表面Ag纳米颗粒的暴露晶面不利于*CO吸附,以下将详细讨论。
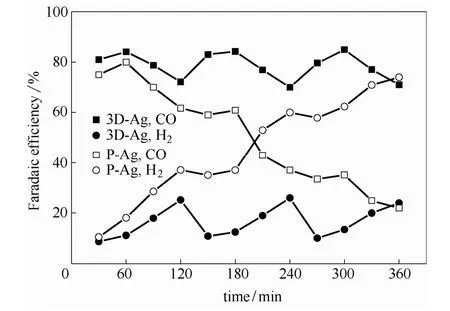
图9 还原CO2套用实验中3D-Ag电极和P-Ag电极FECO和FEH2与时间的关系Fig.9 Cyclic yield curve of CO and H2 on 3D-Ag and P-Ag electrodes from re-saturated used-electrolyte
2.3 3D-Ag电极还原 CO2高活性、选择性和稳定性机理探讨
为探讨Ag电极上CO2电还原的机理,图10将iRu校正的电极电位对各产物PCD的对数绘图,获得用于分析电化学还原 CO2的 Tafel曲线[20,25-26]。电位在-0.50~-1.90 V之间,3D-Ag电极和 P-Ag电极上从CO2还原为CO的Tafel斜率分别为118和 128 mV·dec-1。
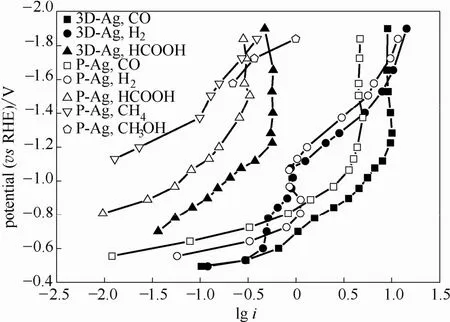
图10 3D-Ag和P-Ag电极还原CO2生成各产物Tafel曲线Fig.10 Tafel plots of CO2 electroreduction products for 3D-Ag and P-Ag
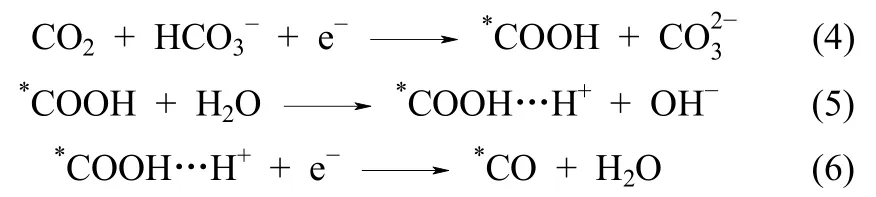
Rosen等[27]提出了电还原CO2至CO的机理[式(4)~式(6)],根据其理论推导,当电极上*COOH和*COOH…H+表面覆盖率小时,如Tafel斜率理论值为118 mV·dec-1,则式(4)为速率控制步骤,即控速步骤是溶解的 CO2分子分别从 Ag电极和接受电子和质子,在电极表面形成吸附的*COOH;Fletcher[28]也根据第一性原理计算提出在反应过程为式(4)~式(6)时,若速控步骤为式(4),则Tafel理论值为120 mV·dec-1;若速控步骤为式(5),则Tafel理论值为60 mV·dec-1。根据其推导结果,本实验无论对于P-Ag还是3D-Ag电极,速率控制步骤均为式(4)。
3D-Ag电极上CO2电催化还原行为明显不同的起因,可能是纳米尺寸效应引起的,因为3D-Ag电极表面纳米Ag颗粒暴露导致电化学表面积大大提高,相应的催化活性位数量显著提高[21],所以3D-Ag电极显示了比P-Ag电极更高的PCDCO,如果扣除电极表面粗糙度的影响,3D-Ag电极的SACO仍明显高于P-Ag电极的SACO,前者约为后者的5倍。物理化学表征结果表明,这主要是由于纳米颗粒必然包含了大量的边角位,边位是Ag颗粒上CO2电还原为CO的主要活性位[29]。
采用ORC方法制备3D-Ag电极时残存在电极表面的少量磷酸盐也可能导致 3D-Ag电极活性的提高。为此,保持电解液离子强度一致,在 0.1 mol·L-1的 KHCO3溶液中分别加入 0.01 mol·L-1Na3PO4和 0.03 mol·L-1NaClO4,经 P-Ag 电极在-1.07 V电位下还原CO21 h后,FECO分别为63.53%和72.31%,前者的FECO与加NaClO4的对照组相比没有提高,表明3D-Ag电极表面可能存在的磷酸根离子对电化学还原CO2没有促进作用。
此外,暴露的晶面在电化学还原CO2为CO过程中也起到了重要作用。3D-Ag电极表面纳米 Ag暴露晶面主要为(200)和(111)晶面,未发现(110)晶面。Back等[29]根据第一性原理计算提出各晶面稳定*COOH和*CO呈比例关系,稳定*COOH由强至弱为(110)、(100)和(111),(110)晶面稳定*COOH 最强,这与Rosen等[27]和Hoshi等[30]的研究结果一致,而稳定*CO由强至弱的顺序为(100)、(110)和(111),(111)晶面吸附*CO能力最弱。若还原CO2以CO为主产物,那么催化剂活性位需稳定*COOH能力强以激活CO2,同时与*CO结合弱使其易于脱离催化剂表面形成CO,因此单纯增加稳定*COOH能力不能提高还原CO2生成CO的选择性和活性。
虽然(110)晶面稳定*COOH最强,但其脱附*CO能力没有(111)晶面强,易生成其他产物或引起催化剂中毒。Qiu等[19]研究发现使P-Ag电极失活的物种为*CHO或*COH,而该中间体可由*CO进一步还原得到。Yano等[31]研究发现Ag电极在还原CO2时电极表面会吸附中间体或生成石墨碳使 Ag电极失活,而石墨碳是由*CO在电极表面进一步还原生成的。因此,Ag电极在还原CO2时需及时脱附*CO以免引起中毒,而 3D-Ag电极表面纳米银的(111)晶面吸附*CO能力最弱,不容易中毒,生成CO选择性更高。
3 结 论
在磷酸钠电解液中经过 ORC处理后制备的3D-Ag电极和P-Ag电极相比在还原CO2过程中具有更高的活性、选择性和稳定性。3D-Ag电极的FECO在整个电位范围内均高于P-Ag电极,在电位-1.02 V反应1 h后,FECO达到最高84.07%,比P-Ag电极高4.12%。稳定性实验显示3D-Ag电极在3次套用实验后仍有较高活性,不易失活,3D-Ag电极的比活性为1.86×10-6A·cm-2,是P-Ag电极的 5倍。3D-Ag电极表面可观察到明显纳米 Ag颗粒,粒径在30~150 nm之间,Ag(100)和Ag(111)晶面暴露,未发现Ag(110)晶面。所制备的Ag纳米颗粒可以充分稳定*COOH并易于*CO脱附,生成主产物CO。
[1]TAVONI M,KRIEGLER E,RIAHI K,et al.Post-2020 climate agreements in the major economies assessed in the light of global models[J].Nat.Clim.Change,2015,5(2):119-126.
[2]WANG S J,FANG C L,WANG Y,et al.Quantifying the relationship between urban development intensity and carbon dioxide emissions using a panel data analysis[J].Ecol.Indic.,2015,49:121-131.
[3]KANECO S,KATSUMATA H,SUZUKI T,et al.Electrochemical reduction of carbon dioxide to ethylene at a copper electrode in methanol using potassium hydroxide and rubidium hydroxide supporting electrolytes[J].Electrochim.Acta,2006,51(16):3316-3321.
[4]JITARU M,LOWY D A,TOMA M,et al.Electrochemical reduction of carbon dioxide on flat metallic cathodes[J].J.Appl.Electrochem.,1997,27(8):875-889.
[5]MISTRY H,RESKE R,ZENG Z,et al.Exceptional size-dependent activity enhancement in the electroreduction of CO2over Au nanoparticles[J].J.Am.Chem.Soc.,2014,136(47):16473-16476.
[6]DECICCIO D,AHN S T,SEN S,et al.Electrochemical reduction of CO2with clathrate hydrate electrolytes and copper foam electrodes[J].Electrochem.Commun.,2015,52:13-16.
[7]OGURA K.Electrochemical reduction of carbon dioxide to ethylene:mechanistic approach[J].J.CO2Util.,2013,1:43-49.
[8]ZHANG L,NIU D,ZHANG K,et al.Electrochemical activation of CO2in ionic liquid (BMIMBF4):synthesis of organic carbonates under mild conditions[J].Green Chem.,2008,10(2):202-206.
[9]SALEHI-KHOJIN A,JHONG H R M,ROSEN B A,et al.Nanoparticle silver catalysts that show enhanced activity for carbon dioxide electrolysis[J].J.Phys.Chem.C,2013,117(4):1627-1632.
[10]HORI Y.Electrochemical CO2reduction on metal electrodes[M]//Modern Aspects of Electrochemistry.New York:Springer,2008:89-189.
[11]HATSUKADE T,KUHL K P,CAVE E R,et al.Insights into the electrocatalytic reduction of CO2on metallic silver surfaces[J].Phys.Chem.Chem.Phys.,2014,16(27):13814-13819.
[12]TORNOW C E,THORSON M R,MA S,et al.Nitrogen-based catalysts for the electrochemical reduction of CO2to CO[J].J.Am.Chem.Soc.,2012,134(48):19520-19523.
[13]ZHOU L Q,LING C,JONES M,et al.Selective CO2reduction on a polycrystalline Ag electrode enhanced by anodization treatment[J].Chem.Commun.,2015,51(100):17704-17707.
[14]HE Z Q,SHEN J,NI Z L,et al.Electrochemically created roughened lead plate for electrochemical reduction of aqueous CO2[J].Catal.Commun.,2015,72:38-42.
[15]HE Z Q,LIU T,TANG J T,et al.Highly active,selective and stable electroreduction of carbon dioxide to carbon monoxide on a silver catalyst with truncated hexagonal bipyramidal shape[J].Electrochim.Acta,2016,222:1234-1242.
[16]KOSTECKI R,AUGUSTYNSKI J.Electrochemical reduction of CO2at an activated silver electrode[J].Ber.Bunsen-ges.Phys.Chem.,1994,98(12):1510-1515.
[17]CHEN Y H,LI C W,KANAN M W.Aqueous CO2reduction at very low overpotential on oxide-derived Au nanoparticles[J].J.Am.Chem.Soc.,2012,134(49):19969-19972.
[18]KÖLELI F,ATILAN T,PALAMUT N,et al.Electrochemical reduction of CO2at Pb- and Sn-electrodes in a fixed-bed reactor in aqueous K2CO3and KHCO3media[J].J.Appl.Electrochem.,2003,33(5):447-450.
[19]QIU J P,TANG J T,SHEN J,et al.Preparation of a silver electrode with a three-dimensional surface and its performance in the electrochemical reduction of carbon dioxide[J].Electrochim.Acta,2016,203:99-108.
[20]HSIEH Y C,SENANAYAKE S D,ZHANG Y,et al.Effect of chloride anions on the synthesis and enhanced catalytic activity of silver nanocoral electrodes for CO2electroreduction[J].ACS Catal.,2015,5(9):5349-5356.
[21]LU Q,ROSEN J,ZHOU Y,et al.A selective and efficient electrocatalyst for carbon dioxide reduction[J].Nat.Commun.,2014,5:3242.
[22]ROBERTS F S,KUHL K P,NILSSON A.High selectivity for ethylene from carbon dioxide reduction over copper nanocube electrocatalysts[J].Angew.Chem.Int.Edit.,2015,54(17):5179-5182.
[23]XU Y H,ZHANG H,CHU C P,et al.Dechlorination of chloroacetic acids by electrocatalytic reduction using activated silver electrodes in aqueous solutions of different pH[J].J.Electroanal.Chem.,2012,664:39-45.
[24]JEE M S,JEON H S,KIM C,et al.Enhancement in carbon dioxide activity and stability on nanostructured silver electrode and the role of oxygen[J].Appl.Catal.B—Environ.,2016,180:372-378.
[25]LI C W,KANAN M W.CO2reduction at low overpotential on Cu electrodes resulting from the reduction of thick Cu2O films[J].J.Am.Chem.Soc.,2012,134(17):7231-7234.
[26]LU Q,ROSEN J,JIAO F.Nanostructured metallic electrocatalysts for carbon dioxide reduction[J].ChemCatChem,2015,7(1):38-47.
[27]ROSEN J,HUTCHINGS G S,LU Q,et al.Mechanistic insights into the electrochemical reduction of CO2to CO on nanostructured Ag surfaces[J].ACS Catal.,2015,5(7):4293-4299.
[28]FLETCHER S.Tafel slopes from first principles[J].J.Solid State Electr.,2009,13(4):537-549.
[29]BACK S,YEOM M S,JUNG Y.Active sites of Au and Ag nanoparticle catalysts for CO2electroreduction to CO[J].ACS Catal.,2015,5(9):5089-5096.
[30]HOSHI N,KATO M,HORI Y.Electrochemical reduction of CO2on single crystal electrodes of silver Ag (111),Ag (100) and Ag (110)[J].J.Electroanal.Chem.,1997,440(1/2):283-286.
[31]YANO H,SHIRAI F,NAKAYAMA M,et al.Electrochemical reduction of CO2at three-phase (gas∣liquid∣solid) and two-phase(liquid∣solid) interfaces on Ag electrodes[J].J.Electroanal.Chem.,2002,533(1):113-118.
date:2017-06-22.
Prof.SONG Shuang,ss@zjut.edu.cn
supported by the National Natural Science Foundation of China (21477117,21177115) and the Natural Science Foundation of Zhejiang Province (LR14E080001).
Preparation of three-dimensional Ag electrode by oxidation-reduction cycle method in sodium phosphate aqueous solution for reduction CO2to CO
HE Zhiqiao,WEI Rongfei,YAN Tingting,XU Xuyang,CHEN Jianmeng,SONG Shuang
(College of Environment,Zhejiang University of Technology,Hangzhou310032,Zhejiang,China)
Silver electrode with a three-dimensional surface (3D-Ag) was synthesized by a facile oxidation-reduction cycle method.The structure and properties of the electrode were characterized by X-ray diffraction (XRD),field-emission scanning electron microscopy (FE-SEM),high-resolution transmission electron microscopy (HRTEM) and potential steps.The results showed that Ag nanoparticles with {100} and {111} facets exposed and a diameter of 30—150 nm dispersed uniformly on the as-prepared 3D-Ag.In comparison to untreated Ag plate,the synthesized 3D-Ag electrode exhibits superior activity,selectivity and stability toward electrocatalytic reduction of CO2to CO.Moreover,the 3D-Ag electrode could maintain its high activity during three successive periods of two hours,while the bulk silver electrode gradually lost its activity.The high performance of 3D-Ag electrode could be ascribed to that the Ag nanoparticles are beneficial to the stabilization of the surface adsorbed COOH species,and to the desorption of the reduction intermediates of adsorbed CO species during the reduction of CO2.
silver electrode; electrochemistry; nanostructure; carbon dioxide; reduction; carbon monoxide; cyclic voltammetry
O 643
A
0438—1157(2017)12—4809—07
10.11949/j.issn.0438-1157.20170797
2017-06-22收到初稿,2017-08-30收到修改稿。
联系人:宋爽。
何志桥(1973—),男,教授。
国家自然科学基金项目(21477117,21177115);浙江省自然科学基金杰出青年项目(LR14E080001)。

