响应面法优化黄秋葵总酚超声提取工艺及抗氧化活性
阮景军,韦小宝,严 俊,程剑平
(1.贵州大学农学院 贵阳 550025; 2.成都大学药学与生物工程学院 成都 625014)
响应面法优化黄秋葵总酚超声提取工艺及抗氧化活性
阮景军1,韦小宝1,严 俊2,程剑平1
(1.贵州大学农学院 贵阳 550025; 2.成都大学药学与生物工程学院 成都 625014)
为了确定黄秋葵果实中多酚类化合物超声辅助提取最佳工艺条件,并对其抗氧化活性进行评价,以黄秋葵果实为原料,使用丙酮作为提取溶剂(V丙酮∶V水∶V盐酸=70∶29∶1),采用超声波辅助法提取黄秋葵果实中的多酚类化合物。在单因素试验的基础上,利用响应面法优化黄秋葵果实中多酚类化合物的提取工艺,并建立数学模型,分析2个单因素之间的交互作用。结果表明,影响黄秋葵果实中总酚含量的显著因素为液料比、超声温度和超声时间,得到的最佳提取工艺条件为液料比20、超声温度51.2℃、提取时间18 min,此条件下提取到的多酚类化合物质量分数为(20.43±2.42)mg·g-1,且抗氧化试验结果表明,黄秋葵果实多酚类化合物具有很强的抗氧化活性。利用响应面法优化黄秋葵果实中总酚的最佳提取条件,试验结果与理论预测值拟合度高,可为黄秋葵果实总酚提取提供理论依据。
黄秋葵;总酚;超声波辅助提取;响应面
黄秋葵[Abelmoschus esculentus(L.)Moench]是锦葵科、秋葵属一年生草本植物,俗称羊角豆,又名咖啡秋葵、补肾草和咖啡黄葵等,原产于非洲和南美热带丛林地区,在我国南、北方均有种植。目前,全国各地种植的黄秋葵主要出售嫩果,其嫩果不仅富含多种蛋白质、糖、黄酮和多不饱和脂肪酸[1-2]等活性物质,而且其酚类物质的含量也较高[2]。天然植物酚类化合物具有消除自由基及抗氧化、降脂、抗骨质疏松、抗心血管疾病和防癌抗癌等作用[3-5],黄秋葵嫩果由于富含多种氨基酸、糖类和多不饱和脂肪酸等营养成分以及其他多种生物活性物质如酚类、黄酮类和维生素等[6],素有“蔬菜王”之称,具有健脾胃、保护肝脏和心脏、通淋利尿、增强血管扩张力、减少肺损伤、提高机体免疫力、抗疲劳等多种保健功能[7-8],是一种很有发展潜力的保健型营养蔬菜[9]。其天然产物及其加工产品可广泛用于医药卫生、食品加工、保健品生产和化妆品研发等行业[10],具有非常广阔的开发和应用前景。
由于超声-微波协同萃取生物活性物质的方法具有操作简单、能耗低、生产成本低、提取率高和提取时间短等优点,已广泛应用于蛋白质、脂类、糖类、色素分子、黄酮类、酚类和果胶等物质的提取[10-15]。笔者以黄秋葵鲜果为原料,采用超声-微波协同萃取法提取黄秋葵鲜果中的总酚,通过响应面法优化黄秋葵鲜果总酚提取工艺,并检测总酚的抗氧化活性,为开发利用黄秋葵鲜果中的酚类物质、提高黄秋葵的利用效益提供理论依据。
1 材料与方法
1.1 材料
成熟的黄秋葵果实于2015年8月采自贵州兴义。
1.2 方法
1.2.1 样品前处理 黄秋葵鲜果经低温预冷处理后,真空冷冻干燥36 h,经万能粉碎机粉碎后倒入烧杯中,再按液料比20加入石油醚,于25℃避光浸提脱脂18 h,静置待澄清后去除上清液,残渣避光自然风干,于-20℃保存备用。
1.2.2 超声波辅助溶剂法提取黄秋葵鲜果中总酚 参考侯学敏等[16]的方法,略有改动。精确称取0.500 0 g黄秋葵鲜果(已脱脂)倒入50 mL离心管中,按液料比20加入丙酮(70%),漩涡 30 s,置于超声波清洗机中,50℃条件下超声抽提20 min,4 000 r·min-1离心10 min,残渣再重复抽提 2次,然后合并2次抽提的上清液。取出2 mL上清液用甲醇(含1%甲酸)定容至5 mL,用于总酚测定,样品先经0.45 μm纤维素膜过滤,再经HPLC检测。剩余的溶液于37℃真空旋转蒸发去除溶剂,-80℃保存。
1.2.3 黄秋葵鲜果中总酚抽提单因素试验 首先对抽提溶剂种类、溶剂体积分数、液料比、超声温度及超声时间进行单因素试验,以确定各因素对抽提效果的最适条件。单因素试验各因素的设定值参照1.2.2节,抽提试验因素为丙酮(70%)、液料比20、温度50℃、时间20 min,单因素试验中只改变单因素项,其余的抽提条件不变。抽提溶剂选用甲醇、乙醇、正丁醇、乙酸乙酯、丙酮和三氯甲烷(体积分数为70%,含1%的盐酸),有机溶剂选用丙酮,体积分数分别为40%、50%、60%、70%、80%,液料比分别选用 10、20、30、40,超声时间分别选用 10、20、30、40、50 min,超声温度分别选用 30、40、50、60、70℃。
1.2.4 响应面试验优化黄秋葵鲜果中酚类化合物抽提工艺 依据单因素的试验结果,应用Box-Behnken试验设计软件,以总酚含量为响应值,对液料比、超声温度和超声时间3个因素进行响应面分析。各因素及水平编码见表1。
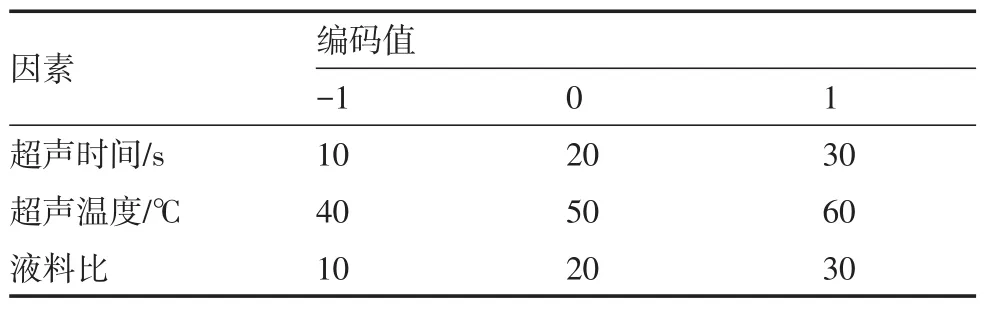
表1 黄秋葵鲜果中酚类化合物抽提因素水平(部分)
1.3 指标测定
总酚含量测定参考魏征等[15]的方法。取100 μL样品溶液和各梯度的标准液放入10 mL具塞试管中,依次向试管中加入3 mL的蒸馏水、250 μL的福林酚试剂、750 μL 20%(ω)的 Na2CO3溶液和 900 μL的蒸馏水,总体积为5 mL。漩涡混匀后于40℃水浴30 min,波长760 nm测其吸光值,空白对照为100 μL蒸馏水,其余条件不变。以没食子酸为标准液,测定结果以没食子酸的当量数表示(mg·g-1,鲜质量),最后得到的总酚标准曲线为y=0.002 1x-0.047(R2=0.9962),其线性范围在 50~1 000 μg·mL-1之间。
黄秋葵鲜果中总酚抗氧化能力测定参考Yao[12]的方法测定ORAC(氧化自由基吸收能力)活性。将100 μmol·L-1DPPH(1,1-二苯基-2-三硝基苯肼)溶于96%乙醇,将1 mL DPPH溶液与1 mL样品混匀,室温黑暗环境中静置10 min。最后将所得溶液在517 nm测吸光值,结果以每克Trolox equivalents(TE)(6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸)含有多少μg样品来表示。50 μL不同浓度的样品(0~5 mg·mL-1)放在一个 96 孔板,加入 50 μL 的荧光素溶液混合均匀,然后迅速加入150 μL AAPH到每个孔中混匀,构建空白对照和Trolox的标准衰减曲线,50 μL空白(甲醇)或Trolox的标准溶液中加入空白对照孔中作为参比溶液。将该微量培养板立即放置到the Synergy™微量荧光分光光度计中(Bio-Tek Instruments,Inc.,Winooski,VT,USA),每分钟读取1个值,共读80 min。该微量荧光分光光度计的荧光过滤器激发波长设置在485 nm,误差为±20 nm,发射波长设定在530 nm,误差为±20 nm,工作温度为37℃。样品的每个ORAC值是通过使用Trolox的浓度和荧光衰减曲线(AUC)下的净区域之间的回归方程计算。对应于一个样品的净AUC是通过空白对照的AUC减去样品的AUC计算出的。ORAC值表示为每克Trolox equivalents(TE)含有多少μg样品。
1.4 数据处理
采用Office 2010统计所有数据,并采用SPSS 22.0进行ANOVA和Duncan’s差异显著性分析,并采用Design-Expert 10进行响应面分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 抽提溶剂种类对黄秋葵鲜果总酚提取的影响 在抽提溶剂体积分数为70%条件下,进行不同提取溶剂的单因素试验。图1表明,不同的抽提溶剂对黄秋葵鲜果中的总酚含量有较大影响。甲醇、乙醇和丙酮的提取量明显高于正丁醇、乙酸乙酯和三氯甲烷的提取量。其中,丙酮作为抽提试剂提取黄秋葵鲜果总酚质量分数为64.8 mg·g-1,高于甲醇和乙酸乙酯作为抽提试剂时提取的总酚含量。因此,选用丙酮作为黄秋葵鲜果酚类物质提取溶剂的效果较好。
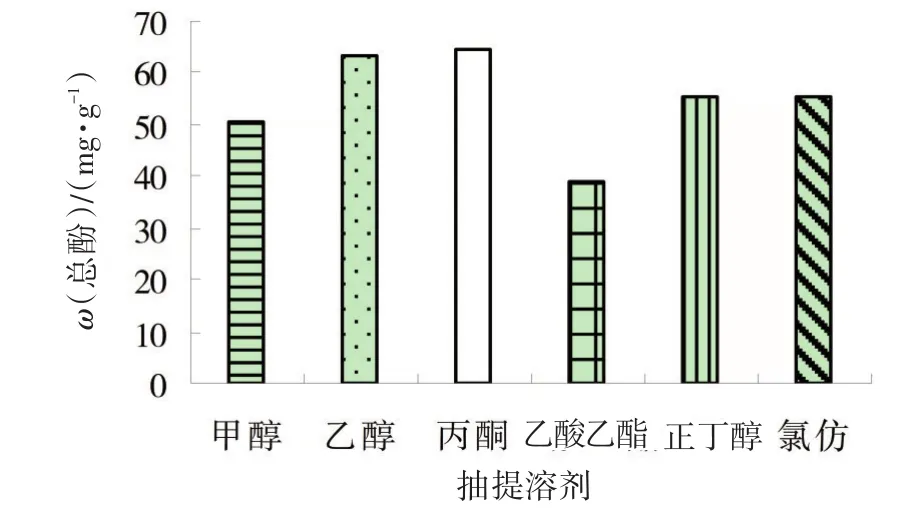
图1 抽提溶剂种类对黄秋葵鲜果总酚提取的影响
2.1.2 丙酮体积分数对黄秋葵鲜果总酚提取的影响 在以丙酮为提取溶剂、液料比20、超声温度50℃、超声时间20 min条件下,进行不同丙酮体积百分数单因素试验。由图2可知,黄秋葵鲜果中总酚类物质含量在丙酮体积分数60%~80%之间差异不明显,可能因为丙酮体积分数过高时,会使样品中某些脂溶性和醇溶性的杂质析出增多,这些成分往往与丙酮-水分子进行竞争性结合。因此,干扰因素随之增大,不仅会导致总酚含量下降,还可能给后续提取和加工工作带来不利影响[16]。综合考虑,选择体积分数为70%的丙酮水溶液作为溶剂进行抽提。
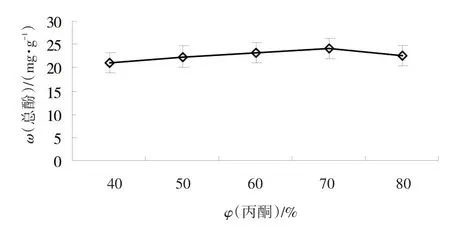
图2 丙酮体积分数对黄秋葵鲜果总酚提取的影响
2.1.3 液料比对黄秋葵鲜果总酚提取的影响 以70%丙酮为提取溶剂、提取超声温度为50℃、提取超声时间为20 min条件下,进行不同液料比的单因素试验。图3表明,在液料比10~20范围内,黄秋葵鲜果总酚含量在不同条件下含量均随提取溶剂用量增加而增大;但液料比大于20的情况下,总酚含量呈下降趋势。综合考虑以上各个因素,液料比为20的条件下的提取效果较好。
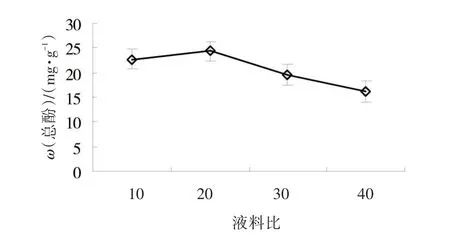
图3 料液比对黄秋葵鲜果总酚提取的影响
2.1.4 提取时间对黄秋葵鲜果中总酚提取的影响 以70%丙酮为提取溶剂、液料比为20、超声温度为50℃条件下,进行不同超声提取时间的单因素试验。提取时间对总酚提取影响较大(图4),黄秋葵鲜果中总酚含量在抽提时间10~20 min内,随超声时间的延长明显增加,提取时间超过20 min后随超声提取时间的延长而逐渐降低。一般超声提取时间越长,提取的酚类物质的含量越高,但超声提取时间大于20 min后,其提取含量反而降低,这可能是由于超声时间过长,其他的脂溶性成分也随之析出,因此,超声抽提时间20 min时总酚提取效果较好。
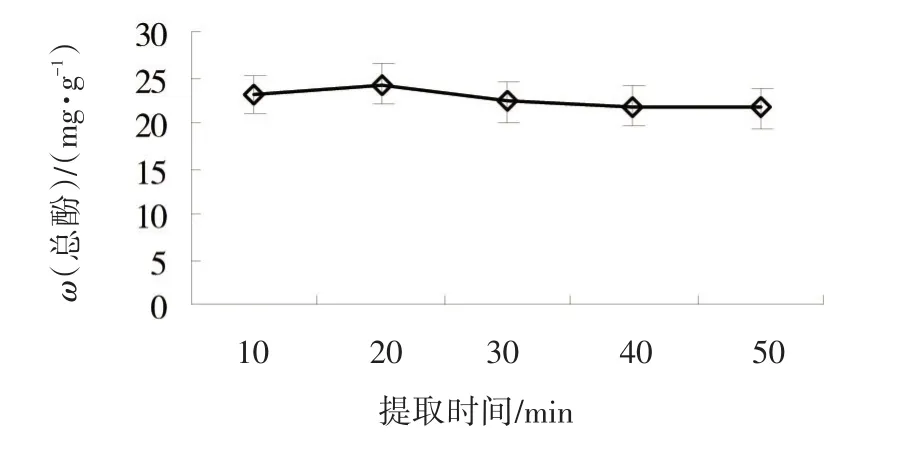
图4 提取时间对黄秋葵鲜果总酚提取的影响
2.1.5 超声温度对黄秋葵鲜果总酚提取的影响以70%丙酮为提取溶剂、液料比为20、超声时间为20 min条件下,进行不同超声温度的单因素试验。由图5可知,在30~50℃范围内,随着超声温度的提高,黄秋葵鲜果总酚含量相应提高,总酚含量在50℃时达到最大值,随后逐渐下降。
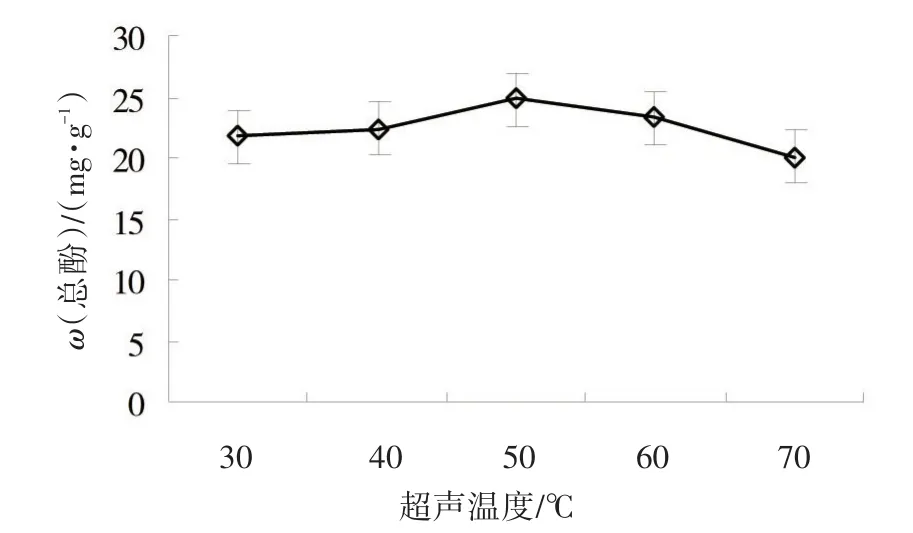
图5 超声温度对黄秋葵鲜果总酚提取的影响
2.2 响应面优化试验结果
2.2.1 回归方程的建立与方差分析 由单因素试验结果可知,不同单因素对黄秋葵鲜果中总酚提取效果的影响基本相同,结合单因素试验结果,最终选择超声时间、液料比和超声温度3个因素为自变量,以总酚含量作为响应值,对超声波辅助提取黄秋葵鲜果总酚参数进行响应面法优化分析。根据试验结果(表2),经Design-expert 10.0.0软件对试验数据进行回归分析(表3),二次回归拟合后,得到超声辅助溶剂提取圆黄秋葵鲜果总酚数据分析值。
从表3可知,以总酚含量为响应值的回归模型极显著,该模型相关系数R2=0.999 8,校正决定系数R2Adj=0.923 5,失拟项P=0.4527>0.05,失拟不显著。拟合曲线为Y=23.40+0.51A+0.2B+0.74C-0.72AB-0.81AC-0.83BC-2.08A2-2.47B2-1.99C2。一次项中超声时间对总酚含量的线性效应显著;二次项中超声提取时间对总酚含量曲面效应显著,液料比和超声温度极显著;交互项中,液料比和超声温度间差异达到极显著,证明该模型与试验拟合度较好,而且变量与响应值之间线性关系显著,可用于对总酚提取试验理论值的推测。由F检验得到的各个因素影响大小顺序为:超声时间>液料比>超声温度。
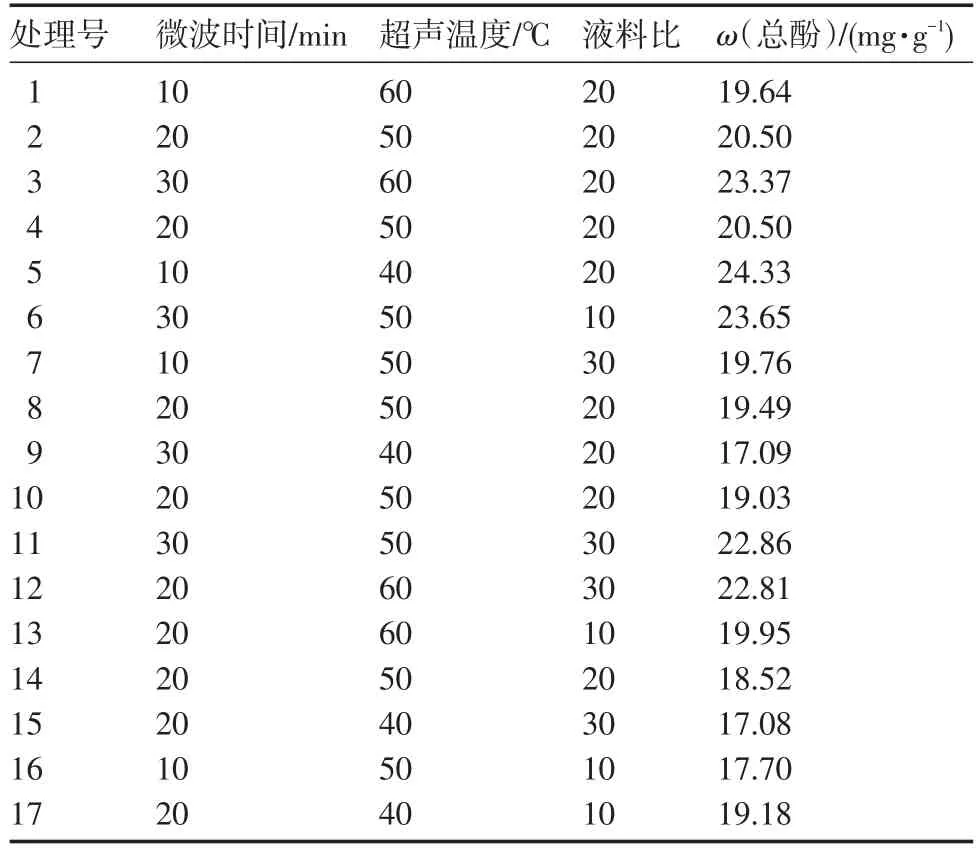
表2 响应面试验设计及结果
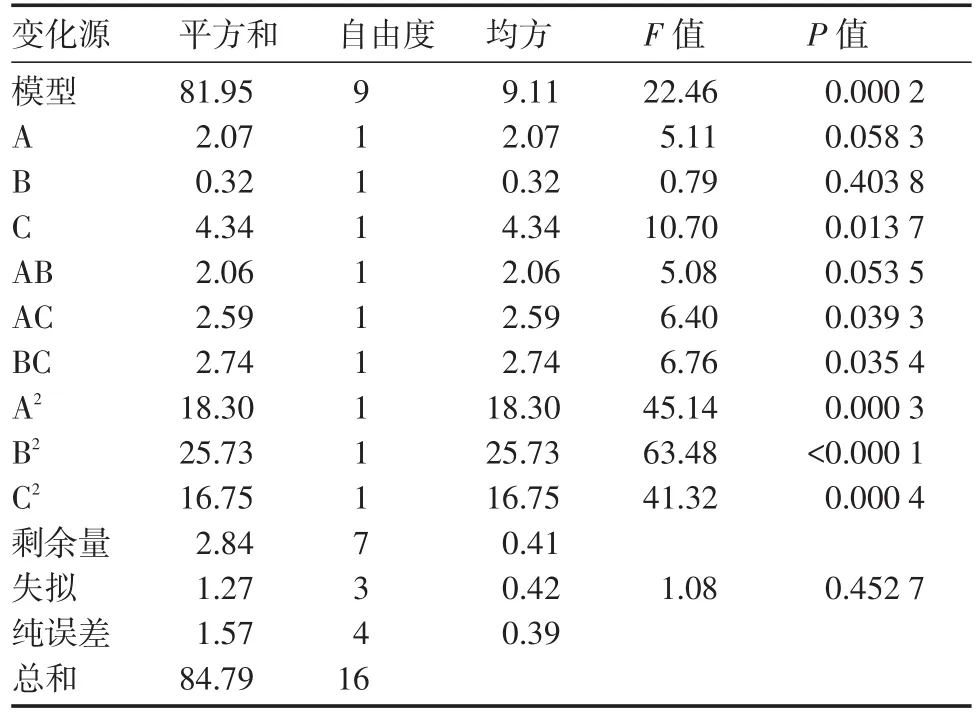
表3 总酚含量回归方程各项方差分析
2.2.2 响应面分析 通过Box-Behnken法所得到的多元二次回归模型及其得到的响应面图和等高线图等,可用于评价单因素对黄秋葵鲜果中总酚含量的影响的两两交互作用,可以确定各个因素之间的最佳水平范围。
各单因素交互作用的响应面立体分析见图6,可较直观地看出各单因素相互作用对黄秋葵鲜果中总酚含量的影响,超声提取时间对总酚提取工艺的影响最大,表现为响应面曲线较陡;而液料比和超声温度对总酚含量的影响较小,表现为其响应面曲线较平滑,并且,随着其数值的变化响应值变化也较小。从图6-b可以看出,响应面曲线较陡,说明超声温度和液料比相互作用对总酚含量的影响较明显,这符合方差分析的结果。图6-c响应曲面曲线较陡,图6-b次之,图6-a则最为平缓,说明超声温度和液料比间相互作用对总酚含量的影响最为明显,这与通过方差分析的结果相一致。
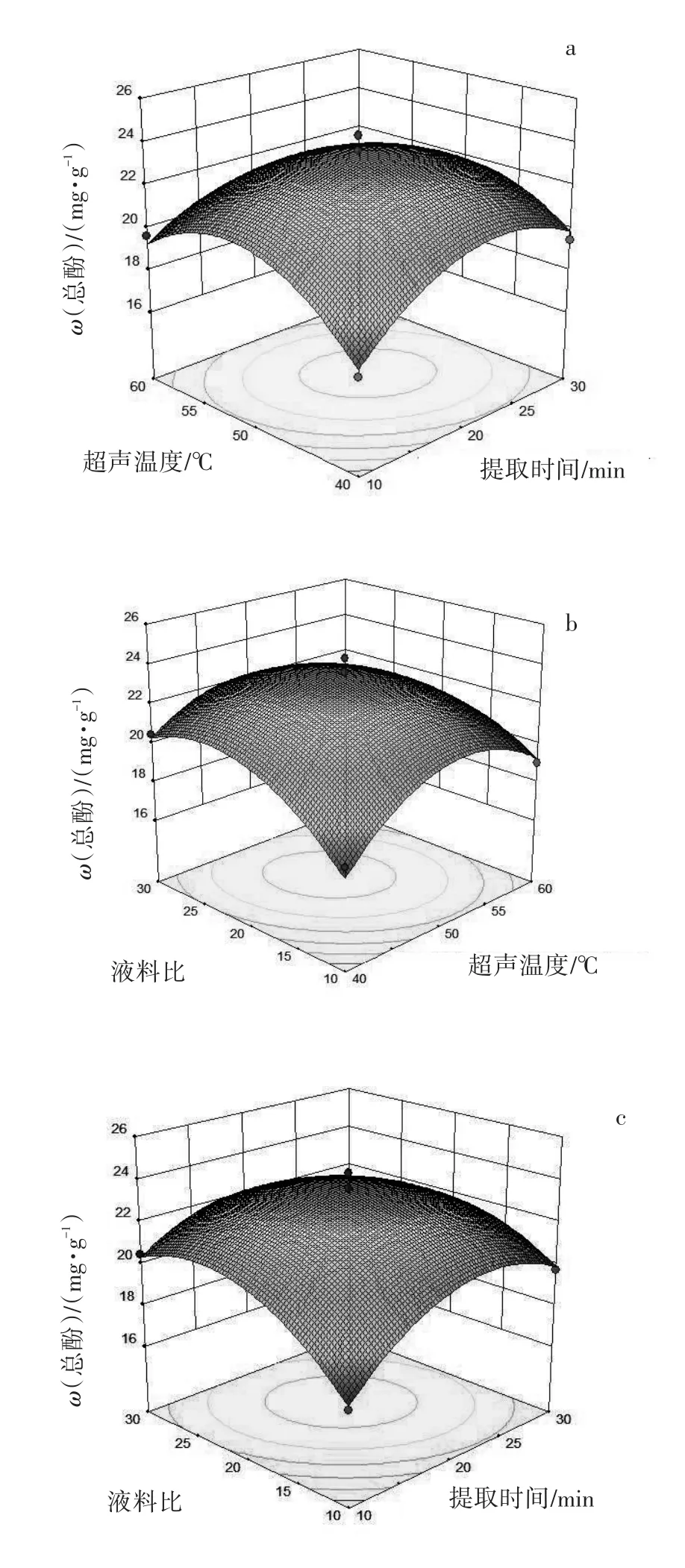
图6 各因素交互作用对总酚含量影响的响应面图
2.2.3 验证试验结果 采用Design-Expert 10.0软件,根据所建立的数学模型对参数进行最优化分析,得到的最佳提取工艺条件为:液料比20、超声温度51.2℃、提取时间18 min,在此条件下进行3组平行试验作验证,总酚类物质的质量分数为(22.43±2.42)mg·g-1,实际得到的结果与理论预测值之间能够高度吻合。因此,通过响应面优化得到的最佳提取工艺条件真实可靠,很有应用价值。
2.3 抗氧化试验结果
用四乙基氯化铵(TEAC)的值表示1,1二苯基-2三硝基苯肼(DPPH)和氧自由基吸收能力(ORAC)即自由基的清除率,来评价黄秋葵总酚对自由基的清除能力。推荐使用一种以上的方法,可以对抗氧化功效进行一个较全面的预测[14],结果见表4。
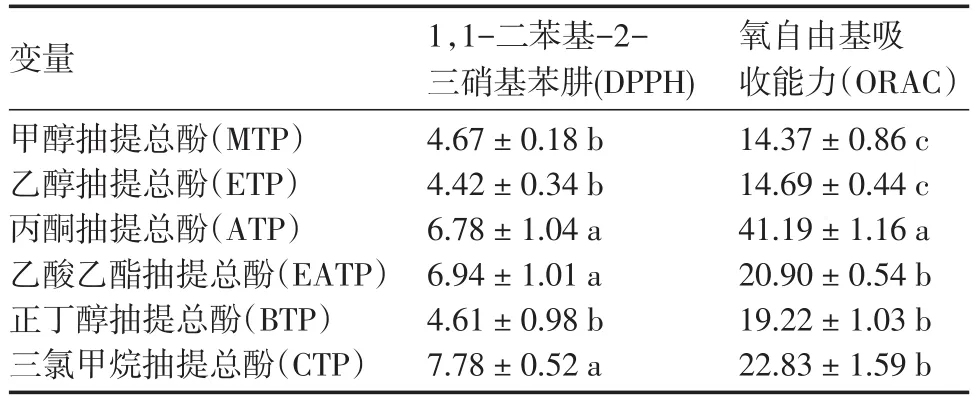
表4 不同有机溶剂抽提物的DPPH和ORAC清除率
2.3.1 DPPH法测酚类物质的抗氧化能力 DPPH是相对稳定的有机自由基基团,已被广泛应用于不同的植物提取物的抗氧化活性的测定。DPPH在有机溶剂中是一种稳定的自由基,能接受一个电子或者氢离子,在波长为517 nm下具有最大吸收值。当有自由基清除剂存在时,DPPH的单电子会被自由基清除剂捕捉而使其自身颜色变浅,在最大光吸收波长处的吸光值下降,且吸光值下降的程度呈线性关系,吸光度下降表明其抗氧化性增加,从而可以评价该样品的抗氧化能力。在这项研究中,乙酸乙酯抽提总酚(EATP)显示出最高的DPPH值,随后是丙酮抽提总酚(ATP)。
2.3.2 ORAC法测酚类物质的抗氧化能力 ORAC的标准单位为 μmol Trolox当量(TE)/g或 μmol Trolox当量(TE)/mL,表示每g或每mL样品的抗氧化力,丙酮抽提总酚(ATP)表现最高的ORAC值,黄秋葵总酚的抗氧化能力在这里是首次报道。
3 讨论
黄秋葵鲜果中多酚类物质提取工艺,受原料预处理和测定方法等多种因素的影响,并且前处理对结果的影响远大于测定方法。黄秋葵鲜果中多酚类物质的常用提取溶剂有丙酮、乙醇、甲醇、乙酸乙酯和水等。由于每种溶剂的极性不同,对多酚类物质的提取效果和提取物的抗氧化能力存在较大差异。魏征等[15]将上述几种常用溶剂最佳体积分数的提取效率进行了对比分析,得出以50%~75%的丙酮溶液提取圆叶葡萄多酚,其提取效果要优于60%乙醇和70%甲醇。Xu等[17]比较了6种常用提取溶剂对8种主要豆类食品中多酚类物质的提取效率之间的差异,得出相似的结论,即酸化的70%丙酮(含0.5%乙酸)或80%丙酮对多酚类物质的提取有最佳效率,这均与笔者得到的结果一致。在多酚类物质的提取试验中,提取量与液料比之间存在交互作用,通常提取溶剂的用量越大,提取的效果越好,即提取等量的酚类化合物所需溶剂的用量也越多。但溶剂用量过大,一方面会造成资源浪费,另一方面也会对后续的过滤、浓缩和纯化等工作带来一些麻烦。笔者在大量前人试验的基础之上设计试验[17-18],提取和抗氧化性结果表明,本次试验取得了较好的效果。
超声波产生的热效应和机械作用可以使植物细胞内的可溶性物质快速释放、扩散并溶解进入溶剂中,同时由于没有经过高温和高压,可以较好地保持提取物的结构和活性,具有提取时间短、效率高和消耗溶剂少等优点,尤其对于多酚类物质等热敏性物质,超声提取的优势尤为明显。张艳霞等[19]采用超声辅助双水相法提取石榴皮多酚类化合物,结果表明,最佳的提取工艺参数为:超声时间32 min、超声温度40℃、硫酸铵用量0.36 g·mL-1(每mL水硫酸铵用量为0.36 g)、液料比为37,在此条件下提取,多酚的得率为(10.63±0.28)%。蒋孟君等[20]采用响应面辅助超声提取食用玫瑰花总酚类物质,结果表明,提取温度是影响食用玫瑰多酚提取效果的主要因素;超声提取的最佳条件为乙醇体积分数70%、提取温度40℃、液料比25、提取3次,每次40 min,经试验验证,此条件下总多酚质量分数为93.81 mg·g-1。超声温度过低,提取率低;超声温度过高,会导致热不稳定性和挥发性成分易被破坏和挥发,使得多酚类物质提取量降低;多酚含量随液料比降低而升高,但液料比过小会为后续的浓缩操作带来不便;超声时间太短,提取率过低,超声时间过长,可能会导致多酚类物质的氧化分解。笔者采用超声辅助溶剂提取黄秋葵鲜果中的总酚类物质,超声提取时间对总酚类物质提取工艺的影响最大,最佳抽提条件为:液料比20、超声温度51.2℃和超声时间18 min。在此条件下进行验证试验,得到的总酚类物质质量分数为(20.43±2.42)mg·g-1。
酚类物质抗氧化能力的测定,虽然DPPH方法简便、快速,但一般只有2~3倍相对较小的线性反应范围。此外,DPPH自由基可以通过其他还原剂以及H转移脱色,可能会导致测定的值不够准确。ORAC法是可以把抑制时间和抑制程度结合成一个单一的量而进行的唯一准确的测定方法。
4 结论
根据单因素试验结果,选择液料比、超声时间和超声温度3个因素对黄秋葵鲜果中苯酚的提取工艺进行响应面优化分析,得到的最佳抽提工艺条件为:液料比20、超声温度51.2℃和超声时间18 min。在此条件下进行验证试验,得到的总酚类物质质量分数为(20.43±2.42)mg·g-1,实际结果与理论预测拟合度高。
[1]NORATTO G D,ANGEL M G,TALCOTT S T,et al.Polyphenolics from açaí(Euterpe oleraceaMart.)and red muscadine grape(Vitis rotundifolia)protect human umbilical vascular endothelial cells(HUVEC)from glucose-and lipopolysaccharide(LPS)-induced in flammation and target microRNA-126[J].Journal of Agricultural and Food Chemistry,2011,59(14):7999-8012.
[2]华雨薇,李春阳,王帆,等.蓝莓叶多酚对高脂小鼠血脂及肝脏组织的影响[J].食品科学,2015,36(12):34-38.
[3]GOURINENI V,SHAY N F,CHUNG S,et al.Muscadine grape(Vitis rotundifolia)and wine phytochemicals prevented obesity-as⁃sociated metabolic complications in C57BL/6J mice[J].Journal of Agricultural and Food Chemistry,2012,60(31):7674-7681.
[4]MERTENS T S U,LEE J H,PERCIVAL S S,et al.Induction of cell death in Caco-2 human colon carcinoma cells by ellagic acid rich fractions from muscadine grapes(Vitis rotundifolia)[J].Journal of Agricultural and Food Chemistry,2006,54(15):5336-5343.
[5]HUDSON T S,HARTLE D K,HURSTING S D,et al.Inhibition of prostate cancer growth by muscadine grape skin extract and resveratrol through distinct mechanisms[J].Cancer Research,2007,67(17):8396-8405.
[6]李加兴,陈选,邓佳琴,等.黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J].食品科学,2014,35(10):121-125.
[7]薛治浦,李欣,朱文学.响应面法优化丹参叶总酚酸超声波辅助提取工艺[J].食品科学,2011,32(12):34-38.
[8]PARK Y J,BISWAS R,PHILLIPS R D,et al.Antibacterial activities of blueberry and uscadine phenolic extracts[J].Journal of Food Science,2011,76(2):101-105.
[9]BROWN J C,JIANG Xiuping.Activities of muscadine grape skin and polyphenolic constituents againstHelicobacter pylori[J].Journal of Applied Microbiology,2013,114(4):982-991.
[10]KIM S,NISHIMOTO S K,BUMGARDNER J D,et al.A chitosan/β-glycerophosphate thermo-sensitive gel for the delivery of ellagic acid for the treatment of brain cancer[J].Biomaterials,2010,31(14):4157-4166.
[11]MAZZONE G,TOSCANO M,RUSSON.Density functional predic⁃tions of antioxidant activity and UV spectral features of nasutin A,isonasutin,ellagic acid,and one of its possible derivatives[J].Journal of Agricultural and Food Chemistry,2013,61(40):9650-9657.
[12]YAO Y,SHI Z,REN G.Antioxidant and immunoregulatory activity of polysaccharides from quinoa(Chenopodium quinoaWilld.)[J].International journal of molecular sciences,2014,15(10):19307-19318.
[13]BINDON K A,MADANI S H,PENDLETON P,et al.Factors affecting skin tannin extractability in ripening grapes[J].Journal of Agricultural and Food Chemistry,2014,62(5):1130-1141.
[14]LU Zhongwei,LIU Yajun,ZHAO Lei,et al.Effect of low-intensity white light mediated de-etiolation on the biosynthesis of poly⁃phenols in tea seedlings[J].Plant Physiology and iochemistry,2014,80(7):328-336.
[15]魏征,赵雅娇,黄羽,等.响应面试验优化超声波辅助提取圆叶葡萄鞣花酸和总酚工艺[J].食品科学,2015,36(12):29-35.
[16]侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128.
[17]XU CM,ZHANG YL,CAO L,et al.Phenolic compounds and antioxidant properties of different grape cultivars grown in China[J].Food Chemistry,2010,119(4):1557-1565.
[18]YOU QI,CHEN FENG,WANG XI,et al.Analysis of phenolic composition of noble muscadine(Vitis rotundifolia) by HPLC-MS and the relationship to its antioxidant capacity[J].Journal of Food Science,2012,77(10):C1115-C1123 .
[19]张艳霞,朱彩平,邓红,等.超声辅助双水相提取石榴皮多酚[J].食品与发酵工业,2016,42(12):150-156.
[20]蒋孟君,王艺,任建青,等.超声提取食用玫瑰花总酚及其大孔树脂纯化前后抗氧化活性[J].食品工业科技,2017,38(18):155-165.
Total phenols from okra fruits:optimization of extraction process by response surface methodology and antioxidant activity
RUAN JingJun1,WEI Xiaobao1,YAN Jun2,CHENG Jianping1
(1.College of Agriculture,Guizhou University,Guiyang 550025,Guizhou,China;2.School of Pharmacy and Bioengineering,Chengdu University,Chengdu 610106,Sichuan,China)
To explore the optimal ultrasonic-assisted extraction conditions of total phenols from Okra Fruits and evaluate the antioxidant.The polyphenols in the fruit of okra were extracted by acetone as the extraction solvent(acetone-waterhydrochloric acid volume ratio 70∶29∶1).On the basis of single factor experiment,the extraction process of polyphenols in okra fruit was optimized by response surface methodology,and the mathematical model was established to analyze the interaction between two single factors.The results showed that ratio of liquid to solid,ultrasonic temperature and ultrasonic time to be the most signi fi cant factors affecting the extraction ef fi ciencies of total phenols.The optimum extraction conditions for total phenols from Okra fruits were determined as follows:ratio of liquid to solid,20,ultrasonic temperature,51.2℃,extraction time 18 min.The predicted content of total phenols under these conditions was(20.43±2.42)mg·g-1,agreeing with the experimental values.Response surface methodology is applicable for the optimization of ultrasonic extraction of total phenols from Okra fruits.The total phenols from Okra fruits have strong antioxidant capacity.These investigations will be theoretical reference for further development and utilization of Okra fruits.
Okra fruits;Total phenols;Ultrasonic-Assisted extraction;Response surface methodology
2017-07-10;
2017-10-31
国家自然科学基金(31660531)
阮景军,男,副教授,主要从事作物遗传育种研究。E-mail:chenggy508@sohu.com
程剑平,男,教授,博士生导师,主要从事作物遗传育种和植物营养研究。Tel:0851-201611019;E-mail:chengjianping63@qq.com

