不同感染途径致大鼠肺炎模型制备的比较
丁军颖,高翔,洪燕英,桂红,韦志友,丁雪霏 卢幼然,安世栋,崔煦然,郭玉红,刘清泉*
(1.首都医科大学附属北京中医医院 北京市中医研究所 中医感染性疾病基础研究北京市重点实验室,北京 100010; 2.首都医科大学附属北京中医医院,北京 100010)
研究报告
不同感染途径致大鼠肺炎模型制备的比较
丁军颖1#,高翔2#,洪燕英2,桂红2,韦志友1,丁雪霏1卢幼然1,安世栋1,崔煦然1,郭玉红2,刘清泉1*
(1.首都医科大学附属北京中医医院 北京市中医研究所 中医感染性疾病基础研究北京市重点实验室,北京 100010; 2.首都医科大学附属北京中医医院,北京 100010)
目的探索铜绿假单胞菌致大鼠肺炎模型的制备方法,为后续研究奠定实验基础。方法将Sprague-Dawley(SD)大鼠48只随机分为4组:A对照组、B气管注射组、C气管插管感染组和D滴鼻感染组。适应饲喂3 d后,分别给予不同造模干预,分别于干预后5、10和15 d动态监测各亚组大鼠体重、体温、白细胞数、肺组织病理学变化等。结果各模型组大鼠行为学表现、体重、体温、白细胞、肺组织炎症病理学表现均与对照组差异有显著性;②各模型组均证实为铜绿假单胞菌感染,对照组则阴性。结论经滴鼻途径以铜绿假单胞菌感染大鼠,可得到合格大鼠肺炎模型;此感染途径可避免手术创口带来的炎症反应干扰,简便易行,可推广。
铜绿假单胞菌;耐药菌;肺炎;炎症反应;大鼠
重症肺炎是临床较为常见的急危重症[1],稳定可靠的动物模型是研究重症肺炎防治及机制的必要前提与基础。细菌性肺炎是最常见的重症肺炎[2,3],可因细菌泛耐药多耐药而不治致死,所以国内外学者都在积极寻求包括中医药在内的有效防治途径,耐药菌致肺炎的动物模型制备显得尤为重要。目前虽有所报道,但多因制备过程复杂或动物品系所限[4,5],尚不能大批量获取用于中医药防治耐药菌致肺炎研究的SD大鼠模型。
本研究将对比不同感染途径,通过SD大鼠生理病理状态及肺组织病理学变化等进行初步鉴定,再结合肺组织分离的PA,据重症肺炎诊断标准进一步鉴定,最终确定高效感染途径的同时,为后续研究提供稳定可靠的模型。
1 材料与方法
1.1 材料
1.1.1 实验动物
6~8周龄SPF级SD雄性大鼠48只,体重(160±10)g,购自北京维通利华实验动物技术有限公司【SCXK(京)2011-0011】;实验操作于北京市中医研究所【SYXK(京)2013-0002】,并经过本院动物伦理委员会审批【2015070102】。
1.1.2 试剂与仪器
铜绿假单胞菌由临床分离获得,经三家三甲医院(北京中医药大学东直门医院、首都医科大学附属北京朝阳医院和首都医科大学附属北京中医医院)互证,编号PA-R003,留存备用。实验研究前常规复苏培养,以生理盐水调整麦氏浊度值至1,获取新鲜菌液备用。
本实验所及仪器均为实验室常规仪器。
1.2 方法
1.2.1 动物分组
随机分为对照组、模型1组、模型2组和模型3组,每组12只;模型干预前适应饲喂3 d,干预当天设为 0 d,干预后第5、10和15天处死的分别设为各组的Ⅰ、Ⅱ和Ⅲ亚组;各亚组分笼饲养,每笼4只,饲养条件为恒温(20±4)℃,光照和黑暗12 h更替,自由进食及饮水。
1.2.2 气管注射感染
大鼠常规麻醉后,仰卧位固定于操作台上,将舌头拉出口外固定,暴露声门,以导管插入气管约0.5 cm,拔出导丝,以注射器将0.6 mL菌液经导管注入大鼠气管,尤其最后加注少许空气,以确保菌液全部进入气管[6]。
1.2.3 气管插管感染
大鼠常规麻醉后,仰卧位固定于操作台上,颈部消毒、备皮,逐层切开颈部皮肤至暴露上段气管(如图1示),以Y 型静脉留置针经气管插管,拔出针芯,将0.6 mL菌液由留置针白色帽端处注入。切口缝合,保持大鼠直立位1 min,确保菌液进入气管支气管[7,8]。
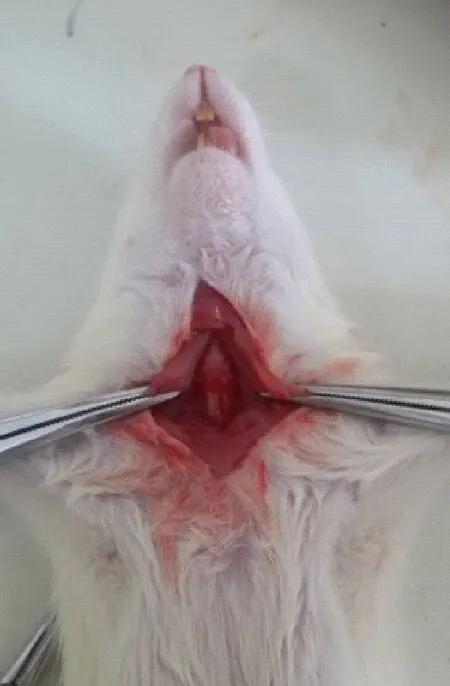
图1 大鼠颈部气管暴露示意图Fig.1 Diagram of surgical exposure of the cervical trachea in a rat
1.2.4 滴鼻感染
大鼠常规麻醉后,使大鼠鼻孔处于45度向上倾斜状态,将0.6 mL菌液以微量加样器滴入鼻腔,再改变大鼠体位,使其保持直立位约 1 min,确保菌液进入气管支气管。
对照组大鼠用0.6 mL生理盐水滴鼻。上述各种干预后 24 h 内死亡的排除出实验,并重新以相同干预的大鼠替代入组。
1.3 诊断标准
参考 2016 年中国医师协会急诊医师分会发布的“中国急诊重症肺炎临床实践专家共识”,2016年中华医学会呼吸病学分会发表的“中国成人社区获得性肺炎诊断和治疗指南”和Luna 等关于重症耐甲氧西林金黄色葡萄球菌肺炎动物模型诊断标准,结合预试验结果确定本研究大鼠重症肺炎模型制备成功的诊断标准:(1)出现反应迟缓、嗜睡、进食饮水减少等;(2) 呼吸喘促,可见明显双胸廓运动;(3) 体重增长低于3 g/d,体温>38℃,即呈现高温;(4) 血及双肺典型炎症表现:白细胞>15×109/L,肺组织出现炎细胞浸润和或出血等。
1.4 动态监测
1.4.1 生理观察
观察大鼠生理病理状况是否主动摄食摄水;是否呆滞、竖毛、嗜睡;鼻腔及眼眶有无分泌物;有无气促,有无喘鸣音;尿色、量及粪便变化等。
1.4.2 体重监测
适应饲喂时开始记录体重,干预后于处死前记录各亚组大鼠体重。
1.4.3 体温监测
从适应饲喂开始每天监测大鼠体温,探测时,使其处于自然状态,避免过于紧张,将兽用电子体温计软头部位插入直肠约 5~8 cm,读数即可。
1.4.4 血中白细胞监测
各亚组大鼠常规麻醉后,无菌开腹,腹主动脉取血(如图2示)。
常规显微镜下细胞计数,四个大方格白细胞为N,按如下公式计算白细胞数(109/L)=(N×10×20/4) ×106。
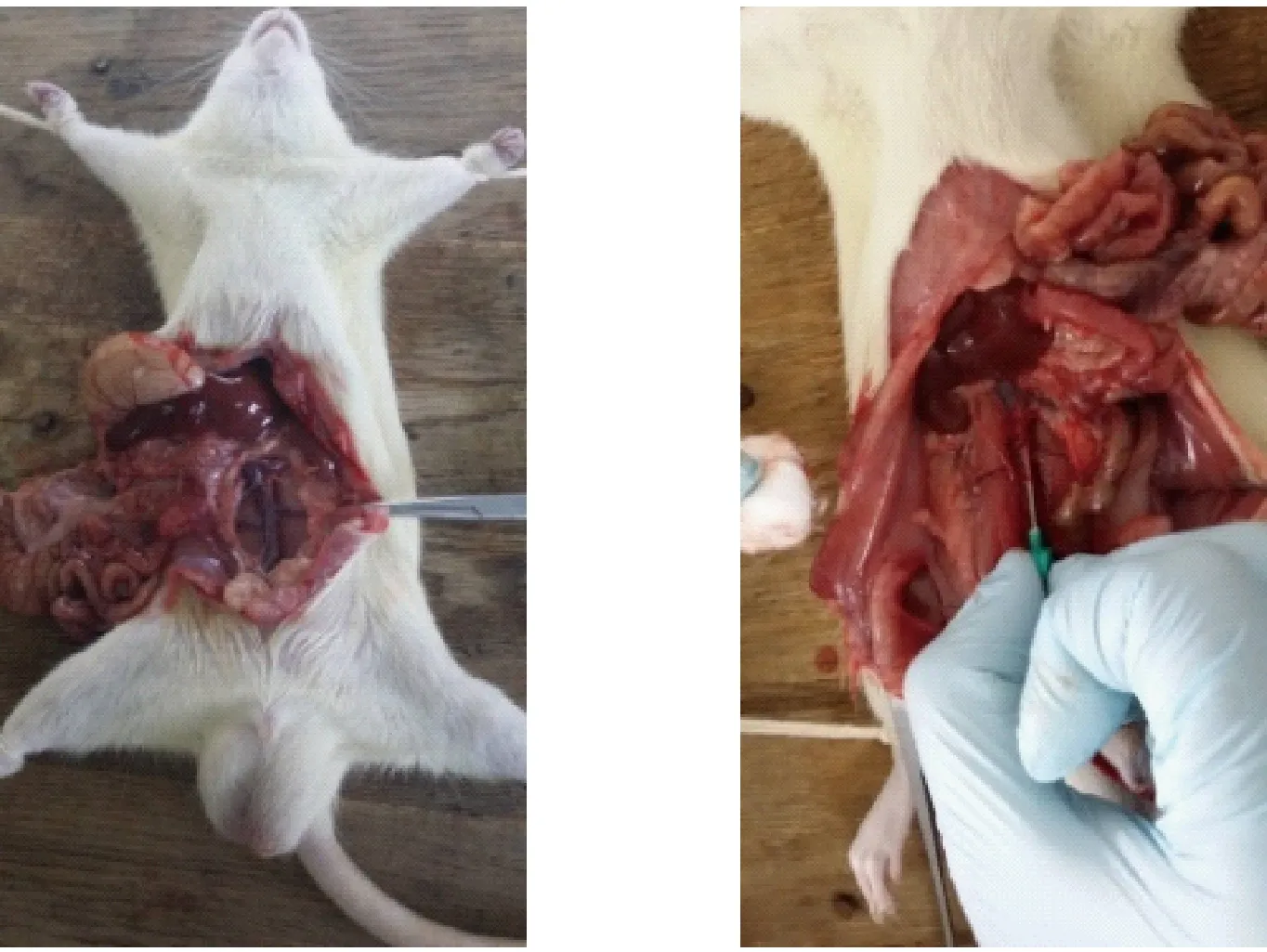
图2 大鼠腹主动脉取血示意图Fig.2 Blood sampling from the abdominal aorta in a rat
1.4.5 肺组织病理学监测
分别在干预后第 5、10和15 天,处死各亚组大鼠,无菌分离肺组织,左肺后叶行组织病理学检查:进行肺组织宏观病理观察后,再以4% 多聚甲醛固定、脱水、浸蜡包埋,连续切片(5 μm)后,常规HE染色,光镜下观察,每例标本随机选 6 张切片,每张切片随机取 3 个视野采集图像留存分析。
1.4.6 肺组织菌落计数
分别在感染后第 5、10和15 天,处死各亚组大鼠,无菌分离肺组织,左肺前叶行肺组织匀浆菌落计数:置于无菌1 mL组织匀浆器中,以800 μL 0.9%生理盐水研磨成匀浆,常规接种培养。通过形态识别后传代,以PCR方法鉴定是否是铜绿假单胞菌。预期目的条带为504 bp,引物如下:
上游P1: 5’ATGGAAATGCTGAAATTCGG 3’
下游P2: 5’CTTCTTCAGCTCGACGCGAC 3’
1.5 统计学方法
2 结果
2.1 行为学变化观察结果
干预5 h后,模型组大鼠出现烦躁,活动度增强;干预后第 2~5 天,模型组大鼠摄食摄水减少,反应迟缓,活动减弱,毛发乱,光泽差,鼻腔和眼眶可见分泌物,现腹式呼吸,闻及喘鸣音。干预后第 6~10天,大鼠食欲、活动度进一步下降,蜷缩聚集明显,毛发乱且黏腻,鼻腔及眼眶分泌物增多,部分嗜睡(触之可醒),喘鸣音伴寒战,偶见大鼠死亡。干预后第11~15天,各症状进一步加重,几乎无进食,呈脱骨貌,活动极度迟缓,瘫卧笼角,被毛逆立,大鼠眼眶和鼻腔分泌物又减少,喘促明显,可见张口呼吸,垫料局部黄褐色,各模型组均有死亡,以气管插管感染模型组最多。
对照组大鼠食欲、皮毛、活动度、呼吸系统状况、体重、体温等较干预前无明显变化;摄食、摄水正常,反应灵敏,活动自如,皮毛顺滑光亮,无嗜睡,无异常分泌物,无气促,无喘鸣,整体状态良好。
2.2 体重结果
造模干预前适应饲喂3 d,干预当天体重记为0天结果,与每亚组结果比较,结果如图3示。
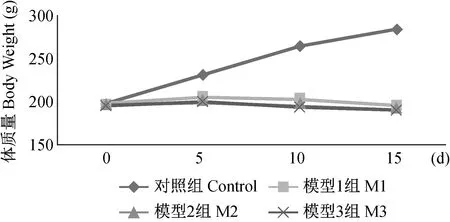
图3 各组大鼠体重随时间变化的结果Fig.3 Changes of body weight with time in the rats
2.3 体温结果
造模干预前各组大鼠体温差异无显著性(P> 0.05)。 经预实验反复摸索,造模干预次日,各模型组大鼠即出现发热,干预后5 d,各模型组间比较,差异无显著性(P> 0.05),与对照组相比,均出现显著升高(P< 0.05)。干预后10 d,各模型组均有不同程度降温,气管插管感染模型组下降最不明显,与另两个模型组差异有显著性 (P< 0.05)。干预后15 d,各模型组大鼠体温仍处于高温状态,较10 d时又都略有上升,模型Ⅲ组仍与另两个模型组差异有显著性,如图 4示。
2.4 白细胞结果
各模型组在干预后5 d,血中白细胞数明显升高,5 d和10 d时各模型组间差异无显著性,但与对照组比较都高,且差异有显著性 (P<0.01),干预15 d时模型Ⅲ组白细胞数较另两模型组更低,可能与该组手术创伤较大,死亡较多有关,如图5示。
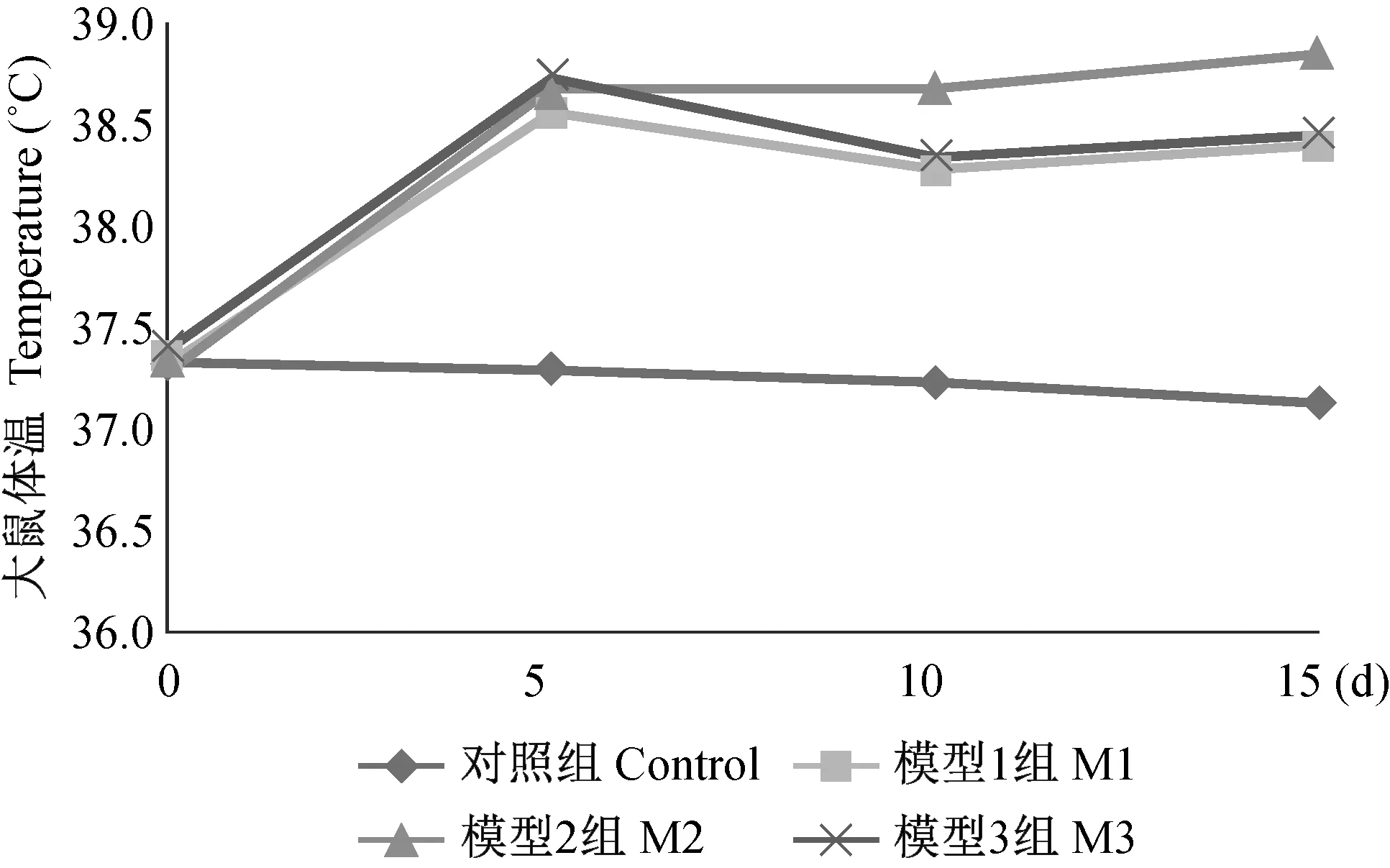
图4 各组大鼠体温随时间变化的结果Fig.4 Changes of body temperature with time in the rats of each group
2.5 病理学变化结果
在干预后5、10和15 d时,对照组大鼠肺组织均呈红色,形态正常,弹性良好,无出血点;肺泡大小相对一致,肺泡壁较薄,支气管上皮完整,管腔内无分泌物。
各模型组在干预5 d后,肺脏均出现典型炎症表现,各模型组差异无显著性,且均持续至15 d。炎症表现主要有,肉眼观察颜色呈暗红色,有明显出血瘀点,触之有实质感;显微镜下明显看到炎性细胞浸润,肺泡结构不清等,如图6示。
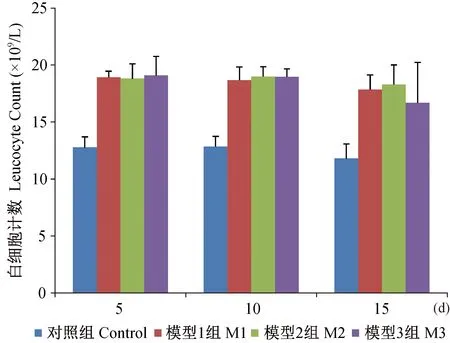
图5 各组大鼠白细胞随时间变化的结果Fig.5 Changes of leukocyte count with time in the rats from each group
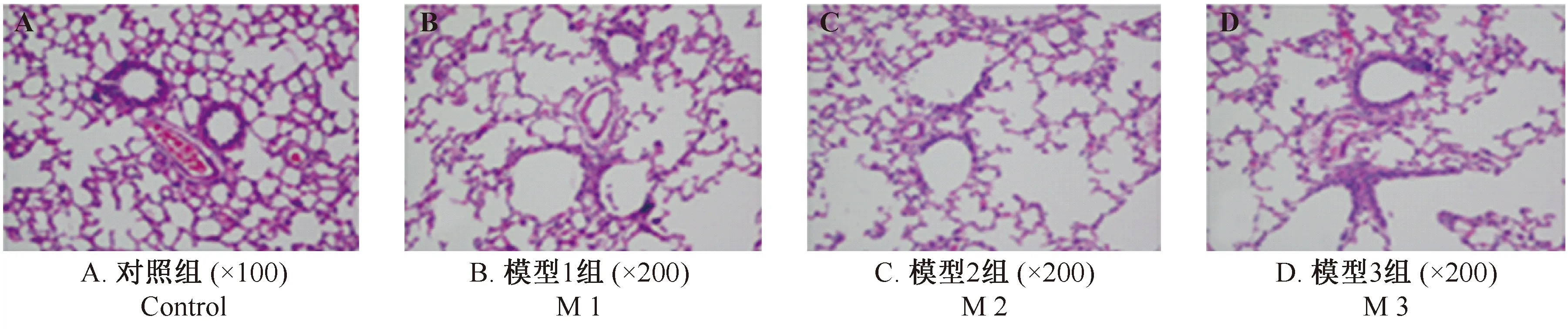
图6 各组大鼠干预5 d时肺组织的HE染色结果Fig.6 Histological changes of lung tissues in the rats of each group at 5 days after intervention(HE staining)
2.6 肺组织病原菌鉴定
各组肺组织匀浆标准接种,分离传代后,各模型组均可筛到扁平湿润、边缘不整齐有金属光泽的典型铜绿假单胞菌菌落;挑取单个菌落进行常规 PCR鉴定,均可扩增到大小为 504 bp 的条带(如图 7示),与预期片段大小一致,证实各模型组肺脏中确有 PA病原菌存在。

注:A.对照组;B.分子标尺组;C.模型1组;D.模型2组;E.模型3组。图7 铜绿假单胞菌鉴定结果Note.A.control group ;B.marker;C.model group 1;D.model group 2;E.model group 3.Fig.7 Identification of Pseudomonas aeruginosa in the rats
2.7 最佳途径的确定
综合分析上述结果,各模型组自干预后均无明显生长,即各干预措施均严重影响大鼠食欲;各模型组体温均呈高温后略降趋势;白细胞数变化规律也较一致,但死亡情况差异有显著性,推测与模型Ⅲ组手术创伤较大有关;各模型组自干预5 d起,肺脏病理学炎症变化一致且差异无显著性。据此筛选出感染效果均一稳定,感染途径简便易行的肺炎模型制备途径—滴鼻感染。
3 讨论
肺炎是指终末气道、肺泡腔及肺间质等相关的肺实质炎症,可由多种病原体如细菌、病毒、衣原体和真菌等引起,以细菌病原最为多见[2,3]。近年由于我国抗生素的不规范使用甚至滥用,使得临床耐药菌越来越多,成为医学界亟待解决的难题[9]。为提高耐药菌致肺炎的病原诊断及防治能力,建立接近临床肺炎表征的动物模型,开展相关研究尤为必要且迫切,所以,本模型制备尤具实际应用价值。
在临床重症肺炎病例中,分离出来的革兰阴性菌比例最高,其中铜绿假单胞菌和鲍曼不动杆菌较为常见[10,11]。所以,以铜绿假单胞菌做肺炎模型的研究最贴近临床,模拟价值最高,具有实际应用前景。早在1979年,Cash 等[12]以气管切开注射的方式构建了铜绿假单胞菌致小鼠肺部感染的模型;李倬哲等[13]于 2001 年通过气管接种,建立了大鼠-铜绿假单胞菌-肺炎模型;同年,李华强等[14]利用气管插管后推注活菌成功建立免疫功能低下的大鼠肺炎模型。李斌等[15]则比较了不同途径(经皮气管穿刺及经鼻喷雾吸入)建立兔肺炎模型的优劣。这些模型的制备充分证实了铜绿假单胞菌作为病原菌的可行性。至于浓度,一般选择 108~ 109cfu/mL,注菌量随动物体重及种属而有所不同。
本实验尝试的各感染方式,受条件所限,感染部位多为前端气管较严重。但肺炎重症时可累及下呼吸道、全肺乃至全身器官,所以,后期研究可结合脓毒症开展。滴鼻途径的确定尤具突破性意义。早在1996年,Takashima 等[16]在小鼠麻醉后,经鼻滴入106cfu/mL菌液,成功建立肺炎链球菌肺炎小鼠模型。罗明晶等[17]在小鼠麻醉后,经鼻给予 40 μL的 2×108cfu/mL 的金葡菌悬液,建立了金黄色葡萄球菌肺炎模型。刘晓红等[18]以滴鼻方式滴入100 μL 的 1 ×107ccu/mL肺炎支原体菌液,建立过小鼠支原体肺炎模型。这都证明了滴鼻途径的可行性,但都局限于小鼠,本研究以滴鼻途径成功建立了大鼠模型,具有一定创新性,且更贴近实际研究—基础研究实验首选大鼠[19],具备更好的推广潜力。
病毒性肺炎多选用小鼠制备模型,采用病毒滴鼻,经鼻黏膜吸收,造模易成功[20]。细菌性肺炎因研究多使用 SD 大鼠或 Wistar大鼠[21,22],所以本实验制备模型也选择SD 大鼠,确保与后续研究更好衔接。另外,大鼠对细菌感染的耐受力好,死亡率相对较低;且对病原菌刺激敏感、适合规模化制备,便于推广使用。
[1] 牛波,池跃朋,帅金凤,等.儿童难治性肺炎支原体肺炎免疫机制探讨[J].中国医药导报,2016,13(6): 107-110.
[2] 郭霞,喻昌利,安庆丽,等.老年重症肺炎患者病原学分布及预后危险因素分析 [J].广东医学,2016,37(6): 873-875.
[3] 聂海贞.儿童重症肺炎病原菌分布特点及抗菌药物耐药趋势分析 [J].妇幼保健,2016,10(14): 209-210.
[4] 杨东,仇玮祎,张畅,等.地塞米松治疗LPS诱导急性肺炎模型小鼠病理学评价方法的建立 [J].实验动物科学,2013,30(4): 13-16,69.
[5] 史光华.实验动物机构认可制度助力实验动物质量保障体系的建设与完善 [J].实验动物科学,2016,33(1): 38-40,48.
[6] 赵振江,赵瑞斌,姚泽忠.建立幼龄 SD 大鼠肺炎克雷伯杆菌肺炎模型的一种新方法 [J].中国现代医生,2016,47(5): 22-23.
[7] 陈业民,黄文杰,李胜利,等.肺炎克雷伯菌致大鼠重症肺炎模型的建立 [J].第一军医大学学报,2005,25(12): 1498 -1502.
[8] 卢伟波,赵子文,钟维农,等.肺炎克雷伯杆菌致大鼠重症肺炎模型的改良与评估 [J].中国病理生理杂志,2013,29(3): 571-576.
[9] 胡强,汪宏云,段民屹,等.中医辩证治疗重症肺炎并发抗生素相关性腹泻的疗效观察 [J].西部医学,2017,29(1): 89-92,96.
[10] 刘策,叶芳.我国社区获得性肺炎病原学分布特点 [J].中国医药导报,2016,13(15): 55-58.
[11] 王亚华,祝永明,吴晓燕,等.铜绿假单胞菌和鲍曼不动杆菌的临床分布和耐药性分析 [J].中国医药导报,2015,12(16): 20-24.
[12] Cash HA,Woods DE,McCullough B,et al. A rat model of chronic respiratory infection with Pseudomonas aeruginosa[J].Am Rev Respir Dis,1979,19: 453-459.
[13] 李倬哲,何礼贤,陈雪华,等.粒细胞减少大鼠铜绿假单胞菌肺部感染模型的建立及炎症反应研究[J].中华结核和呼吸杂志,2001,24(11): 674-678.
[14] 李华强,张文俊,潘婕,等.免疫低下时绿脓杆菌肺炎大鼠肠源性感染的实验研究[J].中国实用儿科杂志,2001,16(5): 286-288.
[15] 李斌,朱冬青,于红,等. 建立铜绿假单胞菌肺部感染动物模型的两种方法[J].第二军医大学学报,2012,33(8): 829-832.
[16] Takashima K,Tateda K,Matsumoto T,et al.Establishment of a model of penicillin-resistant Streptococcus pneumoniae pneumonia in healthy CBA/J mice[J].J Med Microbiol,1996,45(5): 319-322.
[17] 罗明晶.忍冬藤注射液对金黄色葡萄球菌肺炎小鼠的保护作用 [D].硕士,吉林大学.2012.
[18] 刘晓红,辛德莉,侯安存,等.小鼠肺炎支原体肺炎模型的建立及组织病理学评分方法的应用[J].重庆医学,2004,33(9): 1338-1339.
[19] 冯丽萍,陶凌云,周洁,等.上海地区实验动物病原体感染指数分析[J].中国实验动物学报,2016,24(3): 309-312.
[20] 陈丹军,董莹莹,任睿芳,等.截断疗法与常规疗法抑制流感病毒性肺炎小鼠肺组织炎症作用的比较 [J].北京中医药大学学报,2015,39(5): 367-371.
[21] 刘君波,黄梦珊,余晨曦,等.气管内反复滴入脂多糖法建立大鼠慢性阻塞性肺疾病模型[J].中国实验动物学报,2011,19(2): 129-133.
[22] 肖雪琴,赖剑,罗耀玲,等.双黄连逆转肺炎克雷伯菌耐药的体内效果初探 [J].赣南医学院学报,2016,36(2): 190-192.
Comparisononthepreparationofratmodelsofpneumoniabydifferentinfectionroute
DING Jun-ying1#,GAO Xiang2#,HONG Yan-ying2,GUI Hong2,WEI Zhi-you1DING Xue-fei1,LU You-ran1,AN Shi-dong1,CUI Xu-ran1,GUO Yu-hong2,LIU Qing-quan1*
(1.Beijing Key Lab of Basic Study on TCM Infectious Diseases,Beijing Hospital of TCM,Capital Medical University,Beijing Institute of TCM,Beijing 100010,China; 2.Beijing Hospital of TCM,Capital Medical University,Beijing 100010)
ObjectiveTo explore the preparation of a rat model of pneumonia model induced byPseudomonasaeruginosa(PA)using different methods,and to lay the foundation for further studies.Methods48 SD rats were randomly divided into 4 groups: the control group (A),the intratracheal injection group (B),the trachea cannulation group (C) and the intranasal inoculation group (D).After intervention with different treatment modalities,the body weight,temperature,white blood cell count and lung pathological changes in the rats of all groups were detected at 5,10,15 days.Results1.The behavior,body weight,temperature,leukocytes and pathological inflammatory changes of the lung in rats of the model groups were significantly different from that of control group.2.Pseudomonasaeruginosawas detected in rats of all the model groups,but the control group was negative.ConclusionsRat model ofPseudomonasaeruginosainfected pneumonia can be successfully established by intranasal inoculation.This method can avoid the inflammatory interference from operation,and is simple and suitable for popularization.
Pseudomonasaeruginosa; Drug resistant bacteria; Pneumonia; Inflammatory reaction; Rats
LIU Qing-quan.E-mail: profliu1@126.com
国家自然科学基金项目(No.81503399,No.81373813);国家“重大新药创制”科技重大专项(No.2013ZX09102026);首都医科大学附属北京中医医院院级课题(No.YJ-201734);首都医科大学基础-临床科研合作基金(No.16JL74)。
丁军颖(1977-),女,副教授,研究方向:耐药菌感染与防治机制研究。E-mail: 18211197728@163.com;
高翔(1975-)女,主管技师,研究方向:医学检验微生物。E-mail:ruiyang0620@163.com。#共同第一作者
刘清泉(1965-),男,教授,研究生导师,研究方向:急危重症的中医药防治。 E-mail: profliu1@126.com
Q95-33
A
1005-4847(2017) 06-0600-05
10.3969/j.issn.1005-4847.2017.06.003
2017-04-21

