深度共熔溶剂分离提取玉米芯纤维素
刘洪杰,邢山川,张思思,陆文超,刘少杰
(河北科技大学化学与制药工程学院,河北石家庄 050018)
深度共熔溶剂分离提取玉米芯纤维素
刘洪杰,邢山川,张思思,陆文超,刘少杰
(河北科技大学化学与制药工程学院,河北石家庄 050018)
为探索纤维素分离提取的新方法,采用以1,4丁二醇(BDO)和氯化胆碱(ChCl)为氢键供受体的深度共熔溶剂(DES),分离提取废弃生物质玉米芯中的纤维素。通过实验考察了常压下ChCl与BDO物质的量比、温度、时间、液固比对纤维物质得率和纤维素含量的影响,通过红外光谱(FT-IR)、热重分析(TG/DTG)、X射线衍射(XRD)、扫描电镜(SEM)等对原料和产品进行了表征分析。结果表明:当ChCl-BDO物质的量比为1∶3、温度为180 ℃、时间为4 h、液固比为20∶1时,纤维物质的得率为44.6%,纤维素含量为77.8%,木质素的脱除率达到95%,半纤维素的脱除率为75%,纤维素基本不损失。FT-IR,TG/DTG,XRD,SEM分析表明,玉米芯经DES处理后,木质素、半纤维素被大量脱除,得到的纤维物质内部较松散,纤维素的结构基本未被破坏。DES在纤维素分离提取领域有着良好的应用前景。
生物质;玉米芯;深度共熔溶剂;纤维素;分离
纤维素是地球上最古老、最丰富的天然高分子,是由D-吡喃式葡萄糖基以β-1,4糖苷键链接而成的线性大分子多糖,其分子链主要由结晶区和无定形区2部分构成[1]。由于纤维素具有无毒无害、可生物降解、价格低廉且可再生等优点,因而被广泛应用于食品、医药、建筑、造纸等各个行业。近年来,随着化石资源储量的不断减少和人们对环境污染问题的日益关注,纤维素这种可持续发展的可再生资源的应用愈来愈受到重视[2]。在天然纤维素原料中,纤维素往往是与半纤维素、木质素交联在一起的,如何有效地将纤维素与半纤维素、木质素分离是实现纤维素高附加值利用的基础[3-4]。目前纤维素提取方法主要可分为物理法、化学法和生物法,其中物理法对半纤维素、木质素分离不彻底;生物法所需周期较长,降解效率较低,阻碍了其在工业上的应用;化学法如常见的酸/碱处理法,存在污染严重、纤维素损失量大的问题[5]。因此,有关纤维素分离提取的新方法一直以来都是人们研究的热点领域。
2004年,ABBOTT等[6]首次以天然可再生物质合成制备出了深度共熔溶剂(DES),它主要是由季铵盐和氢键供体所组成的低温共熔混合物,熔点显著低于各个组分纯物质的熔点。这类DES除了具备传统离子液体挥发性低、溶解性好、稳定性高的优良特性外,还具有低毒、可生物降解、价格低廉、易于制备等特点[7-8]。2012年,FRANCISCO等[9]首先报道了用DES处理小麦秸秆,发现某些DES对木质素具有较好的溶解性,对纤维素几乎不溶解,因此可根据溶解性能的不同实现对纤维素和木质素的选择性分离。GUNNY等[10]用DES处理稻壳,相较于采用稀碱溶液处理,可获得更高的葡萄糖得率和更低的能量消耗。目前,国内外学者先后报道了采用不同DES对水稻秸秆[11]、木材[12]、玉米秸秆[13]等进行预处理研究。研究结果表明,DES在植物生物质预处理领域显现出良好的应用前景,但报道中用于处理的DES多是以酸作为氢键供体,而以多元醇作为氢键供体的DES较少见于报道。
1,4-丁二醇作为一种良好的氢键供体,对木质素有着较好的溶解性。本研究首次用以1,4-丁二醇(BDO)和氯化胆碱(ChCl)作为氢键供受体的(ChCl-BDO)DES,分离提取玉米芯中的纤维素,考察ChCl与BDO物质的量比、温度、时间、液固比等因素对分离提取效果的影响,并对原料和产品进行分析表征。处理后的DES经收集,可通过加入乙醇-水溶液,待析出溶解的物质后,对其进行再生处理。
1 原料与实验方法
1.1 主要原料与仪器
玉米芯,取自河北省石家庄市某郊区;氯化胆碱、1,4-丁二醇,上海麦克林生化科技有限公司提供;无水乙醇、氢氧化钠,天津市永大化学试剂有限公司提供;硝酸、盐酸等,所用试剂均为分析纯。
电子分析天平(CP214),上海奥豪斯仪器有限公司提供;集热式恒温加热磁力搅拌器(DF-101S),河南省予华仪器有限公司提供;高速万能粉碎机(FW-100),天津市泰斯特仪器有限公司提供;箱式电阻炉(SX2-4-10),龙口市电炉制造厂提供;紫外可见光分光度计(UV-1901),上海佑科仪器仪表有限公司提供。
1.2 实验方法
1.2.1 原料预处理
将玉米芯经洗涤、除杂、自然风干后,切成4~5 cm小段,用粉碎机粉碎后过0.147 mm(100目)筛,将试样于干燥环境中保存备用。
1.2.2 ChCl-BDO溶剂的合成
将不同物质的量比的ChCl-BDO换算成相对应的质量比后,按质量比准确称量一定质量的二组分,加入到锥形瓶中混合,于50 ℃下磁力搅拌直至两者形成均匀透明的溶液,冷却后置于干燥器中保存备用。
1.2.3 玉米芯纤维素的分离提取
取适量玉米芯粉末及ChCl-BDO溶剂,加入到反应容器中,在一定温度下反应一定时间。反应结束后,将物料过滤分离,所得剩余固体用无水乙醇多次洗涤,于105 ℃下干燥后称重,分析计算纤维物质得率及其中纤维素的含量。通过单因素实验,分别考察不同温度、时间、物质的量比、液固比对纤维物质得率及纤维素含量的影响。
1.2.4 原料和产品的组分测定和分析计算
纤维素含量的测定采用“硝酸-乙醇”法[14],半纤维素含量的测定采用国标GB/T 745—2003,木质素测定采用国标GB/T 10337—2008(酸不溶木素)及GB/T 747—2003(酸溶木素)。
纤维物质得率=M2/M1×100%。式中:M1为处理前绝干玉米芯质量,g;M2为处理后绝干固体质量,g。
纤维素损失率=[(C1-C2)/C1]×100%。式中:C1为处理前绝干玉米芯中纤维素质量,g;C2为处理后绝干固体中纤维素质量,g。
半纤维素脱除率=[(H1-H2)/H1]×100%。式中:H1为处理前绝干玉米芯中半纤维素质量,g;H2为处理后绝干固体中半纤维素质量,g。
木质素脱除率=[(L1-L2)/L1]×100%。式中:L1为处理前绝干玉米芯中木质素质量,g;L2为处理后绝干固体中木质素的含量。
1.2.5 表征分析
对原料玉米芯和产品(DES处理后得到的固体)分别进行红外光谱分析(FT-IR),采用美国PE公司的Frontier型红外光谱仪,用KBr压片,扫描范围为4 00~4 000 cm-1,扫描次数32次,分辨率为4 cm-1;热重分析(TG/DTG),采用美国TA公司Q600型同步热分析仪,条件为N2保护,气体流量为20 mL/min,升温范围为25~700 ℃,升温速率为10 ℃/min;X射线衍射分析(XRD),采用日本Rigaku公司的D/MAX-2500型X射线衍射仪,特征射线为CuKα,Ni片滤波,电压30 kV,电流15 mA,扫描范围为5°~60°,扫描速率为0.02°/s;扫描电镜分析(SEM),采用荷兰Phenom公司的PhenomProx型电镜能谱一体台式扫描电子显微镜,对样品的微观形貌进行观察。
2 结果与讨论
2.1 温度对纤维物质得率及纤维素含量的影响
在时间为12 h,ChCl与BDO物质的量比为1∶9,液固比为30∶1的条件下,考察温度分别为90,120,150,180 ℃时对纤维物质得率及纤维素含量的影响,结果如图1所示。
由图1可以看出,随着温度的增加,纤维物质得率逐渐降低而其中纤维素的含量逐渐增加,当温度从90 ℃升高到150 ℃时,纤维物质得率由91.75%降低至77.83%,固体中纤维素的含量由38.14%升高为45.82%。当温度从150 ℃升高到180 ℃时,纤维素含量、纤维物质得率均有一个较大变化,分别由45.82%提高到76.6%,由77.83%降低至45.23%。这主要是因为随着温度的升高,玉米芯中的半纤维素、木质素等组分脱除率增加,造成纤维物质得率下降,同时纤维物质中纤维素的含量相对增加,而温度高有利于反应试剂对半纤维素、木质素的溶解脱除。实验结果表明,在180 ℃时半纤维素、木质素的脱除率分别为77.8%和86.8%,但温度从90 ℃升高到180 ℃时,纤维素的损失量也由不发生损失到损失1.45%,继续升高温度可能会对纤维素造成更大的损失,因此温度选择为180 ℃。
2.2 时间对纤维物质得率及纤维素含量的影响
在温度为180 ℃,ChCl与BDO物质的量比为1∶9,液固比为30∶1的条件下,考察时间分别为1,4,8,12 h时对纤维物质得率及纤维素含量的影响,结果如图2所示。
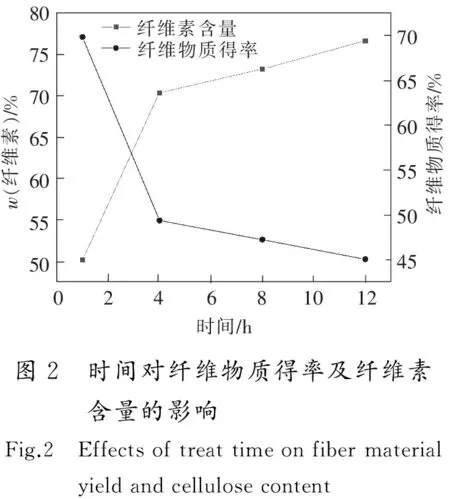
由图2可以看出,当时间从1 h增加到4 h时,纤维物质得率由69.77%降低至49.32%,纤维素含量由50.16%增加到70.3%;而时间超过4 h后,纤维物质得率和纤维素含量的变化趋势明显减小;当时间增加到12 h时,纤维物质得率和纤维素含量仅分别变化了4.32%和6.30%。这是因为时间过短时,溶剂与固体的接触时间短,反应不充分,大量的半纤维素、木质素还没有来得及脱除,因此纤维物质得率较高,纤维素含量较低。而时间过长时,溶剂对半纤维素、木质素的脱除能力接近最大值,因此纤维物质得率和纤维素含量变化趋势减缓。当时间从4 h增加到12 h后,也会对纤维素造成1.45%的损失,说明随着时间的延长,对纤维素的破坏也越严重。因此,为了避免对纤维素造成破坏以及降低能量消耗,综合考虑后将最佳时间定为4 h。
2.3 物质的量比对纤维物质得率及纤维素含量的影响
在温度为180 ℃、时间为4 h、液固比为30∶1的条件下,考察ChCl与BDO物质的量比(1∶3,1∶5,1∶7,1∶9,1∶11)对纤维物质得率及纤维素含量的影响,结果如图3所示。
由图3可以看出,在ChCl-BDO溶剂中,随着BDO相对含量的增加,纤维物质得率逐渐升高,纤维素含量逐渐降低。研究表明,ChCl具有相催化转移作用[15],在ChCl-BDO溶剂中,提高ChCl的量,可以提高ChCl-BDO溶剂对半纤维素、木质素的脱除能力。但研究发现,当ChCl与BDO物质的量比为1∶1和1∶2时,溶剂在室温下有结晶现象,不能形成均匀透明的溶液。综合考虑后将ChCl与BDO物质的量比定为1∶3。
2.4 液固比对纤维物质得率及纤维素含量的影响
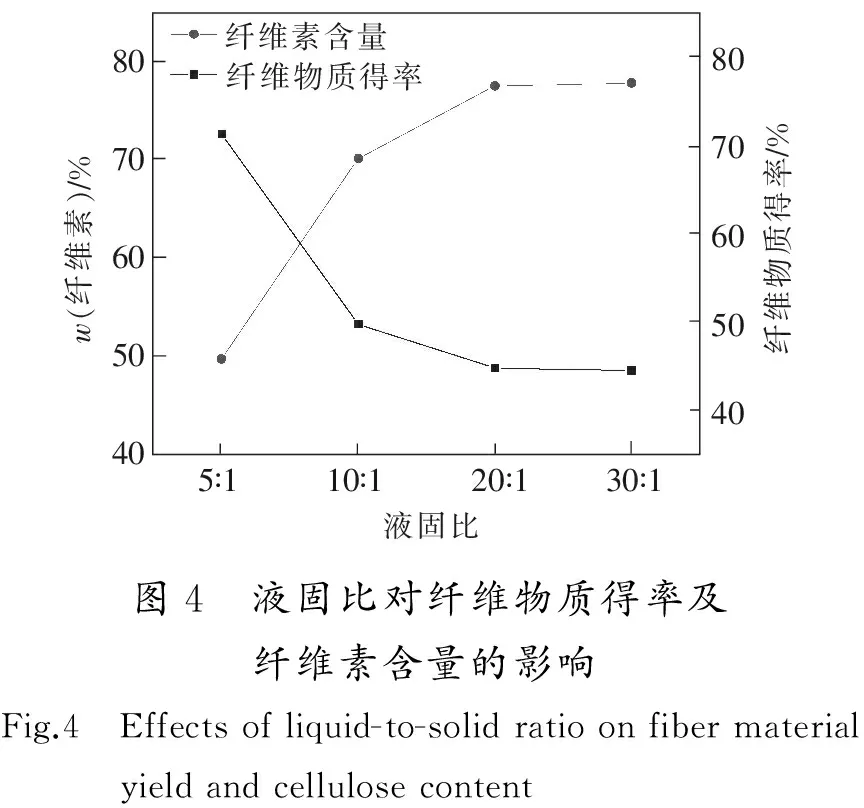
在温度为180 ℃、时间为4 h及ChCl与BDO物质的量比为1∶9的条件下,考察液固比(5∶1,10∶1,20∶1,30∶1)对纤维物质得率及纤维素含量的影响,结果如图4所示。
由图4可以看出,随着液固比的增加,纤维物质得率先下降后趋于平稳,纤维素含量先升高后趋于平稳。当液固比为5∶1时,主要是因为液固比太小,溶剂不能有效浸渍固体,也无法对体系进行搅拌,最终溶剂对固体中的半纤维素、木质素脱除很少,造成纤维物质得率较高,纤维素含量较低。当液固比为20∶1后,再增加液固比,纤维物质得率和纤维素含量基本不再发生变化。这说明在不改变其他反应条件下,仅增加溶剂量,并不能增加对固体其他组分的溶解量。因此综合考虑后,将液固比定为20∶1。

2.5 原料和产品的表征分析
2.5.1 红外光谱(FT-IR)分析
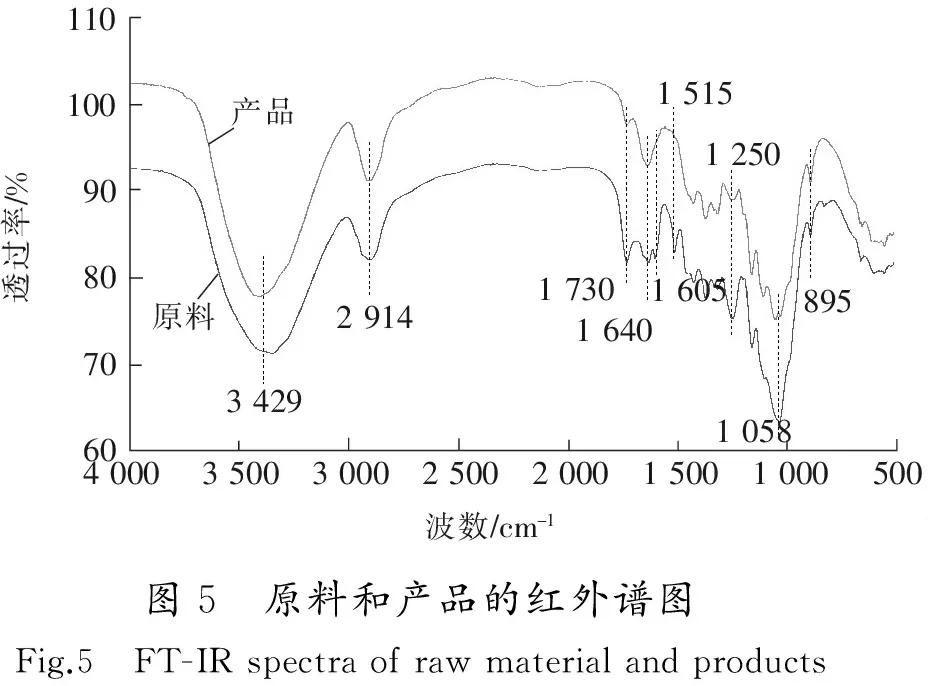
图5是原料玉米芯和产品DES处理后固体的红外光谱图。对比两者的红外光谱图可以发现,相较于原料玉米芯的红外谱图,经DES处理后固体的红外谱图明显有一些峰消失或强度减弱。图5中3 429 cm-1处为—OH伸缩振动峰;2 914和1 370 cm-1处为甲基、亚甲基、次甲基中C—H伸缩、弯曲振动吸收峰;1 455,1 335, 1 430和1 319 cm-1分别为—OH弯曲吸收峰和CH2弯曲、摇摆吸收峰;1 165,1 112和1 034 cm-1为纤维素分子链中C—O—C结构产生的伸缩振动峰[16];895 cm-1为纤维素分子中β-糖苷键链接的特征吸收峰[17],1 730 cm-1为半纤维素和木质素分子结构中—C=O伸缩振动吸收峰;1 640 cm-1处为固体中所含水分子H—O—H弯曲振动吸收峰;1 605和1 515 cm-1为木质素的芳环特征吸收峰;1 250 cm-1附近吸收峰为醚键C—O伸展振动吸收峰[18-19]。观察原料和产品的红外谱图,发现经DES处理后产品中1 605 cm-1和1 515cm-1两处峰消失,1 730 cm-1和1 250 cm-1两处吸收峰强度明显减弱。这说明经DES处理后,原料中大部分木质素和半纤维素被脱除,而1 112,1 058和1 034 cm-1等处的纤维素特征峰的变化,表明处理后产品中大部分为纤维素。
2.5.2 热重(TG,DTG)分析
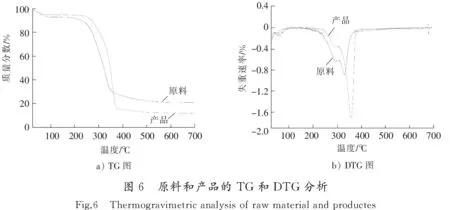
图6是原料玉米芯和产品DES处理后固体的TG和DTG图。从图6可以看出,两者在25~100 ℃均有一个小的失重峰,这主要是由于水分的蒸发所造成的。从TG图中可以看出原料的主要失重温度范围为250~350 ℃。从DTG中可以看到,在该温度范围内出现的2个失重峰,对应的温度分别为295 ℃和329 ℃,产品的主要失重温度范围为300~370 ℃。从DTG图中可以看到有大小2个失重峰,主要峰对应的温度为356 ℃,主峰左侧的小峰对应的温度为290 ℃。由于半纤维素主要为松散的无定形结构,因此热稳定性较差,热分解温度为 190~350 ℃[20]。纤维素作为由葡萄糖单元连接而成的线性高分子聚合物,易于在分子链内形成结晶区,因此纤维素热稳定性较好,热分解温度为275~350 ℃[21]。木质素是由3种苯基丙烷结构单元连接而成的具有三维空间的高分子聚合物,由于组成及结构的复杂性,使得木质素的热分解温度范围较宽,为130~500 ℃[22]。由于玉米芯中木质素含量不高,且半纤维素与木质素之间存在化学键的连接,半纤维素热分解的同时也会促进木质素的热分解,因此在原料DTG图中左侧的失重峰应该为半纤维素、木质素的热分解峰[23]。对比原料和产品的TG和DTG可以发现,产品的热稳定性高于原料,且产品的最终残余质量要低于原料。这主要是由于经ChCl-BDO溶剂处理后,原料中大部分木质素、半纤维素等被脱除,产品中热稳定性较高的纤维素含量相对增加,木质素等易在高温下产生结焦物质的杂质组分含量减少,因此处理后产品的热稳定性高于原料,最终残余质量比原料的少。但从产品的DTG图可以看出,在纤维素失重峰的左侧依然有小失重峰,这说明处理后固体中还含有少量半纤维素和木质素。
2.5.3 X衍射(XRD)分析
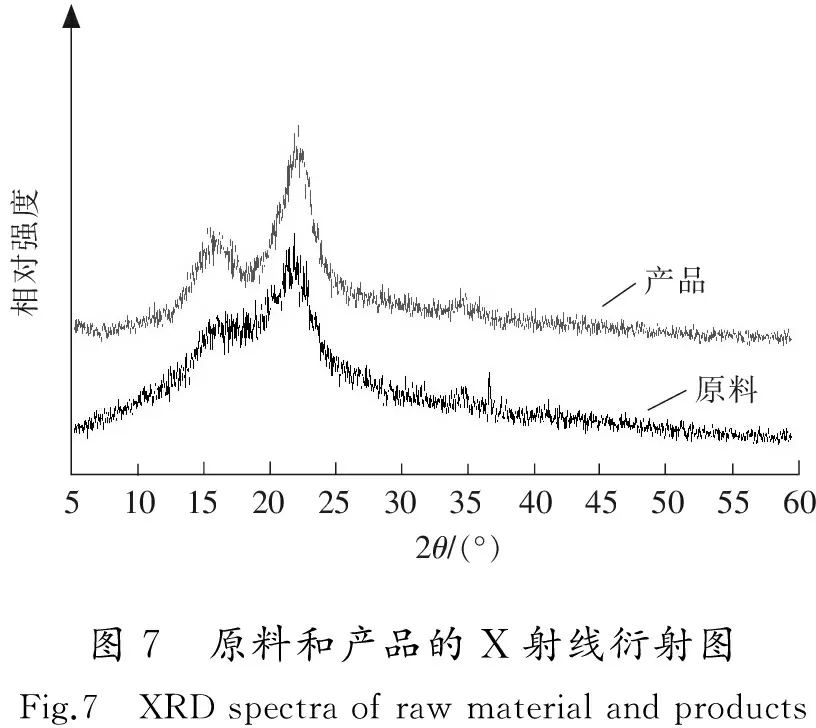
2.5.4 扫描电镜(SEM)分析

图8是原料玉米芯和产品DES处理后固体的扫描电镜图,对比两图可以发现原料玉米芯经DES处理后形貌发生了显著变化。从图8 a)可以看出,原料玉米芯呈无规则碎片状固体,图中长条状物质可能为采样或表征分析过程中引入的其他杂质成分;从图8 b)可以看出,原料经DES处理后,固体呈纤维状,尺寸有所减小,且表面变得粗糙,并出现了一些褶皱和小孔,这可能是由于DES处理过程中将包裹纤维素的半纤维素、木质素等组分脱除,使得纤维素内部暴露出来,但由于处理后固体还含有一些非纤维组分,因而得到的固体并不是表面光滑的纤维状固体。原料经DES处理后,由于半纤维素、木质素的脱除以及固体中空隙的增加,均有利于反应试剂在纤维素内部的渗透,为后期纤维素的功能化改性奠定了良好基础。
3 结 语
1)以玉米芯为原料,采用深度共熔溶剂体系对纤维素进行了分离提取,通过单因素实验,找到了最佳工艺条件:温度为180 ℃、时间为4 h、物质的量比为1∶3、液固比为20∶1。在该条件下,纤维物质得率为44.6%,纤维素含量为77.5%,显示出深度共熔溶剂在纤维素分离提取领域有着良好的应用前景。
2)以BDO和ChCl作为氢键供受体的深度共熔溶剂处理玉米芯,在温度较高时才能对半纤维素、木质素有一个良好的脱除效果,且在处理过程中基本不会对纤维素造成破坏。在最佳条件下,木质素的脱除率可达95%,半纤维素的脱除率为75%。
3)FT-IR和TG/DTG分析表明,经ChCl-BDO溶剂处理后固体中的纤维素含量较高;XRD分析表明经ChCl-BDO溶剂处理后,纤维素的晶型没有发生改变;SEM分析表明,玉米芯经ChCl-BDO溶剂处理后,表面形貌发生了显著变化,纤维内部空隙增加,有利于反应试剂的渗透。
后续工作将会对分离提取得到的纤维素进行功能化改性以及对DES的重复利用进行研究。
/
[1] LI J B, QING D D, ZHANG M Y, et al. Joint action of ultrasonic and Fe3+to improveselectivity of acid hydrolysis for microcrystalline cellulose[J]. Carbohydrate Polymers, 2015,129: 44-49.
[2] 张智峰. 纤维素改性研究进展[J]. 化工进展, 2010, 29(8): 1493-1501.
ZHANG Zhifeng. Research progress in cellulose modification[J]. Chemical Industry and Engeering Progress, 2010, 29(8): 1493-1501.
[3] LU P, HSIEH Y L. Preparation and characterization of cellulose nanocrystals from rice straw[J]. Carbohydrate Polymers, 2012, 87(1): 564-573.
[4] MARYAM R, RABI B. Effect of cellulose characteristic and hydrolyze conditions on morphology and size of nanocrystal cellulose extracted from wheat straw [J]. International Journal of Polymeric Materials and Polymeric Biomaterials, 2011, 60(8): 529-541.
[5] 周谈龙, 宗文明, 曹成茂, 等. 木质纤维素预处理工艺研究现状及展望[J]. 安徽农业科学, 2014,42(18): 5920-5923.
ZHOU Tanlong, ZONG Wenming, CAO Chengmao, et al. Research status and prospect of lignocellulose pretreatment technology[J]. Journal of Anhui Agri Sci,2014, 42(18): 5920-5923.
[6] ABBOTT A P, BOOTHBY D, CAPPER G, et al. Deep eutectic solvents formed between choline chloride and carboxylic acids: Versatile alternatives to ionic liquids[J]. Am Chem Soc, 2004, 126:9142-9147.
[7] 刘静, 赵地顺, 刘冉, 等. 离子液体型表面活性剂[C12min]Br缓蚀性能研究[J]. 河北科技大学学报, 2016, 37(1): 70-75.
LIU Jing, ZHAO Dishun, LIU Ran, et al. Corrosion inhibition performance of a ionic liquid surfactant [C12min]Br[J]. Journal of Hebei University of Science and Technology, 2016, 37(1): 70-75.
[8] 常杰, 刘钧, 郭姝君, 等. 新型深度共熔溶剂选择性分离木质素的研究[J]. 华南理工大学学报(自然科学版), 2016, 44(6): 14-20.
CHANG Jie, LIU Jun, GUO Shujun, et al. Investigation into selective separation of lignin in novel deep eutectic solvent[J]. Journal of South China University of Technology (Natural Science Edition), 2016, 44(6): 14-20.
[9] FRANCISCO M, BRUINHORST A V D, KROOM M C. New natural renewable low transition temperature mixtures (LTTMs):Scree-ning as solvents for lignocellulosic biomass processing[J]. Green Chemistry, 2012,14(8):2153-2157.
[10] GUNNY A A N, ARBAIN D, NASHEF E M, et al. Applicability evaluation of deep eutectic solvents-cellulase system for lignocellulose hydrolysis[J]. Bioresource Technology, 2015, 181: 297-302.
[11] KUMAR A K, PARIKH B S, PRAVAKAR M. Natural deep eutectic solvent mediated pretreatment of rice straw: Bioanalytical characterization of lignin extract and enzymatic hydrolysis of pretreated biomass residue[J]. Environ Sci Pollut Res,2016,23(10):9265-9275.
[12] VASCO C A, MA R S, QUINTERO M, et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents(DES): A source of lignin for valorization[J]. Green Chemistry, 2016, 18: 5133-5141.
[13] XU G C, DING J C, HAN R Z, et al. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation[J]. Bioresource Technology, 2016, 203: 364-369.
[14] 蒋建新. 生物质化学分析技术[M]. 北京: 化学工业出版社, 2013.
[15] 高鸿宾. 有机化学[M]. 北京: 高等教育出版社, 2005.
[16] JOHAR N, AHMAD I, DUFRESNE A. Extraction: Preparation and characterization of cellulose fibres and nanocrystals from rice husk[J]. Industrial Crops and Products, 2012, 37: 93-99.
[17] MA X J, YANG X F, LIN L, et al. Degradation and dissolution of hemicelluloses during bamboo hydrothermal pretreatment[J]. Bioresource Technology, 2014, 161: 215-220.
[18] ZHANG P, DONG S J, MA H H, et al. Fractionation of corn stover into cellulose: Hemicellulose and lignin using a series of ionic liquids[J]. Industrial Crops and Products, 2015, 76: 688-696.
[19] COLOM X, CARRILLO F, NOGUES F, et al. Structural analysis of photodegraded wood by means of FTIR spectroscopy[J]. Polym Degrad Stab,2003, 80: 543-549.
[20] 程合丽, 詹怀宇, 李兵云, 等. 玉米秆半纤维素的碱化提取与表征[J]. 中国造纸学报, 2011, 26(3): 26-29.
CHENG Heli, ZHAN Huaiyu, LI Bingyun, et al. Isolation and characterization of corn stover hemicellulose[J]. Transations of Chain Pulp and Paper, 2011, 26(3): 26-29.
[21] KIM U, EOM S H, WADA M. Thermal decomposition of native cellulose: Influence on crystalline size[J]. Polymer Degradation and Stability, 2010, 95 : 778-781.
[22] 张坤, 王高煊, 王晓俊, 等. 玉米秸秆木质素的提取工艺优化及表征[J]. 食品科学, 2015, 36(6): 58-62.
ZHANG Kun, WANG Gaoxuan, WANG Xiaojun, et al. Extraction and characterization of lignin from corn stover[J]. Food Science, 2015, 36(6): 58-62.
[23] POLETTO M, ZATTERA A J, FORTE M M C, et al. Thermal decomposition of wood: Influence of wood components and cellulose crystallite size[J]. Bioresource Technology, 2012, 109: 148-153.
[24] SILVÉRIO H A, NETO W P F, DANTAS N O, et al. Extraction and characterization of cellulose nanocrystals from corncob for application as reinforcing agent in nanocomposites[J]. Industrial Corps and Products, 2013, 44: 427-436.
[25] DITZEL F I, PRESTES E, CARVALHO B M, et al. Nanocrystalline cellulose extracted from pine wood and corncob[J]. Carbohydrate Polymers, 2017, 157: 1577-1585.
[26] 曹延娟, 辛斌杰, 吴湘济, 等. 生物质棉纤维再生纤维素膜的制备与性能分析[J]. 河北科技大学学报, 2015, 36(3): 269-278.
CAO Yanjuan, XIN Binjie, WU Xiangji, et al. Preparation and characterization of regenerated cellulose membaranes from natural cotton fiber[J]. Joural of Hebei University of Science and Technology, 2015, 36(3): 269-278.
[27] SEGAL L, CREELY J J, MARTLE A E, et al. An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer[J]. Textile Research Journal, 1959, 29(10): 786-794.
Study on extraction of cellulose from corn cobs by deep eutectic solvents
LIU Hongjie, XING Shanchuan, ZHANG Sisi, LU Wenchao, LIU Shaojie
(School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
In order to explore a new method for the separation and extraction of cellulose, cellulose is extracted from waste biomass corn cobs by deep eutectic solvent(DES), in which 1,4-butanediol (BDO) and choline chloride (ChCl) are used as the donor and the acceptor of hydrogen bonds, respectively. The influence of the molar ration of ChCl to BDO, the treatment temperature, the interaction time and liquid-solid ratio to fiber material yield and cellulose content under ordinary pressure is investigated through experiment. The structures of raw materials and the products are characterized by using infrared spectroscopy (FT-IR), thermogravimetric (TG/DTG), X-ray diffraction (XRD) and scanning electron microscopy (SEM). The result shows that the fiber material yield and cellulose content are 44.6% and 77.8%, respectively under the optimum conditions which are ChCl-BDO molar ration of 1∶3, treatment temperature of 180 ℃, reaction time of 4 h and liquid-solid ration of 20∶1(g∶g), and under the condition, the removal rate of lignin and hemicellulose are 95% and 75%, respectively, with only losing a little cellulose. The FT-IR, TG/DTG, XRD and SEM results show that the lignin and hemicellulose in the corn cobs are greatly removed after DES treatment. The fiber material internal is more loose and the structure of the cellulose is barely damaged. The result shows that DES has a good prospect in the field of cellulose separation and extraction.
biomass; corn cob; deep eutectic solvent; cellulose; separation
1008-1542(2017)06-0548-07
10.7535/hbkd.2017yx06007
TQ352.4
A
2017-09-06;
2017-10-16;责任编辑:张士莹
国家自然科学基金(21304030);河北省高等学校科学技术研究优秀青年基金(YQ2013001)
刘洪杰(1964—),男,河北景县人,高级工程师,主要从事化工工艺技术方面的研究。
刘少杰副教授。E-mail:sjliu16@163.com
刘洪杰,邢山川,张思思,等.深度共熔溶剂分离提取玉米芯纤维素[J].河北科技大学学报,2017,38(6):548-554.
LIU Hongjie,XING Shanchuan,ZHANG Sisi,et al.Study on extraction of cellulose from corn cobs by deep eutectic solvents[J].Journal of Hebei University of Science and Technology,2017,38(6):548-554.

