不同术前预处理方式改善术后胰岛素抵抗的效果比较
高星
(湖北省孝感市中心医院手术室,湖北孝感 432000)
不同术前预处理方式改善术后胰岛素抵抗的效果比较
高星
(湖北省孝感市中心医院手术室,湖北孝感 432000)
目的:比较不同术前预处理方式改善术后胰岛素抵抗的效果。方法:2015年2月至2016年12月210例拟行胃肠道手术患者随机分为3组,分别于术前给予碳水化合物400 mL、乳清蛋白液400 mL、蒸馏水400 mL,比较3组患者手术前后胰岛素抵抗指数(HOMA-IR)、血糖等指标变化,并观察其术后恢复情况,总结术前预处理对术后胰岛素抵抗状态的影响。结果:各组患者术后FPG、FINS、HOMA-IR均较术前升高,HOMA-IS、ISI均较术前降低,对照组变化更为明显,差异有统计学意义(P<0.05);乳清蛋白组术后即刻FINS、HOMA-IR高于碳水化合物组,差异有统计学意义(P<0.05)。各组患者术前30 min口渴感、疲劳感均较术前3 h降低,碳水化合物组、乳清蛋白组术前30 min饥饿感较术前3 h降低,差异有统计学意义(P<0.05)。碳水化合物组、乳清蛋白组同时期FPG、FINS等指标以及各项主观舒适度评分组间比较,差异无统计学意义(P>0.05)。碳水化合物组、乳清蛋白组术后胃内残留量、发热时间、肛门排气时间均低于对照组,差异有统计学意义(P>0.05)。结论:术前给予碳水化合物或乳清蛋白均可有效提高主观舒适度、改善胰岛素抵抗、缩短恢复时间,碳水化合物预处理改善胰岛素抵抗效果更佳。
预处理;胰岛素抵抗;碳水化合物;乳清蛋白
手术患者围术期应激反应难免会影响机体代谢并引发胰岛素抵抗,影响患者康复进程[1]。胰岛素抵抗是手术应激反应引发代谢反应的中心环节,患者以胰岛素敏感性下降、胰岛素作用减弱及代偿性胰岛素分泌增加等病理生理改变为主要表现,持续高血糖状态还可造成菌血症、感染、多发性神经病变等并发症发生风险加剧[2]。既往胃肠道择期手术术前准备强调禁食,但大量研究发现,禁食可造成机体代谢变化,增加术后胰岛素抵抗发生风险,因此,近年来临床愈发注重术前调控减少应激[3-4]。本研究就碳水化合物、乳清蛋白的代谢调控作用与安全性进行了对比。
1 资料与方法
1.1 一般资料
排除合并糖尿病等内分泌疾病者,以及合并感染性疾病、免疫功能不全以及既往长期服用糖皮质激素、非甾体类抗炎药物者。以我院2015年2月至2016年12月收治的210例拟行胃肠道手术患者随机分为碳水化合物组、乳清蛋白组、对照组进行前瞻性对照分析。3组患者年龄、性别、体质量指数(BMI)、美国麻醉师协会(ASA)麻醉危险度分级等一般临床资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 预处理方案
各组患者术前均禁食12 h,行常规胃肠道准备,术前2 h,按照患者组别实施相应预处理方案[5-6]:碳水化合物组:口服Nutricia preOp溶液(荷兰纽迪西亚公司)400 mL,配方:葡萄糖0.2 g,果糖1.3 g,麦芽糖0.7 g,多聚糖10.0 g,钠0.05 g,钾0.122 g,氯0.006 g,钙0.006 g,磷0.001 g,镁0.001 g;共含碳水化合物50.4 g,能量860 kJ。乳清蛋白组:口服乳清蛋白液400 mL,配方:加瑞CFM全乳清蛋白质粉(上海金好尔公司)4 g(每100 g蛋白质粉中含有蛋白质90 g,乳矿物质3 g,钙0.6 g,钾0.4 g,镁0.090 g,磷0.210 g,铁0.0093 g,脂肪1 g,碳水化合物1 g)。对照组:口服蒸馏水400 mL。患者手术均由同组医生完成,麻醉诱导为芬太尼联合丙泊酚,麻醉维持七氟烷吸入联合丙泊酚泵注。术中均未给予葡萄糖液、胰岛素补充及血液输注。
1.3 指标处理
胰岛素抵抗:分别于术前4 h、术后即刻抽取各组患者空腹静脉血10 mL,对其空腹血糖(FPG)、空腹胰岛素(FINS)进行检测,并计算胰岛素抵抗指数(HOMA-IR)、胰岛素分泌指数(HOMA-IS)及胰岛素敏感指数(ISI),计算公式[7]:HOMA-IR=FPG×FINS/22.5;HOMA-IS=(FPG×20)/(FPG-3.5);ISI=1/(FPG常用对数+FINS常用对数)。
主观舒适度:分别于术前3 h、术前30 min,使用视觉模拟评分法(VAS),记录其主观舒适度,包括口渴感、饥饿感、焦虑感、恶心感、疲劳感、虚弱感共6项内容。
手术情况及恢复情况:记录各组患者手术时间、术中出血量、术中补液量、术中尿量,术后胃内残留量、发热时间、抗生素使用时间、肛门排气时间、住院时间,以及术后并发症发生情况,并进行组间比较。
SPSS18.0分析数据,以P<0.05为差异有统计学意义。
2 结果
2.1 胰岛素抵抗状态变化
各组患者术后FPG、FINS、HOMA-IR均较术前升高,HOMA-IS、ISI均较术前降低,对照组变化更为明显,差异有统计学意义(P<0.05);乳清蛋白组术后即刻FINS、HOMA-IR高于碳水化合物组,差异有统计学意义(P<0.05)。见表1。
表1 各组患者胰岛素抵抗状态变化比较()
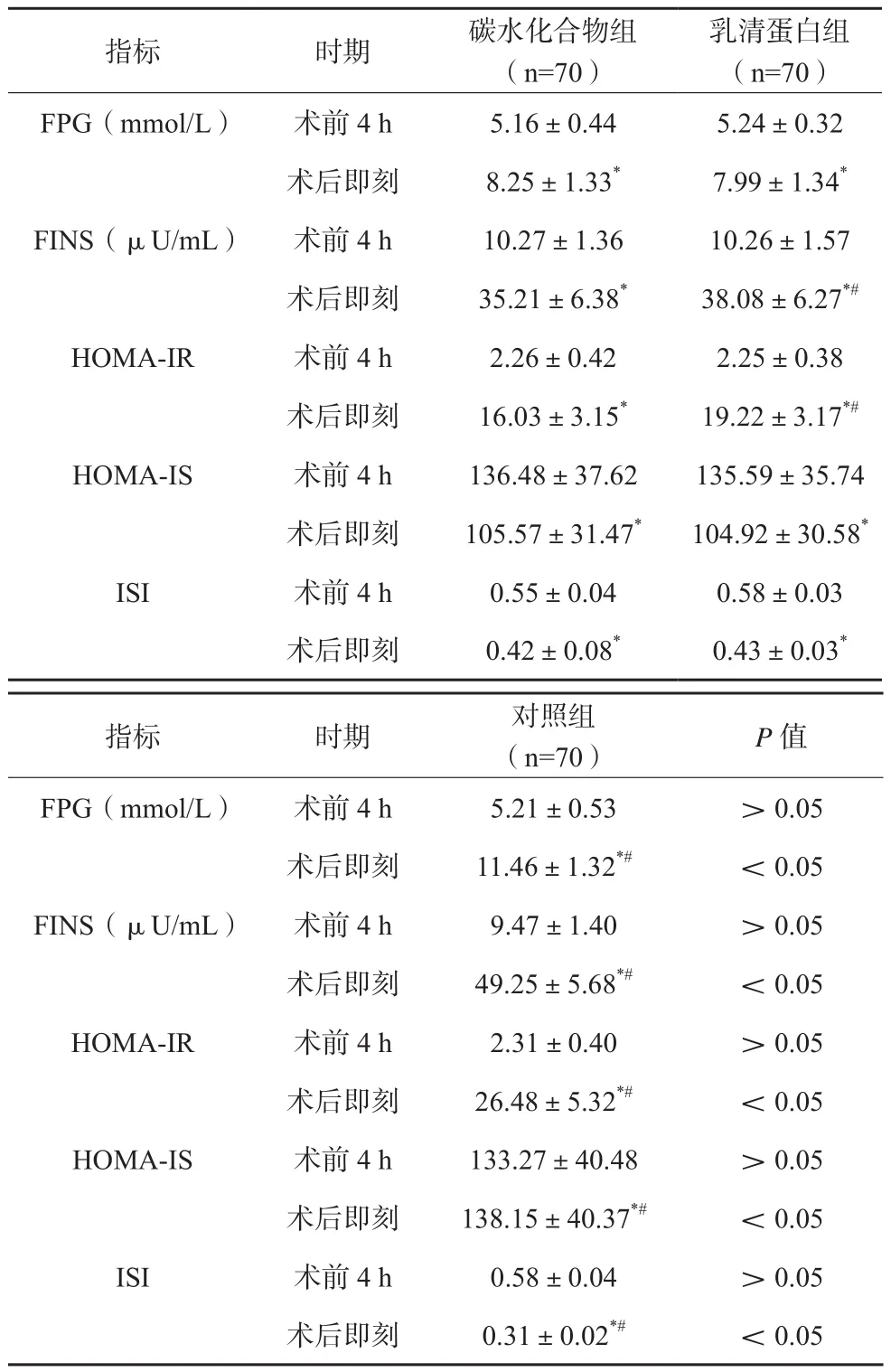
表1 各组患者胰岛素抵抗状态变化比较()
注:与术前比较,*P<0.05;与碳水化合物组比较,#P<0.05
碳水化合物组 乳清蛋白组指标 时期 (n=70) (n=70)FPG(mmol/L) 术前4 h 5.16±0.44 5.24±0.32术后即刻 8.25±1.33* 7.99±1.34*FINS(μU/mL) 术前4 h 10.27±1.36 10.26±1.57术后即刻 35.21±6.38* 38.08±6.27*#HOMA-IR 术前4 h 2.26±0.42 2.25±0.38术后即刻 16.03±3.15* 19.22±3.17*#HOMA-IS 术前4 h 136.48±37.62 135.59±35.74术后即刻 105.57±31.47* 104.92±30.58*ISI 术前4 h 0.55±0.04 0.58±0.03术后即刻 0.42±0.08* 0.43±0.03*指标 时期 对照组(n=70) P值FPG(mmol/L) 术前4 h 5.21±0.53 >0.05术后即刻 11.46±1.32*# <0.05 FINS(μU/mL) 术前4 h 9.47±1.40 >0.05术后即刻 49.25±5.68*# <0.05 HOMA-IR 术前4 h 2.31±0.40 >0.05术后即刻 26.48±5.32*# <0.05 HOMA-IS 术前4 h 133.27±40.48 >0.05术后即刻 138.15±40.37*# <0.05 ISI 术前4 h 0.58±0.04 >0.05术后即刻 0.31±0.02*# <0.05
2.2 主观舒适度变化
各组患者术前30 min口渴感、疲劳感均较术前3 h降低,碳水化合物组、乳清蛋白组术前30 min饥饿感较术前3 h降低,差异有统计学意义(P<0.05)。碳水化合物组、乳清蛋白组同时期各项主观舒适度评分组间比较,差异无统计学意义(P>0.05)。见表2。
2.3 手术情况及恢复情况
各组患者术后均未见围术期严重并发症发生。各组患者手术情况比较,差异无统计学意义(P>0.05);碳水化合物组、乳清蛋白组术后胃内残留量、发热时间、肛门排气时间均低于对照组,差异有统计学意义(P>0.05)。见表3。
表2 各组患者胰岛素主观舒适度评分变化比较(分,)

表2 各组患者胰岛素主观舒适度评分变化比较(分,)
注:与术前比较,*P<0.05;与碳水化合物组比较,#P<0.05
项目 时期 碳水化合物组(n=70)乳清蛋白组(n=70)对照组(n=70) P值口渴感 术前3 h 5.38±0.52 5.29±0.44 5.37±0.55>0.05术前30 min 0.99±0.24* 1.05±0.23*0.91±0.18*<0.05饥饿感 术前3 h 4.62±0.58 4.67±0.40 4.46±0.52>0.05术前30 min 1.59±0.23* 1.52±0.33*4.17±0.70#<0.05焦虑感 术前3 h 3.36±0.48 3.37±0.45 3.37±0.52>0.05术前30 min 3.76±0.50 3.71±0.58 3.71±0.48 >0.05恶心感 术前3 h 0.25±0.04 0.26±0.03 0.24±0.05>0.05术前30 min 0.29±0.05 0.25±0.08 0.26±0.04 >0.05疲劳感 术前3 h 1.18±0.24 1.17±0.25 1.16±0.25>0.05术前30 min 0.45±0.12* 0.40±0.11*0.48±0.14*>0.05虚弱感 术前3 h 0.18±0.03 0.19±0.04 0.19±0.04>0.05术前30 min 0.17±0.04 0.16±0.03 0.15±0.03 >0.05
表3 各组患者手术情况及恢复情况比较()

表3 各组患者手术情况及恢复情况比较()
注:与碳水化合物组比较,#P<0.05
指标 碳水化合物组(n=70)乳清蛋白组(n=70)对照组(n=70) P值手术时间(min) 182.05±34.16 183.44±35.92 176.58±32.39 >0.05术中出血量(mL) 162.40±35.08 166.37±31.58 165.94±37.91 >0.05术中补液量(mL) 1725.53±281.371669.48±302.551724.30±255.89 >0.05术中尿量(mL) 420.37±99.87 425.86±92.94 415.68±92.94 >0.05胃内残留量(mL) 36.28±5.17 35.52±5.64 47.98±3.76# <0.05发热时间(d) 1.27±0.33 1.35±0.27 3.27±0.81# <0.05抗生素使用时间(d) 2.50±0.39 2.64±0.48 2.85±0.99# <0.05肛门排气时间(d) 2.97±0.48 2.85±0.34 4.26±0.58# <0.05
3 讨论
作为手术应激引发代谢反应的中心环节,胰岛素抵抗的发生不仅会导致高血糖状态,还可增加患者并发症发生率及死亡风险[8-10]。既往认为,术前胃排空对于减少麻醉后酸性胃内容物反流、误吸具有重要意义[11]。然而,文献报道术前长时间禁食是术后胰岛素抵抗的独立危险因素,即禁食所致肝糖原储备消耗、机体可利用能源丧失可成为额外代谢应激,对患者预后造成不良影响[12]。为解决这一问题,有学者在全髋关节置换术前采取葡萄糖和胰岛素静脉输注方案以模拟生理吸收状态,使患者术后胰岛素抵抗程度得到明显控制,但这一方案的弊端在于需频繁监测血糖浓度,且血糖浓度控制不当可能引发其他不良反应[13-14]。
本研究采用碳水化合物口服、乳清蛋白口服两种术前预处理方案,患者术后FPG、FINS均有所升高,但其升高程度低于对照组。术前口服碳水化合物能够刺激内源性胰岛素分泌,使机体保持类似于餐后吸收状态,从而增加外周葡萄糖的利用效率,达到改善术后胰岛素抵抗的目的[15];此外,手术创伤、疼痛应激均可引发神经传导、分解激素的负性调节,进而引起胰岛素与受体结合异常、胰岛素受体数量下降、受体酪氨酸磷酸化障碍,导致胰岛素抵抗的发生[16],而术前碳水化合物的吸收能够促进胰岛素作用传导通路上关键酶激活,促进术后胰岛素受体功能的恢复以及外周组织利用葡萄糖能力的恢复,从而抑制胰岛素抵抗[17]。因此,口服碳水化合物组术后胰岛素抵抗程度更低于蛋白组。乳清蛋白富含人体必需的氨基酸,且在小肠内有着较高的吸收速度与吸收率,故术前口服乳清蛋白有利于患者术期营养支持[18]。所以,碳水化合物组、乳清蛋白组术前主观舒适度评分优于对照组。
[1] GJESSING P F, CONSTANTIN-TEODOSIU D, HAGVE M,et al. Preoperative carbohydrate supplementation attenuates post-surgery insulin resistance via reduced inflammatory inhibition of the insulin-mediated restraint on muscle pyruvate dehydrogenase kinase 4 expression[J]. Clin Nutr, 2015, 34(6):1177-1183.
[2] BABAN B, THORELL A, NYGREN J, et al. Determination of insulin resistance in surgery: the choice of method is crucial[J].Clin Nutr, 2015, 34(1): 123-128.
[3] LJUNGGREN S, HAHN R G, NYSTRÖM T. Insulin sensitivity and beta-cell function after carbohydrate oral loading in hip replacement surgery: a double-blind, randomised controlled clinical trial[J]. Clin Nutr, 2014, 33(3): 392-398.
[4] ZHAO G, CAO S, CUI J. Fast-track surgery improves postoperative clinical recovery and reduces postoperative insulin resistance after esophagectomy for esophageal cancer[J].Support Care Cancer, 2014, 22(2): 351-358.
[5] GJESSING P F, HAGVE M, FUSKEVÅG O M, et al. Singledose carbohydrate treatment in the immediate preoperative phase diminishes development of postoperative peripheral insulin resistance[J]. Clin Nutr, 2015, 34(1): 156-164.
[6] 陈俊勇, 程黎阳, 谢正勇, 等. 糖预负荷对胃癌术后胰岛素抵抗的影响及其相关研究[J]. 中华胃肠外科杂志, 2015, 18(12):1256-1260.
[7] NYGREN J, THORELL A, LJUNGQVIST O. Preoperative oral carbohydrate therapy[J]. Curr Opin Anaesthesiol, 2015, 28(3):364-369.
[8] SACKS F M, CAREY V J, ANDERSON C A M, et al. Effects of high vs low glycemic index of dietary carbohydrate on cardiovascular disease risk factors and insulin sensitivity: the OmniCarb randomized clinical trial[J]. JAMA, 2014, 312(23):2531-2541.
[9] 朱岭, 张应天, 彭开勤,等. 腹部大手术后胰岛素抵抗和高糖血症的临床处理策略[J]. 中华医学杂志, 2005, 85(19):1358-1359..
[10] BANG P, THORELL A, CARLSSON-SKWIRUT C, et al.Free dissociable IGF-I: Association with changes in IGFBP-3 proteolysis and insulin sensitivity after surgery[J]. Clin Nutr,2016, 35(2): 408-413.
[11] BILKU D K, DENNISON A R, HALL T C, et al. Role of preoperative carbohydrate loading: a systematic review[J]. Ann R Coll Surg Engl, 2014, 96(1): 15-22.
[12] 陈旭东, 张雯雯, 王宏光, 等. 围术期胰岛素抵抗与肝胆胰手术创伤程度的关系[J]. 解放军医学院学报, 2017, 38(4): 320-322.
[13] YKI-JÄRVINEN H. Nutritional modulation of non-alcoholic fatty liver disease and insulin resistance[J]. Nutrients, 2015,7(11): 9127-9138.
[14] CAMPOS G M, RABL C, HAVEL P J, et al. Changes in postprandial glucose and pancreatic hormones, and steady-state insulin and free fatty acids after gastric bypass surgery[J]. Surg Obes Relat Dis, 2014, 10(1): 1-8.
[15] 高群. 术前口服或静滴10%葡萄糖溶液对妇科手术患者围术期胰岛素抵抗的影响[D]. 苏州:苏州大学, 2016.
[16] 曹战江, 于健春, 康维明, 等. 术前口服葡萄糖溶液对胃肠术后胰岛素抵抗及炎症反应的影响[J]. 中华内分泌外科杂志, 2015,9(4): 305-308.
[17] SINGH M, CHAUDHARY M, VASHISTHA A, et al. Evaluation of effects of a preoperative 2-hour fast with glutamine and carbohydrate rich drink on insulin resistance in maxillofacial surgery[J]. J Oral Biol Craniofac Res, 2015, 5(1): 34-39.
[18] TEWARI N, AWAD S, MACDONALD I A, et al. Obesityrelated insulin resistance: implications for the surgical patient[J].Int J Obes, 2015, 39(11): 1575.
R657.5
A
2095-5200(2017)06-128-03
10.11876/mimt201706051
高星,本科,研究方向:手术室临床,Email:2469713820@qq.com。

