猪支原体肺炎疫苗免疫效果评价
龚文波,杜德燕,邱文英,朱冬梅,邹智坤,郭建宝
(华派生物工程集团有限公司,四川 简阳 641400)
猪支原体肺炎疫苗免疫效果评价
龚文波,杜德燕,邱文英,朱冬梅,邹智坤,郭建宝
(华派生物工程集团有限公司,四川 简阳 641400)
本试验以不同厂家生产的猪支原体肺炎疫苗接种健康仔猪,然后从增重情况、血清抗体效价、肺部病变评分及肺部病变减少率等多个方面对疫苗免疫效果进行评价。结果表明,不同厂家生产的猪支原体肺炎疫苗的免疫效果存在较大差异,单一从某方面评价免疫效果所得出的结果可能存在偏差,如咳嗽指数与肺部评分就无直接相关性。
猪支原体肺炎;商品化疫苗;免疫效果;评价
猪肺炎支原体(Mhp)可引起猪支原体肺炎(MPS),也称为猪喘气病。该病具有高传染性、高发病率和低死亡率的特点。猪肺炎支原体长期滞留于猪体内且治疗效果不佳,造成猪饲料转化率降低,该病的广泛性流行给养猪业造成了很大的经济损失[1]。疫苗在预防猪支原体肺炎中起着至关重要的作用,如何合理地评价疫苗效果从而指导猪场正确选用猪支原体肺炎疫苗对养猪场户尤为重要。基于此,本试验从市场上采购了几种常见的商品化猪支原体肺炎疫苗,以盲样方式进行免疫接种及攻毒,然后进行免疫效果比较。
1 材料与方法
1.1 材料
1.1.1 疫苗 选用6个厂家生产的商品化猪支原体肺炎疫苗,每种疫苗抽取3瓶混合(至少20 mL),记录疫苗类型、批号、生产日期等信息,分别标记为疫苗A、疫苗B、疫苗C、疫苗 D、疫苗E及疫苗F,将标记好的盲样送往相关检验小组进行免疫效果评价。
1.1.2 主要试剂盒 猪支原体肺炎(ELISA)抗体检测试剂盒,批号:HK575,购自IDEXX公司;猪支原体肺炎微量间接血凝(IHA)检测试剂盒,批号:2016003,由华派生物工程集团有限公司自制。
1.1.3 试验动物 14日龄健康仔猪,猪繁殖与呼吸综合征、猪伪狂犬病、猪瘟抗原阴性,猪放射性胸膜肺炎、猪支原体肺炎母源抗体阴性。
1.1.4 攻毒用毒种 猪支原体济南系冻干肺组织毒,由华派生物工程集团有限公司提供。
1.2 试验方法
1.2.1 试验分组 将80头14日龄健康仔猪随机分为8组,每组10头,分别标记为A组、B组、C组、D组、E组、F组、空白对照组及攻毒对照组。空白对照组仔猪在独立的环境中隔离饲养,各组仔猪的环境条件及饲养管理均保持一致。
1.2.2 免疫 每组仔猪在14日龄接种相同标记的猪支原体肺炎疫苗,接种剂量为每头猪1头份(2 mL),接种方式按厂家说明书进行,攻毒对照组每头接种2mL生理盐水。首免后14 d加强免疫一次,免疫剂量为1头份/头,攻毒对照组每头接种2mL生理盐水。
1.2.3 攻毒 加强免疫后4d进行攻毒保护试验。疫苗接种组及攻毒对照组的每头仔猪经气管内接种猪肺炎支原体济南系冻干肺组织毒5mL(含100MID),攻毒后连续观察25d进行剖杀。
1.2.4 免疫效果评价指标
1.2.4.1 日增重 所有试验猪在免疫当天、攻毒当天及剖杀当天进行称重,计算各个阶段的日增重情况。
1.2.4.2 免疫接种后临床症状观察 所有试验猪在免疫后进行临床症状观察,观察内容包括:精神、食欲、注射部位反应、全身反应等。
1.2.4.3 血清抗体检测 于免疫当天(未接种前)及首免后14d、28d、42d分别采血,采用IDEXX抗体检测试剂盒、自制微量间接血凝检测试剂盒进行血清抗体检测。
1.2.4.4 攻毒后临床症状观察及咳嗽指数 所有试验猪在攻毒后连续观察25d,每天上午、下午各观察1次,每次至少观察15min。检测范围包括总体健康状况、活动情况、精神食欲状况和咳嗽指数。咳嗽指数标记如下:0(没有咳嗽),1(追赶时轻度咳嗽),2(休息时轻度咳嗽),3(追赶时温和咳嗽),4(休息时温和咳嗽),5(追赶时严重咳嗽),6(休息时严重咳嗽)。计算每组每天的平均咳嗽指数。
1.2.4.5 肺脏病变情况 攻毒后25d剖杀试验猪,采用Goowin氏55分记分法对肺脏病变情况进行评分,记分标准为:每个尖叶、心叶满分各为10分,膈叶的前三分之一满分为5分,中间叶满分为5分。病变记分时,分别对每个肺叶进行记分,根据发生实质病变的肺叶面积占该肺叶的比例进行打分,如满分为10分的肺叶有3/10的面积产生实质化病变则该肺叶打3分,如满分为5分的肺叶有3/10的面积产生实质化病变则该肺叶打1.5分。记分时只对肺叶的一面进行记分,如肺叶两面均有病变,以病变面积大的一面进行记分。各个肺叶打分总和即为该发病猪的肺部病变得分。分别对免疫组猪和对照组猪进行记分,按照以下公式计算各组免疫猪的肺部病变减少率:
肺部病变减少率=(对照猪肺炎几何平均分-免疫猪肺炎几何平均分)/对照猪肺炎几何平均分×100%
2 结果
2.1 平均增重 试验结果表明,在免疫后至攻毒前,D组、E组试验猪的平均增重及平均日增重优于空白对照组及攻毒对照组;A组试验猪的平均增重和平均日增重与攻毒组相当,略低于空白对照组;B组、C组及E组试验猪的平均增重、平均日增重相当,均明显低于空白对照组及攻毒对照组。在攻毒后,由于各组疫苗免疫效果的差异,试验猪产生的免疫保护力也有所不同,因此其健康状况所受影响不同,从而导致各组平均体重存在明显差异。其中D组和F组的平均增重明显优于其余各疫苗组和空白对照组,A组、B组及E组的平均增重较低,显著低于空白对照组。结果见表1。

表1 各组试验猪各阶段增重情况 kg
2.2 接种后临床症状观察结果 除A组试验猪在接种疫苗后有2/10出现精神不振、食欲下降的临床症状外,其余5组试验猪在接种疫苗后均精神食欲正常,注射部位无红肿炎症现象,无局部或全身不良反应。
2.3 各时间点血清抗体检测 用2种试剂盒进行检测,结果显示:C、D组和F组在各时间点测得的抗体水平均明显优于其余各疫苗组;B组、D组和F组首免后6周抗体水平处于上升趋势,而A组、C组及E组抗体水平在首免后第4周达到高峰,第6周开始呈现下降趋势;空白对照组及攻毒对照组抗体水平无明显变化,均为阴性。综合各组抗体水平试验结果,D组及F组抗体水平显著高于其余疫苗组,且其高抗体水平维持时间较其余疫苗组长,说明免疫接种疫苗D及疫苗F的免疫猪更有可能获得更高的免疫保护力及更长的免疫保护期(结果见表2)。
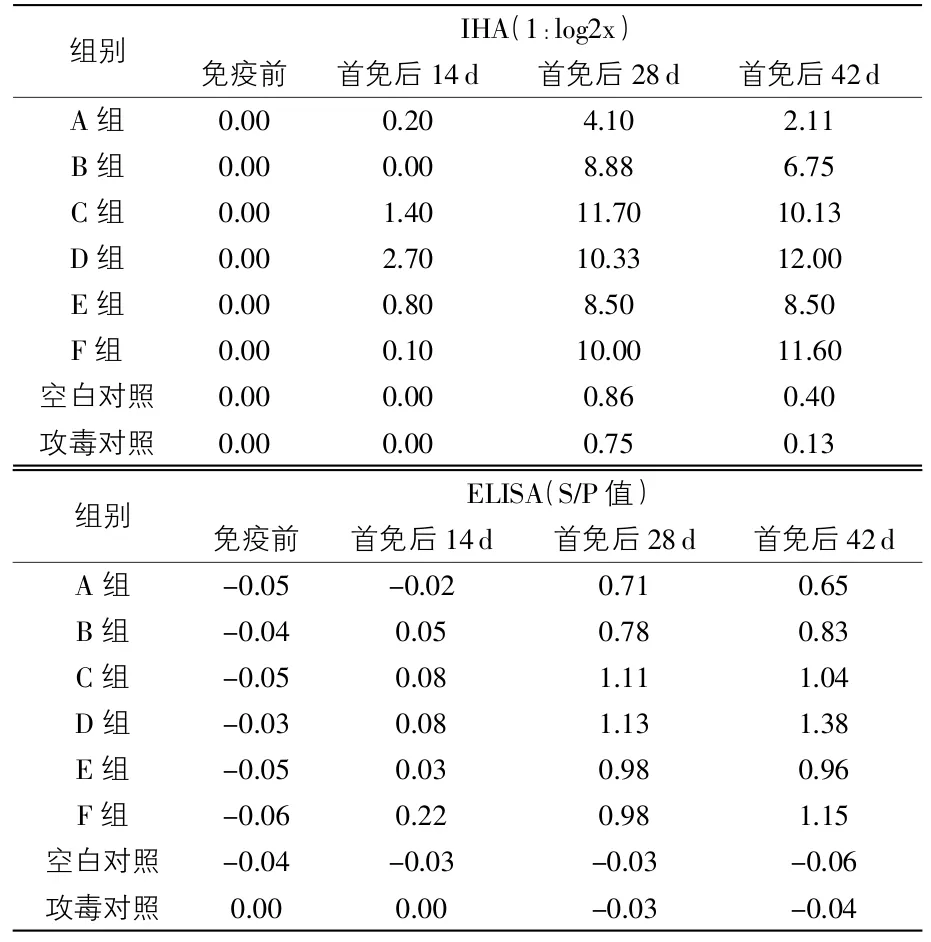
表2 各时间点血清抗体水平检测结果
对两种方法的检测结果进行分析后发现:ELISA方法的抗体水平消长趋势与IHA方法基本一致,两种检测方法具有很高的符合率。而采用IHA方法能检测出试验猪的具体抗体水平,可以为分析免疫个体及群体的抗体水平提供可靠依据。
2.4 攻毒后临床症状观察及咳嗽指数 在使用猪肺炎支原体强毒株进行攻毒后,发现D组和F组各有1头在追赶时出现轻度咳嗽,D组和F组所有试验猪未出现其他临床症状;其余免疫组的咳嗽头数和咳嗽指数均高于D组和F组;空白对照组所有试验猪未出现咳嗽、气喘等临床症状;攻毒对照组试验猪有10头出现咳嗽、气喘、食欲下降等症状。攻毒后25d观察期内,最早出现咳嗽症状的为攻毒对照组仔猪,部分试验猪在攻毒后第7d出现咳嗽症状,部分免疫猪在攻毒后25d观察到咳嗽症状。
2.5 肺部病变情况 使用猪肺炎支原体强毒进行攻毒后,采用Goodwin氏55分法记分,结果如下:攻毒对照组的肺部病变评分平均为43.75,D组和F组试验猪的肺部病变评分最低,肺部病变减少率效果相当,表明试验猪接种疫苗D及疫苗F后能有效抵抗猪肺炎支原体强毒的攻击。A组肺部病变减少率较低,低于60%,B组、C组及E组的肺部病变减少率均在60%~70%之间(结果见表3)。

表3 各组肺部病变评分及肺部病变减少率
2.6 咳嗽指数与肺部病变减少率的相关性分析 在70头攻毒试验猪中,有26头发生了咳嗽,其中2头试验猪的肺部病变减少率大于等于60%,而在未观察到咳嗽的54头试验猪中,有16头试验猪的肺部病变减少率小于60%。结果表明:咳嗽指数与肺部病变减少率无直接相关性,因此咳嗽指数只能作为猪支原体肺炎疫苗免疫效果评价的辅助判定指标,不能完全代替肺部病变减少率这一金标准(结果见表4)。

表4 咳嗽指数与肺部病变减少率的相关性 头
3 小结与分析
虽然使用猪支原体肺炎疫苗并不能阻止猪群感染该病原[2-3],但进行疫苗免疫接种后能有效减少支原体在呼吸道的定植,同时降低猪群的感染水平[4]。另有研究报道,接种疫苗可减少商品猪的临床症状及肺部损伤,降低治疗费用[5]。本试验采用盲样法进行检测,以保证检验的公正有效性。在免疫效果评价过程中,分别以增重情况、免疫接种后的临床症状观察、血清抗体水平检测、攻毒后咳嗽指数、攻毒后肺部病变评分及肺部病变减少率等作为评价指标,结果表明:免疫接种疫苗D(商品名:支肺通)和疫苗F的试验猪在日增重、血清抗体效价、攻毒后咳嗽指数、攻毒后的肺部病变减少率等方面均优于其余疫苗。
从本次试验可以看出,在猪支原体肺炎灭活疫苗的免疫效果评价指标中,试验攻毒后的增重、接种后的血清抗体水平、攻毒后的肺部病变减少率存在正相关性,而咳嗽指数与肺部病变减少率无直接相关性。肺炎病变减少率越高,则增重越明显。有报道称,由猪肺炎支原体引起的肺炎每10%的病变区域可以导致体重少增加23~37 g/d,对日龄小的猪的影响更大,日龄小的猪感染猪肺炎支原体后,对体重的影响是终生的,而肺损伤过程有时并不能观察到临床症状。因此,养猪场在判定猪只是否感染猪肺炎支原体时,不能仅根据猪只是否有咳嗽而判定。在血清抗体效价检测中,ELISA方法的抗体水平消长趋势与IHA方法基本一致,两种检测方法具有很高的符合率。采用IHA方法能检测出试验猪的具体抗体水平,可以为分析免疫个体及群体的抗体水平提供可靠依据,且操作简单、成本更加低廉、无需专门的检测仪器,因此更适用于基层兽医部门及养殖场。■
[1] Barbara E,Jeffery J,Sylvie D,et al.Diseases of Swine[M].9th Edition.United States:Wiley Blackwell,2006:785-787.
[2] Maes D,Deluyker H,Verdonck M,et al.Effect of vaccination againstMycoplasma hyopneumoniae in pig herds with an all-in/all-out production system[J].Vaccine,1999,17(9-10):1024-1034.
[3] Thacker E L,Thacker B J,Boettcher T B,et al.Comparison of antibody production,lymphocyte stimulation and protection induced by four commercial Mycplasma hyopneumoniae bacterins[J].J Swine Health Prod,1998,6(3):107-112.
[4] Sibila M,Nofrarías M,López-Soria S,et al.Chronological study of Mycoplasma hyopneumoniae infection,seroconversion and asscociated lung lesions in vaccinated and non-caccinated pigs[J].Vet Microbiol,2007,122(1-2):97-107.
[5] Maes D,Deluyker H,Verdonck M,et al.Effect of vaccination againstMycoplasma hyopneumoniae in pig herds with a continuous production system[J].J Vet Med,1998,45(8):495-505.
Evaluation of Immune Effect on Mycoplasma Hyopneumoniae Vaccine
Gong Wenbo,Du Deyan,Qiu Wenying,et al.
(Sichuan Huapai Bioengineering Group Co.,Ltd.,Sichuan Jianyang 641400,China)
The purpose of this research was to evaluate the immune effect of different commercial Mycoplasma hyopneumoniae vaccine.Firstly,healthy piglets were immunized with vaccines from different manufacturers,then the weight gain,serum antibody titer,lung lesion score and lung lesion reduction rate of pigets were detected to evaluate the effect of vaccine.The results showed that the immune effects of different vaccines had large differences,evaluating the immune effect from single aspect may be a deviation,such as cough index score wasn,t associated with lung lesion score.
Mycoplasma hyopneumoniae;Commercial vaccine;Immune effect;Evaluation
S852.4
B
1001-8964(2017)12-0024-04
2017-08-07
龚文波(1965-),男,重庆垫江人,硕士研究生,高级工程师,华派生物工程集团有限公司总经理,主要从事兽用生物制品的研发及生产管理。

