CeO2/SiO2吸附剂的制备及其对碘酸根的吸附
林 锦,吴 艳,韦悦周
上海交通大学 核科学与工程学院,上海 200240
CeO2/SiO2吸附剂的制备及其对碘酸根的吸附
林 锦,吴 艳,韦悦周*
上海交通大学 核科学与工程学院,上海 200240

CeO2;SiO2;吸附;碘酸根
在碘的同位素中只有127I是天然稳定存在的核素,其余均为放射性核素。其中主要的放射性核素131I和129I由核裂变产生,半衰期分别为8.04 d和1.6×107a。由于人体的甲状腺能够富集碘,因此放射性碘对人类健康存在潜在威胁。环境和人体中的放射性碘的主要来源有核试验、核电站的运行、核医学的应用以及重大核事故的放射性释放等[1]。

粉末状的氧化铈在吸附柱中会产生较大的柱压,易造成吸附柱的堵塞,且流速较慢,不适合进行柱操作。因此本工作的研究目的是合成一种能够有效去除碘酸根的新型吸附剂,且具有大的比表面积和快的动力学,适合进行柱操作,能够适应高速的废水处理工艺。由本课题组所研发的SiO2载体孔隙率高、粒径小、机械强度好,且耐辐照性能强[13-14]。因此本工作拟采用真空灌注法将CeO2担载到多孔SiO2载体中制备出新型的CeO2/SiO2吸附剂,通过扫描电镜(SEM)、X射线衍射(XRD)和红外光谱(IR)对CeO2/SiO2吸附剂进行表征,并进一步研究其对碘酸根的吸附行为和共存离子的影响,确定碘酸根的最佳吸附条件。
1 实验部分
1.1 试剂与仪器
六水合硝酸铈、碘酸钾,分析纯;碘标准溶液,质量浓度为1 000 mg/L;均为阿拉丁试剂提供。甲醇,分析纯,上海凌峰化学试剂有限公司提供。氯化钠,分析纯,国药集团化学试剂有限公司提供。
N-1100D-W/WD旋转蒸发仪,日本EYELA公司;D8 DA VINCE型X射线衍射仪(XRD),德国Bruker公司;NOVA NanoSEM 230低真空超高分辨场发射扫描电子显微镜(SEM),美国FEI公司;Nicolet 6700傅里叶红外光谱仪(IR),美国ThermoFisher公司;ICP-AES-7510等离子体发射光谱仪,日本岛津公司。
1.2 CeO2/SiO2的制备
CeO2/SiO2吸附剂的制备采用真空灌注法,通过以下步骤进行:首先将六水合硝酸铈溶解在甲醇中得到硝酸铈的甲醇溶液,再加入二氧化硅颗粒;然后将混合物通过旋转蒸发仪在室温和负压下旋转1 h,减压蒸馏除去甲醇并进行干燥;所得产物置于马弗炉中煅烧,制成CeO2/SiO2吸附剂。
1.3 吸附实验
1.3.1碘酸根的吸附容量和吸附率 碘酸根的浓度通过等离子体发射光谱仪进行测定,吸附容量(Q,mmol/g)和吸附率(F,%)的计算公式如下:
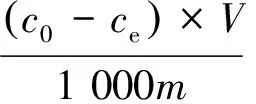
(1)
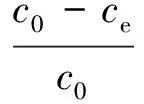
(2)
式中:c0和ce分别是溶液中碘酸根的初始浓度和平衡浓度,mmol/L;V,溶液的体积,mL;m,吸附剂的质量,g。
1.3.2静态吸附和脱附实验 称取一定量的CeO2/SiO2吸附剂于样品瓶中,加入一定体积的碘酸钾水溶液后置于恒温水浴摇床中振荡一定时间,取出过滤,用等离子体发射光谱仪测定吸附前后溶液中碘酸根的浓度,并计算相应的吸附容量和吸附率。称取一定量吸附碘酸根后的CeO2/SiO2吸附剂于样品瓶中,加入一定体积的洗脱液后置于恒温水浴摇床中振荡一定时间,取出过滤,测定脱附液中的碘酸根的浓度,并计算相应的脱附率。
1.3.3动态吸附实验 采用湿法装柱,将一定量的CeO2/SiO2吸附剂装入到吸附柱中,再通入与料液pH相同的氯化钠溶液,对吸附剂进行预平衡。最后将含有碘酸根的料液以一定流速流过吸附柱,用馏分收集器接收流出液,并测定流出液中的碘酸根浓度。
2 结果与讨论
2.1 CeO2/SiO2的基础表征
2.1.1SEM图像和粒径分布 为观察CeO2/SiO2吸附前后的形貌变化,称取一定量的CeO2/SiO2于含有碘酸根离子的溶液中进行静态吸附,从而得到吸附碘酸根后的CeO2/SiO2。图1为CeO2/SiO2吸附碘酸根前后的扫描电镜图(SEM)。如图1所示,合成的CeO2/SiO2吸附剂是一种形状均匀的球体,表面较为光滑,没有附着物,说明CeO2主要是在SiO2的孔道中。吸附剂表面可观察到明显的孔隙,有利于溶液扩散到SiO2内部与CeO2反应,为吸附剂具有良好的动力学提供了理论依据。通过静态吸附后CeO2/SiO2的表面形态没有发生明显的变化和破裂,仍保持原有的形貌,说明CeO2/SiO2吸附剂具有较好的稳定性。图2是CeO2/SiO2的粒径分布图,由图2可知其粒径分布为正态分布,且粒径主要分布在60 μm附近。

图1 吸附前(a)和吸附后(b)CeO2/SiO2的扫描电镜图像Fig.1 SEM images of CeO2/SiO2 before(a) and after(b) adsorption

图2 CeO2/SiO2的粒径分布Fig.2 Particle size distribution of CeO2/SiO2
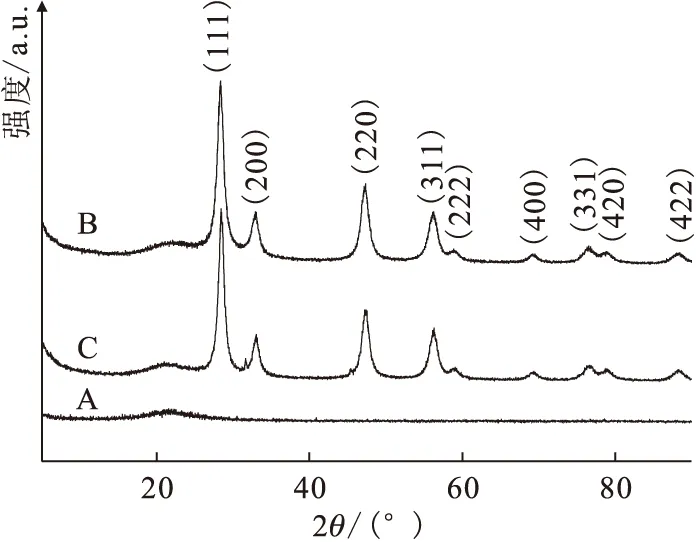
A——SiO2,B——吸附碘酸根前CeO2/SiO2,C——吸附碘酸根后CeO2/SiO2图3 SiO2以及吸附碘酸根前后的XRD谱图Fig.3 XRD patterns of SiO2 and CeO2/SiO2 before and after adsorption
2.1.2XRD分析 图3为SiO2、吸附前的CeO2/SiO2以及2.1.1节中所述吸附碘酸根后的CeO2/SiO2的XRD谱图。如图3所示,由于SiO2是非晶体,其衍射峰(2θ=22°)十分平缓,而图3中已标出晶面(2θ=28°、33°、47°、56°、59°、69°、76°、79°、88°)的衍射峰是CeO2的特征峰,表明CeO2被成功担载到SiO2载体中。谱图中吸附前CeO2/SiO2的衍射峰较为尖锐,且没有出现其它衍射峰,表明吸附剂中的CeO2结晶良好,纯度较高。而吸附碘酸根后,CeO2/SiO2的XRD谱图几乎没有改变,衍射峰仍然较为尖锐,说明吸附剂中的CeO2没有明显的泄漏和变化,稳定性较好。
2.1.3IR分析 图4是SiO2、CeO2、吸附前的CeO2/SiO2以及2.1.1节中所述吸附碘酸根后的CeO2/SiO2的IR谱图。图4中3 400 cm-1附近宽而强的吸收峰是吸附水羟基和表面羟基的伸缩振动峰,1 630 cm-1和1 380 cm-1附近的两个吸收峰分别是吸附水羟基和表面羟基的变角振动峰[15],而1 100 cm-1、800 cm-1和470 cm-1附近的吸收峰是SiO2的特征峰[16]。比较吸附前后CeO2/SiO2的IR谱图可以发现1 380 cm-1附近的吸收峰明显变弱,由此可推断吸附剂的表面羟基在吸附碘酸根过程中发生了变化,而水合金属氧化物在水溶液中吸附阴离子的主要机理是阴离子交换[17],因此可以推测CeO2/SiO2的表面羟基与水溶液中的碘酸根发生了离子交换反应,如下所示:
(3)
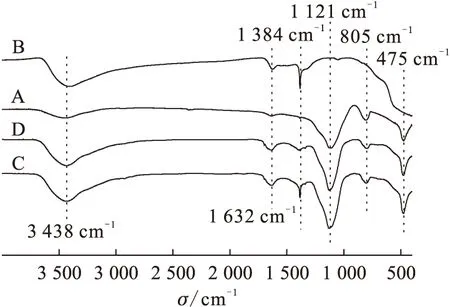
A——SiO2,B——CeO2,C——吸附碘酸根前CeO2/SiO2,D——吸附碘酸根后CeO2/SiO2图4 SiO2、CeO2以及CeO2/SiO2吸附碘酸根前后的IR谱图Fig.4 IR spectra of SiO2, CeO2 and CeO2/SiO2 before and after adsorption
2.2 CeO2/SiO2对碘酸根的静态吸附
2.2.1pH对吸附的影响 由于福岛核事故产生的废水是放射性海水,因此分别在纯水和0.6 mol/L NaCl两种环境下研究溶液pH对吸附效果的影响,结果示于图5。由图5可看出,吸附剂在两种环境下的吸附率并没有太大的差别,且在较广的pH值范围内对碘酸根有较高的吸附率,在pH=9时,两种环境下的吸附率仍能达到88%以上。溶液pH对吸附过程的影响较小,随着pH值的增大,吸附率缓慢降低。由IR分析可知,CeO2/SiO2对碘酸根的吸附机理主要是离子交换,而随着pH的增大,溶液中氢氧根的浓度增大,氢氧根与碘酸根形成竞争吸附;且通过测定不同pH条件下CeO2/SiO2的Zeta电势可得其表面零电荷点pHPZC=6.5,因此在碱性条件下CeO2/SiO2表面带负电荷,不利于碘酸根的吸附。以上原因导致了吸附率随着pH的增大缓慢降低。考虑到福岛核事故废水的pH值在7~8之间,以下的实验均在中性条件下进行。

m/V=0.05 g/10 mL, t=3 h, r=120 r/minc(NaCl), mol/L: ■——0,●——0.6图5 溶液pH对碘酸根吸附的影响Fig.5 Effect of pH on the adsorption of iodate
2.2.2吸附动力学 为了探究时间对吸附过程的影响,在不同的振荡时间取样测定溶液中的碘酸根的浓度,结果示于图6(a)。由图6(a)可知,在吸附的起始阶段,吸附容量随着振荡时间的增加而迅速增大,一定时间后,吸附容量趋于稳定,吸附达到平衡。在纯水环境下,CeO2/SiO2对碘酸根的吸附需要35 min达到平衡,而在0.6 mol/L NaCl环境下需要1 h达到平衡。根据准一级与准二级动力学模型的线性方程式对所得数据进行线性拟合[18]:
ln(Qe-Qt)=lnQe-k1t
(4)
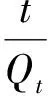
(5)
式中:t为振荡时间,h;Qt为在t时刻的吸附容量,mmol/g;Qe为平衡吸附容量,mmol/g;k1(h-1)和k2(g/(mmol·h))为吸附速率常数。动力学模型拟合结果示于图6(b)和(c),相关模型参数列于表1。由表1可知,在纯水和0.6 mol/L NaCl两种环境下,准二级动力学模型拟合的相关系数(r2)均在0.999以上,比准一级动力学模型更接近1,且由准二级动力学模型计算得到的平衡吸附容量与实验得到的平衡吸附容量基本一致。因此CeO2/SiO2对碘酸根的吸附更符合准二级动力学模型,而化学键的形成是影响准二级动力学吸附作用的主要因素,因此吸附过程属于化学吸附[19]。由IR分析推断的吸附机理是阴离子交换,碘酸根与吸附剂之间以离子键相结合,属于化学吸附,这与动力学模型拟合结果相一致。
2.2.3吸附等温线 为探究CeO2/SiO2对碘酸根的饱和吸附容量,在不同温度下通过改变碘酸根的初始浓度进行实验,图7为实验得到的吸附等温线以及不同等温线模型的拟合结果。从图7可以看出,随着溶液中碘酸根平衡浓度的增加,吸附容量随之增大,最终趋于稳定,且随着温度的升高,饱和吸附容量随之增大,说明CeO2/SiO2对碘酸根的吸附是一个吸热过程。用Freundlich、Langmuir以及Redlich-Peterson等温吸附模型对实验数据进行非线性拟合[18, 20]。

T=298 K, ρin(I)=250 mg/L, m/V=0.05 g/10 mL, pH=7, r=120 r/minc(NaCl), mol/L: ■——0,●——0.6图6 时间对碘酸根吸附的影响(a)和准一级(b)、准二级(c)动力学模型拟合Fig.6 Effect of contact time on adsorption of iodate(a) and the fitting of adsorption data to pseudo-first-order(b) and pseudo-second-order(c) kinetic equations

c(NaCl)/(mol·L-1)准一级动力学模型准二级动力学模型Qe,cal/(mmol·g-1)k1/h-1r2Qe,cal/(mmol·g-1)k2/(g·mmol-1·h-1)r2Qe,exp/(mmol·g-1)00077271109469025630592099970253060076225806673021729648099950233
Freundlich等温吸附模型方程:
(6)
式中:kf为Freundlich吸附常数,mmol/g,是吸附容量的一个近似指标;n也是Freundlich吸附常数。
Langmuir等温吸附模型方程:
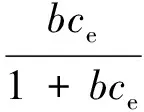
(7)
式中:Qm为饱和吸附容量,mmol/g;b为Langmuir常数,L/mmol。
Redlich-Peterson等温吸附模型方程:
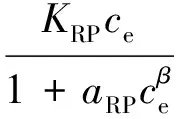
(8)
式中:KRP(L/g)、aRP(L/mg)和β为Redlich-Peterson常数。
表2列出了各等温吸附模型的相关参数和线性相关系数。由表2可知,Langmuir和Redlich-Peterson模型对不同温度下的吸附等温线的拟合结果较好,线性相关系数接近1。在298 K温度下,实验得到的饱和吸附量为0.262 mmol/g,而由Langmuir模型计算得到的饱和吸附量为0.261 mmol/g,与实验值十分相近。Redlich-Peterson模型既适用于均匀吸附,也适用不均匀吸附,当β接近1时,Redlich-Peterson模型具有Langmuir模型的特征。从表2可知,不同温度下Redlich-Peterson模型参数β的值在0.90~0.98之间,比较接近于1,说明在该吸附过程中Redlich-Peterson模型近似于Langmuir模型。以上分析结果表明CeO2/SiO2对碘酸根的吸附是均匀吸附。


c(NaCl)=0.6 mol/L, m/V=0.05 g/10 mL, pH=7, t=3 h, r=120 r/min(a):■——25 ℃,●——45 ℃,▲——65 ℃;(b): 25 ℃,1——Freundlich模型,2——Langmuir模型,3——Redlich-Peterson模型;(c): 45 ℃,1——Freundlich模型,2——Langmuir模型,3——Redlich-Peterson模型;(d): 65 ℃,1——Freundlich模型,2——Langmuir模型,3——Redlich-Peterson模型图7 不同温度下碘酸根的吸附等温线(a)及等温线模型拟合(b,c,d)Fig.7 Adsorption isotherm of iodate(a) and fitting of adsorption isotherm at different temperatures(b,c,d)

等温吸附模型T/K参数r2Freundlich298kf=0258,n=80707688318kf=0268,n=65709108338kf=0290,n=63209395Langmuir298Qm=0261,b=1461909876318Qm=0260,b=1209309224338Qm=0278,b=1091108987Redlich⁃Peterson298KRP=4196,aRP=16027,β=09809894318KRP=5336,aRP=19892,β=09209877338KRP=8028,aRP=27840,β=09009957
2.2.5脱附再生 图9为不同浓度NaOH溶液作为脱附剂进行脱附实验的结果。以纯水为脱附剂时,碘酸根的脱附率仅约为7%,而以0.01 mol/L的NaOH溶液为脱附剂时,碘酸根的脱附率可达到83%,当继续增大NaOH浓度时,碘酸根的脱附率并没有明显的增加。因此用低浓度的NaOH溶液便可实现对吸附剂的有效脱附,有利于吸附剂的重复利用。
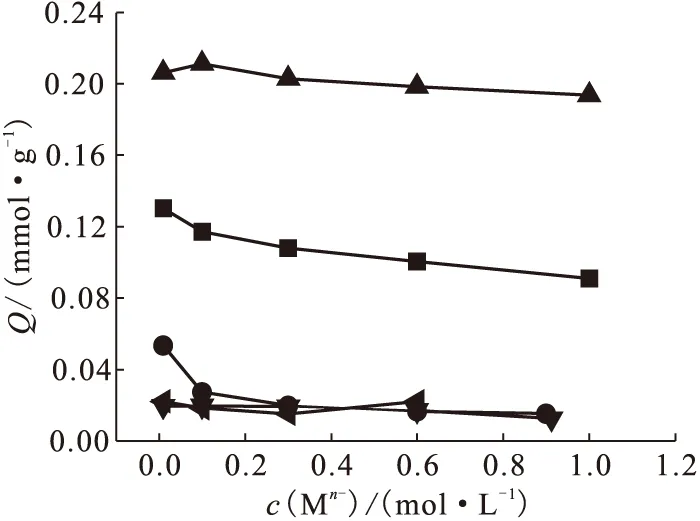
m/V=0.05 g/10 mL,t=3 h,r=120 r/min■●▲▼◆图8 共存阴离子的影响Fig.8 Effect of coexisting anions on adsorption of iodate
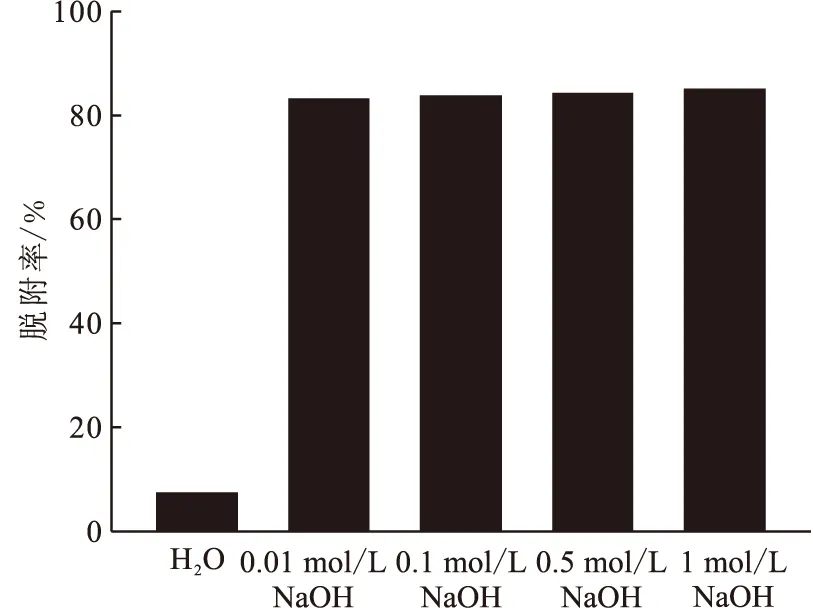
T=298 K, m/V=0.05 g/20 mL, t=3 h, r=120 r/min图9 不同浓度NaOH条件下碘酸根的脱附Fig.9 Desorption of iodate from loaded CeO2/SiO2with different concentration of NaOH solution
2.3 CeO2/SiO2对碘酸根的动态吸附
将含有碘酸根的溶液以0.1 mL/min的流速通过吸附柱,采用馏分收集器接收流出液,并测定流出液中碘酸根的浓度,从而得到碘酸根的穿透曲线,示于图10。由图10可知,碘酸根的穿透曲线呈S型,较为陡峭,通过计算可得5%穿透吸附容量和总吸附容量分别为0.151 mmol/g和0.166 mmol/g,因此吸附柱的利用率高达90.96%。用Thomas模型对穿透曲线进行拟合[21]:
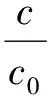
(9)
式中:KTH为Thomas速率常数;Qm为饱和吸附容量;m为柱中吸附剂的质量;V为流出液体积;c0为吸附质的初始浓度;c为吸附质的流出浓度;v为流速。

T=298 K, c(NaCl)=0.6 mol/L, pH=6.86, 实线为Thomas模型拟合图10 碘酸根的穿透曲线及Thomas模型拟合Fig.10 Breakthrough curve of iodate and fitting of Thomas model
表3列出了Thomas模型的相关参数和相关系数。由表3可知,通过Thomas模型拟合计算得到的饱和吸附容量约为0.161 mmol/g,与实验值(0.166 mmol/g)非常相近,且模型拟合的相关系数r2为0.993 2,说明Thomas模型对穿透曲线的拟合结果较好。

表3 Thomas模型参数Table 3 Thomas model parameters for breakthrough curve
3 结 论
通过真空灌注法成功合成了CeO2/SiO2吸附剂,并探究了其对碘酸根的吸附行为。实验结果表明:
(1) 合成的CeO2/SiO2吸附剂是一种均匀的球体,具有一定的孔隙和较好的机械强度;
(2) 根据红外谱图的分析,推测CeO2/SiO2对碘酸根的吸附是通过碘酸根与吸附剂表面的羟基进行离子交换;
(3) 溶液pH对吸附过程影响较小,且CeO2/SiO2能在较广的pH值范围内对碘酸根有较高的吸附率;
(4) 吸附剂的吸附速率较快,且吸附过程符合准二级动力学模型以及Langmuir和Redlich-Peterson模型,说明CeO2/SiO2对碘酸根的吸附是均匀的化学吸附;
(6) 通过对穿透曲线的分析计算可得,吸附柱的柱效率为90.96%,且穿透曲线能较好符合Thomas模型。
[1] 朱昌寿.放射性碘的危害评价[J].国际放射医学核医学杂志,1995(4):172-176.
[2] Sylvester P, Milner T, Jensen J. Radioactive liquid waste treatment at fukushima daiichi[J]. J Chem Tech Biotech, 2013, 88(88): 1592-1596.
[3] Wu H, Wu Y, Chen Z, et al. Adsorption behaviors of iodide anion on silver loaded macroporous silicas[J]. Nucl Sci Tech, 2015, 26(3): 40-46.
[4] Sachse A, Merceille A, Barré Y, et al. Macroporous lta-monoliths for in-flow removal of radioactive strontium from aqueous effluents: application to the case of fukushima[J]. Microporous Mesoporous Mater, 2012, 164(15): 251-258.
[5] 贾麟,刘阳,张光辉,等.去除水体中放射性碘核素的研究进展[J].工业水处理,2015,35(7):10-13.
[6] 张慧芳,高晓雷,郭探,等.单质碘、碘酸根和碘离子的吸附研究进展[J].核化学与放射化学,2011,33(3):129-135.

[9] Mahmudov R, Huang C P. Selective adsorption of oxyanions on activated carbon exemplified by filtrasorb 400 (f400)[J]. Sep Purif Technol, 2011, 77(3): 294-300.
[10] Hong C, Weng H, Jilani G, et al. Evaluation of iodide and iodate for adsorption-desorption characteristics and bioavailability in three types of soil[J]. Biol Trace Elem Res, 2012, 146(2): 262-271.
[11] Nilchi A, Yaftian M, Aboulhasanlo G, et al. Adsorption of selected ions on hydrous cerium oxide[J]. J Radioanal Nucl Chem, 2009, 279(1): 65-74.
[12] Li R, Li Q, Gao S, et al. Exceptional arsenic adsorption performance of hydrous cerium oxide nanoparticles: Part A: adsorption capacity and mechanism[J]. Chem Eng J, 2012, s 185-186(1): 127-135.
[13] Wei Y Z, Ning S Y, Wang Q L, et al. Adsorption materials development for the separation of actinides and specific fission products from high level waste[J]. Adv Sci Tech, 2014, 94: 103-110.
[14] 王启龙,吴艳,韦悦周.硅基磷钼酸铵吸附剂的合成及其对Cs的吸附[J].核化学与放射化学,2014,36(4):210-215.
[15] 宋宽秀,颜秀茹,胡留长,等.RExOy·nH2O对氟离子的吸附性能[J].应用化学,1998,15(4):92-94.
[16] Song X, Jiang N, Li Y, et al. Synthesis of CeO2-coated SiO2nanoparticle and dispersion stability of its suspension[J]. Mater Chem Phys, 2008, 110(1): 128-135.
[17] 焦中志,张昱,杨敏,等.稀土铈基无机吸附剂对氟的吸附性能[J].环境化学,2002,21(4):365-370.
[18] Zhou Y, Qiang J, Hu X, et al. Heavy metal ions and organic dyes removal from water by cellulose modified with maleic anhydride[J]. J Mater Sci, 2012, 47(12): 5019-5029.
[19] 孙小莉,曾庆轩,冯长根.多胺型阴离子交换纤维吸附铬(Ⅵ)的动力学[J].物理化学学报,2009,25(10):1951-1957.
[20] Benzaoui T, Selatnia A, Djabali D. Adsorption of copper (Ⅱ) ions from aqueous solution using bottom ash of expired drugs incineration[J]. Adsorpt Sci Technol, 2017(4): 0263617416685099.
[21] Yan G, Viraraghavan T. Heavy metal removal in a biosorption column by immobilized m. rouxii biomass[J]. Bioresour Technol, 2001, 78(3): 243-249.
PreparationofCeO2/SiO2AdsorbentandItsAdsorptionforIodate
LIN Jin, WU Yan, WEI Yue-zhou*
School of Nuclear Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China

CeO2; SiO2; adsorption; iodate
2017-03-27;
2017-05-15
国家自然科学基金资助项目(11405106,11675102)
林 锦(1992—),男,福建福州人,硕士研究生,核科学与技术专业,E-mail: linj2015@sjtu.edu.cn *通信联系人:韦悦周(1962—),男,广西南宁人,博士,教授,博士生导师,核化学工程专业,E-mail: yzwei@ sjtu.edu.cn
TL941.1
A
0253-9950(2017)06-0459-08
10.7538/hhx.2017.39.06.0459

