模拟氮沉降下不同凋落物处理对太岳山华北落叶松林土壤呼吸的影响
白英辰,陈 晶,康峰峰,程小琴,韩海荣,朱 江
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京100083)
模拟氮沉降下不同凋落物处理对太岳山华北落叶松林土壤呼吸的影响
白英辰,陈 晶,康峰峰,程小琴,韩海荣,朱 江
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京100083)
土壤呼吸是全球碳循环的重要组成部分,氮沉降会影响土壤中碳储量变化。为阐明模拟氮沉降和不同凋落物处理对土壤呼吸速率的影响,本研究在山西太岳山好地方林场进行氮沉降模拟试验,并对林地表面进行对照(C)、去凋(B)、去根去调(A)处理。结果表明:土壤呼吸速率的季节变化主要受土壤温度和含水量影响,氮沉降并没有改变土壤呼吸速率的季节变化规律。整个观测期内,模拟氮沉降促进了不同凋落物处理下土壤呼吸速率,且均在高氮水平下达到显著(P<0.05);高氮促进生长季凋落物层的呼吸;去凋和去根去凋处理抑制了土壤呼吸速率,且低氮和中氮水平降低了抑制土壤呼吸的幅度。土壤温度敏感性随着氮水平的增加而增加。土壤呼吸速率与土壤湿度拟合关系不显著(P>0.05),而与土壤温度的拟合关系极显著(P<0.001)。相比于单因子模型,土壤温度与水分双因子复合模型(RS=aebTWc)能更好地解释土壤呼吸季节变化。
模拟氮沉降;凋落物处理;土壤呼吸速率;华北落叶松林
在陆地生态系统中,土壤主要通过土壤呼吸向大气排放CO2,土壤呼吸是大气CO2重要的来源[1]。全球土壤呼吸碳排放高达68~100 Pg·a-1,约占大气CO2循环的10%[2-3],相当于化石燃料燃烧所释放的CO2量的11倍。因此,研究土壤呼吸机制和不同陆地生态系统土壤呼吸的控制因子,并找到减少土壤CO2的排放的合理管理政策和相关技术,增加碳吸存成为近年来的研究热点。
氮元素在氮素短缺的陆地生态系统中已成为影响土壤呼吸的重要因子。未来的几十年里,随着大气氮沉降速率加快[4-5]和氮肥的大量应用,大量的氮元素将进入到陆地生态系统中。这些将使土壤中氮现状和植被中氮集中的状况得到改变,且氮沉降会影响微生物群落活动[6],凋落物分解过程[7]和根系生物量[8],这些最终会改变土壤呼吸的现状。作为土壤呼吸的重要碳源,凋落物控制土壤小气候,通过吸收氮元素改变土壤氮含量[9],进而影响土壤呼吸速率。在全球氮沉降和氮素缺乏陆地生态系统中,氮沉降对土壤呼吸的影响机制仍不清楚。关于氮沉降对土壤呼吸的影响在草原生态系统、农田生态系统中进行了许多试验。而温带森林生态系统中,华北落叶松林的模拟氮沉降试验均位于1 000~1 500 m的低海拔地区[10-11],关于高海拔下模拟氮沉降对温带森林土壤呼吸影响的研究不多。
由于华北落叶松具有生长速率快、抗性较强、适应范围广等优点,因此我国广大地区在新中国成立后进行了大量引种。山西省引用了大量的华北落叶松,基本上超过了原天然林的分布生境。以太岳山华北落叶松林为研究对象,通过模拟氮沉降下不同凋落物处理对土壤呼吸速率产生的影响,为探究氮沉降对土壤呼吸影响机制提供理论依据,并为人工林提供适当管理策略。
1 研究地区与研究方法
1.1 研究区概况
试验样地位于山西省长治市沁源县太岳山国有林管理局好地方林场,地理位置为111 °59 ′~112 °05′ E,36 °40 ′~ 36 °47 ′ N。林区海拔为2 037~2 294 m,平均海拔2 165.5 m。地貌属大起伏亚高山,褐土为主要土壤类型。该区气候属温带大陆性季风气候,四季分明,雨量集中在夏季,占全年降水量的60%以上,年平均气温6.2 ℃,年平均降水量600 mm,无霜期120 d。乔木层优势树种为华北落叶松Larix principis-rupprechtii,灌木主要有土庄绣线菊Spiraea pubescens、忍冬Lonicera japonica和黄刺玫Rosa xanthina等。草本主要有:大油芒Spodiopogon sibiricus、细叶苔草Carex rigescens和蛇莓Duchesnea indica,小红菊Dendranthema chanetii等。
1.2 研究方法
1.2.1 样地设置
2014年7月在落叶松林选取未被破坏、地势较为平坦、林木分布相对均匀的地段建立1个20 m×35 m的样地,并对样地进行本底调查(表1)。

表1 华北落叶松林样地林分和立地特征Table 1 Stand and site characteristics of nitrogen -loaded plots in Larix principis-rupprechtii plantation
1.2.2 模拟氮沉降方法
太岳山地区氮沉降量约为21.2 kgN·hm-2a-1[12],参照北美Harvard forest等[13]的研究方法,依照背景值设置氮硫沉降处理的强度和频度:按不施氮(CKN,0 kg N·hm-2a-1),低氮(LN,50 kg N·hm-2a-1), 中 氮(MN,100 kg N·hm-2a-1), 高氮(HN,150 kg N·hm-2a-1),每种水平重复3次。使用NH4NO3作为氮源,自2015年4月开始,生长季(4月―10月)的每月月底(在每次测定完月底的土壤呼吸之后进行施氮)在小样方内进行氮沉降处理,使用背式喷雾器每一列进行同一浓度均匀喷洒,每个小样方内施加2 L水[14],对照样方喷施等量的水以避免外加的水造成生物地球化学循环的影响。
1.2.3 凋落物处理
如图1与图2所示,在样地35 m的每5 m处,一列设置9个2 m×2 m的小样方,均避开周围树木。为避免浓度交叉,设置5 m的缓冲带。对林地表明分别作3种水平凋落物处理:对照(保持枯枝落叶层+保留根系,C)、去凋(去除枯枝落叶层,B)、去根+去凋(去除枯枝落叶层+去除根系,A),每种水平处理重复3次,共36个小样方。
去凋处理:去除样方表面的所有凋落物及碎屑。去根处理:采用挖壕法,壕沟深1.0 m,切断所有根系但不移走,壕内用石棉瓦隔离周围根系,紧贴地面去除小样方内所有活体。
1.2.4 土壤呼吸的测定
于2014年7月,在每个小样方中放置1个内径为20 cm,高为10 cm的PVC环,并保持PVC管露出地面3~5 cm,记录每个土壤环露出地面的高度。从2015年5月至2015年10月,生长季每隔15 d(避开雨天)使用LI-8100(LI-COR Inc.)土壤碳通量自动测量系统测定1次,取2次的平均值得月土壤呼吸速率,设定测量时间为3 min,测定土壤呼吸的同时,应用与LI-8100配套的温度、湿度传感器测定土壤5 cm深度的温度、湿度,整个观测期间保持土壤环位置不变。
1.3 数据处理
利用Microsoft Excel 2010和SPSS 20.0软件进行显著性差异分析分析,使用软件Sigmaplot 10.0进行作图。
利用Vant’s Hoff模型进行土壤呼吸(Rs)与温度进行回归分析。

式(1)中,Rs为土壤呼吸速率,单位μmol·m-2s-1;T为温度,单位℃;α为0 ℃时土壤呼吸速率,β为温度反应系数。Q10为土壤呼吸为温度变化的敏感性系数。
呼吸速率与土壤温度及相对含水量线性关系拟合:

呼吸速率与土壤温度及相对含水量非线性拟合:

式(3)中,Rs为呼吸速率,单位 μmol·m-2s-1;T为温度,单位℃;W为土壤5 cm深处相对含水量,单位%;a为温度反应系数,b为水分反应系数,c为截距。
2 结果与分析
2.1 施氮后土壤呼吸速率的季节变化规律
由图1可知,整个观测期间,CKN水平处理下对照(C)处理的土壤呼吸速率最大值出现在7月,去凋(B)土壤呼吸速率最大值出现在9月,去根去凋(A)最大值出现在8月,最大值分别为4.26±0.51、3.14±0.28、2.55±0.17 μmol·m-2s-1; 在 LN 处 理 下, 对照(C)、去凋(B)和去根去调(A)土壤呼吸速率最大值分别出现在在8月、9月和7月,最大值分别为4.23±0.63、3.93±0.28、3.01±0.26 μmol·m-2s-1;在 MN 处理下,对照(C)土壤呼吸速率在8月份达到最高,去凋(B)土壤呼吸速率最大值出现在7月,去根去调(A)最大值出现在9月,最大值分别为5.94±0.64、4.80±0.42、3.93±0.52 μmol·m-2s-1; 在 HN 处理下,对照(C)、去凋(B)和去根去调(A)均在夏季达到最大值,最大值分别为4.28±0.21、4.23±0.22、 7.88±0.49 μmol·m-2s-1。在 不 同 氮 沉降水平下,去凋处理土壤呼吸速率分别比对照(C)低31.5%、6.5%、27.5%和44.7%;去根去凋处理分别比对照(C)低43.9%、23.6%、35.5%和43.8%(表2),表明低氮和中氮水平降低了去凋和去根去凋两种处理抑制土壤呼吸速率的幅度。
在整个观测期间,去根+去凋(A)处理中,MN和HN水平下土壤呼吸速率显著高于CKN(P<0.05),而LN与CKN没有产生显著差异(P>0.05),各氮沉降水平土壤呼吸速率分别比CKN高15.4%、44.4%和50.6%(表2)。在去凋(B)处理中,MN土壤呼吸速率与CKN产生显著差异(P<0.05),各施氮水平的平均土壤呼吸速率分别比CKN高15.7%、32.8%和21.2%(表1、表2)。对照(C)样方处理下,HN土壤呼吸速率显著高于对照(CKN)浓度(P<0.05),MN和HN与CKN相比没有显著差异(P>0.05)。LN处理下的平均土壤呼吸速率比CKN低15.2%,而MN与HN分别比CKN高25.6%和50.2%(表2)。


图1 氮沉降下不同凋落物处理月平均土壤呼吸速率生长季变化趋势Fig.1 Seasonal dynamic of soil respiration rate under different treatments in growing season with different nitrogen levels
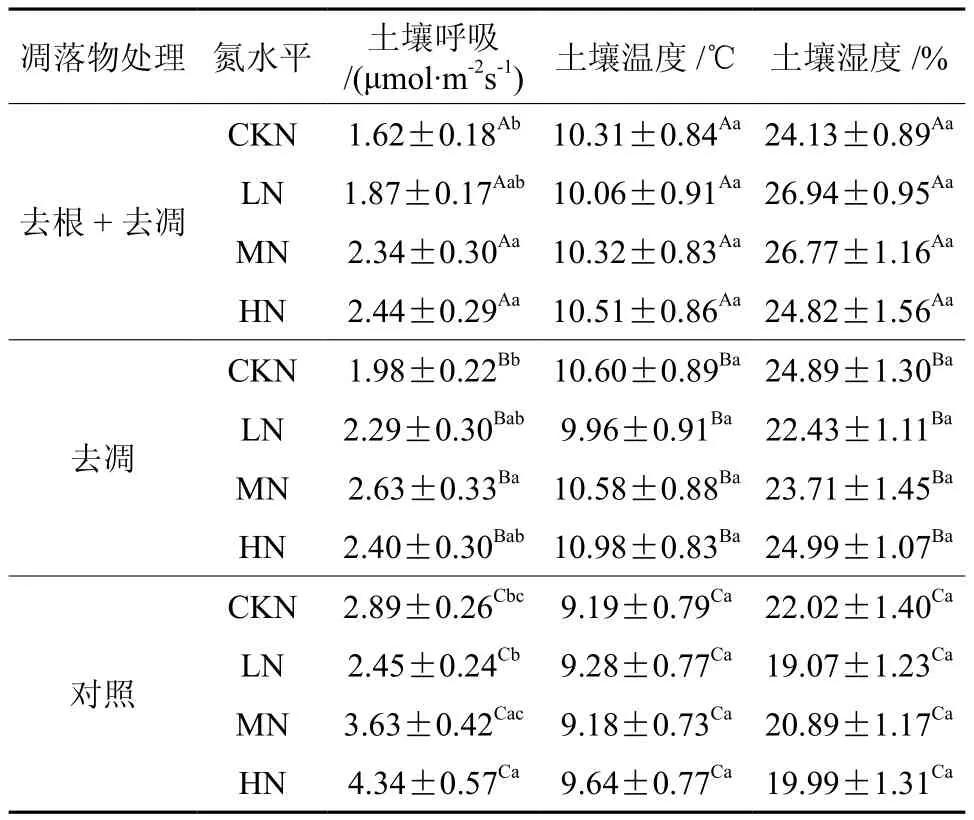
表2 不同处理各氮沉降水平的土壤呼吸速率、土壤温度和土壤湿度的值(平均值±标准误)†Table 2 Changes of soil respiration, soil temperature, soil moisture in different treatment (mean±SD)
2.2 不同处理下5 cm土壤温度与5 cm土壤含水量的变化
图2为CKN水平下5 cm土壤温度和土壤含水量的季节变化趋势。在整个观测期间,土壤温度与土壤含水量均具有明显的季节变化。土壤温度变化范围为3.1~15.8 ℃,不同处理土壤温度均在7月份出现最大值,4月份出现最小值。土壤含水量在生长季前期较低,在夏季和秋季土壤含水量较高,土壤含水量的变化范围为16.64~32.86%。
2.3 土壤呼吸速率与土壤温度及水分的回归分析
在整个观测期间,不同处理下土壤呼吸速率与5 cm土壤温度呈极显著指数正相关关系(P<0.001)(表3),土壤温度解释了土壤呼吸速率变异的34.5~75.4%。除对照(C)样方下,MN降低了模型决定系数R2外,施氮增加了去根+去凋(A)和去凋(B)样方的模型决定系数R2。土壤呼吸速率与土壤水分的回归分析表明,土壤呼吸速率与土壤含水量之间相关性不显著(P>0.05)(表3),表明土壤含水量不能很好地解释凋落物处理下土壤呼吸速率的变异。
土壤温度每上升10 ℃土壤呼吸速率会相对地变化,Q10值主要反映土壤呼吸速率对土壤温度变化的敏感性。在不同处理下,Q10值均表现为HN>MN>LN>CK。在去根+去凋(A)处理下,各氮添加土壤温度敏感性依次为2.91、4.21、4.47;在去凋(B)处理下,各氮添加土壤温度敏感性依次为1.83、2.67、3.79;在对照(C)处理下,各氮添加土壤温度敏感性依次为3.53、3.76、5.61。

图2 观测期土壤温度和土壤含水量的变化趋势Fig.2 Soil temperature and moisture conditions in the observed period

表3 土壤呼吸速率与5 cm土层温度、土层含水量的关系模型†Table 3 The exponential relationship between soil respiration rate and soil temperature as well soil moisture at 5 cm depth
2.4 土壤呼吸与土壤温度及水分的复合关系方程
土壤呼吸的季节变化主要由土壤温度和土壤含水量来调控,当温度和含水量都不在极端条件时,二者共同影响土壤呼吸,为根系和微生物提供了适宜的环境,进而影响土壤碳排放的变化。土壤呼吸速率与土壤温度和土壤含水量的复合关系可利用线性和非线性双变量模型进行分析(表4),结果表明不同处理下的非线性模型拟合效果均好于单因子模型,而线性模型的拟合效果和单因子模型相当。非线性模型解释了土壤呼吸季节变异的46.3~84.1%,表明非线性模型能更准确地预测土壤呼吸速率。
3 讨 论
3.1 氮沉降对不同凋落物处理土壤呼吸速率的影响
在整个观测期间,氮沉降未改变土壤CO2释放的季节变化规律,在不施氮样方和各施氮样方内,土壤呼吸表现出明显的季节变化,即夏季土壤CO2释放量高,而冬季土壤CO2释放量较少,这与许多研究结果一致[15-16]。土壤温度和土壤含水量的变化受研究地温带季风性气候影响,且不同水平氮沉降并没有改变土壤温度和土壤含水量的变化趋势,故土壤呼吸速率的季节变异与土壤温度、土壤含水量季节变化相似。模拟氮沉降促进了去根+去凋处理后的土壤呼吸速率,即施氮促进了矿质土壤呼吸速率;施氮促进了去凋处理后的土壤呼吸速率,即施氮促进了矿质土壤呼吸+根呼吸;施氮促进了对照处理的呼吸速率,且高水平氮沉降的促进作用高于去凋处理后的土壤呼吸速率,表明高水平氮沉降促进凋落物层呼吸速率。低氮和中氮水平降低了去凋和去根去凋处理对土壤呼吸的抑制程度,这与李化山等研究一致[17],表明施氮会改变凋落物对土壤总呼吸的贡献率。
在对照(C)处理下,不同氮沉降水平均促进了土壤呼吸速率,且土壤呼吸速率在高氮(150 kg·hm-2a-1)水平出现显著差异(P<0.05)。由于目前各研究者模拟氮沉降水平差异较大,氮沉降对土壤呼吸的影响也存在较大差异。张徐源等研究表明5、15和30 kg·hm-2a-1氮沉降水平显著抑制土壤呼吸速率[18]。李睿达等模拟0、7.01、13.9、27.8 kg·hm-2a-1的氮沉降,结果表明氮添加均显著促进CO2排放通量[19];有研究表明中氮(120 kg·hm-2a-1)显著促进土壤呼吸速率,而高氮(240 kg·hm-2a-1)显著抑制土壤呼吸速率[20],这可能由于各试验地的气候不相同,导致根据背景值设置的处理水平对土壤呼吸的影响也有所差异。
土壤中CO2释放在短期内会增加在许多实验研究中均有报道[23],这种促进作用可能是由于施肥后微生物生物量和群落活动增加[24]及根系生产力增加[25];在本研究地第1年中氮素短缺,施氮提高了土壤中有效氮的含量,满足植物生长需求,有利于C被氧化成CO2[26];根系从植物主干中移除后可以继续存活,并在一段时间内进行呼吸[27];氮添加可使叶片中Rubisco酶和叶绿素含量增加,进而增加地上和地下的生物量,进而为根呼吸和为微生物呼吸提供更多底物[28]。

表4 土壤呼吸速率与5 cm土壤温度、5 cm土壤含水量的复合关系方程†Table 4 Combined relationships between soil respiration and soil temperature at 5 cm depth as well soil moisture at 5 cm depth
3.2 土壤温度和土壤含水量对土壤呼吸的影响
土壤呼吸是土壤呼吸过程的主要影响因子,许多研究证明二者之间的温度响应曲线,即温度较低时呼吸速率随温度的升高而呈指数增加[29-30]。本研究结果表明,不同凋落物处理下的土壤呼吸速率与土壤温度之间具有极显著指数正相关性(P<0.000 1),土壤呼吸速率与土壤温度之间的指数关系未因凋落物处理和氮沉降而发生改变,土壤温度解释了土壤呼吸变异的19.5%~75.4%。不同凋落物处理下土壤含水量与土壤呼吸的拟合关系不显著(P>0.05),这与王光军等在油松林的研究结果相似[31]。可能原因为观测期内土壤较湿润,比较适合土壤中根系和微生物的生理活动,难以成为影响土壤呼吸速率的主要限制因子。
本研究对土壤呼吸与土壤温度和土壤含水量的复合关系分别利用线性和非线性模型进行分析,结果表明非线性模型的拟合效果较好,非线性双变量复合模型共同解释了土壤呼吸速率变异的45.6%~84.1%。在非线性复合模型下,与对照处理样方相比,两种凋落物处理降低了决定系数R2,表明凋落物处理改变了土壤呼吸速率与土壤水热的关系。MN降低了对照处理指数关系模型的决定系数R2,原因可能为中氮改变了微生物活性和根系活动,提高了微生物和根系对土壤呼吸速率的影响程度,另一方面降低了土壤温度对土壤呼吸变异的解释能力,这与涂丽华等的研究结果相似[32]。
3.3 土壤呼吸温度敏感性的变化
对照处理样方下CKN的土壤呼吸速率的Q10值为2.87,与温带森林报道的Q10值相近(Q10=2.9±0.26)[33]。去根+去凋处理和去凋处理的Q10值低于对照,表明去除凋落物和去除根系降低了土壤温度敏感性,这与邓琦等的研究结果一致[34]。本研究表明,在每种凋落物处理下,氮添加会增加Q10值,且顺序均为HN>MN>LN>CK,这与Mo等在热带地区研究结果为氮沉降会降低土壤温度敏感性结果相反[35],可能是由于不同森林生态系统所处气候以及森林自身不同的特性造成的。模拟氮沉降后土壤温度敏感性升高,可能为氮沉降改变了微生物群落结构和酶活性,进而改变土壤温度敏感性。
4 结 论
本试验阐明了模拟氮沉降下不同凋落物处理对土壤呼吸速率的短期影响,分析了不同处理下水热因子变化以及对土壤呼吸速率的短期影响。由于试验周期于有一定的局限性,氮沉降对土壤呼吸速率有应激促进效应,因此今后还需进行长期试验验证。此外,今后需增加氮沉降下土壤理化性质、土壤微生物活动和根系等的分析和研究,以揭示氮沉降对土壤碳循环影响的机制。
[1]Bowden R D, Davidson E, Savage K, et al.Chronic nitrogen addition reduce total soil respiration and microbial respiration in temperate forest soil at the Harvard Forest[J].For Ecol Manage,2004, 196(1): 43-56.
[2]Raich J W, Schlesinger W H.The global carbon dioxide fl ux in soil respiration and its relationship to vegetation and climate[J].Tellus, 1992, 44(2): 81-99.
[3]Raich J W, Potter C S.Global pattern of carbon dioxide emission from soils[J].Glob Biogeochem Cycles, 1995,9(1):23-26.
[4]Galloway J N, Levy H I I, Kasibhatla P S.Year 2020:Consequences of population growth and development on the deposition of oxidized nitrogen[J].Ambio, 1994(23): 120-123.
[5]Moister A R, Morgan G A, King J Y, et al.Soil-atmosphere exchange of CH4, CO2, NOx, and N2O in the Colorado Shortgrass Steppe under Elevated[J].Plant and Soil, 2002, 240(2): 201-211.
[6]Compton J E, Watrud L S, Porteous L A, et al.Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard Forest[J].For Ecol Manage, 2004,196(1):143-158.
[7]韩 雪, 王春梅, 蔺照兰.模拟氮沉降对温带森林凋落物分解的影响[J].生态环境学报, 2014, 23(9): 1503-1508.
[8]Subke J A, Hahn V, Battipaglia G, et al.Feedback interactions between needle litter decomposition and rhizosphere activity[J].Oecologia, 2004, 139(4): 551-559.
[9]Vose J M, Ryan M G.Seasonal respiration of foliage, fine roots, and woody tissues in relation to growth, tissue N, and photosynthesis[J].Glob Change Biol, 2002, 8(2): 182-193.
[10]李琛琛, 刘 宁, 郭晋平, 等.氮沉降对华北落叶松叶特性和林下土壤特性的短期影响[J].生态环境学报, 2014, 23(12):1924-1932.
[11]全 权, 张 震, 何念鹏, 等.短期氮添加对东灵山三种森林土壤呼吸的影响[J].生态学杂志, 2015, 34(3): 797-804.
[12]汪金松, 模拟氮沉降对暖温带油松林上壤碳循环过程的影响[D].北京:北京林业大学, 2013.
[13]Aber J, McDowell W, Nadelhoffer K, et al.Nitrogen saturation in temperate forest ecosystems: Hypotheses revisited[J].Bioscience,1998, 48(11): 921-934.
[14]李化山, 汪金松, 赵秀海, 等.模拟氮沉降下去除凋落物对太岳山油松林土壤呼吸的影响[J].生态学杂志, 2014, 33(4):857-866.
[15]Mo J, Zhang W, Zhu W, et al.Nitrogen addition reduces soil respiration in a mature tropical forest in southern China[J].Glob Change Biol, 2008, 14(2): 403-412.
[16]Bowden R D, Davidson E, Savage K, et al.Chronic nitrogen additions reduce total soil respiration and microbial respiration in temperate forest soils at the Harvard Forest[J].Forestry Ecology Management, 2004, 196(1):43-56.
[17]李化山, 汪金松, 刘 星, 等.模拟氮沉降对太岳山油松林土壤呼吸的影响及其持续效应[J].环境科学学报, 2014, 34(1):238-247.
[18]张徐源, 闫文德, 马秀红, 等.模拟氮沉降对樟树人工林土壤呼吸的短期效应[J].中南林业科技大学学报, 2013, 32(3):109-113.
[19]李睿达, 张 凯, 苏 丹, 等.施氮对桉树人工林生长季土壤温室气体通量的影响[J].生态学报, 2015, 35(18): 5931-5939.
[20]李 凯, 江 洪, 由美娜, 等.模拟氮沉降对石栎和苦槠幼苗土壤呼吸的影响[J].生态学报, 2011, 31(1): 82-89.
[21]Hart S C, Stark J M.Nitrogen limitation of the microbial biomass in an old-growth forest soil[J].Ecoscience, 1997(4): 91-98.
[22]涂利华, 胡庭兴, 张 健, 等.模拟氮沉降对华西雨屏区苦竹林细根特性和土壤呼吸的影响[J].应用生态学报, 2010,21(10): 2472-2478.
[23]温都如娜, 方华军, 于贵瑞, 等.模拟氮沉降增加对寒温带针叶林土壤CO2排放的初期影响[J].生态学报, 2012, 32(7):2185-2195.
[24]Lovell R D, Hatch D J.Stimulation of microbial activity following spring applications of nitrogen[J].Biol Fertil Soils,1998, 26(1):28-30.
[25]Magill A H, Aber J D, Hendricks J J, et al.Biogeochemical response of forest ecosystems to simulated chronic nitrogen deposition[J].Ecol Appl, 1997, 7(2): 402-415.
[26]Emmett, B A.The impact of nitrogen on forest soils and feedbacks on the growth[J].Water &Air &Soil pollution[J].1999, 116: 65-74.
[27]Uchida M, Nakatsubo T, Horikoshi T, et al.Contributions of micro-organisms to the carbon dynamics in black spruce (Picea mariana) forest soil in China[J].Ecol Res, 1998, 13(1): 17-26.
[28]Högberg P.Nitrogen impact on forest carbon[J].Nature,2007,447(14): 781-782.
[29]郑 威, 谭一波, 唐 洁, 等.不同坡位下红锥人工林的土壤呼吸特征[J].中南林业科技大学学报, 2015, 35(6): 11-14.
[30]胡正华, 李涵茂, 杨燕萍,等.模拟氮沉降对北亚热带落叶阔叶林土壤呼吸的影响[J].环境科学, 2010, 31(8): 1726-1732.
[31]王光军, 田大伦, 闫文德, 等.改变凋落物输入对杉木人工林土壤呼吸的短期影响[J].植物生态学报, 2009,33(4):739-747.
[32]涂利华, 胡庭兴, 黄立华, 等.华西雨屏区苦竹林土壤呼吸对模拟氮沉降的响应[J].植物生态学报, 2008, 33(4): 728-738.
[33]Bekku YS, Nakatsubo T, Kume A, et al.Effect of warming on the temperature dependence of soil respiration rate in arctic,temperate and tropical soils[J].Appl Soil Ecol, 2003,22(3): 205-210.
[34]邓 琦, 刘世忠, 刘菊秀, 等.南亚热带森林凋落物对土壤呼吸的贡献及其影响因素[J].地球科学进展, 2007,9(22):976-986.
[35]Mo J M, Zhang W, Zhu W X, et al.Response of soil respiration to simulated N deposition in a disturbed and a rehabilitated tropical forest in southern China[J].Plant Soil, 2007, 296(1-2):125-135.
Effect of different litter treatment under simulated nitrogen deposition on soil respiration in Larix principis-rupprechtii Mayr.Plantation in the Taiyue Mountain, China
BAI Yingchen, CHEN Jing, KANG Fengfeng, CHENG Xiaoqin, HAN Hairong, ZHU Jiang
(Key Laboratory of Ministry of Forest Cultivation and Conservation of Ministry of Education, Beijing Forestry University,Beijing 100083, China)
Soil respiration is an important component of the global carbon cycle, and nitrogen deposition may affect soil carbon storage.In order to illustrate the effect of simulated nitrogen deposition and litter treatment control(C), litter exclusion(B), litter and root exclusion(A) on soil respiration, A nitrogen deposition simulation test was carried out at Haodifang forestry station in Taiyue Mountain,Shanxi Province.The results indicated that nitrogen deposition did not change the seasonal patterns of soil respiration, which were mainly controlled by soil temperature and soil moisture.Throughout the observation period, nitrogen deposition promoted soil respiration under different litter treatment, and soil respiration reached a signi fi cant level in HN (P< 0.05).HN promoted litter respiration in seasonal period.Litter removal(B) and root and litter removal reduced soil respiration compared with control(C), but the inhibitions were weakened under LN and MN level.Soil sensitivity increased with the growth of nitrogen level.The relationship between soil respiration and soil moisture was not signi fi cant, while there was a signi fi cant relationship between soil respiration and temperature.Two twovariable composite model with soil temperature and soil moisture(RS=aebTWc) appeared to have a good precision when used to predict the soil respiration compared with one-variable models.
simulated nitrogen deposition; litter treatment; soil respiration rate; Larix principis-rupprechtii
S718.51+6
A
1673-923X(2017)04-0092-08
10.14067/j.cnki.1673-923x.2017.04.016
2015-11-25
林业公益性行业科研专项(201404213)
白英辰,硕士研究生 通讯作者:韩海荣,教授;E-mail:hanhr@bifu.edu.cn
白英辰,陈 晶,康峰峰,等.模拟氮沉降下不同凋落物处理对太岳山华北落叶松林土壤呼吸的影响 [J].中南林业科技大学学报,2017, 37(4): 92-99.
[本文编校:文凤鸣]

