黄鳝血清转铁蛋白多克隆抗体的制备及检测
雷华明,李 伟
( 长江大学 湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025 )
黄鳝血清转铁蛋白多克隆抗体的制备及检测
雷华明,李 伟
( 长江大学 湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025 )
为实现黄鳝血清转铁蛋白基因的原核表达并制备其多克隆抗体,利用基因特异性引物从黄鳝肝脏cDNA中扩增黄鳝转铁蛋白的C端序列,亚克隆至原核表达载体pET-28a(+)中,构建pET/Tf-C重组表达载体;转化大肠杆菌BL21(DE3)后进行IPTG诱导。利用Ni离子亲和层析技术纯化Tf-C蛋白,并免疫新西兰兔制备多克隆抗体;通过间接ELISA技术和组织蛋白印迹对制备的多克隆抗体进行检测。试验结果表明,成功构建pET/Tf-C原核表达载体,并实现了蛋白的表达和纯化;制备的多克隆抗体效价大于1∶25 600,并能特异性地识别来源于黄鳝不同组织的血清转铁蛋白。研究结果对黄鳝血清转铁蛋白功能的研究奠定了基础。
黄鳝; 转铁蛋白; 多克隆抗体; 制备
血清转铁蛋白(Transferrin, Tf)是存在于动物血清中的一种重要铁离子结合蛋白,在机体铁离子代谢和平衡调节中起重要的作用[1],还作用于呼吸、细胞生长和增殖及免疫系统调节等过程[2]。典型的转铁蛋白分子是一条分子量约80 ku的单链多肽,由N端、C端和铰链区组成[3]。鱼类的血清转铁蛋白在鱼类健康养殖方面具有重要的应用前景[4]。近几年就有包括尼罗罗非鱼(Oreochromisniloticus)[5]、白氏文昌鱼 (Branchiostomabelcheri)[6]、斑点叉尾(Ictaluruspunctatus)[7]和鱼(Miichthysmiiuy)[8]等鱼类的转铁蛋白基因被克隆,其重组蛋白的铁离子结合能力、抗菌活性及遗传多样性也成为重要的研究内容。黄鳝(Monopterusalbus)是我国重要的经济鱼类,在全国范围内广泛分布。开展黄鳝免疫相关分子的研究对于黄鳝养殖业健康发展具有重要意义。沈志民等[9]开展了黄鳝血清转铁蛋白的分离纯化及结构和性质的初步分析。王博文等[10]从黄鳝血液中提取了血清转铁蛋白,并对其分子量、表面形貌、二级结构进行了表征。但是,目前国内外尚未见在体外重组表达黄鳝血清转铁蛋白基因并制备其多克隆抗体的相关报道。
笔者通过构建黄鳝血清转铁蛋白的原核表达载体,利用大肠杆菌(Escherichiacoli)表达重组蛋白,经过亲和层系技术纯化该蛋白,同时免疫新西兰兔制备多克隆抗体,分析多克隆抗体的效价及特异性。将为进一步研究黄鳝血清转铁蛋白在铁离子代谢和免疫系统中的作用提供基础资料。
1 材料与方法
1.1 材料
含黄鳝转铁蛋白基因的质粒pE-Tf(本实验室保存);限制性内切酶、LA Taq DNA 聚合酶(大连宝生物);T1感受态细胞、BL21(DE3)感受态细胞、pEASY-T1克隆载体、蛋白质分子量标准(北京全士金);IPTG、弗氏完全佐剂、弗氏不完全佐剂(Sigma公司);HRP标记羊抗兔IgG(Proteintech公司);DAB显色试剂盒(武汉谷歌生物);动物组织总蛋白提取试剂盒(上海贝博生物);Ni离子亲和层系柱(上海七海生物);其他试剂均为国产分析纯。
1.2 原核表达载体的构建
根据笔者实验室克隆的黄鳝转铁蛋白基因(序列号:KF500526),设计了基因特异性引物rc-F(5′-CGGGAATTCGAATGGTGTAATGTGGGC-3′)和rc-R (5′-CACGCGGCCGCCT GTCTGAGTGATTTCATGGC-3′)以扩增转铁蛋白基因的C端序列。上游引物添加了EcoRⅠ酶切位点,而下游引物添加了NotⅠ酶切位点。将扩增产物经过酶切后回收纯化,与进行同样双酶切的pET-28 a进行T4连接酶连接。连接产物转化T1感受态细胞后进行菌液PCR扩增、双酶切和序列测定验证,经过测序正确的质粒命名为pET/Tf-C。
1.3 重组蛋白的诱导表达
将重组表达载体转化大肠杆菌BL21(DE3),涂布于50 μg/mL的卡那霉素平板上进行37 ℃过夜培养。挑取阳性转化子于卡那霉素50 μg/mL的液体LB培养基中37 ℃、230 r/min摇培至指数生长期后添加IPTG,至浓度为0.1 mmol/L,培养4 h。取适量菌液进行超声破碎,加入5×上样缓冲液进行12% SDS-PAGE电泳检测目标蛋白的表达情况。
1.4 重组蛋白的纯化
将上述阳性菌株按照1∶100的比例接种于1 L含有50 μg/mL的卡那霉素的新鲜液体培养基中200 r/min 37 ℃恒温培养8 h。离心收集菌体,用50 mmol/L的PBS(pH 8.3)悬浮菌液,进行超声波破碎。超声波破碎后收集沉淀部分,用裂解缓冲液(6 mol/L盐酸胍,20 mmol/L咪唑,50 mmol/L PBS pH=8.3)洗涤3次后,加入适量裂解缓冲液溶解,上清液经过滤后用5 mL 的亲和层析镍柱His-Binding-Resin 进行纯化,纯化的蛋白经含6、3、1.5、0.5、0.1 mol/L的盐酸胍缓冲液梯度透析复性后,使用透析袋浓缩,用BCA法测定蛋白含量。
1.5 多克隆抗体的制备
将500 μg经纯化的蛋白和等体积弗氏完全佐剂进行充分乳化后采用皮下多点注射法免疫新西兰大白兔。每次间隔1周,共免疫5次。自第2次免疫开始,用500 μg融合蛋白混合不完全弗氏佐剂进行加强免疫。最后一次加强免疫后1周采全血分离抗血清,并于-80 ℃分装保存。
1.6 多克隆抗体的效价分析
以纯化的融合蛋白为包被抗原,以第一次免疫前采集的兔血清为阴性对照,将兔抗Tf-C蛋白多克隆抗体进行1∶200~1∶51 200倍比稀释,以HRP标记的羊抗兔IgG为二抗,以3,3′,5,5′-四甲基联苯胺为底物显色液,进行间接ELISA分析。以免疫血清样品D450值/阴性对照血清D450值≥2时为阳性作为判定标准,制备的多克隆抗体的最大稀释度作为该抗体的有效效价。
1.7 多克隆抗体特异性的Western Blot分析
首先将含有空白质粒的菌株总蛋白、阳性菌株总蛋白和纯化的蛋白进行SDS-PAGE电泳,然后将蛋白转至NC膜上。用制备的抗血清进行1∶200倍稀释后作为一抗,用HRP标记的羊抗兔IgG为二抗进行多抗的特异性检测。
利用动物组织总蛋白提取试剂盒提取黄鳝肝脏、脾脏、肌肉、肠和血液共5种组织的总蛋白。取50 μg各组织总蛋白进行SDS-PAGE电泳,然后将蛋白转至NC膜上。用制备的抗血清进行1∶200倍稀释后作为一抗,用HRP标记的羊抗兔IgG为二抗进行多抗的特异性检测。
2 结 果
2.1 原核表达载体的构建
采用含有限制性酶切位点的基因特异性引物rc-F和rc-R从pE-Tf质粒上可扩增993 bp的条带,而对重组菌进行的菌液PCR扩增发现也可扩增相符大小的片段(图1a)。提取的重组质粒用EcoRⅠ和NotⅠ进行酶切结果获得了1条约1000 bp的条带和1条约5000 bp的条带(图1b),结果表明,黄鳝Tf-C序列已经成功克隆至pET-28a(+)中。

图1 重组表达载体的验证
2.2 重组蛋白的诱导表达及纯化
将测序验证过的质粒pET/Tf-C转化大肠杆菌BL21(DE3)后,用0.1 mmol/L的IPTG诱导4 h后发现重组菌表达了1条约37 ku的蛋白条带,与预期Tf-C分子量相符,主要以包涵体形式存在。进一步将该菌株大量扩繁超声破碎后,进行包涵体蛋白的纯化和复性,12%SDS-PAGE电泳检测发现,使用Ni-NTA琼脂糖亲和层系柱获得的样品蛋白所含杂带较少,说明最终纯化的目的蛋白纯度较高,可用于下一步的多抗制备(图2)。

图2 黄鳝Tf-C重组蛋白的诱导表达及纯化
ck1:空白质粒菌株; ck2:重组菌未诱导; 1:重组菌IPTG诱导; 2:纯化的Tf-C.
2.3 多克隆抗体的效价检测
纯化的蛋白免疫新西兰大白兔后获得的超免疫血清通过间接ELISA方法进行检测,当D450(阳性血清)/D450(阴性血清)≥2.1时,结果为阳性。检测结果显示,阳性血清的最高稀释度为1∶25 600(图3)。该结果表明,成功获得了较高效价的兔抗Tf-C蛋白的免疫血清。

图3 间接ELISA检测多抗血清的效价
2.4 多克隆抗体的Western Blot检测
多抗血清对纯化重组蛋白特异性的检测结果表明,自制的多抗可以与纯化的蛋白只产生1条特异带,而与阳性重组菌的总蛋白产生较特异的反应;空白质粒的总蛋白并未与多抗产生特异性反应,说明制备的多抗血清具备较好的特异性(图4)。

图4 Western Blot 分析多抗的特异性
CK:转空白质粒菌株总蛋白; 1:转重组质粒菌株总蛋白; 2: 纯化的Tf-C蛋白.
2.5 多抗与组织来源的总蛋白的特异性反应检测
为进一步分析多抗是否与动物组织总蛋白产生特异性反应,将制备的多抗血清作为一抗,用HRP标记的羊抗兔IgG作为二抗进行了Western Blot分析。结果表明,制备的抗血清也可较特异性地与来源于黄鳝肝脏、脾脏、肌肉、肠和血液中的总蛋白产生特异性条带,各组织带型、大小一致,进一步说明制备的兔抗Tf-C血清具备良好的特异性和应用价值(图5)。
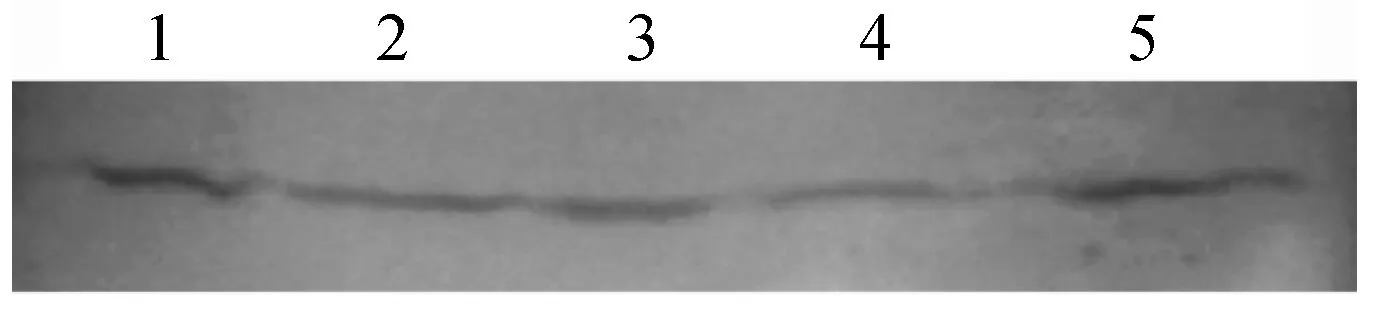
图5 抗血清与组织蛋白的Western blot检测
3 讨 论
铁离子代谢平衡对机体维持活性氧运输、电子传递和DNA合成等过程至关重要。血清转铁蛋白和其受体一起在调控细胞内铁离子代谢平衡及降低Fe3+离子转化为Fe2+对细胞造成细胞毒性的解毒过程中具有重要作用;并且它们还是重要的免疫相关分子[11]。国内外鱼类育种学家已开展了诸多鱼类转铁蛋白基因的分离、遗传多样性分析及与先天免疫关系等的研究[5-8,12]。鱼体中的转铁蛋白也被认为是抗菌性非特异性体液免疫机制的重要组成部分[13]。黄鳝作为我国淡水养殖业中重要的经济鱼类,其健康养殖和可持续性发展受到了出血病等多种细菌性病害的影响[14]。黄鳝抗病分子育种的研究亟需分离和鉴定黄鳝免疫相关基因并开展功能研究以应用于养殖实践。黄鳝血清转铁蛋白基因的分离和鉴定为这种需求提供了基本条件。
人类的血清转铁蛋白蛋白结构是由一个N端和一个C端及中间短小的链接区组成的两个相对独立的功能单位构成的[15]。N端和C端都具有Fe3+的高亲和性和可逆的结合位点;造成这个现象的原因很可能是因为早期的转铁蛋白基因进行了加倍和融合,从而提高了铁离子结合能力[16]。黄鳝血清转铁蛋白也和其他脊椎动物一样具有N端和C端结构。笔者利用其C端重组蛋白制备的多克隆抗体能够特异性地识别各组织总蛋白中的血清转铁蛋白,一方面证实了血清转铁蛋白的组织分布是较为广泛的,另外一方面也提示只采用C端基因序列进行重组表达蛋白进而制备多抗是可行的。黄鳝血清Tf-C多克隆抗体的制备为进一步研究黄鳝血清转铁蛋白的功能奠定了基础。
[1] Oppenheimer S J. Iron and its relation to immunity and infections disease [J]. Journal of Nutrition, 2001, 131(2s/2):616-635.
[2] Gomme P T, McCann K B, Bertolini J. Transferrin: structure, function and potential therapeutic actions [J]. Drug Discov Today, 2005, 10(4):267-273.
[3] Mizutani K, Toyoda M, Mikami B. X-ray structures of transferrins and related proteins [J]. Biochim Biophys Acta, 2012, 1820(3):203-211.
[4] 龙华,曾勇,李谷. 鱼类血清转铁蛋白的研究现状与应用前景 [J].水产学报, 2001,25(2):181-186.
[5] Poochai W, Choowongkomon K, Srisapoome P, et al. Characterization and expression analysis of the transferrin gene in Nile tilapia (Oreochromisniloticus) and its upregulation in response toStreptococcusagalactiaeinfection [J]. Fish Physiol Biochem, 2014, 40(5):1473-1485.
[6] Liu J, Zhang S, Li L. A transferrin-like homolog in amphioxusBranchiostomabelcheri: identification, expression and functional characterization [J]. Molecular Immunology, 2009,46(15):3117-3124.
[7] Liu H, Takano T, Abernathy J, et al. Structure and expression of transferrin gene of channel catfish,Ictaluruspunctatus[J]. Fish & Shellfish Immunology, 2010,28(1):159-166.
[8] Sun Y Y, Zhu Z H, Wang R X, et al. Miiuy croaker transferrin gene and evidence for positive selection events reveal different evolutionary patterns [J]. PLoS One, 2012,7(9):e43936.
[9] 沈志民, 冷晓华, 冯佑民. 白鲢鱼与黄鳝血清转铁蛋白的分离纯化及其结构和性质的比较 [J]. 生物化学杂志, 1991, 7(3):269-274.
[10] 王博文, 任天瑞, 董亚明, 等. 黄鳝血清转铁蛋白的提取及表征 [J]. 过程生物学报, 2012, 12(1):125-130.
[11] Brandsma M E, Jevnikar A M, Ma S. Recombinant human transferrin: beyond iron binding and transport [J]. Biotechnology Advances, 2011, 29(2):230-238.
[12] Yang L,Gui J F. Positive selection on multiple antique allelic lineages of transferrin in the polyploidCarassiusauratus[J].Molecular Biology and Evolution, 2004, 21(7):1264-1277.
[13] García-Fernández C, Sánchez J A, Blanco G. Characterization of the gilthead seabream (SparusaurataL.) transferrin gene: genomic structure, constitutive expression and SNP variation [J]. Fish & Shellfish Immunology, 2011,31(4):548-556.
[14] Li W, Sun W X, Fan J, et al. Genetic diversity of wild and cultured swamp eel (Monopterusalbus) populations from central China revealed by ISSR markers [J]. Biologia, 2013,68(4):727-732.
[15] Davis B,Saltman P, Benson H. The stability constants of the iron-transferrin complex [J]. Biochem Biophys Res Comm, 1962(8):56-60.
[16] Lambert L A,Perri H, Meehan T J. Evolution of duplications in the transferrin family of proteins [J]. Comp Biochem Physiol, 2005,140(1):11-25.
PreparationandIdentificationofPolyclonalAntibodyofSerumTransferrininSwampEelMonopterusalbus
LEI Huaming, LI Wei
( Engineering Research Center of Ecology and Agricultural Use of Wetland,Ministry of Education,Yangtze University, Jingzhou 434025, China )
This study was performed to express swamp eel transferrin C-lobe inEscherichiacoliin swamp eelMonopterusalbusand to generate rabbit polyclonal antibody of the protein. A pair of primers was used to amplify the C-lobe sequence of swamp eel tranferrin gene from the liver cDNAs. Subsequently, the purified fragments were subcloned into pET 28a(+), and then, the constructed plamid was introduced into BL21(DE3). After it was induced and expressed, recombinant protein was purified by one step affinity chromatography with a Ni-NTA agarose column. New Zealand white rabbits were immunized with the purified protein to generate polyclonal antibodies. Indirect enzyme-linked immunosorbent assay (ELISA) was applied to examine the titers of the polyclonal antibody, and Western-blotting was used to detect the specificity of the antibody. Results showed that the titer of the polyclonal antibody was more than 1∶25 600 with indirect ELISA and combined specifically with the overexpressed protein inEscherichiacoliand crude proteins from different tissues of swamp eel. The polyclonal antibody with high affinity and specificity was generated successfully and used for further research on biological function of transferrin in fish.
Monopterusalbus; transferrin; polyclonal antibody; preparation
10.16378/j.cnki.1003-1111.2017.21.019
2016-03-08;
2016-05-12.
国家大学生创新创业训练计划项目(201510489007);湿地生态与农业利用教育部工程研究中心开放课题(KF2015016).
雷华明(1994—)男,本科生;研究方向:生化与分子生物学. E-mail: 1049810861@qq.com.通讯作者:李伟(1976—)男, 副教授;研究方向:鱼类分子生物学. E-mail:wetli@yangtzeu.edu.cn.
S917.4
A
1003-1111(2017)02-0220-04

