养殖大菱鲆肠道中大菱鲆弧菌的分离鉴定及药敏试验
崔惠敬,孟玉霞,冯文倩,赵前程,马永生
( 大连海洋大学 食品科学与工程学院,辽宁 大连 116023 )
养殖大菱鲆肠道中大菱鲆弧菌的分离鉴定及药敏试验
崔惠敬,孟玉霞,冯文倩,赵前程,马永生
( 大连海洋大学 食品科学与工程学院,辽宁 大连 116023 )
2014年11月,大连地区某大菱鲆养殖场发生病害并伴有死亡,主要症状为吻部下颌明显出血,腹腔积水,肝脏充血,肠道出血有白便。从患病大菱鲆肠道中分离出1株可在硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基上生长的菌株HZ-C1,人工回接感染试验证明其对健康大菱鲆具有较强致病性。通过形态学观察、16S rDNA序列同源性分析及生理生化试验确定菌株HZ-C1为大菱鲆弧菌。药敏检测结果显示,大菱鲆弧菌HZ-C1对氯霉素、丁胺卡那及头孢曲松等11种抗生素敏感,但对青霉素、四环素及诺氟沙星等15种抗生素耐药。本研究为大连地区养殖大菱鲆细菌性病害防治提供了一定病原学依据。
大菱鲆;大菱鲆弧菌;分离鉴定;药敏试验
大菱鲆(Scophthalmusmaximus)俗称“多宝鱼”,自1992年由英国引入后,大菱鲆的养殖规模和产量逐年扩大,目前已成为我国海水养殖鱼类产量最大的品种。2010年我国大菱鲆养殖产量达到6.0×104t,占世界养殖总量的87.1%,已成为世界大菱鲆养殖第一大国[1]。但随着高密度工厂化养殖的迅速发展,病害问题日趋严重,严重制约了大菱鲆养殖产业的持续健康发展。细菌性疾病是大菱鲆养殖中危害最为严重的一种疾病,目前我国养殖大菱鲆已报道的致病菌有迟钝爱德华氏菌(Edwardsiellatarda)[2],鱼肠道弧菌(Vibrioichthyoenteri)[3]、鳗弧菌(V.anguillarum)[4]、溶藻弧菌(V.alginolyticus)[5]等。
2014年11月,大连地区某大菱鲆养殖场发生病害并有大量死亡,主要症状表现为吻部下颌明显出血,鱼体解剖后发现腹腔积水,肝脏充血发红,肠道出血有白便。笔者从患病大菱鲆肠道中分离出1株优势细菌,经人工回接感染试验证明其对大菱鲆存在较强致病性,并通过形态学观察、生理生化试验、16S rDNA序列分析进行鉴定,同时对此菌进行药敏检测。本研究旨在为养殖大菱鲆细菌性疾病防治提供病原学依据。
1 材料与方法
1.1 材料
大菱鲆病鱼样本2014年11月取自辽宁省大连市某养殖场,体质量600~800 g。细菌基因组提取、扩增仪均购自大连宝生物工程有限公司;PCR试剂购自上海生工生物工程股份有限公司;细菌微量生化鉴定管、药敏纸片等均购自杭州微生物试剂有限公司;透射电镜JEM-1200EX为日本电子株式会社生产;Leica DMI3000B倒置荧光显微镜为Leica微系统股份有限公司生产。
1.2 方法
1.2.1 病鱼解剖与致病菌分离
将患病大菱鲆体表用无菌水冲洗3遍后,置超净台已用乙醇消毒的托盘中,无菌条件下解剖鱼体,分离病变肠道、肝脏及腹水。取适量样本,分别置于1.5 mL离心管中,加入灭菌生理盐水均质后,用灭菌棉签沾取均匀涂布在2216E固体培养基和硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基,25 ℃恒温培养48 h后,挑取典型单菌落,重悬于200 μL灭菌生理盐水,接种纯化3次。
1.2.2 患病大菱鲆肠道组织切片观察
取患病大菱鲆肠道和肝脏组织,用10%福尔马林溶液进行固定,再经过乙醇脱水、石蜡包埋、切片、烘干、苏木精—伊红染色及封片,然后在光学显微镜下观察并拍照。
1.2.3 细菌鉴定
形态学观察:将纯化后的细菌用铜网捞取后晾干,再用2.5%(m/V)磷钨酸负染约3 min,通风橱中晾干后,置于透射电镜下观察菌体形态。另将细菌进行革兰氏染色后,置光学显微镜下观察。
生理生化试验:无菌操作挑取适量菌加入生理盐水中,再加入微量发酵管中,于25 ℃恒温培养24~48 h,观察生理生化反应。
16S rDNA序列分析及系统发育树构建:用灭菌牙签挑1个单菌落置入100 μL灭菌超纯水中,轻微振荡,100 ℃水浴锅中水浴10 min,7200 r/min离心3 min,取上清液作为DNA模板;PCR扩增采用16S rDNA通用引物,正向引物27 F:5′-AGAG TTTGATCCTGGCTCAG-3′;反向引物1492 R:5′-TACGGCTACCTTGTTACGACTT-3′,预期扩增片段大小约1450 bp。
PCR反应体系50 μL:DNA模板2 μL,正向、反向引物各1 μL,EX Taq DNA聚合酶 25 μL,无菌超纯水21 μL。PCR循环参数:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸10 min;降温至4 ℃。琼脂糖凝胶电泳检测PCR结果,并将PCR产物送上海生工生物工程股份有限公司测序。将测得的16S rDNA序列通过Blast检索和ClustalX 1.8软件进行序列比对分析,根据邻位相连法利用Mega 6.0软件构建系统发育树,自举分析检测置信度,自举数集为1000次。
1.2.4 大菱鲆回接感染试验
将分离得到的菌株HZ-C1接种于2216E液体培养基中,于25 ℃,180 r/min振荡过夜培养。将菌液于4 ℃,7200 r/min离心10 min,弃上清液,加入同体积无菌生理盐水洗涤两遍,再用无菌生理盐水重悬,并将菌液稀释至设定密度备用。平均体质量约50 g/尾的健康大菱鲆购自大连天正实业有限公司,暂养7 d后进行试验;养殖过程中水温控制在(18±2) ℃,投喂2次/d,换水1次/d。试验时将大菱鲆随机分为3组,每组10尾;试验组大菱鲆每尾分别腹腔注射100 μL密度为5×107、2×108cfu/mL的菌液,对照组每尾注射100 μL无菌生理盐水。连续20 d记录发病及死亡情况,并对发病死亡的大菱鲆进行细菌再分离鉴定。
1.2.5 药敏试验
采用常规Kriby-Bauer纸片扩散法进行药敏试验,选用30种抗生素对分离菌株进行药敏试验,将HZ-C1菌悬液涂布于2216E平板上,用镊子将药敏纸片贴于培养基表面,25 ℃培养箱中培养48 h,测量各种药物的抑菌圈直径,试验重复3次,计算平均值,以判定菌株对抗生素的敏感性。
2 结果与分析
2.1 患病大菱鲆症状及组织病理切片观察
患病大菱鲆主要临床症状表现为吻部下颌明显出血,腹腔积水,肝脏充血发红,肠内无食物,肠壁有血丝,直肠段有白便(图1)。
自然发病大菱鲆组织病理切片见图2。由图2可见,病鱼肝细胞胞质中充盈脂滴,空泡变性,胞间界限模糊,排列杂乱,且有出血。肠道组织病理切片结果显示大菱鲆肠壁细胞坏死,细胞间质崩解,肠黏膜严重溃烂,肠绒毛脱落。
2.2 病原菌的分离鉴定
2.2.1 形态学观察
自患病大菱鲆肠道中分离获得1株优势菌株HZ-C1,将该菌涂于2216E固体培养基上25 ℃恒温培养48 h,菌落呈圆形、透明、光滑湿润、突起而且边缘整齐;透射电镜观察发现该菌呈短杆状,细胞大小约为0.5 μm×1.1 μm,具单极生鞭毛(图3),符合弧菌的典型特征。
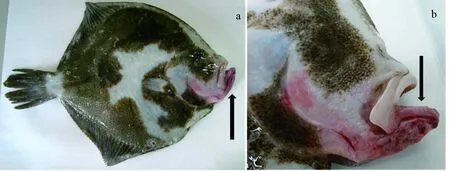
图1 患病大菱鲆的临床症状箭头显示吻部下颌明显充血

图2 患病及健康大菱鲆肝脏(a,b)及肠道(c,d)组织切片a、c为患病大菱鲆组织,b、d为健康大菱鲆组织.
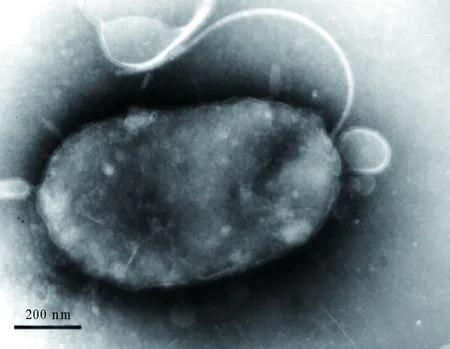
图3 分离菌株HZ-C1的透射电镜照片
2.2.2 生理生化特征检测结果
对所得菌株进行生理生化检测(表1),结果显示菌株HZ-C1能在硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基上形成浅黄色菌落,革兰氏阴性,可运动,能在含1%~3%NaCl蛋白胨水中生长,氧化酶、葡萄糖、甲基红试验、精氨酸双水解酶等呈阳性,枸橼酸盐、尿素酶、产H2S、乙酰甲基甲醇试验等为阴性,鉴定结果与《伯杰氏细菌鉴定手册》[6]中大菱鲆弧菌(V.scophthalmi)的生化特征一致。

表1 菌株HZ-C1的生理生化试验结果
注:“+”表示阳性,“-”表示阴性,“+g-”表示产酸不产气,“S”表示敏感性.
2.2.3 菌株16S rDNA基因扩增、测序及系统发育树分析
以细菌基因组DNA为模板,PCR扩增菌株HZ-C1的16S rDNA序列,电泳检测结果显示在约1500 bp处有明显目的条带(图4);测序结果表明,目的片段大小为1450 bp。将16S rDNA序列通过BLAST检索系统进行序列比对分析,结果表明,HZ-C1与大菱鲆弧菌 AFWE01000105.1序列同源性为99%;并选择10个弧菌模式菌株16S rDNA序列构建系统发育树,菌株HZ-C1与大菱鲆弧菌AFWE01000105.1聚为一个分支(图5),结合菌株HZ-C1的生理生化特征,鉴定菌株HZ-C1为大菱鲆弧菌。

图4 菌株HZ-C1的16S rDNA的PCR扩增结果
2.3 大菱鲆回接感染试验结果
健康大菱鲆经腹腔注射大菱鲆弧菌HZ-C1菌液后,均出现发病症状,攻毒感染1 d后大菱鲆摄食明显减少;感染5 d后,部分鱼停止摄食,反应迟缓,游动无力;感染后第7 d,较高密度攻毒组(2×108cfu/mL)的部分大菱鲆出现游动失衡,鱼体翻转,腹部朝上,并开始死亡,试验周期内死亡率达40%(表2)。感染死亡的大菱鲆吻部及鱼鳍有出血症状,剖检后发现腹部积水,肝脏充血,肠内无食物,有充血症状。从攻毒感染的病鱼腹腔及肠道中再次分离得到纯培养物,并通过16S rDNA序列分析鉴定为大菱鲆弧菌,与回感菌株一致。对照组大菱鲆在试验周期内正常摄食生长,无发病症状。
2.4 药敏试验结果
选用30种抗生素对大菱鲆弧菌HZ-C1菌株进行药敏试验,结果显示大菱鲆弧菌HZ-C1对氯霉素、丁胺卡那、头孢曲松等11种抗生素敏感;对头孢氨苄、卡那霉素、新霉素等4种抗生素中度敏感(表3);但对青霉素、四环素、诺氟沙星等15种抗生素耐药,可见该菌对抗生素耐药情况已比较严重。
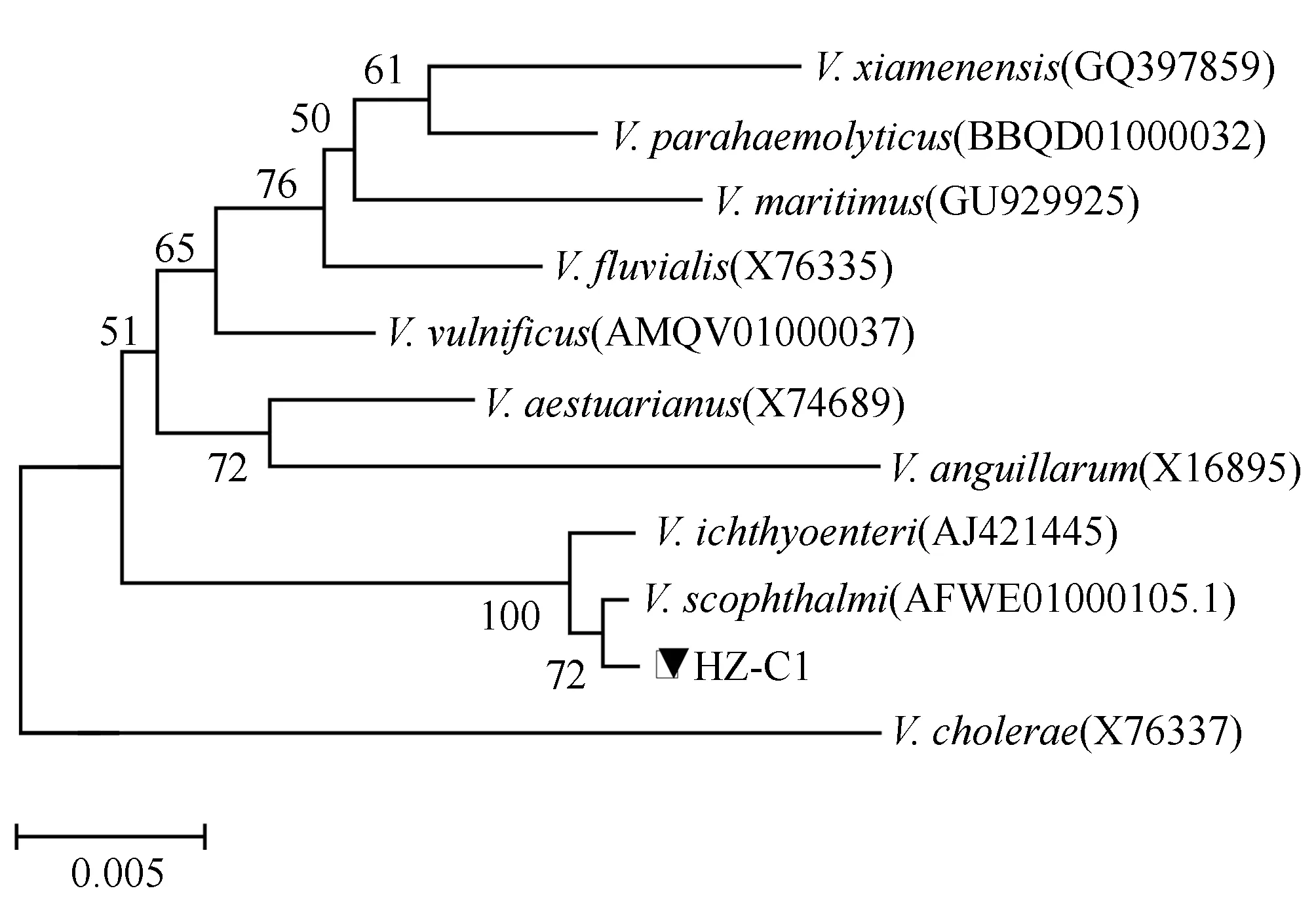
图5 基于分离菌株HZ-C1的16S rDNA序列构建的系统发育树
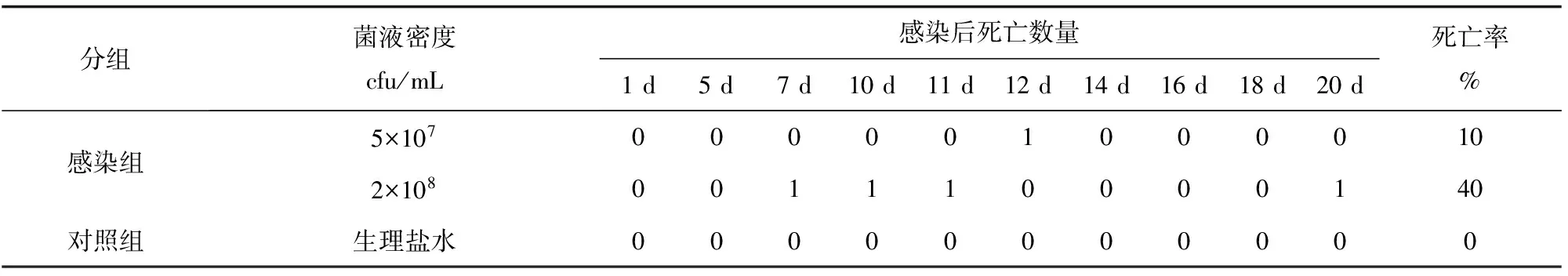
分组菌液密度cfu/mL感染后死亡数量1d5d7d10d11d12d14d16d18d20d死亡率%感染组5×1070000010000102×108001110000140对照组生理盐水00000000000

表3 大菱鲆弧菌HZ-C1菌株的药敏试验结果
注:S高度敏感,I中度敏感,R耐药.
3 讨 论
大菱鲆为我国北方沿海海水养殖鱼类产量最大的品种,但高密度工厂化养殖导致大菱鲆细菌性病害日益频发,其中弧菌病是危害最严重的病害之一,已报道的致病性弧菌包括副溶血性弧菌(V.parahaemolyticus)[7]、鳗弧菌[4,8]、溶藻弧菌[5]和哈维弧菌(V.harveyi)[9-10]等。大菱鲆弧菌最早由西班牙学者自养殖大菱鲆仔鱼肠道中分离并鉴定为弧菌属细菌的一个新种[11],该菌表型与鱼肠道弧菌很相近,后者是导致褐牙鲆(Paralichthysolivaceus)稚鱼肠道坏死的主要病原[12]。基因水平上,大菱鲆弧菌与鱼肠道弧菌16S rDNA序列相似度达99%[13]。理化指标上二者也很接近,仅有3项指标上存在差异[14],大菱鲆弧菌的精氨酸双水解酶呈阳性,能在35 ℃条件下生长,但不能在6% NaCl高盐蛋白胨水中生长[11],而鱼肠道弧菌在这3项理化指标上正好与之相反[15],本研究分离得到的菌株理化指标与大菱鲆弧菌相符,结合16S rDNA序列分析结果,可以确定该菌为大菱鲆弧菌。
早期研究认为大菱鲆弧菌是定殖在健康大菱鲆肠道中的优势菌群[16],且对大菱鲆具有宿主特异性。不过后续也有自患病褐牙鲆[17]、大西洋牙鲆(P.dentatus)[18]、细点牙鲷(Dentexdentex)[19]、菲律宾蛤仔(Ruditapesphilippinarum)[20]和死亡的蓝鳍金枪鱼(Thunnusmaccoyii)肾脏中[21]分离出该菌,特别是在患病褐牙鲆体内具有较高分离率。Kang[22]研究了韩国济州地区患病褐牙鲆细菌性病原的多样性,结果显示大菱鲆弧菌占26%,仅次于哈维弧菌(32%)。Jo等[23]自患弧菌病的褐牙鲆中分离出大菱鲆弧菌、哈维弧菌、鳗弧菌、溶藻弧菌等,其中大菱鲆弧菌占所分离菌株的60.1%。国内有学者也曾从山东半岛养殖场患腹水和白便症状的大菱鲆体内分离出溶藻弧菌、鲨鱼弧菌(V.carchariae)和大菱鲆弧菌,但未对大菱鲆弧菌的致病性进行深入研究[24]。
目前研究表明,大菱鲆弧菌是一种条件致病菌[17],养殖鱼类在受到环境胁迫时,易被感染并引发疾病或死亡,这里的胁迫因子包括水温、其他致病菌入侵等。如鳗鲡(Anguillajaponica)在养殖水温升至20 ℃时易被大菱鲆弧菌感染,并出现严重肠炎及腹水症状,死亡率很高[25]。Qiao等[17]研究显示,褐牙鲆在受到副乳房链球菌(Streptococcusparauberis)入侵后,易被大菱鲆弧菌二次感染,累积死亡率由25%升至85%。
一般致病性弧菌的胞外产物是其关键毒力因子之一[26],主要包括蛋白酶类和外毒素。大菱鲆弧菌胞外产物显示出多种蛋白酶活性,如碱性磷酸酶、亮氨酸氨基肽酶、萘酚-AS-BI-磷酸水解酶和N-乙酰-β-葡萄糖苷酶[27],但无溶血活性和细胞毒性作用。这些胞外产物与黏附因子、脂多糖以及某些外膜蛋白等共同构成了大菱鲆弧菌的致病力。根据毒力大小,大菱鲆弧菌临床分离株可分为高毒株和低毒株,将该菌对褐牙鲆进行腹腔注射,高毒株半致死剂量约为4.8×106cfu/g,低毒株半致死剂量约为9.7×108cfu/g,可见菌株之间毒性存在较大差异[27]。褐牙鲆腹腔注射攻毒后临床症状表现为皮肤变黑,腹部积水,肠、肝脏、肌肉出血,脾肾肿大等[17],这与本研究中大菱鲆攻毒后的症状相似。
药敏试验显示,本研究分离出大菱鲆弧菌对11种抗生素敏感性较高,其中包括氯霉素、丁胺卡那、头孢曲松等,但对青霉素、四环素、诺氟沙星、氧氟沙星等存在耐药性。目前我国水产用兽药中抗生素类药物有22种,结合药敏结果可知,可考虑使用氟苯尼考防治大菱鲆弧菌感染。此外,研究发现大菱鲆弧菌临床分离株均能产生生物被膜[26],这可能也与其耐药性有关。值得注意的是本研究分离的菌株对受试的喹诺酮类抗生素均存在耐药情况,这可能与这类抗生素在水产养殖中大量使用相关。2015年农业部2292号公告决定停止在食品动物中使用洛美沙星、培氟沙星、氧氟沙星和诺氟沙星4种喹诺酮类抗生素[28],这也给水产动物病害防控带来挑战,目前迫切需要研发新型抗生素替代品来防治水产养殖动物细菌性疾病。
[1] 雷霁霖, 马爱军, 陈超, 等. 大菱鲆(ScophthalmusmaximusL)养殖现状与可持续发展[J]. 中国工程科学, 2005, 7(5):30-34.
[2] 李筠, 颜显辉, 陈吉祥, 等. 养殖大菱鲆腹水病病原的研究[J]. 中国海洋大学学报:自然科学版, 2006, 36(4):649-654.
[3] 吕俊超, 李轩, 韩茵, 等. 养殖大菱鲆中牙鲆肠弧菌的分离鉴定及组织病理学[J]. 水产学报, 2009, 33(2):311-317.
[4] 王印庚, 牟潜, 张肖荣. 7种消毒剂对大菱鲆烂鳍病致病原鳗弧菌的杀灭作用研究[J]. 齐鲁渔业, 2009(5):12-16.
[5] 薛淑霞, 冯守明, 孙金生. 海水工厂化养殖大菱鲆(Scophthalmusmaximus)和褐牙鲆(Paralichthysolivaceus)腹水病病原菌的分离与鉴定[J]. 海洋与湖沼, 2006, 37(6):548-554.
[6] Krieg N R, Holt J G. Bergey′s manual of systematic bacteriology—1st ed., vol. 1[M]. Baltimore:Williams and Wilkins, 1984.
[7] 胡亮, 赵凤梅, 于兰萍, 等. 副溶血弧菌对养殖大菱鲆致病性研究[J]. 水产科学, 2008, 27(7):340-343.
[8] 靳晓敏, 葛慕湘, 张艳英, 等. 大菱鲆源鳗弧菌耐药表型及耐药基因检测[J]. 水产科学, 2015,34(8):510-514.
[9] 范文辉, 黄倢, 王秀华, 等. 养殖大菱鲆溃疡症病原菌的分离鉴定及系统发育分析[J]. 微生物学报, 2005, 45(5):665-770.
[10] 张晓君, 毕可然, 阎斌伦, 等. 矛尾复虎鱼病原哈氏弧菌的鉴定及特异性检测方法的建立[J]. 水产科学, 2011, 30(12):758-763.
[12] Kim D H, Han H J, Kim S M, et al. Bacterial enteritis and the development of the larval digestive tract in olive flounder,Paralichthysolivaceus(Temminck & Schlegel)[J]. Journal of Fish Diseases, 2004,27(9):497-505.
[13] Sawabe T, Kita-Tsukamoto K, Thompson F L. Inferring the evolutionary history of vibrios by means of multilocus sequence analysis[J]. Journal of Bacteriology, 2007,189(21):7932-7936.
[14] Tarazona E, Perez-Cataluna A, Lucena T, et al. Multilocus sequence analysis of the redefined cladeScophthalmiin the genusVibrio[J]. Systematic and Applied Microbiology, 2015,38(3):169-175.
[15] Ishimaru K, Akagawa-Matsushita M, Muroga K.Vibrioichthyoenterisp nov, a pathogen of Japanese flounder (Paralichthysolivaceus) larvae[J]. International Journal of Systematic Bacteriology, 1996,46(1):155-159.
[16] Blanch A R, Alsina M, Simon M, et al. Determination of bacteria associated with reared turbot (Scophthalmusmaximus) larvae[J]. Journal of Applied Microbiology, 1997,82(6):729-734.
[17] Qiao G, Lee D C, Woo S H, et al. Microbiological characteristics ofVibrioscophthalmiisolates from diseased olive flounderParalichthysolivaceus[J]. Fisheries Science, 2012,78(4):853-863.
[18] Soffientino B, Gwaltney T, Nelson D R, et al. Infectious necrotizing enteritis and mortality caused byVibriocarchariaein summer flounderParalichthysdentatusduring intensive culture[J]. Diseases of Aquatic Organisms, 1999,38(3):201-210.
[19] Sitjà-Bobadilla A, Pujalte M J, Bermejo A, et al. Bacteria associated with winter mortalities in laboratory-reared common dentex (Dentexdentex)[J]. Aquaculture Research, 2007,38(7):733-739.
[20] Hidalgo R B, Cleenwerck I, Balboa S, et al. Diversity of vibrios associated with reared clams in Galicia (NW Spain)[J]. Systematic and Applied Microbiology, 2008,31(3):215-222.
[21] Valdenegro-Vega V, Naeem S, Carson J, et al. Culturable microbiota of ranched southern bluefin tuna (ThunnusmaccoyiiCastelnau)[J]. Journal of Applied Microbiology, 2013,115(4):923-932.
[22] Kang B. A study on the characteristics of bacteria isolated from cultured floundersParalichthysolivaceusshowing disease symptoms in Jeju Area of Korea [D]. Jeju City:CheJu National University,2003.
[23] Jo M, Kim M, Song C. Development of a rapid diagnosis kit for vibrios associated with the farmed olive flounderParalichthysolivaceusin Jeju Island[G]// Journal of Fish Pathol F3. Jeju City: Journal of Fish Pathol, 2006.
[24] 张正, 王印庚, 韩文君, 等. 养殖大菱鲆烂鳍病病原菌的鉴定及系统发育学研究[J]. 海洋科学进展, 2004, 22(2):193-197.
[25] Lee N S, Kim D J, Lee B I, et al.Vibrioscophthalmiinfection in Japanese eelAnguillajaponicaduring seawater adaption[J]. Research Gate, 2012,25(3):173-180.
[26] Montero A B, Austin B. Characterization of extracellular products from an isolate ofVibrioharveyirecovered from diseased post-larvalPenaeusvannamei(Bonne)[J]. Journal of Fish Diseases, 1999,22(5):377-386.
[27] Qiao G, Jang I K, Won K M, et al. Pathogenicity comparison of high- and low-virulence strains ofVibrioscophthalmiin olive flounderParalichthysolivaceus[J]. Fisheries Science, 2013,79(1):99-109.
[28] 中华人民共和国农业部. 中华人民共和国农业部公告第2292号发布在食品动物中停止使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星4种兽药的决定[EB/OL].2015-09-01, [2016-03-24] http:∥www.moa.gov.cn/govpublic/SYJ/201509/t20150907_4819267.htm.
IdentificationandAntimicrobialSusceptibilityTestofVibrioscophthalmiIsolatedfromtheIntestineofCulturedTurbotScophthalmusmaximus
CUI Huijing, MENG Yuxia, FENG Wenqian, ZHAO Qiancheng, MA Yongsheng
( College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China )
In November 2014, a disease occurred among cultured turbotScophthalmusmaximus, and resulted in mass mortality in a turbot farm in Dalian, China. The suffered fish showed syndrome such as hemorrhage of the lower jaw,hydrobdomen,liver congestion and intestinal hemorrhage with white feces. One strain of bacteria was isolated from intestine of the diseased turbot.The bacterium grew on TCBS agar and named as HZ-C1 strain. It was verified that HZ-C1 had a strong pathogenicity to healthy turbot through an artificial infection test. It was identified asVibrioscophthalmiby morphological characteristics, physiological and biochemical test, and the sequence similarity analysis of the 16S rDNA gene. Antimicrobial susceptibility test revealed that HZ-C1 was sensitive to 11 antibiotics including chloramphenicol,amikacin, and ceftriaxone, but resistant to thepenicillin, tetracycline, norfloxacin and other 15 kinds of antibiotics.The findings will provide an etiological evidence for control of bacterial disease in cultured turbotin in Dalian.
Scophthalmusmaximus;Vibrioscophthalmi; isolation and identification; antimicrobial susceptibility test
10.16378/j.cnki.1003-1111.2017.02.001
2016-03-24;
2016-06-07.
辽宁省博士启动基金资助项目(20131010).
崔惠敬(1991-),女,硕士研究生;研究方向:海水动物养殖及病害防治. E-mail:tsuihj@163.com. 通讯作者: 马永生(1982-),男,副教授,博士;研究方向:海水健康养殖与海产品质量安全与控制. E-mail:mayo@dlou.edu.cn.
S917.1
A
1003-1111(2017)02-0125-07

