迟钝爱德华氏菌对杂交东方鲀rags基因表达的影响
张 菡,戴 伟,石洪玥,陈成勋,王庆奎,邢克智
( 天津农学院 水产学院 天津市水产与养殖生态重点实验室,天津 300384 )
迟钝爱德华氏菌对杂交东方鲀rags基因表达的影响
张 菡,戴 伟,石洪玥,陈成勋,王庆奎,邢克智
( 天津农学院 水产学院 天津市水产与养殖生态重点实验室,天津 300384 )
利用实时荧光定量PCR技术检测冀研一号(菊黄东方鲀 ♀×红鳍东方鲀♂)稚鱼肝胰脏、脾脏、头肾中重组激活基因rags在腹腔注射迟钝爱德华氏菌后6、12、24、36、48、72 h内相对表达量的变化情况。试验结果显示,感染迟钝爱德华氏菌后,肝胰脏中rags基因表达呈下降趋势,相对表达量峰值出现在攻毒后6 h。脾脏和头肾中rags基因表达均呈先升后降趋势,但在攻毒后48 h出现反弹回升。脾脏中,rags基因相对表达量峰值出现在攻毒后6 h;头肾中,rag1基因和rag2基因相对表达量峰值分别出现在攻毒后48 h和6 h。与对照组相比,腹腔注射迟钝爱德华氏菌能引起冀研一号东方鲀rags基因表达上调,且rag1基因和rag2基因表达趋势基本一致。
冀研一号东方鲀;重组激活基因;mRNA表达;迟钝爱德华氏菌
冀研一号东方鲀是雌性菊黄东方鲀(Takifuguflavidus)与雄性红鳍东方鲀(T.rubripes)杂交子代。其幼鱼尾鳍呈浅黄且略带黑色,体表色斑花纹与菊黄东方鲀相近,形态特征与红鳍东方鲀和菊黄东方鲀存在明显差异[1]。其食用口感与菊黄东方鲀相似,市场价值高于红鳍东方鲀,但其生长速度快于菊黄东方鲀,接近于红鳍东方鲀,存活率比亲本高,一般约90%[2-3]。研究发现,在抗逆性方面,冀研一号东方鲀对重金属离子、水温和盐度波动具有较强的抗性[1,4-6]。Hansen等[7]首次克隆和分析虹鳟(Oncorhynchusmykiss)的 rag1和 rag2。斑马鱼(Daniorerio)[8]、河鲀(Fugurubripes)[9]、鲤鱼(Cyprinuscarpio)[10]等rags基因研究也相继被报道,国内则针对斑点叉尾(Ictaluruspunctatus)[11]、赤点石斑鱼(Epinephelusakaara)[12]、红笛鲷(Lutjanussanguineus)[13]等进行了研究。目前,rags在人和小鼠体内的表达调控已被深入研究报道,但未见有关冀研一号东方鲀的相关报道。本试验对冀研一号东方鲀注射迟钝爱德华氏菌(Edwardsiellatarda),分析重组激活基因在攻毒不同时间点的表达量变化规律,旨在为东方鲀的免疫应答提供理论依据。
1 材料与方法
1.1 试验鱼
试验用鱼健康状况良好、体表完整,体长(5.2±0.39) cm,由天津海升水产养殖有限公司提供。
1.2 试验方法
1.2.1 试验设计
试验分为对照组(注射磷酸缓冲盐溶液pH 7.2,0.1 mol/L)和攻毒组(注射迟钝爱德华氏菌,1×106cfu/mL),每组3个平行,共120尾。对照组每尾鱼腹腔注射50 μL无菌磷酸缓冲盐溶液,而感染组注射等体积迟钝爱德华氏菌菌液。将迟钝爱德华氏菌接种到牛肉膏蛋白胨液体培养基中,28 ℃过夜培养,取200 μL培养液以涂布法在固体平板上培养,28 ℃培养24 h,经磷酸缓冲盐溶液洗脱,计数,备用。注射开始前,采3尾普通试验鱼作为基础组织样本,注射6、12、24、36、48、72 h后取样,每次每组取3尾,无菌条件下取出肝胰脏、脾脏和头肾,分别置1.5 mL无RNA酶冻存管液氮保存,用于提取RNA。
1.2.2 总 RNA 提取及 cDNA第一条链合成
应用Rnaiso Plus试剂(Takara工程大连有限公司)提取不同组织(肝胰脏、脾脏、头肾)中的总RNA,经1%琼脂糖凝胶电泳检测其完整性,应用分光光度计(德国Eppendorf)测量OD260nm/OD280nm值,将比值为1.7~2.1的RNA应用PrimeScript RTase(Takara工程大连有限公司)合成cDNA第一条链。
1.2.3 rags 基因 mRNA 表达的定量分析
根据GenBank:EU871643.1和GenBank: AF108420.1中东方鲀β-actin、rag1、rag2基因保守序列设计引物(表1),并由苏州金唯智生物科技有限公司合成。PCR扩增体系为20 μL,包括6.4 μL ddH2O、0.8 μL正向引物、0.8 μL反向引物、2 μL模板和10 μL SYBRDE。PCR反应程序为:95 ℃预变性3 min;3步法循环40次(95 ℃变性15 s,退火30 s,72 ℃延伸30 s)。基因结果采用相对表达量的形式,以2-ΔΔCt法进行计算。
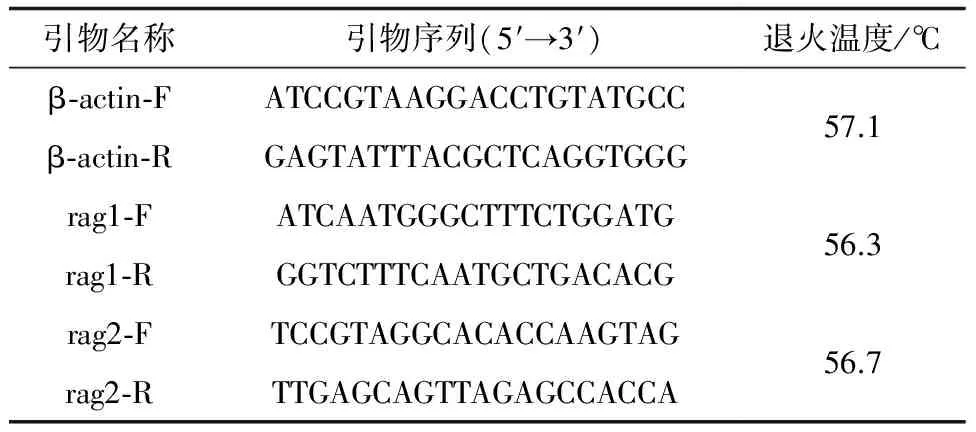
表 1 引物序列
1.3 数据统计分析
采用SPSS 17.0进行统计分析,对攻毒组和对照组rags基因相对表达量进行T检验分析,对攻毒组内各时间点rags基因相对表达量进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。所有数据用平均值±标准差表示。
2 结 果
感染迟钝爱德华氏菌后冀研一号东方鲀肝胰脏组织rags基因相对表达量变化见图1。感染菌体后rags基因相对表达量逐渐下降,峰值出现在攻毒后6 h;与对照组相比,攻毒后6、12、24 h rag1基因表达极显著升高(P<0.01);攻毒后24 h,rag2基因表达显著高于对照组(P<0.05),攻毒后 6、12 h时,rag2基因表达极显著高于对照组(P<0.01)。
感染迟钝爱德华氏菌后冀研一号东方鲀脾脏组织rags基因相对表达量变化见图2。随菌体感染时间延长,rags基因相对表达量呈先升后降趋势,并在攻毒后48 h出现反弹回升,其相对表达量峰值出现在攻毒后6 h;在6 h时rag1基因相对表达量与其他各时间点的相对表达量差异显著(P<0.05),第6、12、48 h时与对照组差异极显著(P<0.01);与对照组相比,感染菌体后rag2基因相对表达量在第6、12、24、48 h极显著升高(P<0.01)。
感染迟钝爱德华氏菌后冀研一号东方鲀头肾组织rags基因相对表达量变化见图3。菌体感染时间延长,rags基因相对表达量呈先升后降趋势,并在攻毒后48 h出现反弹回升;rag1基因相对表达量在攻毒后48 h达到最大值,显著高于其他各时间点的相对表达量(P<0.05),极显著高于对照组(P<0.01);rag2基因相对表达量在攻毒后6 h达到最大值,与其他各时间点的相对表达量差异显著(P<0.05),极显著高于对照组(P<0.01)。
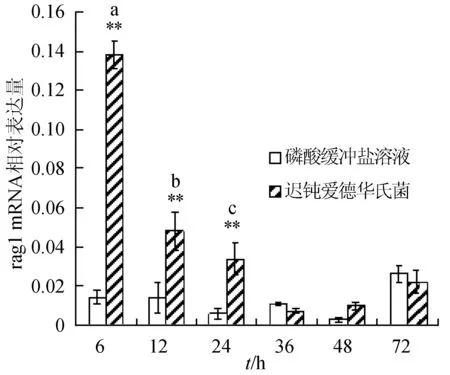
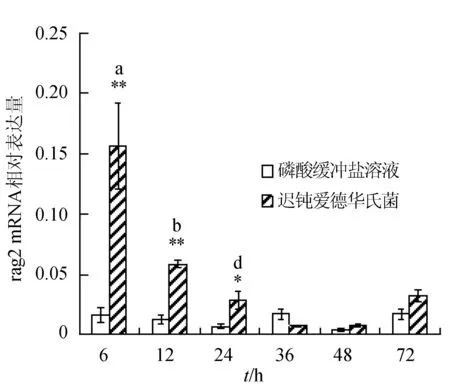
图1 肝胰脏组织不同时刻rag1和rag2基因相对表达量**表示攻毒组与对照组差异极显著(P<0.01);*表示攻毒组与对照组差异显著(P<0.05).不同字母表示攻毒组内不同时间点表达差异显著.下同.
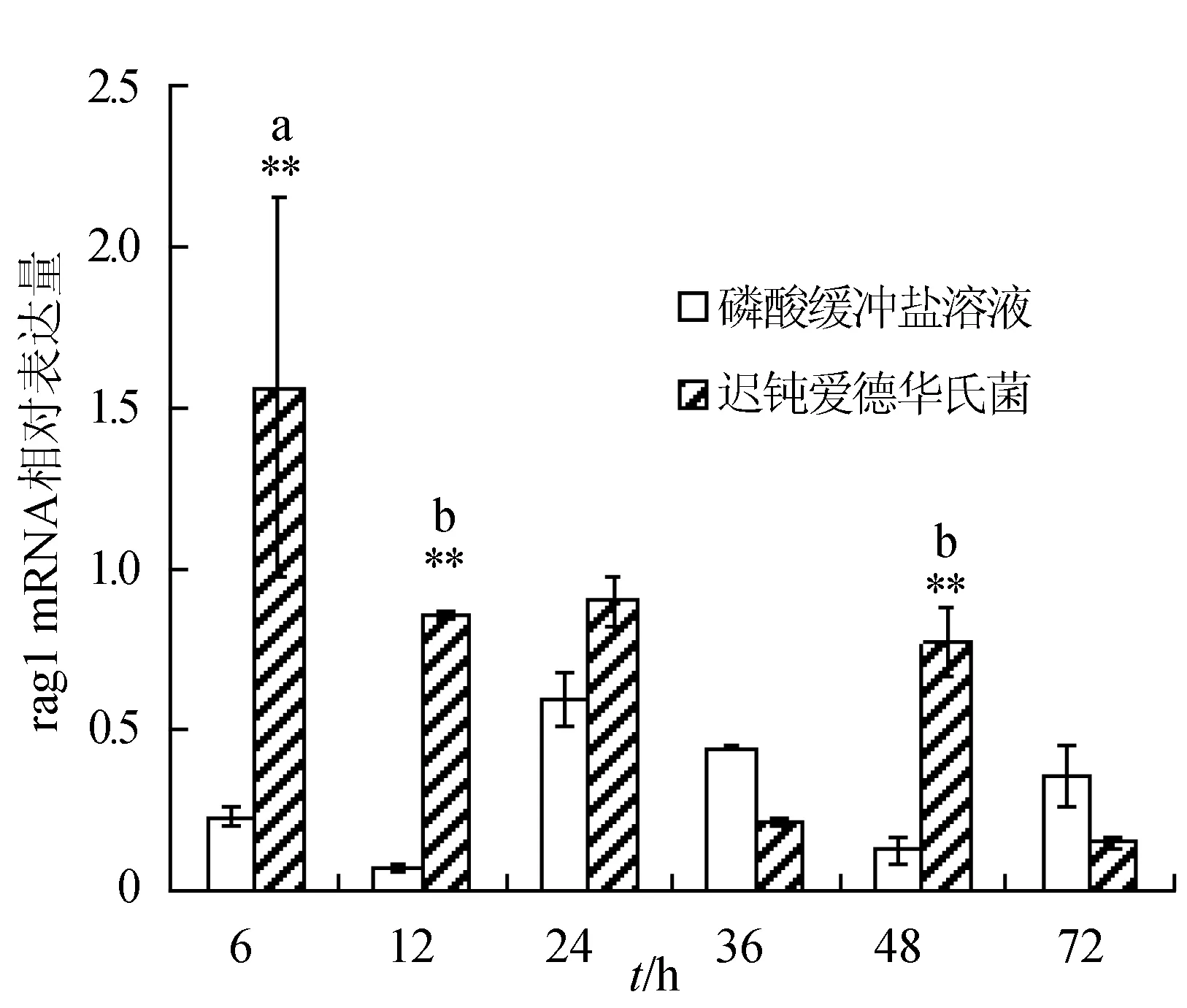
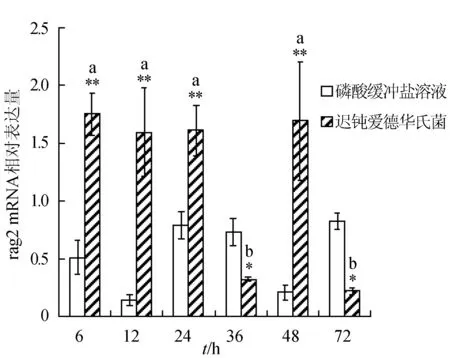
图2 脾脏组织不同时刻rag1和 rag2基因相对表达量
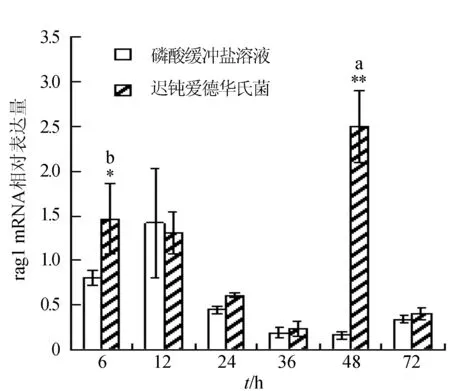
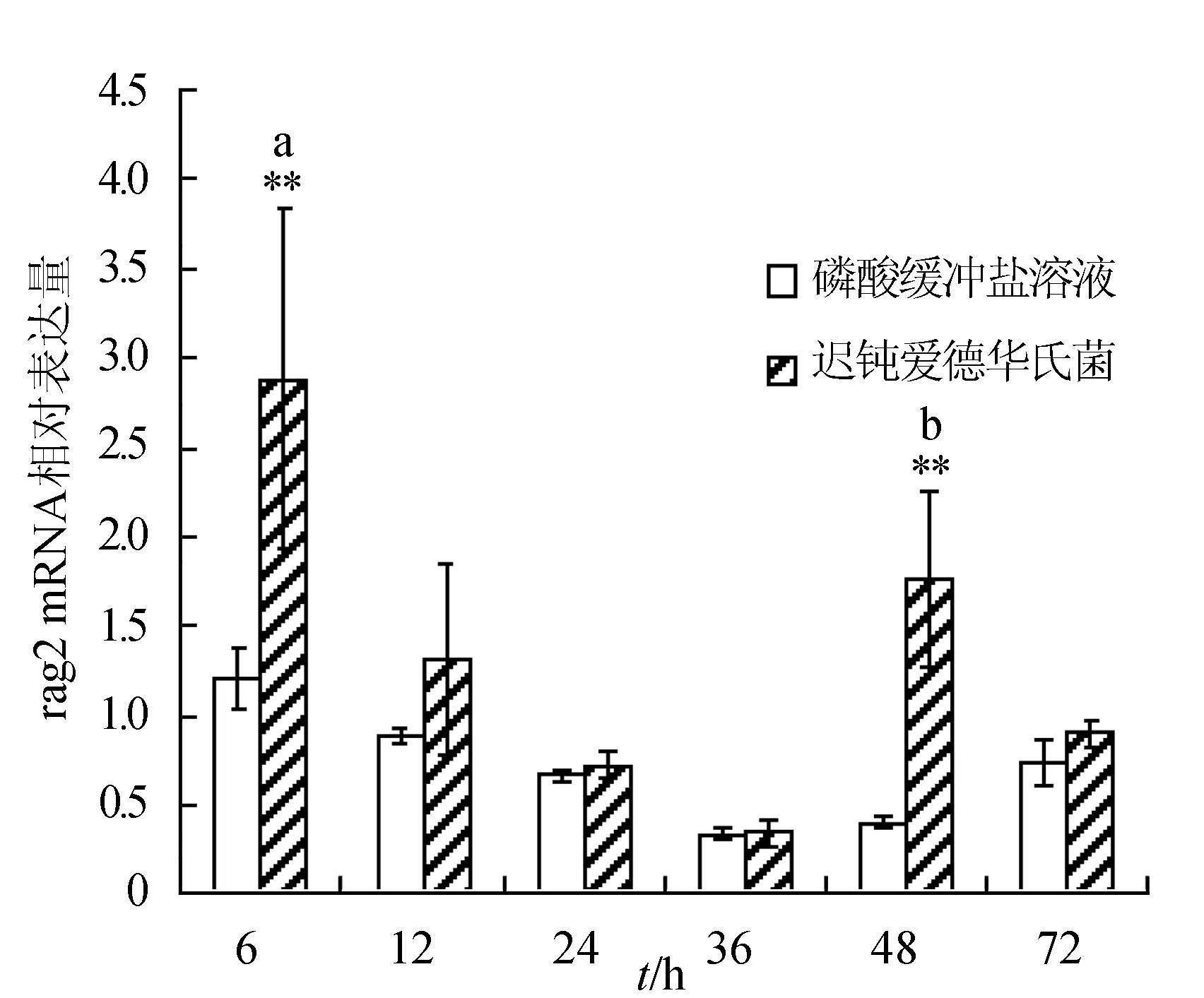
图3 头肾组织不同时刻rag1和rag2基因相对表达量
3 讨 论
3.1 rags基因在鱼体不同组织中的表达
李幸等[14]以实时荧光定量方法检测rag1基因在太平洋鳕(Gadusmacrocephalus)胸腺、头肾、脾脏和肝脏的表达情况,发现rag1基因仅在胸腺和头肾两种组织中表达。Mao等[12]采用同样方法检测rag1基因在赤点石斑鱼的肝、头肾、脾、胸腺、脑、肌肉、肠、心脏、鳃和性腺中表达情况,rag1基因转录只发生在胸腺和头肾组织中。但红笛鲷经灭活溶藻弧菌(Vibrioalginolyticus)免疫后,rag1基因在头肾、胸腺、脾脏、肝脏、肠和脑组织中均有表达[13]。本试验发现,rags基因不仅可在头肾中表达,同时还在脾脏和肝胰脏中检测到其表达,与红笛鲷报道的结果相一致。是因为免疫原刺激,导致rags基因在鱼体不同组织中产生差异表达。
3.2 rag1基因和rag2基因表达的协同性
rag1 和 rag2基因是重组激活基因由于序列差异而区分的。结构上,在鲤科和鲀科中rag1基因含有两个内含子,而斑点叉尾和虹鳟中rag1基因只有一个内含子,其他物种中rag1和rag2基因一样,不含内含子。目前,已有研究提出rag1基因和rag2基因能够同步表达,并且二者功能上存在协同作用。本研究发现冀研一号东方鲀肝胰腺、脾脏和头肾中rag1和rag2基因表达趋势基本一致。在灭活菌感染红笛鲷不同组织中rag1和rag2基因表达量的变化趋势也基本保持一致[13]。而Kapitonov等[15]提出rag1和rag2基因编码得到的蛋白是通过相同的转座子完成的。
3.3 细菌攻毒对rags基因表达量的影响
本研究发现,冀研一号东方鲀注射迟钝爱德华氏菌后,肝胰脏中rags基因表达呈下降趋势,有可能是因为细菌感染后导致v(d)j重组发生错误[16-18]。头肾中rags基因表达均呈先升后降的趋势,但在攻毒后48 h出现反弹回升。这与头肾所含的淋巴细胞密切相关[19]。Zhang等[13]应用实时荧光定量方法检测灭活溶藻弧菌免疫后红笛鲷不同时间点rags基因表达情况,发现在0~24 h,肝胰脏、脾脏和头肾中rag1和rag2 mRNA 的表达量均下调至最低值,24~96 h,均呈先升后降且趋于平缓的趋势。红笛鲷和冀研一号东方鲀二者对细菌攻毒后的表达存在差异,分析原因可能在于以下两点,其一可能是因为试验鱼不同,其二可能是因活菌与灭活菌的差异导致,活菌对机体的免疫刺激更为强烈,时间持续更长[20]。
综上所述,腹腔注射迟钝爱德华氏菌能引起冀研一号东方鲀rags基因表达上调,且rag1基因和rag2基因表达趋势基本一致。rags基因作为特异性免疫系统的重要成员,在冀研一号东方鲀特异性免疫应答中发挥着重要的作用。
[1] 范文涛,刘海金,赵文江,等.菊黄东方鲀♀×红鳍东方鲀♂杂交后代早期形态特征及生长速度的比较[J].水产学报,2011, 35(7):1065-1071.
[2] 陈林,李思发,简伟业,等.吉奥罗非鱼(新吉富罗非鱼♀×奥利亚罗非鱼♂)生长性能的评估[J].上海海洋大学学报,2008,17(3):257-262.
[3] 李思发,王成辉,刘志国,等.三种红鲤生长性状的杂种优势与遗传相关分析[J].水产学报,2006,30(2):175-180.
[4] 张福崇,万玉美,方笑,等.盐度对杂交东方鲀存活和摄食的影响[J].河北渔业,2012(12):2-6.
[5] 张福崇,赵海涛,万玉美.杂交河鲀F1代苗种生产与养殖技术研究[J].河北渔业,2011(10):19-21.
[6] 高扬.利用高通量测序技术对东方鲀杂交优势的初步解析[D].北京:中国科学院大学,2013.
[7] Hansen J D, Kaattari S L. The recombination activating gene 1 (RAG1) of rainbow trout (Oncorhynchusmykiss) : cloning, expression, and phylogenetic analysis[J]. Immunogenetics, 1995, 42(3):188-195.
[8] Willett C, Cherry J, Steiner L. Characterization and expression of the recombination activating genes (RAG1 and RAG2) of zebrafish[J]. Immunogenetics, 1997, 45(6):394-404.
[9] Peixoto B R, Mikawa Y, Brenner S. Characterization of the recombinase activating gene-1 and 2 locus in the Japanese pufferfish,Fugurubripes[J]. Gene, 2000, 246(s1/2):275-283.
[10] Huttenhuis H B T, Huising M O, Meulen T V D, et al. RAG expression identifies B and T cell lymphopoietic tissues during the development of common carp (Cyprinuscarpio)[J]. Developmental & Comparative Immunology, 2005, 29(12):1033-1047.
[11] 公衍文,张云,黄庆,等.斑点叉尾鮰重组激活基因克隆与鉴定[J].第三军医大学学报,2004,26(8): 700-703.
[12] Mao M G, Lei J L, Alex P M, et al. Characterization of RAG1 and IgM (mu chain) marking development of the immune system in red spotted grouper (Epinephelusakaara)[J]. Fish & Shellfish Immunology, 2012, 33(4): 725-735.
[13] Zhang X L, Lu Y S, Jian J C, et al. Cloning and expression analysis of recombination activating genes (RAG1/2) in red snapper (Lutjanussanguineus)[J]. Annual Review of Economics, 2012, 32(4):534-543.
[14] 李幸,温施慧,毛明光,等. 太平洋鳕RAG1和IgM基因荧光定量PCR方法的建立及初步应用[J].水产学报,2015,39(4):475-484.
[15] Kapitonov V V, Koonin E V. Evolution of the RAG1-RAG2 locus: both proteins came from the same transposon[J]. Biology Direct, 2015, 10(20):1-8.
[16] Wilson A, Held W, MacDonald H R. Two waves of recombinase gene expression in developing thymocytes[J]. Journal of Experimental Medicine, 1994, 179(4):1355-1360.
[17] Grawunder U, Leu T M, Schatz D G, et al. Down-regulation of RAG1 and RAG2 gene expression in preB cells after functional immunoglobulin heavy chain rearrangement[J]. Immunity, 1995, 3(5):601-608.
[18] Sylva T R D, Fong I C, Cunningham L A, et al. RAG1/2 re-expression causes receptor revision in a model B cell line[J]. Molecular Immunology, 2007, 44(5):889-899.
[19] 陈健,张东,叶坤,等. 大黄鱼在感染刺激隐核虫后MHC IIB基因的表达[J]. 安徽农业科学,2015(7):143-146.
[20] 何宗林. 活菌H37Ra与灭活菌H37Rv感染小鼠腹腔巨噬细胞实验研究[D]. 重庆:重庆医科大学,2012.
EffectsofEdwardsiellatardaInjectiononmRNAExpressionsofRecombinationActivatingGenesragsinJiyan-1Fugu
ZHANG Han, DAI Wei, SHI Hongyue, CHEN Chengxun, WANG Qingkui, XING Kezhi
( Tianjin Key Laboratory of Aqua-Ecology and Aquaculture, Fisheries College, Tianjin Agricultural University, Tianjin 300384, China )
In this study, Jiyan-1 fuguTakifuguflavidus♀×T.rubripes♂ juveniles were injected withEdwardsiellatardafor different times (6, 12, 24, 36, 48, and 72 h), and mRNA expressions of recombination activating genes rags in liver, spleen and kidney were investigated using quantitative real-time PCR technology. The results showed that mRNA expressions of rags in liver was decreased with time, and reached the peak values 6 h after injection. The mRNA expression of rags in spleen and kidney were increased first and then decreased with a rebound in 48 h. The peak values of rags mRNA expressions in spleen were observed 6 h after injection, and rag1 and rag2 mRNA expressions in kidney reached the peak values in 48 h and 6 h, respectively. As compared to the control group,E.tardainjection upregulated mRNA expressions ofrags, and both rag1 and rag2 mRNA expressions were changed in the same trend.
Jiyan-1 fugu; recombination activating gene; mRNA expression;Edwardsiellatarda
10.16378/j.cnki.1003-1111.2017.02.018
2016-05-03;
2016-06-12.
国家星火计划重大项目(2013GA610002);天津市创新团队基金资助项目(TD12-5018);天津市应用基础与前沿技术研究计划重点项目(13JCZDJC29200);天津市科技支撑计划重大项目(12ZCDZNC05900).
张菡(1990—),女,硕士研究生;研究方向:水产动物增养殖学. E-mail:13820487312@163.com.通讯作者:邢克智(1956—),男,教授,研究方向:水产生态与养殖. E-mail:kzxing6668@126.com.
S942.5
A
1003-1111(2017)02-0216-04

