自然早产胎盘中细胞凋亡抑制因子survivin表达水平的定量检测及其临床研究*
徐小华,郑双云,金亚玲
(中山大学第八附属医院 妇产科,深圳 福田 518000)
·经验交流·
自然早产胎盘中细胞凋亡抑制因子survivin表达水平的定量检测及其临床研究*
徐小华,郑双云,金亚玲
(中山大学第八附属医院 妇产科,深圳 福田 518000)
目的分析自然早产胎盘中细胞凋亡抑制因子生存素(survivin)表达水平及其定量检测在自然早产中的诊断价值。方法选择2015年12月‐2016年12月福田医院住院部分娩的60例胎盘,其中自然早产30 例(观察组),足月产30例(对照组)。采集胎盘,对两组分别采用细胞凋亡抑制因子survivin免疫检测和survivin mRNA定量测定逆转录-聚合酶链反应(RT-PCR)法并进行比较。结果观察组胎盘survivin因子阳性表达率为26.67%(8/30),survivin-mRNA基因阳性表达率为16.67%(5/30),对照组分别为53.33%(16/30)、50.00%(15/30),差异具有统计学意义(P <0.05)。观察组胎盘survivin因子阳性细胞百分比为(57.10±4.82)%,survivin-mRNA相对表达量(0.68±0.23),对照组分别为(72.06±7.59)%、(2.09±0.47),差异具有统计学意义(t分别为11.102、4.910,P <0.05)。结论适时监测诱发孕妇早产的survivin因子,及早治疗干预,有助于避免早产的发生,提高新生儿的生存质量。
生存素;自然早产胎盘;细胞凋亡抑制因子;免疫组化;RT-PCR法
早产是指妊娠满28周至不足37周(196~258日)间分娩者,此时娩出的新生儿称为早产儿,流行病学调查显示[1],其在我国发生率约占总分娩的5%~15%左右,而早产儿因各器官发育不成熟,易出现较多如新生儿颅内出血、肺透明膜病、坏死性小肠炎等并发症,导致我国出生1岁以内死亡的婴儿约2/3为早产儿[2]。因此,如何诊断早产的发生并对其进行干预成为产科领域内较棘手的问题之一。生存素(survivin)是细胞凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)的成员之一,其主要作用是抑制细胞凋亡[3],本研究选取30例自然早产及30例足月生产分娩的胎盘分别进行细胞凋亡抑制因子survivin免疫检测和survivin mRNA定量测定,旨在为自然早产诊断及改善新生儿生存质量提供依据,现报道如下。
1 资料与方法
1.1 研究对象
选择2015年12月‐2016年12月福田医院住院部分娩的60例胎盘,其中自然早产30例(观察组),足月产30例(对照组)。纳入标准:① 产妇年龄为22~35岁;②均同意参与本次研究,签署知情同意书;③单胎、头位妊娠,孕周≥28周。排除标准:①存在甲状腺功能异常、妊娠期糖尿病等其他严重妊娠合并症者;②重要脏器严重功能不全或者严重凝血功能异常者。
观察组年龄24~35岁,平均(30.5±4.5)岁,顺产16例,剖宫产14例;对照组年龄23~34岁,平均(28.9±3.2)岁,顺产18例,剖宫产12例,两组基础资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 标本采集 从胎盘母体面中央处起始,垂直至胎儿面贯穿避开出血、坏死、钙化部位取材,在胎盘娩出5 min内完成,约1 cm×1 cm×1 cm大小,切取胎盘组织立即在生理盐水中洗净血液,其中一部分液氮固定,-80℃保存,剩余部分置入10%中性甲醛溶液固定,常规石蜡包埋切片。
1.2.2 免疫组化 survivin因子免疫组化用SP法,具体方法简述如下:石蜡切片脱蜡后滴加鼠抗人survivin(第一抗体)以及羊抗鼠survivin(第二抗体),在光学显微镜下观察染色结果,每切片随意计数5个高倍视野中阳性染色纤维数,每张切片在400倍的视野下随机选取50帧图像,MPIAS-2000型高清晰度彩色病理图像分析系统进行分析。
1.2.3 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)survivin mRNA的检测采用Bio-Rad CFX96 Real-Time PCR System(红土生物技术有限公司提供)进行RT-PCR法测定。采用TRIZOL法提取总RNA,进行RNA的定量测定,通过逆转录形成cDNA,进行PCR扩增,最后根据图像处理后进行定量分析。
1.3 统计学方法
采用SPSS 20.0统计学软件对本次试验数据进行处理分析。计数资料以百分比(%)进行描述,采用χ2检验或者Fisher精确检验;计量资料以均数 +标准差(±s)表示,采用 t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组胎盘survivin因子阳性结果比较
survivin正常阳性定位于细胞核/细胞浆,按染色强度及阳性细胞数占总细胞的百分比综合判断结果(见图1)。观察组survivin因子阳性表达率及阳性细胞百分比低于对照组,差异具有统计学意义(P<0.05),见表1。
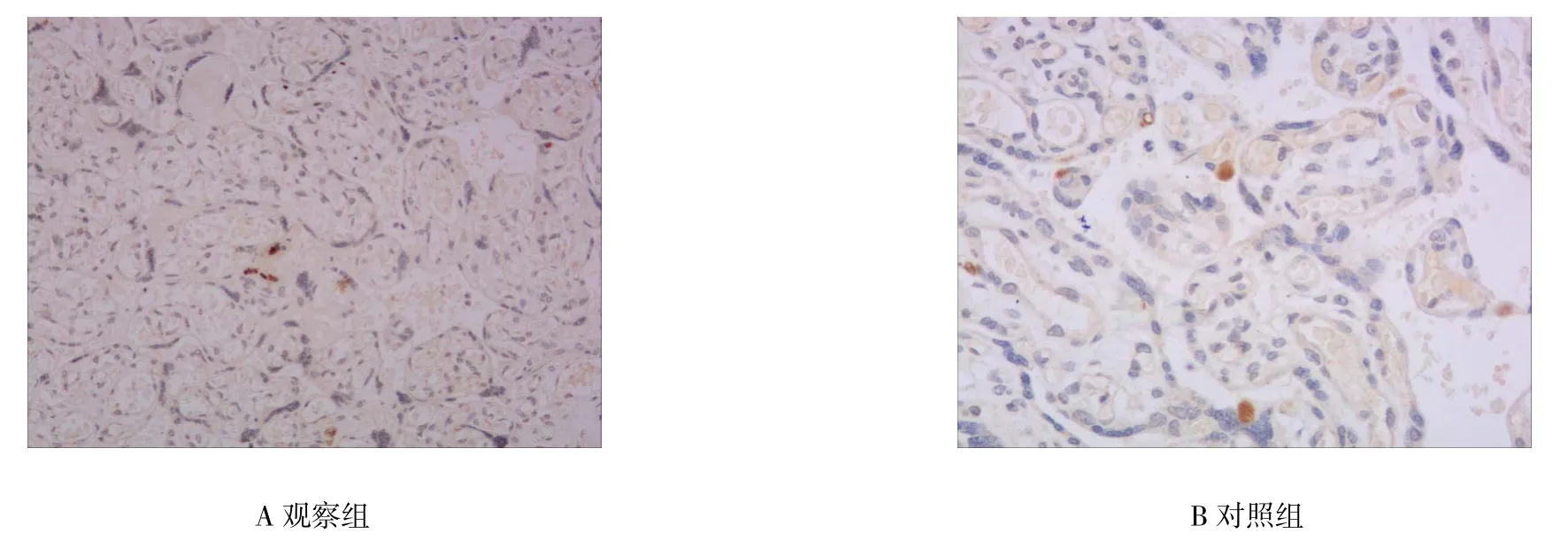
图1 免疫组化检测survivin在胎盘组织中分布和水平的变化情况

表1 两组胎盘survivin因子阳性结果比较
2.2 两组胎盘survivin-mRNA基因表达结果比较
观察组survivin-mRNA基因阳性表达率及相对表达量低于对照组,差异具有统计学意义(P<0.05),见表2。

表2 两组胎盘survivin-mRNA基因表达结果比较
3 讨论
早产儿具有死亡率高、并发症多及留有后遗症等特点,所有死亡新生儿中28%为早产(占无畸形儿死亡中的70%),孕周小于32周的早产儿,有20%存活不到1年,70%早产儿视网膜病、呼吸暂停、动脉导管未闭、脑瘫及慢性肺部疾病等近远期并发症多[4]。因此早期诊断和治疗早产,预防早产的发生对降低围产儿死亡率起着积极重要的作用。
survivin基因位于17号染色体q25区,靠近端粒,其主要作用是抑制细胞凋亡,若表达量达到一定水平之后,细胞失去了正常增殖周期中凋亡开关的限制,使得细胞发生异常增殖现象,大量研究证实其表达水平与乳腺癌、胃癌等各种癌症相关[5-6]。但是,研究发现[7],survivin除参与细胞凋亡的控制外,还特异地参与细胞周期G2-M期表达,具有调节细胞有丝分裂的主要功能,其通过保护细胞器完整性抑制细胞凋亡。胎盘的绒毛滋养层细胞是胎儿与母体进行物质交换所需营养的主要来源,早产的发生与母体绒毛滋养层细胞增殖与凋亡间的失衡密切相关,而survivin基因在正常绒毛滋养层细胞中抑制细胞凋亡[8]。本研究通过对自然早产与足月分娩的胎盘进行survivin免疫组化检测及survivin mRNA定量检测发现,观察组survivin因子阳性表达率及阳性细胞百分比显著低于对照组,survivin-mRNA基因阳性表达率及相对表达量显著低于对照组,表明survivin在胎盘中的表达不足可能引起早产发生,与文献报道[9-10]相一致。但是本研究样本量较少,只能为survivin基因预测早产提供初步依据,survivin基因表达水平降低使绒毛滋养层细胞过度凋亡导致早产机制有待更深入的研究。
综上所述,适时监测诱发孕妇早产的survivin因子,及早治疗干预,有助于避免早产的发生,提高新生儿的生存质量。
[1]叶彩霞,王淑华,王丽荣,等.早期围生保健对预防早产降低早产发生率的临床探讨[J].中国医学前沿杂志(电子版),2014,6(6):79-81.
[2]刘展.早产发生的高危因素分析及对围产结局的影响研究[J].中国妇幼保健,2016,9(4):707-708.
[3]朱红霞,刘爽,周翠琦,等.抗凋亡基因survivin促进细胞转化的作用机制[J].中华医学杂志,2012,82(5):338-340.
[4]胡春霞,李跃萍,华少萍,等.470例早产相关因素及早产儿结局分析[J].中国妇幼保健,2013,6(18):2914-2916.
[5]龚代鹏,张竹青,张妍,等.p-STAT3、Survivin和Mcl-1蛋白在胃癌组织中的表达及意义[J].中华临床医师杂志:电子版,2015,15(6):915-920.
[6]韩建秋,郝丽惠,赵丽冰,等.抑制Survivin基因对人卵巢癌SKOV3细胞增殖和凋亡的影响[J].现代肿瘤医学,2015,23(10):1355-1358.
[7]李春芳,苟文丽,宗璐,等.HtrA1、Survivin在早发型重度子痈前期胎盘组织中的表达及意义[J].西安交通大学学报(医学版),2014,3(54):678-681.
[8]Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis gene,survivin,expressed in canecel and lymphoma[J].Nat Med,2013,3(8):917-923.
[9]司马玲.Survivin、bcl-2和bax在反复自然流产绒毛组织中的表达及意义的研究[J].新疆医科大学,2013,4(28):716-719
[10]徐小华,郑双芸,金亚玲,等.自然早产胎盘中细胞凋亡抑制因子survivin表达水平[J].中国优生与遗传杂志,2016,24(4):28-30.
R714.21
B
10.19338/j.issn.1672-2019.2017.09.013
2017-06-07
深圳市福田区卫生公益性科研项目(FTWS2015040)
(张立芳 编辑)

