Th17细胞在侵袭性烟曲霉病中双向调节作用的研究进展
耿婉如 贺航咏 童朝晖
(1.首都医科大学附属北京朝阳医院呼吸与危重症科,北京 100032;2.内蒙古民族大学附属医院呼吸内科,通辽 028000)
·综述·
Th17细胞在侵袭性烟曲霉病中双向调节作用的研究进展
耿婉如1,2贺航咏1童朝晖1
(1.首都医科大学附属北京朝阳医院呼吸与危重症科,北京 100032;2.内蒙古民族大学附属医院呼吸内科,通辽 028000)
辅助性T细胞17 (Th17)在机体侵袭性肺烟曲霉病中有防御和破坏性作用,一方面经常可以观察到曲霉菌感染后Th17细胞数量的增加,IL-17水平升高、或者Th17细胞促稳定因子IL-23的升高,其机制可能为分泌特异的细胞因子、介导自身免疫反应或者趋化效应性T细胞等几个方面;另一方面体内Th17细胞免疫反应可导致免疫损伤,其机制中主要包含直接作用和间接作用两种,直接作用表现为IL-17在体内外均可以促进烟曲霉生长,间接作用表现为IL-17可通过上调促炎介质、抑制Th1免疫反应或促进Th2免疫反应等机制促进炎症发生发展。Th17细胞对侵袭性肺烟曲霉病的这种双向调节作用主要与烟曲霉与感染环境如宿主免疫状态、感染时间、真菌细胞壁的特异成分的相互作用等有关。
Th17细胞;侵袭性肺烟曲霉病;免疫应答;综述
侵袭性肺烟曲霉病 (Invasive pulmonary aspergillosis,IPA)是一种由烟曲霉所致的肺部侵袭性感染性疾病,属机会性感染疾病。随着近年来接受造血干细胞移植、实体器官移植和其他原因需应用大剂量激素等免疫抑制剂的免疫缺陷宿主的增多,IPA的发病率也呈增高趋势[1]。此外,一些免疫功能相对正常的慢性阻塞性肺病、医院获得性肺炎患者,近年来也被发现合并IPA感染[2]。
关于IPA的免疫发病机制,辅助性T细胞Th1/Th2细胞的平衡模式在学术界占统治地位,这一理论认为,Th1在体内通过细胞免疫负责防御反应,而Th2则通过体液免疫负责破坏性反应,二者之间的平衡共同维护身体处于免疫机能正常状态,当这种平衡被打破,则可诱发免疫机能紊乱而出现侵袭性肺部真菌感染。此外,对一些受体 (如Toll样受体 (Toll-like receptors,TLRs))和C型凝集素受体的研究,也有助于了解IPA免疫发病机制。
近年来一种新的辅助型T细胞Th17 (T help cell 17,Th17)细胞的出现,更新了人们对IPA免疫机制的认知。本文对Th17细胞在IPA发病机制中的研究现状做一综述,以便更深入地理解IPA的免疫发病机制和Th17在本病中的重要角色。
1 Th17细胞的发现
在发现Th17细胞之前,学术界一直将Naïve CD4+T细胞分为包括辅助性T细胞1型 (T help cell 1,Th1)、辅助性T细胞2型 (T help cell 2,Th2)的效应T细胞和调节性T细胞 (regulatory T cell,Treg)三种。传统上认为Th1通过激活吞噬细胞介导细胞免疫而引起炎症,它主要分泌的细胞因子是γ-干扰素 (Interferon γ,IFN-γ)和白介素-2 (interleukin-2,IL-2);Th2通过激活嗜酸性粒细胞介导体液免疫而抑制炎症,主要产生白介素-4 (interleukin-4,IL-4)、白介素-5 (interleukin-5,IL-5)和白介素-13 (interleukin-13,IL-13)等细胞因子。Treg细胞主要通过产生IL-10、TGF-β等细胞因子的方式参与免疫应答,对Th1和Th2发挥抑制作用。
2003年,在对实验性自身免疫性脑脊髓膜炎 (Experimental Autoimmune Encephalomyelitis,EAE)鼠模型的实验研究发现,虽然Th1细胞是介导炎症发生细胞,但IFN-γ因子缺陷并不阻碍炎症发生[3]。随后的研究提示IL-23,而不是IL-12,才是诱发实验性自身免疫性脑脊髓膜炎的必要因素[4],这引起了人们对Th1细胞诱发炎症理论的质疑,也提示由IL-23影响分化的T细胞在该疾病中发挥了更重要的诱导作用。
2 a之后,即2005年,学者Park等在研究鼠的两种自身免疫病模型即实验性自身免疫性脑脊髓炎和胶原诱导关节炎时发现了一种新型效应T细胞——它不同于传统的Th1和Th2辅助性T细胞,它以分泌白介素-17 (interleukin-17,IL-17)而得名,也分泌白介素-22 (interleukin-22,IL-22)、白介素-6 (interleukin-6,IL-6)、肿瘤坏死因子α (tumor necrosis factor,TNFα)等细胞因子,有独立的分化途径[5],因而被命名为辅助性T细胞17。
2 烟曲霉真菌感染后Th17细胞的分化过程
真菌孢子在空气中广泛存在,其浓度大概是1~100个/m3。当真菌孢子被吸入肺泡后,暴露出细胞壁上多种病原相关分子模式 (pathogen associated molecular pattern,PAMP),免疫细胞通过模式识别受体 (pattern recognition receptor,PRR)与真菌表面的相应配体结合后介导免疫细胞吞噬病原、分泌细胞因子[6]等。这些PRR主要包括:Toll样受体、树突状细胞相关性C型植物血凝素-1 (Dectin-1)[7]等。免疫细胞识别抗原还需体内的抗原呈递细胞 (APC)相助,主要包括树突状细胞,负责抗原监视并促进T细胞分泌相应的细胞因子和化学因子,在识别PAMP后,激活其他原始T细胞;并刺激原始T细胞向不同功能的Th细胞分化[8]。
原始T细胞的分化通路有:(1)在IL-12的作用下分化成Th1细胞,使其通过激活巨噬细胞在烟曲霉感染后发挥重要的抗感染免疫作用;(2)在IL-4、IL-10作用下分化成Th2细胞,在真菌感染中发挥自己独特的作用;(3)在IL-4和转化生长因子β (Transforming Growth factor β,TGF-β)作用下分化成后来发现的Th9细胞;(4)向Th17细胞分化[9](如图1所示)。
Th17的分化途径与其他T细胞不同。在Th17细胞的完整分化过程需要3个阶段:诱导、扩增、稳定/维持阶段。最初,其分化通过IL-6和TGF-β两个具有相反作用的细胞因子启动[10]。天然免疫系统研究发现,在有特定模式识别受体发挥作用的细胞中,IL-6呈高表达,在感染部位可聚集大量IL-6发挥促炎作用;而TGF-β可通过诱导叉头框蛋白3 (forkhead box protein 3,FOXP3)表达,促进产生Treg而抑制自身免疫病,在炎症继发组织损伤中起保护作用[10]。关于Th17细胞诱导分化阶段的研究,大多来自于EAE疾病动物模型。Bettelli[11]使用一种免疫TGFβ转基因小鼠,证实IL-6的大量产生伴随有Th17细胞的相应增多。Li[12]给予外在条件性抑制TGF-β基因,使得T细胞TGF-β基因失活,则无法产生Th17细胞,而小鼠的EAE也相应减轻。这些研究都提示了TGF-β和IL-6共同参与了Th17细胞的分化起始阶段,而且也分别提示Th17细胞及其分泌的IL-17在自身免疫病中发挥重要作用。
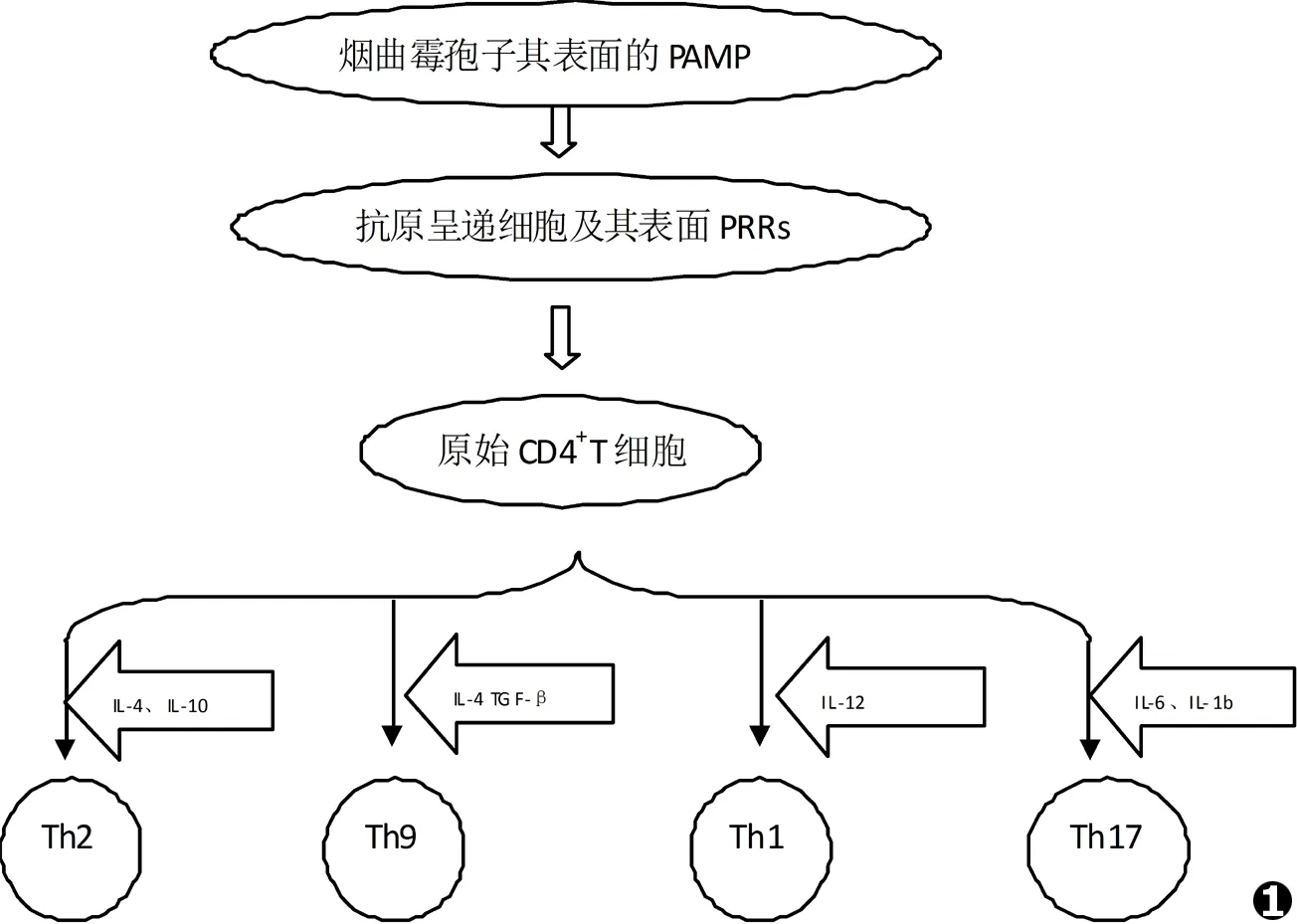
图1真菌感染后原始CD4+T细胞分化为不同效应T细胞模式图
Fig.1Model chart for the Naive CD4+T cells differentiate into effector T cells after fungal infection
关于Th17细胞扩增阶段的研究:新分化的Th17细胞通过分泌白介素21 (interleukin-21,IL-21)来完成自身扩增。IL-21是IL-2家族的成员,在Th17细胞中也可分泌。Korn等[13]研究发现,如果IL-6缺失,IL-21也可以代替它与TGF-β一起引起Th17细胞的分化。无论是体内试验还是体外实验,当IL-6存在的时候,IL-21受体缺失的小鼠表现为Th17细胞应答明显减少。研究提示,IL-21可以以自分泌的方式促进Th17细胞的分化。
世界各国对于税收优惠的主要三种方式有:税率式优惠、税基式优惠、税额式优惠,以上三种税收优惠政策不仅在影响范围有大小之分,影响深远度也有远近之分。由于发达国家税收优惠政策更加丰富,因此小微企业可选择的税收优惠政策更加多元化,同时也可以选择多种税收优惠政策将其自由组合,增加了小微企业对于税收优惠的自主选择性,对于促进小微企业快速发展十分有利。我国税收优惠政策以税率式优惠与税额式优惠作为重点,尚没有针对融资等方面的税收优惠政策,相较于发达国家的税收优惠政策则略显单一,对于小微企业税收优惠起到的作用不大,很难进一步提高小微企业的自主创新及其核心竞争力,难以维持这些企业的持续发展。
关于Th17细胞稳定/维持阶段的研究:IL-23完成Th17细胞的稳定和维持阶段。然而,进一步的研究发现,TGF-β和IL-6共同诱导产生的Th17细胞并不产生组织炎症,而只有在IL-23的作用下,使白介素10 (interleukin-10,IL-10)表达由高降低,才可以引起组织炎症,这提示IL-23主要是稳定和维持Th17细胞特性[14]。
3 Th17细胞在IPA感染免疫中的作用
Th17细胞作为一类新发现的T细胞亚群,在曲霉菌感染的免疫病理机制方面逐渐受到关注。既往的研究出现了有争议的结论。IL-23在Th17细胞的诱导分化中起了很重要的强化和稳固作用,Th17细胞通过分泌包括IL-17A在内的多种细胞因子参与炎症反应,部分学者提出曲霉菌感染性炎症的IL-23/IL-17A轴的重要作用理论[15]。基于此理论,一些学者认为:IL-23/IL-17轴在对肺孢子菌的免疫反应中发挥防御作用,在这些研究中,经常可以观察到曲霉菌感染后Th17细胞数量的增加,IL-17水平升高或者Th17细胞促稳定因子IL-23的升高,其机制可能是IL-12依赖的促进Th1免疫反应机制、促进中性粒细胞募集和限制Th2型免疫反应而发挥抗真菌作用[16]。另一些学者认为,体内Th17细胞免疫反应可导致免疫损伤,其列举的实验中往往观察到,IL-17妨碍中性粒细胞介导的曲霉孢子的清除和杀灭,较高的IL-23/IL-17依赖的炎症应答与烟曲霉的易感性相关,Th17免疫应答通路下调Th1细胞介导的抗菌作用等[17]。
3.1 Th17细胞在IPA中的防御作用
恰如T细胞在艾滋病中发挥重要抗感染作用,多数学者认为高功能的T细胞反应尤其是Th17细胞是真菌感染强有力的免疫保护因素[18-19]。诸多基因敲除动物方面的研究,均证实Th17/IL-17在烟曲霉感染中的防御作用。2007年,学者Rudner等进行一系列基因敲除小鼠动物模型实验,发现IL-23p19-/-的小鼠在感染肺孢子菌后,感染清除能力暂时下降。IL-23p19-/-小鼠,肺部的淋巴细胞趋化因子IP-10、MIG、巨噬细胞炎性蛋白MIP-1α、MIP-1β和正常T细胞活化调节因子均下降,肺组织中效应CD4+T细胞减少。而抗IL-17中和抗体和抗IL-23p19抗体则可以使野生型小鼠的真菌负荷增加。研究结果表明IL-23/IL-17轴在宿主对肺孢子菌的免疫反应中发挥防御作用[20]。有研究报道缺乏IL-17或抗体中和IL-17可使小鼠对曲霉菌高度易感[21];人类中涉及Th17分化的蛋白质遗传变异可影响对烟曲霉的易感性,例如IL-1β启动子域多态性[22]、IL-23受体基因多态性[23]、信号转导与转录激活因子 (Signal Transducer and Activator of Transcription 3,STAT3)基因突变[24](如Job综合征、先天产IL-17T细胞缺陷、中性粒细胞趋化功能降低、IgE升高、对烟曲霉易感)。对真菌抗原识别和激活Th17通路十分关键的模式识别受体Dectin-1基因缺陷也显示了对烟曲霉易感:如Dectin-1缺陷鼠显示在接种真菌后死亡率增加[21];人类编码Dectin-1的基因Y238x多态性显示,一种表达短缩Dectin-1蛋白的基因型患者无论是移植的供者还是受者均与真菌易感性增高相关[25]。这些研究是Th17/IL-17相关通路在抗真菌感染免疫保护方面承担不可或缺角色的有力证明。
Th17细胞在IPA抗感染免疫中发挥防御反应的机制为:分泌特异的细胞因子、介导自身免疫反应或者趋化效应性T细胞等几个方面。Zelante等[15]发现,在IFN-γ缺乏时,IL-23能够通过IL-12p35依赖的机制发挥保护性抗真菌作用。在对真菌的反应中,IL-23是由骨髓来源的DC细胞亚群产生的,通过Toll 样受体/髓样分化因子88 (myeloid differentiation factor 88,MyD88)依赖的炎症途径产生。Kaya等[26]学者发现,IL-17A受体信号缺陷可见于Th2细胞反应增强和真菌过敏反应。这些结果表明Th17信号途径主要通过促进Th1型免疫反应和限制Th2型免疫反应中有调节作用。对IL-17A的免疫效应功能研究发现:IL-17A可动员中性粒细胞[27],诱导防御素的产生而对感染发挥有效的控制作用,但在感染期间,IL-17A-IL-17RA途径的作用尚不确定[28]。
有学者发现肺部产生IL-17是Dectin-1依赖性的,Dectin-1通过减少lL-12和IFN-γ在天然细胞中的产生,改变曲霉感染时CD4+T细胞应答,使烟曲霉特异性CD4+T细胞中Th17细胞分泌IL-17数量增加,从而使烟曲霉的清除率增加[29]。
除了那些免疫功能正常的侵袭性烟曲霉感染动物模型,也有学者对于粒细胞缺乏的IPA患者感染中Th17细胞的作用机制进行了研究。结果显示:在粒细胞缺乏IPA宿主中,Th17细胞型免疫反应起保护作用[30]。经环磷酰胺或氢化可的松腹腔注射,建立免疫缺陷的小鼠动物模型,发现IL-17A和肿瘤坏死因子a水平升高,而IFN-γ并不增加,提示了IL-17A在免疫缺陷鼠炎症过程中的重要角色。国外有研究发现粒细胞缺乏IPA患者经纤维支气管镜肺泡灌洗液和血清中IL-17水平很低,认为烟曲霉并不刺激IL-17的产生,宿主对烟曲霉的防御不依赖于Th17应答,反而烟曲霉调节色氨酸代谢和释放犬尿氨酸,阻止了IL-17的产生和炎症介质的释放[31]。
3.2 Th17细胞在IPA中促进感染作用
然而,与此同时也有大量的研究表明,Th17细胞在烟曲霉感染的发生发展过程中起到促进作用。其机制中主要包含直接作用和间接作用两种,直接作用表现为IL-17在体内外均可以促进烟曲霉生长,间接作用表现为IL-17可通过上调促炎介质、抑制Th1免疫反应或促进Th2免疫反应等机制促进炎症发生发展。
一项研究发现,IL-17A在体内外均可以促进烟曲霉生长,为Th17细胞发挥促感染作用提供了最强有力的理论基础[32]。
此外,Zelante[15]发现在鼠感染曲霉菌或白色念珠菌的实验中,Th17通路细胞因子IL-23、IL-17可能扮演了非保护性角色,增高的Th17应答使小鼠对烟曲霉易感增加。Zelante的研究发现IL-23、IL-17表现了针对Th1应答的负性调节能力,使体外中性粒细胞介导的杀伤作用及体内真菌清除作用受损,考虑其机制可能是IL-23、IL-17抑制了IFN-γ对一种可促进免疫耐受的色氨酸降解酶 (吲哚胺-2,3-加双氧酶)的诱导,加重了真菌感染过程中与Th17细胞活化相关的组织炎症病理损伤[15]。而另一学者在得出相同研究结论后,认为Th17细胞发挥促感染作用的机制在于抑制IFN-γ对吲哚胺2,3-双加氧酶 (Indoleamine 2,3-dioxygenase,IDO)的诱导,使中性粒细胞基质金属蛋白酶9 (Neutrophils matrix metalloproteinases 9,MMP9)和髓过氧化物酶 (Myeloperoxidase,MPO)的产生显著增加,从而加重真菌感染过程中和Th17细胞活化相关的组织炎症病理损伤,对中性粒细胞的炎症程序发挥负性调节作用[33]。此外,IL-23/IL-17还可损伤IDO依赖性中性粒细胞抗炎及抗菌功能。具有免疫活性的IPA小鼠病原菌清除主要是通过巨噬细胞的天然免疫反应,其中凋亡机制可限制宿主炎症损害[30]。另一项慢性真菌感染的实验模型中,发现炎症反应的特点是以嗜酸性粒细胞和Th2细胞相关的细胞因子为主,其水平与IL-17正相关,提示Th17可能在宿主感染曲霉菌的过程中因偏向Th2的应答而变得有害[34]。
国内2014年北京大学第一医院王润超等[35]检测了人21例肺曲霉病患者和19例正常健康人的外周血单个核细胞,结果显示IPA患者CD4+T细胞的比例较之健康对照组明显降低。IPA患者Th1和Treg占CD4+T细胞的比例较之健康人对照组均明显降低,Th17占CD4+T细胞的比例较之健康人对照组均有所升高,Th2占CD4+T细胞的比例较之健康人对照组均无明显变化。IPA患者血清中的IFN-γ、IL-17A以及TGF-β的表达量较之健康人对照组明显降低,而IL-4的表达则在两组之间无明显差异。IL-17A表达未见增强,考虑到Th17型细胞绝对数量较少所致。
综上,考虑IL-17A作为Th17细胞分泌的重要促炎细胞因子,通过上调炎性介质,抑制Th1免疫反应或者促进Th2免疫反应等介质促进炎症的发生发展,在IPA的发病过程中起到促炎作用。
3.3 Th17在IPA中的双向调节作用
综上所述,Th17在烟曲霉的感染中表现出了促感染和抗感染的双向调节作用。那么,究其原因,目前研究倾向于与烟曲霉与感染环境如宿主免疫状态、感染时间、真菌细胞壁的特异成分的相互作用等有关。与真菌清除相关的过度组织免疫损伤需要调节性T细胞对免疫效应的完美调节来避免[36]。
Th17细胞在不同的宿主中,同一宿主的不同时期,甚至在同一宿主同一时期的不同部位中,均面对不同的免疫环境。当Th17细胞在其中识别不同的烟曲霉抗原时,则会表现出不同的免疫表型。从而,这些不同的Th17细胞表型会调控Th17细胞下游的不同信号通路,引起不同的免疫反应。有学者[37]研究发现,自然来源的Th17细胞主要由丝氨酸/苏氨酸激酶Akt途径调控,而肿瘤诱导的Th17细胞发育过程由哺乳动物雷帕霉素靶蛋白2 (mammalian target of rapamycin 2,mTOR2)和人交叉框蛋白 (Forkhead box O1,FOXO)途径调控。因此,不同亚型的Akt对不同来源的Th17细胞起到调控作用,如果删除mTOR2,而不是Akt,可以导致肿瘤诱导的Th17细胞产生障碍。这些结果显示,Th17细胞的发育过程中其调节机制非常精细。因此,当机体内的Th17细胞接触到不同的烟曲霉抗原时,其发育过程由不同的调节途径所调控,因此表现出不同的免疫表型,由此,调控其下游的不同信号通路,引起机体不同的免疫反应。这也可以解释机体感染烟曲霉后的多种临床表现如侵袭性烟曲霉病、过敏性支气管肺曲霉病 (allergic broncho pulmonary aspergillosis,ABPA)或者肺曲霉球病。然而,究竟是何种特异性的烟曲霉抗原会引起何种Th17细胞的免疫表型尚未可知,仍需进一步探索。
4 结语与展望
综上所述,由于目前我们有两个相反方向的证据,因此Th17在肺部侵袭性烟曲霉感染中究竟起到何种作用,尚不能对其进行精准预测。但可以肯定的是,Th17在侵袭性曲霉菌病中的表现,与患者的免疫状态、免疫反应细胞、模式受体的不同而出现差异。但是烟曲霉与宿主之间错综复杂的免疫反应尚不完全清楚。因此我们有必要对其机制进行进一步的深入研究,如果能从中发现生物学标记物如IL-17,就像在HIV患者中检测CD4+细胞技术一样,将能够有利于对侵袭性肺曲霉病患者进行分层,制定更佳的医疗决策,对明确这类患者的预后将起到重要作用。如果能更深入地研究Th17与其他免疫细胞之间的活动规律;了解与之相关的各种细胞因子、趋化因子、转录因子在免疫应答中的交互影响,并观察它们对炎症发展的意义,从而找到趋利避害的方法,将有希望开发靶向Th17的免疫治疗路径,有助于建立个体化治疗方案,为侵袭性曲霉感染的防治提供新思路。
[1] Walsh TJ,Anaissie EJ,Denning DW,et al.Treatment of aspergilosis:clinical practice guideline of the Infection of the Infeciouts Diseases Society of America[J].Clin Infect DIs,2008,46(3):327-360.
[2] Gibbons JG,Rokas A.The function and evolution of the Aspergillus genome[J].Trends Mocrobiol,2013,21(1):14-22.
[3] Kastelein RA,Hunter CA,Cua DJ.Discovery and biology of IL-23 and IL-27:related but functionally distinct regulators of inflammation[J].Annu Rev Immunol,2007,25(25):221-242.
[4] Cua DJ,Sherlock J,Chen Y,et al.Interleukin-23 rather than interleukin-12 is the critical cytokine for antouinnune inflammation of the brain[J].Nature,2003,421(6924):744.
[5] Park H,Li Z,Yang XO,et al.A distinct line age of CD4T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[6] van de Veerdonk FL,Joosten LA,Netea MG.The interplay between inflammasome activation and antifungal host defense[J].Immunol Rev,2015,265(1):172-180.
[7] Wang R,Wan Z,Li R.Th and Treg response induced by Aspergillus fumigates pulsed dendritic cellsinvitro[J].Chin Med J (Engl),2014,127:3616-3622.
[8] Camargo JF,Husain S.Immune correlates of protection in human invasive aspergillosis[J].Clin Infect Dis,2014,59(4):569-577.
[9] Thakur R,Anand R,Tiwari S,et al.Cytokines induce effector T-helper cells during invasive aspergillosis;what we have learned aboutT-helper cells[J]? Front Microbiol,2015,5(429):429-431.
[10] VeldhoenM,Hocking RJ,Ackins CJ,et al.TGF-β in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells[J].Immunity,2006,24(2):179-189.
[11] Betteli E,Carrier Y,Gao W,et al.Reciprocal debelopmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[12] Li MO,Wan YY,Flavell RA.T cell-produced transforming growth factorb1 controls T cell tolerance and regulates Th1 and Th17-cell differentiation[J].Immunity,2007,26(5):579-591.
[13] Korn T,Bettelli E,Gao W,et al.IL-21 initiates an alternative pathway to induce proinflammatory TH17 cells[J].Nature,2007,448(7152):484-487.
[14] Stumhofer JS,Sliver Js,Laurece A,et al.Interleukins27 and 6 induce STAT3-mediated T cell production of interleukin10[J].Nature Immunol,2007,8(12):1363-1371.
[15] Zelante T,AD Luca,P Bonifazi,et al.IL-23 and the Th17 pathway promote inflammation and impair antifungal immune resistance[J].Eur J Immunol,2007,37(10):2695-2706.
[16] Deep GS,Gibbons RS.Interleukins 17 and 23 influence the host response toHistoplamacapsulatum[J].J Infect Dis,2009,200(1):142-151.
[17] Zelante T,Bozza S,De Luca A,et al.Th17 cells in the setting ofAspergillusinfection and pathology[J].Med Mycol,2009,47 (sup 1):S162-169.
[18] Jolink H,de Boer R,Hombrink P,et al.Pulmonary immune responses againstAspergillusfumigatusare characterized by high frequencies of IL-17 producing T-cells[J].J Infect,2017,74(1):81-88.
[19] Delsing CE,Becker KL,Simon A,et al.Th17 cytokine deficiency in patients withAspergillusskull base osteomyelitis[J].BMC Infect Dis,2015,15(1):140.
[20] Rudner XL,Happel KI,Young EA,et al.Interleukin-23 (IL-23)-IL-17 cytokine axis in murinePneumocystiscarinniiinfection[J].Infect Immun,2007,75(6):3055-3061.
[21] Werner JL,Metz AE,Horn D,et al.Requisite role for the dectin-1 beta-glucan receptor in pulmonary defense against Aspergillus fumigatus[J].J Immunol,2009,182(8):4938-4946.
[22] Sainz J,Pérez E,Gómez-Lopera S,et al.IL1 gene cluster polymorphisms and its haplotypes may predict the risk to develop invasive pulmonary aspergillosis and modulate C-reactive protein level[J].J Clin Immunol,2008,28(5):473-485.
[23] Carvalho A,Cunha C,Di Ianni M,et al.Prognostic significance of genetic variants in the IL-23/Th17 pathway for the outcome of T cell-depleted allogeneic stem cell transplantation[J].Bone Marrow Transplant,2010,45(11):1645-1652.
[24] Milner JD,Brenchley JM,Laurence A,et al.Impaired T(H)17 cell differentiation in subjects with autosomal dominant hyper-IgE syndrome[J].Nature,2008,452(7188):773-776.
[25] Sainz J,Lupiáez CB,Segura-Catena J,et al.Dectin-1 and DC-SIGN polymorphisms associated with invasive pulmonary Aspergillosis infection[J].PLoS One,2012,7(2):322-373.
[26] Kaya TI,Eskandari G,Guvenc U,et al.CD4+CD25+ Treg cells in patients with toenail onychomycosis[J].Arch Dermatol Res,2009,301(10):725-729.
[27] Taylor PR,Leal SM Jr,Sun Y,et al.Aspergillus and Fusarium corneal infections are regulated by Th17 cells and IL-17-producing neutrophils[J].J Immunol,2014,192(7):3319-3327.
[28] Conti HR,Shen F,Nayyar N,et al.Th17 cells and IL-17 receptor signaling are essential for mucosal host defense against oral candidiasis[J].J Exp Med,2009,206(2):299-311.
[29] Rivera,A.TM Hohl,N Collins,et al.Dectin-1 diversifies Aspergillus fumigatus-specific T cell responses by inhibiting T helper type 1 CD4T cell differentiation[J].J Exp Med,2011,208(2):369-381.
[30] Armstrong-Jamed DP,Turnbull SA,Teo I,et al.Impaired interferon-gamma responses,increased interleukin-17 expression,and a tumor necrosis factor -alpha transcriptional program in invasive aspergillosis[J].J Infect Dis,2009,200(8):1341-1351.
[31] Chai LY,Van de Veerdonk F,Marijnissen RJ,et al.Anti-Aspergillus human host defence relies on type 1 T helper(Th1),rather than type 17 T helper(Th17),cellular immunity[J].Immunology,2010,130(1):46-54.
[32] Zelante T,Iannitti RG,De Luca A,et al.Sensing of mammalian IL-17A regulates fungal adaptation and virulence[J].Nat Commun,2012,3(2):683-688.
[33] Bozza S,Clavaud C,Giovannini G,et al.Immune sensing ofAspergillusfumigatusproteins,glycolipids,and polysaccharides and the impact on Th immunity and vaccination[J].J Immunol,2009,183(4):2407-2414.
[34] Murdock BJ,Falkowski NR,Shreiner AB,et al.Interleukin-17 drives pulmonary eosinophilia following repeated exposure toAspergillusfumigatusconidia[J].Infect Immun,2012,80(4):1424-1436.
[35] 王润超,万喆,李若瑜.21例侵袭性肺曲霉病患者Th及Treg细胞的检测[J].中国真菌学杂志,2014,9(5):287-292.
[36] Salescampos H,Tonani L,Cardoso C R B,et al.The immune interplay between the host and the pathogen inAspergillusfumigatuslung infection[J].Biomed Res Int,2013,2013 (4):69302-69303.
[37] Kim JS,Sklarz T,Banks LB,et al.Natural and inducible TH17 cells are regulated differently by Akt and mTOR pathways[J].Nat Immunol,2013,14(6):611-618.
R 519.8
B
1673-3827(2017)12-0312-06
国家自然科学基金 (81400003)
耿婉如,女 (蒙古族),博士研究生在读.E-mail:geng-wanru@163.com
童朝晖,E-mail:tongzhh@hotmail.com;贺航咏,E-mail:yonghang2004@sina.com
2017-04-13
[本文编辑] 王 飞

