Mg(OH)2浆液吸收脱碳过程的组分动态分析
何志成,李立清,谢鹏飞,汪椿皓,莫雅绵
Mg(OH)2浆液吸收脱碳过程的组分动态分析
何志成,李立清,谢鹏飞,汪椿皓,莫雅绵
(中南大学能源科学与工程学院,湖南长沙410083)
为了探究Mg(OH)2浆液在鼓泡塔中吸收CO2的过程原理,采用实验和理论计算对Mg(OH)2-CO2-H2O吸收体系进行了组分浓度动态分析。研究结果表明:该吸收过程依据反应产物可分为3个阶段,第一阶段为Mg(OH)2与CO2反应生成Mg(HCO3)2的过程,第二阶段为Mg(OH)2将CO2固定为MgCO3的过程,第三阶段为MgCO3对CO2的吸收过程;随着气相CO2浓度升高,可发现高浓度(体积分数20%~30%)吸收过程会出现第二阶段消失的特殊现象;当CO2分压一定时,第一阶段反应时间长度几乎不随Mg(OH)2浓度而变化,第二阶段和第三阶段反应时间长度则与Mg(OH)2浓度成正比,平衡时生成的MgCO3固体含量与浆液初始浓度成正比;20~50℃,第一阶段反应时间长度与温度成反比,低温区间(20~35℃),第二阶段和第三阶段反应时间长度随温度升高而缩短,高温区间(35~50℃)则相反,35℃左右,吸收达到平衡时间最短。
鼓泡塔;氢氧化镁;二氧化碳;吸收
温室效应对气候变化的不利影响引起全世界的关注[1-2]。富氧燃烧、燃前捕集、燃后捕集是3种主要的CO2捕集技术[3],化学吸收作为燃后捕集技术中最有潜力的方法引起了广泛的研究[4-5]。近年来关于镁基矿物进行CO2的捕集和封存的研究逐渐增多[6-8]。Mg(OH)2具有良好的物理性质,无毒、无气味、不易燃和低腐蚀性,其水溶液能够与CO2进行化学反应,在较低的温度下(65℃),Mg(HCO3)2溶液可以再生出Mg(OH)2[9-11],具有广阔的应用 前景。
目前关于Mg(OH)2浆液脱碳的基础理论研究并不多见,很多相关解释都基于假设,如JUNG[12]、LI[13]和CHENG[9]等根据吸收效率曲线将吸收过程划分为3个阶段(如图1):第一阶段,由于饱和Mg(OH)2浆液中存在的大量OH–,使得CO2的吸收效率处在最高水平,这个阶段的吸收时间很短;第二阶段,由于OH–的消耗,悬浮Mg(OH)2颗粒开始溶解并电离产生新的OH–维持一定的吸收效率,由于Mg(OH)2溶解速度的限制,这个阶段的效率稳定在较高水平;第三阶段,由于前两个阶段大量消耗Mg(OH)2同时生成的MgCO3覆盖于Mg(OH)2颗粒表面,导致Mg(OH)2颗粒与水接触的表面积减少,溶解量降低,吸收效率急剧下降。这是在较低CO2体积分数(4%~16%)情况下的现象,较高CO2浓度的吸收过程需进一步研究。本文作者通过实验模拟和理论计算对Mg(OH)2-CO2-H2O体系吸收过程进行了 研究。
要解释吸收过程机理,必须了解化学反应之间的关系和组分的变化情况,在Mg(OH)2-CO2-H2O体系中,生成物复杂,组分之间互相影响,想要准确检测不同时刻溶液中每一个组分浓度是极大的难题。CHENG[9]通过HCl滴定和元素分析仪分别测定液相和固相中的碳组分,又利用CO2红外分析仪测定气体中C含量,但是对比气-液-固三相测试结果发现,液固相与气相测得的C含量在第5min时的不平衡率就达到10%。低浓度HCO3–和Mg2+在溶液中存在时,它们会形成络合物MgHCO3+[14],络合离子的存在对实际组分浓度测试影响非常大。因此,针对Mg(OH)2-CO2-H2O体系,本研究采用电解质水溶液化学模拟软件OLI Analyzer来模拟吸收过程中不同时刻溶液中的组分浓度。OLI Analyzer内置丰富的数据库,具有强大的功能,广泛用于石油、化工领域,如Aspen、PRO-II等大型化学工艺流程模拟软件中都包含有OLI电解质包[15]。

图1 不同浓度Mg(OH)2浆液脱碳的吸收效率[9]
本文基于Mg(OH)2-CO2-H2O吸收体系内液相组分浓度的动态模拟分析,对以往文献中3个阶段的吸收机理进行了验证并重新定义,同时探究了浆液、CO2浓度与温度等参数对3个阶段吸收特性的影响。本研究有助于进一步完善可再生Mg(OH)2浆液吸收CO2的理论基础,促进Mg(OH)2浆液脱碳工艺的优化设计和推广应用。
1 实验方法
1.1 实验原料
Mg(OH)2,纯度≥98%,分析纯,西陇化工股份有限公司;二氧化碳,纯度≥99.999%,长沙高科气体有限公司;氮气,纯度≥99.999%,长沙高科气体有限公司。
1.2 实验方法
采用恒温鼓泡吸收工艺实验研究Mg(OH)2- CO2-H2O吸收过程(如图2所示)。利用质量流量计调节N2-CO2混合气体比例,模拟配置裂解煤气。利用自制的干燥器(冰盐浴)对进入煤气分析仪前的混合气体进行脱水处理,冷却后的气体返回至恒温水浴槽中加热,经过过滤器后,送入红外煤气分析仪(Gasboard-3100,武汉四方光电科技有限公司)在线测定吸收前后气体CO2成分浓度,吸收始末吸收液的pH由pH计(CT-6023,衢州艾普计量仪器有限公司)测量。吸收效率根据式(1)计算。

图2 吸收实验装置图
1—鼓泡塔;2—质量流量计;3—气体缓冲瓶;4,5—阀门; 6—磁力搅拌器;7—恒温水浴槽;8—干燥器;9—过滤器; 10—在线煤气分析仪;11—数据采集系统

式中,1、2分别表示吸收塔进出口CO2浓度。实验条件汇总见表1。

表1 实验条件
2 结果与讨论
2.1 吸收过程3个阶段的理论基础
CO2-Mg(OH)2-H2O系统包含气-液-固三相物理溶解与连串化学反应,吸收过程表述如式(2)~式(9)。

CO2(g)CO2(aq) (2) Mg(OH)2(s)Mg2++OH–(3) CO2(aq)+H2OH2CO3(4) H2CO3H++HCO3–(5) HCO3–H++CO32–(6) H++OH–H2O(7) Mg2++HCO3–—→MgHCO3+(8) Mg2++CO32–MgCO3(s)(9)
其包括5个传质历程:①CO2从气相主体传递到气液界面[式(2)];②CO2溶解于液膜与水反应并电离[式(4)~式(6)];③Mg(OH)2溶解于液膜并电离[式(3)];④离子从液膜向液相主体扩散;⑤离子在反应界面发生化学反应[式(7)~式(9)]。
pH是表征吸收过程进行程度的直观变量,弄清溶液中主要组分浓度与pH的关系有利于更好地解释吸收过程。在不考虑各组分活度及络合物的影响下,Mg(OH)2吸收CO2过程中式(3)、式(5)~式(8)的平衡常数(25℃)见式(10)~式(14)[16]。

k1=[Mg2+][OH–]2=5.1×10–12(10) k2=[H+][HCO3–]/[H2CO3]=4.2×10–7(11) k3=[H+][CO32–]/[HCO3–]=4.7×10–11(12) kw=[H+][OH–]=1.0×10–14(13) k4=[Mg2+][CO32–]=6.8×10–6(14)
根据式(3)、式(9)和平衡常数1、4的关系,经计算,CO2-Mg(OH)2-H2O吸收体系存在4种可能情况:①初始Mg(OH)2溶液浓度低,反应式(3)未达到或刚达到溶解平衡,此时0≤1.084×10–4mol/L;②初始溶液呈白色浆液状,但反应式(9)过程中MgCO3未达到或刚达到的溶解平衡,整个过程不会有MgCO3固体析出,此时1.084×10–4mol/L<0≤5.544×10–3mol/L;③MgCO3沉淀产生并最终溶解,且MgCO3固体产生在Mg(OH)2溶解完全之前,溶液最后变澄清,此时5.544×10–3mol/L<0≤1.814×10–2mol/L;④MgCO3固体产生且最终固体剩余不能溶解完全,此时0>1.814×10–2mol/L。由于实际中Mg(OH)2浓度一般使用范围大于0.02mol/L,故在本文只对第4种情况分析。溶液中离子主要以Mg2+、HCO3–和CO32–形式存在,见式(15)~式(17)。
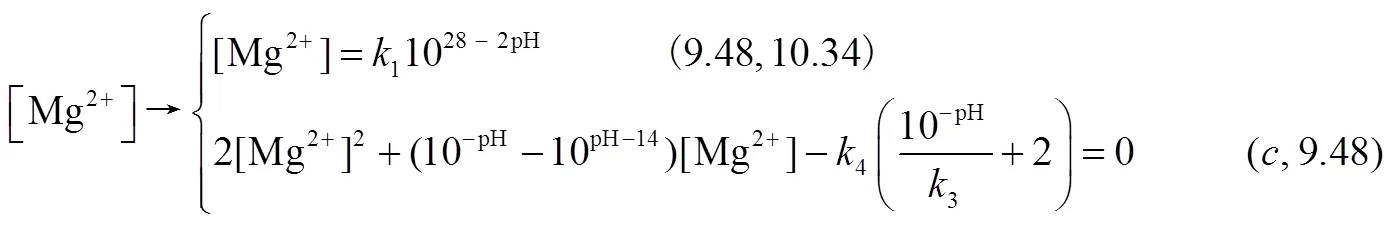


式中,为平衡状态下的pH,根据电荷守恒、物料守恒和沉淀溶解平衡求得=8.35。
用Matlab模拟Mg2+、HCO3–和CO32–的浓度随pH的变化关系,如图3所示。模拟发现,Mg2+、HCO3–和CO32–的浓度随pH的变化,并以pH=9.48为分界点。
pH在9.48~10.34段,Mg(OH)2的消耗导致Mg2+、HCO3–和CO32–均随pH减小而增加。
pH=9.48时出现转折点,这是由于MgCO3的产生导致溶液中组分改变。因为0>0.01814 mol/L,这时仍有Mg(OH)2存在,所以反应式(3)、式(9)需同时保持平衡,[CO32–]/[OH–]2=1.33×106,代入式(11)~式(13)可知,溶液中HCO3–和H+含量不变。所以只要在Mg(OH)2消耗完全前,MgCO3沉淀会持续生成,且溶液中pH和其他组分保持不变。
pH<9.48阶段,Mg(OH)2消耗完全,MgCO3沉淀开始溶解,由式(14)决定了Mg2+的增加会导致CO32–减少,MgCO3溶解使HCO3–和Mg2+增加直到平衡,平衡时溶液的pH=8.35。
溶液中组分浓度随pH变化(由10.34降至8.35)分为3个阶段,表2为实验所测溶液始末的pH,这些值基本在理论计算的pH变化范围内。按照上述分析,吸收过程也应分为3个阶段。
2.2 3个阶段的吸收机理
根据2.1节的理论计算,认为第三阶段吸收效Analyzer软件分析了25℃、15%浓度CO2在率下降的原因应与MgCO3生成有关。利用OLI0.025 mol/L Mg(OH)2浆液中吸收过程的组分浓度变化规律,见图4。LI等[13]和CHENG[9]定义的第一阶段为饱和Mg(OH)2溶液中存在的大量OH–,使得CO2的吸收效率上升至最高水平(pH在0~1min快速下降段),但这个阶段的吸收时间很短。本文作者根据产物(见图4)和吸收效率(见图5)对吸收过程的3个阶段进行了重新定义,并给出了界定方法。

图3 初始浓度C0>1.814×10–2 mol/L时离子浓度随pH变化的关系
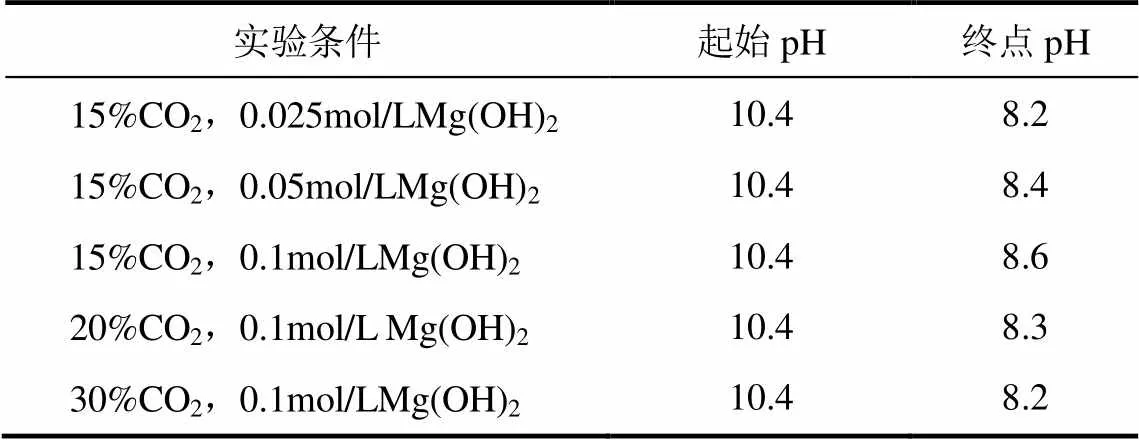
表2 Mg(OH)2浆液脱碳过程始末溶液pH(25℃)

图4 25℃、15%体积分数CO2与0.025mol/L Mg(OH)2反应的吸收液成分变化规律

图5 25℃、15%体积分数CO2与0.025 mol/L Mg(OH)2反应的吸收效率曲线
第一阶段(0~7min,图4,图5),由于饱和Mg(OH)2溶液中存在的大量OH–,与反应5电离出的H+快速中和反应[见反应式(7)],pH(初始值=10.32)在开始段(0~1min)迅速下降,吸收效率上升到至最高水平(图5)。1~7min,OH–的消耗使反应式(3)平衡右移,由于Mg(OH)2溶解速率的限制,溶液pH和效率相对于初始阶段(0~1min)开始稳步下降(见图4,图5),随着反应式(5)和反应式(7)的进行,HCO3–的增多,反应6电离出的CO32–逐渐增多,整个阶段没有MgCO3沉淀生成,浆液吸收的CO2主要以HCO3–形式存在。这个阶段的总反应式近似为式(18)。
Mg(OH)2+CO2—→Mg(HCO3)2(18)
第二阶段(7~16min,图4,图5),Mg(OH)2继续溶解到一定程度,由于pH达到9.54时,第一阶段累积的CO32–和Mg2+离子积大于溶度积常数,MgCO3沉淀生成。但此过程中,溶液里的离子浓度基本稳定(图4),pH(9.54)与理论计算不考虑活度和络合物的计算值9.48接近。在效率图上这个阶段保持在较高水平,形成稳定的缓冲带(图5)。此阶段溶液中的总反应可近似为式(19)。
Mg(OH)2+CO2—→MgCO3+H2O (19)
在这个阶段,Mg(OH)2的溶解速率近似等于生成物MgCO3的生成速率。这个过程的特征是pH稳定较高水平(pH=9.54)(图4),CO2与Mg(OH)2的溶解速率较快,溶液中总离子浓度基本不变,MgCO3开始生成,宏观上被Mg(OH)2吸收的CO2以MgCO3的形式固定。
第三阶段(16min以后,图4,图5),Mg(OH)2消耗完全,CO2继续溶解,MgCO3随着pH的显著下降开始减少,HCO3–含量增加,溶液中Mg2+和HCO3–成为溶液中的主要成分,络合反应式(8)生成的MgHCO3+明显增多(图4)。系统的吸收效率开始显著下降(图5)。
在16~20min这段时间内,因为MgCO3溶解度大(4远大于1),MgHCO3+的生成消耗Mg2+和HCO3–[反应式(8)],CO2持续通入提供H+,反应式(6)左移消耗CO32–,使反应式(9)左移,MgCO3沉淀颗粒溶解,这个阶段的pH和吸收效率仍保持较高水平(图4,图5)。
反应进行到20min以后,因为Mg2+持续增加和CO32–含量减少至极微量水平,MgCO3沉淀溶解速率降低,这个阶段pH和吸收效率迅速下降(图4,图5)。
反应进行到30min时,MgCO3降解完全,化学反应接近平衡,效率最低(图5),离子浓度和pH达到平衡(图4),平衡pH(8.5)与2.1节不考虑活度和络合物的计算值8.35接近。此时,溶液中主要成分为HCO3–,Mg2+及其络合物MgHCO3+(图4)。第三阶段总反应式近似为式(20)。
MgCO3+CO2+H2O—→Mg(HCO3)2(20)
3个阶段以MgCO3开始沉淀、MgCO3开始溶解[Mg(OH)2消耗完全]作为分界点。吸收过程机理见图6。
2.3 3个阶段在CO2浓度影响下的变化特性
以往文献(JUNG[17]、LI等[13]和CHENG[9])研究了低体积分数CO2(4%~16%)对Mg(OH)2浆液脱碳系统的吸收性能的影响,为了探究高浓度与低浓度CO2吸收过程存在的差异,本实验对体积分数5%~30%的CO2与0.05mol/L Mg(OH)2浆液反应进行了研究。从图7中发现,低体积分数(5%~15%)范围的CO2浓度与第二阶段时间长度成反比,而高体积分数(20%~30%)范围内出现第二阶段消失的特殊现象。这是因为CO2分压越大,气相侧传质驱动力和气相传质系数更强,溶解C的增多提供大量的H+,反应式(6)平衡右移,消耗更多OH–,促进Mg(OH)2溶解,单位时间Mg(OH)2与CO2反应的量增多,反应达到平衡的时间越短。当CO2体积分数超过20%时,Mg(OH)2在第一阶段pH未达到9.54就消耗完毕(见图4),于是出现第二阶段消失的情况。

图7 5%~30%范围的CO2与0.05mol/L Mg(OH)2浆液反应的吸收效率
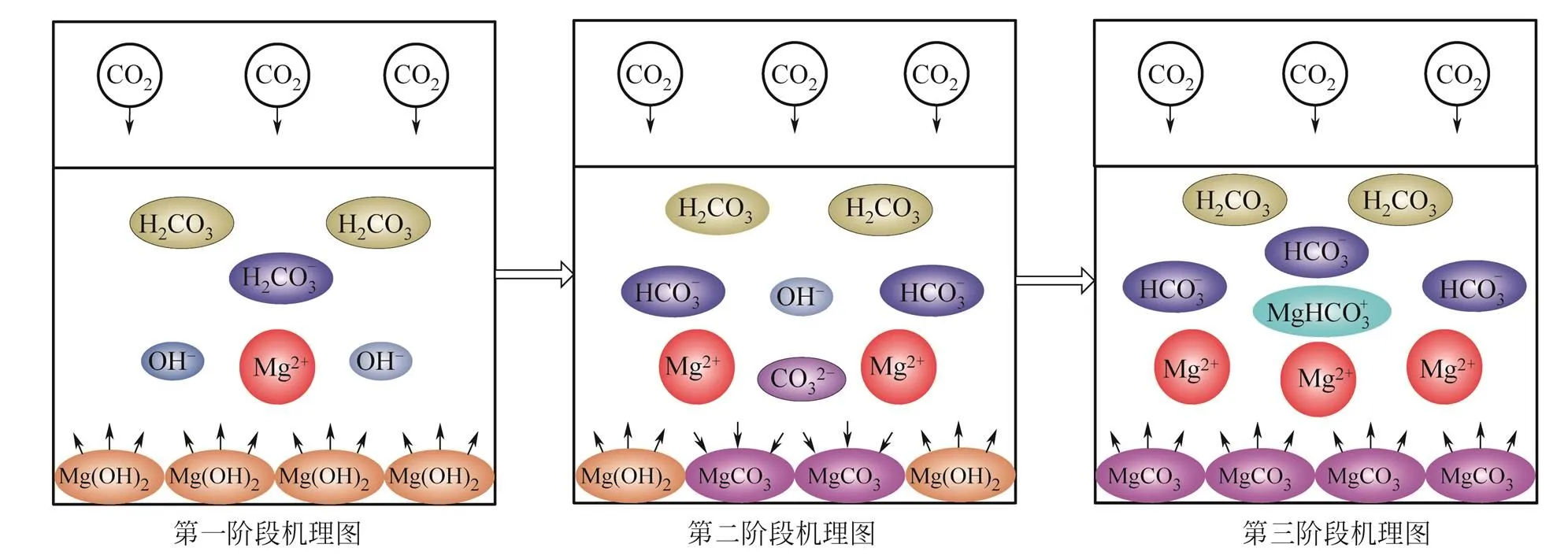
图6 Mg(OH)2浆液脱碳吸收过程机理图
2.4 3个阶段在Mg(OH)2浓度影响下的变化特性
为探讨不同浓度Mg(OH)2吸收CO2的影响,进行了体积分数15%的CO2分别与0.025mol/L、0.05mol/L、0.1mol/L的Mg(OH)2在25℃下的吸收试验。图8(a)为通过对吸收曲线积分获得不同时刻总溶解C含量,利用OLI Analyzer软件对实验条件下的反应溶液进行模拟,得到不同时刻吸收溶液中组分浓度关系。从图8中看出,3个阶段中能看到Mg(OH)2浓度对几种主要组分浓度及pH均有影响。
在CO2分压一定的情况下,第一阶段组分浓度变化情况几乎不随Mg(OH)2浓度而变化,因为CO2分压一定,足量Mg(OH)2溶解速率相同,溶液中组分浓度、pH变化趋势一致,所以第一阶段在3种浓度下没有变化。
第二阶段和第三阶段的反应时间长度与Mg(OH)2浓度成正比。由于第一阶段累积的CO32–和Mg2+离子积开始大于溶度积常数,MgCO3沉淀生成,在CO2分压一定的条件下,3种浓度下的反应速率近似相等,由式(19)看出,反应时间取决于Mg(OH)2浓度,所以第二阶段时间随浓度增加而变长,生成的MgCO3沉淀也越多。第三阶段进行的总反应为式(20),随着MgCO3沉淀的溶解,CO32–含量降低,Mg2+含量增加(见图4),而溶液中CO32–浓度(20%~30%)范围内出现第二阶段消失的特殊现象。这是因为CO2分压越大,气相侧传质驱动力和气相传质系数更强,溶解C的增多提供大量的H+,不可能无限减少,当CO32–的减少与Mg2+增加后的离子积小于溶度积常数,即MgCO3沉淀不会继续溶解,吸收达到平衡,第三阶段结束。从图8(b)中发现,平衡溶液中的MgCO3沉淀量与Mg(OH)2浓度成正比。

图8 Mg(OH)2浆液浓度对脱碳过程的影响
从模拟结果看出,MgCO3+络合离子随时间增多并大量存在与溶液中[图8(f)],这是在实际中对测试结果产生偏差的重要原因。
理论上最佳吸收条件应使第三阶段结束时仅有极微量MgCO3固体沉淀产物,吸收的C全部存在于液相中,0.025mol/L Mg(OH)2浆液吸收的CO2没有MgCO3沉淀产生,而0.05mol/L Mg(OH)2浆液吸收的CO2大部分存在于液相中,有利于再生操 作[10]。考虑到0.05mol/L Mg(OH)2浆液吸收的CO2也较多,所以建议本操作条件下,最佳Mg(OH)2浆液浓度为0.025~0.05mol/L。
2.5 3个阶段在温度影响下的变化特性
为了探讨温度对与Mg(OH)2浆液吸收CO2的影响,实验讨论了体积分数30%的CO2气体分别在20℃、35℃、50℃温度下被0.1mol/L Mg(OH)2溶液吸收规律。
根据双膜理论,CO2-Mg(OH)2-H2O系统中的反应过程可描述为:CO2溶解并电离出H+和CO32–;Mg(OH)2溶解并电离出Mg2+和OH–;当离子在液膜扩散接触时,反应发生。反应速率由CO2和OH–的在液膜中的扩散速率决定。在本实验温度范围内,CO2在水中的溶解度随温度升高而减少[18],而Mg(OH)2溶解度随温度升高而增加[19],MgCO3溶度积随温度升高而减少。温度越高,有利于化学反应加快进行,但不利于气体溶解。
从图9可以看到,20~50℃时第一阶段反应时间长度与温度成反比。这可以解释为,第一阶段,总反应式(18)主要受Mg(OH)2溶解、离子扩散和化学反应速率控制,高温有利于反应朝右进行。低温区间(20~35℃),第二阶段和第三阶段随温度升高而缩短,高温区间(35~50℃)则相反。这可以解释为在第二阶段与第三阶段,反应式(19)、反应式(20)受CO2、Mg(OH)2溶解传质扩散以及化学反应速率综合控制。在较低温度区间内(20~35℃),温度升高,导致的化学反应速率升高、MgCO3溶解度增加以及Mg(OH)2溶解、扩散速度的加快,都决定了Mg(OH)2-CO2-H2O系统吸收速率的提高。但在较高温度区间内(35~50℃),温度升高导致了CO2溶解度降低,这个因素成为控制步骤,从而决定了Mg(OH)2-CO2-H2O系统吸收速率下降。本实验研究发现:在35℃条件下,CO2、Mg(OH)2溶解传质扩散以及化学反应速率综合处在较佳水平,因此,35℃左右吸收达到平衡的时间也最短。

图9 温度对Mg(OH)2浆液脱碳过程的影响
3 结论
(1)Mg(OH)2-CO2-H2O系统吸收体系依据吸收过程pH的变化可分为3个阶段:pH>9.48时为Mg(OH)2溶解生成HCO3–和Mg2+等离子的过程,pH=9.48时为Mg(OH)2固体溶解阶段,MgCO3固体生成的阶段,8.35≤pH<9.48为MgCO3固体的溶解阶段,而且从化学反应角度可以认定,第一阶段主要为Mg(OH)2与CO2反应生成Mg(HCO3)2的过程,第二阶段主要为Mg(OH)2将CO2固定为MgCO3,第三阶段主要为MgCO3吸收CO2生成Mg(HCO3)2。
(2)高体积分数CO2(20%~30%)的Mg(OH)2-CO2-H2O吸收体系会出现第二阶段消失的特殊现象,溶液中直接生成Mg(HCO3)2。
(3)当CO2分压不变时,Mg(OH)2-CO2-H2O吸收体系第一阶段时间几乎不随Mg(OH)2浓度而变化,第二阶段和第三阶段的时间与Mg(OH)2浓度成正比。Mg(OH)2浆液初始浓度在0.025~0.05mol/L 的条件下,Mg(OH)2-CO2-H2O吸收体系在第三阶段结束时仅有极微量MgCO3固体产物,最有利于吸收体系的再生操作。
(4)本实验操作条件下,温度35℃左右,Mg(OH)2-CO2-H2O吸收体系达到平衡的时间最短,CO2和Mg(OH)2溶解、扩散传质以及化学反应速率综合处在较佳水平。
[1] 严密,王同涛,李嫣. 典型核电国家温室气体排放现状[J]. 化工进展,2015,34(9):3256-3261.
YAN M,WANG T T,LI Y.Greenhouse gas emission in typical nuclear power countries[J]. Chemical Industry and Engineering Progress,2015,34(9):3256-3261.
[2] AMREI S M H H,MEMARDOOST S,DEHKORDI A M. Comprehensive modeling and CFD simulation of absorption of CO2and H2S by MEA solution in hollow fiber membrane reactors[J]. AIChE Journal,2014,60(2):657-672.
[3] BOUILLON P A,HENNES S,MAHIEUX C. ECO2: Post-combustion or oxyfuel–a comparison between coal power plants with integrated CO2capture[J]. Energy Procedia,2009,1(1):4015-4022.
[4] 贺清尧,蔡凯,晏水平,等. 有机胺基氨基酸盐混合吸收剂对沼气中CO2的分离特性[J]. 化工进展,2015,34(3):857-862.
HE Q Y,CAI K,YAN S P,et al. Performance of CO2removal from biogas by using amine-based amino acid salts blended absorbents[J]. Chemical Industry and Engineering Progress,2015,34(3):857-862.
[5] 冷浩,高建民,张宇,等. 强化结晶氨法脱碳实验研究[J]. 化工学报,2016,67(6):2440-2448.
LENG H,GAO J M,ZHANG Y,et al. Carbon capture by ammonia with reinforced crystallization[J]. CIESC Journal,2016,67(6):2440-2448.
[6] NDUAGU E. Production of Mg(OH)2from Mg-silicate rock for CO2mineral sequestration[J]. Nuclear Instruments & Methods in Physics Research,2012,291: 22-28.
[7] SANNA A,WANG X L,LACINSKA A,et al. Enhancing Mg extraction from lizardite-rich serpentine for CO2mineral sequestration[J]. Minerals Engineering,2013,49(8):135-144.
[8] FRICKER K J,PARK A H A. Effect of H2O on Mg(OH)2carbonation pathways for combined CO2capture and storage[J]. Chemical Engineering Science,2013,100(2):332-341.
[9] CHENG L. CO2separation from coal-fired power plants by regenerable Mg(OH)2solutions[D]. Cincinnati:University of Cincinnati,2013.
[10] BHARADWAJ H K. CO2separation using regenerable Magnesium solutions dissolution,kinectics and VLSE studies[D]. Cincinnati:University of Cincinnati,2012.
[11] LI T Y. The study of CO2removal in slurries with Mg(OH)2suspended particles and the regeneration of products[D]. Cincinnati:University of Cincinnati,2015.
[12] JUNG K S,KEENER T C,KHANG S J,et al. A technical and economic evaluation of CO2separation from power plant flue gases with reclaimed Mg(OH)2[J]. Clean Technologies and Environmental Policy,2004,6(3):201-212.
[13] LI T Y,KEENER T C,CHENG L. Carbon dioxide removal by using Mg(OH)2in a bubble column:effects of various operating parameters[J]. International Journal of Greenhouse Gas Control,2014,31(31):67-76.
[14] TANG J W,JOHANNESSON K H. Rare earth element concentrations,speciation,and fractionation along groundwater flow paths:the Carrizo sand (Texas) and upper Floridan aquifers[M]//Rare Earth Elements in Groundwater Flow Systems. Netherland:Spring Printed,2005:223-251.
[15] SURHONE L MTENNOE M T,HENSSONOW S F,et al. OLI analyzer[M].Germany:Betascript Publishing,2010.
[16] 周同惠,汪尔康,陆婉珍. 分析化学手册[M]. 2版.北京:化学工业出版社,1999:106.
ZHOU T H,WANG E K,LU W Z. Handbook of analytical chemistry[M]. 2nd ed. Beijing:Chemical Industry Press,1999:106.
[17] JUNG K S. CO2separation and regeneration study from power plant flue gases with reclaimed Mg(OH)2[D]. Cincinnati:University of Cincinnati,2005.
[18] CROVETTO R. Evaluation of solubility data of the system CO2–H2O from 273K to the critical point of water[J]. Journal of Physical & Chemical Reference Data,1991,20(3):575-589.
[19] BHARADWAJ H K,LEE J Y,LI X,et al. Dissolution kinetics of magnesium hydroxide for CO2separation from coal-fired power plants[J]. Journal of Hazardous Materials,2013,250/251C(8):292-297.
Dynamic analysis of the main components of the absorption process of capturing CO2with Mg(OH)2slurry
HE Zhicheng,LI Liqing,XIE Pengfei,WANG Chunhao,MO Yamian
(School of Energy Science and Engineering,Central South University,Changsha 410083,Hunan,China)
In order to explore the principle of CO2capturing by Mg(OH)2slurry in bubble column,experiments and theoretical simulation were selected to analyze the component concentration dynamic variation in Mg(OH)2-CO2-H2O system.The research revealed that there are three stages on the basis of the reaction products in absorption process, namely, CO2reacting with dissolved Mg(OH)2in the slurry to generate Mg(HCO3)2in the first stage, Mg(OH)2particles continueously dissolving and being carbonized into MgCO3in the second stage,CO2being captured by MgCO3in the third stage. With CO2concentration enrichment,the second stage disappeares in high CO2concentration(volume fraction is 20%—30%)absorption process. When CO2partial pressure is constant,reaction time of the first stage almost has noting to do with Mg(OH)2concentrtion,reaction time of the second and third stage and MgCO3solid content at quilibrium are proportional to Mg(OH)2concentrtion. Reaction time of the first stage varies inversely to temperature(20—50℃). Reaction time of the second and third stage are shortened with temperature increasing at low temperature zone(20—35℃),while it is exactly the opposite at high temperature zone(35—50℃). The shortest time it took to reach the quilibrium state occurs around 35℃.
bubble column;magnesium hydroxide;carbon dioxide;absorption
X131.1
A
1000–6613(2017)12–4664–08
10.16085/j.issn.1000-6613.2017-0586
2017-04-05;
2017-04-27。
国家科技支撑计划(2015BAL04B02)及国家自然科学基金(20376154)项目。
何志成(1992—),男,硕士研究生,主要从事空气污染控制技术研究。
李立清,教授,博士生导师,研究方向为空气污染控制技术。E-mail:liqingli@csu.edu.cn。

