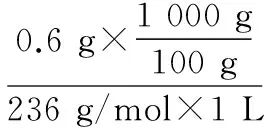核心素养下电解质溶液图象问题大扫描
刘树领 江苏 李小君
山东
核心素养下电解质溶液图象问题大扫描
刘树领 江苏 李小君

图象题就是以图象为载体来设计问题的一类试题,因其承载着较多的信息量、知识点,使得问题设计灵活而巧妙,并且能较好地考查识图读图能力、灵活运用图中隐含信息与所学知识解答具体问题的能力,也正好体现出证据推理与模型认知、宏观辨识与微观探析、变化观念与平衡思想等化学核心素养所要求的内容,因而图象题逐渐成为命题的主流。由于需要借助数学知识来分析图象信息,使得图象题成为难度较大、区分度较高的试题类型之一。
1.pH(或pOH)-体积的变化曲线
该类图象题主要表示向某溶液中倒入或滴加另一溶液时,混合溶液的pH(或pOH)随着混合溶液体积增大而发生变化的曲线,多以电解质溶液的加水稀释、酸碱中和滴定、多元弱酸盐与酸反应、铵盐与碱反应等设计题材,图象既可以是单曲线变化也有多曲线变化。解决问题的关键在于分析曲线的起点、恰好完全反应点、pH=7时对应的溶液组成,进而运用“两弱三守恒”来分析具体问题。“两弱”是指弱电解质的电离、盐类的水解程度一般都较弱;“三守恒”是指电荷守恒(等式中无分子式)、物料守恒(等式中无氢离子与氢氧根离子)、质子守恒(等式中无金属阳离子或铵根离子)。
例1:常温下,用0.1 mol/L NaOH溶液分别滴定20.00 mL 浓度均为0.1 mol/L CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
( )
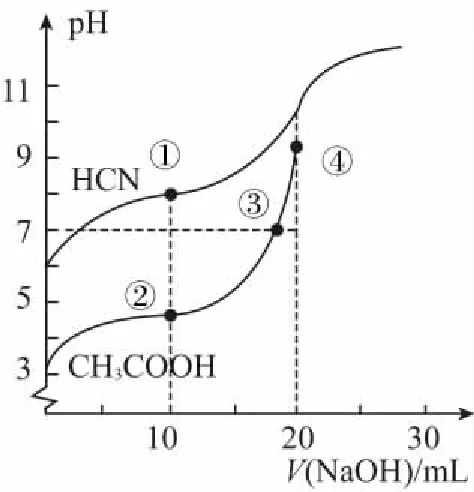
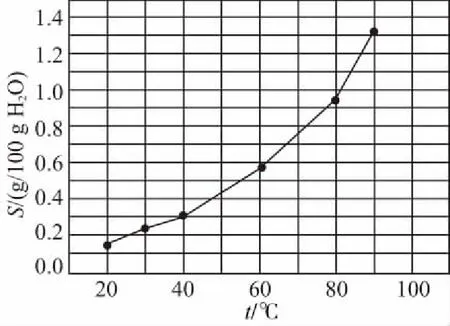
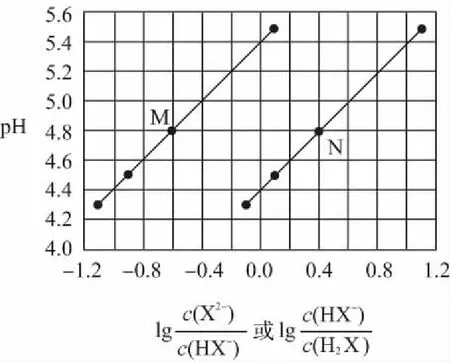
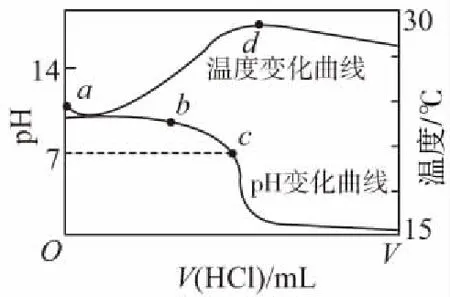
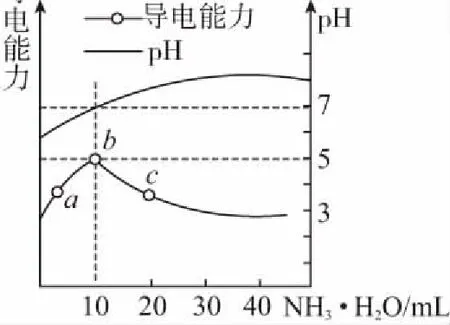
A.点①和点②所示溶液中:c(CH3COO-) B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) 【评析】本题属于双曲线图象题,由两个独立的酸碱中和滴定曲线组合而成,主要考查一元弱酸的电离平衡规律、一元弱酸的强弱判断、盐类水解规律及三大守恒关系。①中溶质为等量的NaCN和HCN,②中溶质为等量的CH3COONa和CH3COOH。由图象可知点①显碱性(NaCN水解大于HCN电离),点②显酸性(CH3COOH电离大于CH3COONa水解),故c(CH3COO-)>c(CN-),所以A错。点③pH=7,由电荷守恒可得c(Na+)=c(CH3COO-)>c(H+)=c(OH-),而④中恰好生成CH3COONa,溶液中存在c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错。点①和点②由物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+)、c(CN-)+c(HCN)=2c(Na+),将两式相减可得c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故C正确。点②和点③所示溶液中都存在电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),且c(Na+)>c(CH3COOH),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),所以D不正确。 【答案】C 微粒的分布分数是指酸碱以各种形式存在的平衡浓度与其分析浓度的比值,也是各型体在总浓度中所占分数,又称分布系数,与其总浓度(或分析浓度)无关,各种型体的分布系数之和为1。分布系数曲线是指溶液中溶质(或微粒)的百分含量随溶液pH变化而变化的曲线图象,隐含着微粒之间的系列转化关系,常常会出现多条曲线及曲线相交现象。解题关键是理清溶质与酸或碱反应的先后顺序,进而确定曲线的对应关系。 ( ) A.pH=1.2时,c(H2A)=c(HA-) B.lg[K2(H2A)]=-4.2 C.pH=2.7时,c(HA-)>c(H2A)=c(A2-) D.pH=4.2时,c(HA-)=c(A2-)=c(H+) 例3水的电离平衡曲线如图所示,下列说法中不正确的是 ( ) A.图中五点的Kw间的关系为B>C>A=D=E B.若从A点到D点,可采用恒温条件下,在水中加入少量的醋酸,提高溶液酸性 C.若从A点到C点,可采用恒温条件下,在水中加入少量的醋酸铵,促进水的电离 D.100℃时,将pH=2的硫酸与0.01 mol/L的KOH溶液等体积混合后,溶液中c(H+)=c(OH-)=10-6mol/L 【评析】本题是两条水的离子积变化曲线图象题,考查的知识点有水的电离平衡影响因素(酸和盐的影响)、水的离子积常数Kw和pH的计算以及溶液酸碱性的判断。利用A点和B点可以计算出25℃曲线上的Kw=10-14、100℃曲线上的Kw=10-12。同一曲线上点的Kw是相等的,从A点到B点,水的电离是吸热的,T升高,Kw也增大,故则有Kw大小关系为B>C>A=D=E,故A正确。从A点到D点,c(H+)增大,c(OH-)减小,且c(H+)>c(OH-),溶液呈酸性,但由于温度不变,Kw不会改变。所以加入醋酸后,可以满足从A点到D点的转移,故B正确。从A点到C点,c(H+)和c(OH-)均增大,Kw增大,所以温度应升高。故不可能在恒温条件下操作,所以C错误。由图可知100℃时水的离子积常数Kw=10-12,pH=2的硫酸与0.01 mol/L的KOH溶液等体积混合后恰好完全反应生成K2SO4,溶液呈中性,故c(H+)=c(OH-)=10-6mol/L,pH=6,故D正确。 【答案】C 例4常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是 ( ) A.Ka2(H2X)的数量级为10-6 C.NaHX溶液中c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) 【答案】D 该类图象基于任何化学反应中一定伴随着能量变化为基础,描述电解质溶液之间混合时出现的温度随溶液体积变化而发生变化的关系,常以酸碱中和反应为素材来设计问题,解题的关键在于理解温度曲线的最高点所表示的含义,即恰好完全反应,进而解答相关问题。 例5室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是 ( ) A.a点由水电离出的c(H+)=1×10-14mol·L-1 D.d点后,温度略下降的主要原因是NH3·H2O电离吸热 【答案】C 电解质溶液是通过自由移动的离子来实现导电的,其导电能力的强弱主要取决于离子浓度的大小,导电能力的大小常通过电导率来表示,因而就出现了溶液导电能力随溶液体积(或浓度)变化而变化的曲线。解题的关键是找出导电曲线上的最高点,进而分析溶液的组成。 例6常温下,向10 mL 0.1 mol/L的HR溶液中逐渐滴入0.1 mol/L的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是 ( ) A.a~b点导电能力增强,说明HR为弱酸 B.b点溶液,c(NH3·H2O)=c(R-)+c(H+)-c(OH-) D.常温下,HR和NH3·H2O的电离平衡常数相等 【答案】B 该类图象题出现得较少,也比较简单,实质上就是沉淀溶解平衡曲线。解答时只要抓住溶解度的含义,即可知溶解度曲线上的任一点均达到饱和状态,对应的溶剂为100 g。 例7溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是 ( ) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速率加快 C.60℃时溴酸银的Ksp约等于6×10-4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 【答案】A 山东省北镇中学,江苏省前黄高级中学)2.微粒分布分数(或系数)-pH(或pOH)的变化曲线
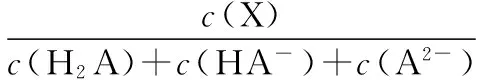


3.浓度-浓度的变化曲线
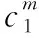

4.对数的变化曲线
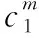

5.温度-体积变化曲线


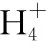
6.导电能力(或电导率)-体积(或浓度)变化曲线
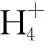

7.溶解度-温度变化曲线