产热脂肪对代谢性疾病的治疗潜能
黄海艳 汤其群
(1复旦大学基础医学院生物化学与分子生物学系 上海 200032; 2复旦大学代谢分子医学教育部重点实验室 上海 200032)

专家简介汤其群,1966年出生,江苏建湖人,长江学者特聘教授,国家杰青,973首席科学家。
1990年毕业于上海医科大学法医学系,1995年获得上海医科大学生物化学与分子生物学博士学位,同年赴美国Johns Hopkins大学医学院生物化学系做博士后。2002年受聘为Johns Hopkins大学医学院儿科内分泌系助理教授兼生化系助理教授。2005年6月辞去美国的职位,全职受聘于复旦大学。现任复旦大学基础医学院院长,生物医学研究院副院长,代谢分子医学教育部重点实验室主任,中国生物化学与分子生物学学会副理事长,代谢专业委员会主任委员,JBiolChem杂志副主编。
主要研究方向为脂肪细胞发育分化的机制和肥胖的成因,以及有效地控制肥胖的方法。在ProcNatlAcadSciUSA,GenesDev,MolCellBiol,MolCellProteomics,JBiolChem等SCI杂志上发表论文60余篇。曾获上海市科技进步一等奖,卫生部科技进步一等奖、国家科技进步二等奖,“霍英东优秀青年教师”一等奖(生物类)和谈家桢生命科学创新奖。
上海医学院创建90周年寄语完善学科体系,创建世界一流医学学科。
产热脂肪对代谢性疾病的治疗潜能
黄海艳1,2汤其群1,2△
(1复旦大学基础医学院生物化学与分子生物学系 上海 200032;2复旦大学代谢分子医学教育部重点实验室 上海 200032)
脂肪组织对全身能量稳态的调节发挥重要作用。人体有3种脂肪组织:白色脂肪(white adipose tissue,WAT),棕色脂肪(brown adipose tissue,BAT)和米色脂肪(beige adipose tissue)。棕色脂肪和米色脂肪通过产热消耗能量,二者并称为产热性脂肪组织。本文将对产热脂肪的调控加以介绍并讨论其对代谢性疾病的治疗潜能,同时也把本课题组在相关领域的贡献加以介绍。
产热脂肪; 能量代谢; 肥胖; 代谢疾病
脂肪组织的分类脂肪组织的功能对于代谢健康起着举足轻重的作用,脂肪组织在肥胖的发生和进展过程中处于核心位置。目前已知人体存在3种脂肪组织:白色脂肪(white adipose tissue,WAT),棕色脂肪(brown adipose tissue,BAT)和米色脂肪(beige adipose tissue)。白色脂肪组织以三酰甘油的形式储存能量及为饥饿时提供能源,同时能以内分泌、旁分泌、自分泌的方式分泌脂肪因子,参与调节机体稳态[1-5]。棕色脂肪组织的主要功能是消耗能量和产热。多种哺乳动物在成年后体内仍保留一定量的棕色脂肪组织,以更好地适应低温胁迫[6]。人在婴儿期,棕色脂肪主要分布在肾周和背部,随着年龄的增长,棕色脂肪发生退化。成人棕色脂肪存在于颈部、锁骨上部和脊柱旁侧[7-11]。棕色脂肪的产热通过交感神经系统作用于棕色脂肪细胞上的β3肾上腺素能受体,并最终由解偶联蛋白1 (uncoupling protein,UCP1)完成。在白色脂肪和肌肉中存在诱导性棕色脂肪(inducible BAT),也被称为米色脂肪(beige fat)[12-16]。米色脂肪细胞通常低表达UCP1,在某些因素诱导下UCP1高水平表达[17-19],进而消耗能量、产热,其产热效率与经典棕色脂肪细胞几乎一样[15-16,18],这个过程称为米色化(beiging)。米色脂肪和棕色脂肪虽然所处部位不同,发育来源不同,但行使相同的产热功能,并在消耗能量方面有同样的潜力,二者并称为产热性脂肪组织[20]。产热性脂肪组织的分化发育、功能调节和临床应用都是近几年代谢领域的研究热点。在生理条件下,有两种激活产热性脂肪组织的情况:冷暴露和饮食摄入(尤其是高热量的食物)。在冷暴露时,产热性脂肪组织激活,起到保持体温恒定的作用;饮食摄入时,产热脂肪活化,缓解一过性能量高峰,从而维持代谢稳态[21]。
产热脂肪组织的激活
产热脂肪组织的来源 在啮齿类,两种产热脂肪细胞起源于不同前体细胞[16,22-25],经典的棕色脂肪细胞起源于来源myf5+的肌节前体细胞[22,25-26],与肌肉细胞相似,而米色脂肪细胞既可以起源于myf5+的细胞,也可以起源于myf5-的细胞[16,24,26]。最新研究结果显示人的米色脂肪起源于脂肪组织血管网络,体外实验显示脂肪组织块发育而来的微血管可以在促血管生成因子(vascular endothelial growth factor,VEGF)和人成纤维细胞生长因子(fibroblast growth factor B,hFGF-B)作用下发育成产热的脂肪细胞[27]。 这些研究提示在人脂肪组织的毛细血管网存在可发育成米色脂肪细胞的前体细胞[15,28-29]。
产热脂肪组织活化的诱导因素 棕色和米色脂肪的发育和产热功能受到多种因素的触发和调节,例如冷暴露、运动、利钠肽(natriuretic peptides)、格列酮类(thiazolidinediones,TZDs)、甲状腺激素、骨形成蛋白7(bone morphogenetic protein 7,Bmp7)、骨形成蛋白8B (bone morphogenetic protein 8b,Bmp8b)、irisin、orexin和成纤维细胞生长因子21(fibroblast growth factor 21,Fgf21)[23,30-31]等。本实验室一直研究BMP4对脂肪细胞发育和代谢的调节作用。我们发现BMP4主要通过激活Smad信号通路诱导多潜能C3H10T1/2细胞向前脂肪细胞定向,p38/MAPK信号通路也参与部分作用,赖氨酰氧化酶(lysyl oxidase,LOX)对该过程非常重要[32]。进一步研究显示,BMP4通过激活p38/MAPK信号通路激活ATF2及下游PGC1α调节脂肪细胞代谢和米色化[33]。具体表现在:脂肪组织特异性过表达BMP4后脂肪细胞内脂滴变小,线粒体新生增加,Ucp1增加。BMP4转基因小鼠代谢有所改善,胰岛素敏感性增加,能抵御由高脂饮食诱导的肥胖和血脂升高[33]。在前脂肪细胞3T3-L1分化过程中加入BMP4,也可使细胞获得米色脂肪细胞的表型。BMP4这种新功能的阐明可为临床干预肥胖和改善胰岛素敏感性提供新思路。另外,在诱导米色脂肪的新生过程中,BMP4促进血管的生成,也下调血管周细胞内PDGFRβ的蛋白水平,从而促进干细胞的成脂分化[34],BMP4协调的两种作用最终使皮下脂肪组织中米色脂肪细胞募集增加,代谢功能增强 (图1)。
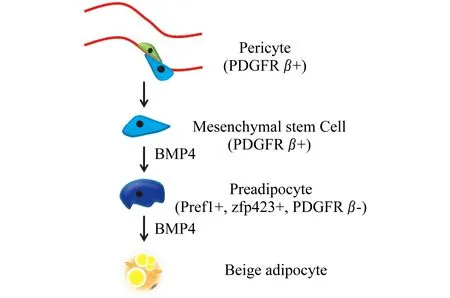
BMP4 stimulates proliferation of stem cells,which exist around the vascular expressing PDGFRβ,as well as adipogenic differentiation and further beiging.
图1BMP4在脂肪细胞招募及米色化中的作用
Fig1TheroleofBMP4inadipocyterecruitmentandbeiging
产热脂肪组织的发育调控 产热脂肪组织消耗能量和产热是通过Ucp1完成的。Ucp1是棕色及米色脂肪细胞线粒体内膜的一种易化的质子通道,质子通过该通道回流,从而破坏呼吸链电子传递过程中所建立的跨内膜的质子电化学梯度,不能驱动ATP合酶合成ATP,而电化学梯度储存的能量以热能形式释放,用于维持体温。Ucp1的表达主要在转录水平进行调节。在Ucp1基因5′侧翼序列含有近端调节区域和远端增强子区域。近端调节区域含有C/EBP调节位点和cAMP调节元件(CRE,cAMP response element)[35-36]。远端增强子区域含有另外2个cAMP (cyclic adenosine monophosphate)调节元件和复杂的核受体结合位点组合,如PPAR (peroxisome proliferator-activated receptor)激活剂、维甲酸类及甲状腺激素等的结合位点[37-39]。调控产热脂肪发育的主要调控因子是PRDM16 (PRD1-BF1-RIZ1 homologous domain containing 16)[40]和过氧化物酶体增生物激活受体γ共激活因子1α (PPARγ-co-activator-1α,PGC-1α)[41-42]。许多诱导棕色脂肪细胞发育的因素也能诱导米色脂肪细胞的形成,例如β3肾上腺素能受体激动剂,PPAR激动剂、维甲酸、FGF21等,另外BMP家族的某些成员、饮食及运动等都能诱导米色脂肪的形成,具体调控机制我们在《新生物学年鉴2014》[43]中有详细描述。以下重点介绍巨噬细胞对米色脂肪细胞的调控,我们课题组在其中做了大量工作。
巨噬细胞调节米色脂肪细胞功能 巨噬细胞具有抗炎性和致炎性两种不同的状态:抗炎性巨噬细胞是M2型巨噬细胞或者替代激活巨噬细胞(Alternative activated macrophage,AAM);而炎性巨噬细胞又被称为M1型巨噬细胞,或者经典激活巨噬细胞(classical activated macrophage,CAM)[44]。正常情况下,M2型巨噬细胞(AAMs)是构成机体脂肪组织中常驻巨噬细胞的主要成分,分泌抗炎因子IL-10,参与维持脂肪组织内的代谢平衡;相反,肥胖状态下体内状态倾向对M1型巨噬细胞(CAMs)的募集。值得注意的是,肥胖并没有使脂肪组织内的M2型巨噬细胞数目减少,有可能数目还会增加,但是M1/M2的比例发生了明显改变使得机体处于促炎阶段[45]。有研究发现冷暴露时脂肪细胞,或者锻炼后的肌细胞可以分泌一种多肽Metrnl,激活嗜酸性粒细胞,后者通过分泌IL4激活M2巨噬细胞[46],M2巨噬细胞可以分泌包括去甲肾上腺素在内的儿茶酚胺,通过激活β3肾上腺素能受体(β3AR),促进WAT中脂肪细胞的脂解、线粒体的新生以及上调产热基因PGC1α和UCP1的表达[47-50]。有研究发现FGF21通过自分泌作用于脂肪细胞促进CCL11的表达和分泌,招募嗜酸性粒细胞进入皮下脂肪组织,增加M2型巨噬细胞的聚集、脂肪前体细胞的增殖和定向成米色脂肪细胞[51]。
缺乏IL-4/IL-13,IL-4的受体IL-4Rα,或IL-4下游的关键转录因子STAT6的小鼠,M2型巨噬细胞的这一系列反应都不能正常进行,同时BAT中UCP1的表达也相对比正常小鼠有所减少[50]。急性暴露在寒冷的环境中超过6 h,这类小鼠维持核心体温的能力也受损[47]。除此之外,用外源性IL-4处理的小鼠可以UCP1依赖的方式增加耗氧量,促进米色化,改善高脂饮食诱导的肥胖[52]。Lee等[53]发现IL-4除了对M2型巨噬细胞发挥作用,还可以直接促进前脂肪细胞分化成为米色细胞。这些研究成果提示,在短期的冷暴露阶段,IL-4/IL-4Rα相关的M2型巨噬细胞的激活所产生的去甲肾上腺素对于棕色脂肪细胞的激活起到了十分关键的作用。
我们课题组发现冷暴露后脂肪组织BMP4表达升高,提示BMP4可以调控冷暴露诱导的米色脂肪的生成。那么BMP4是否调节脂肪组织中巨噬细胞的激活,从而在米色脂肪的生成中发挥作用呢?我们发现BMP4促进M2型巨噬细胞的激活,而抑制M1型巨噬细胞的激活。BMP4通过激活p38/MAPK/STAT6/PI3K-AKT信号通路促进了M2型巨噬细胞的增殖。BMP4除了通过M2型巨噬细胞分泌的儿茶酚胺类激素激活米色脂肪细胞的功能,也能促进M2巨噬细胞分泌促血管生成因子,增加脂肪组织血管的新生,从而在米色脂肪的生成和功能发挥中起作用(待发表)。
产热脂肪组织对代谢性疾病的治疗潜能脂肪组织发育异常与许多疾病密切相关,脂肪组织过多会引起肥胖。过多的脂质沉积又是胰岛素抵抗、2型糖尿病、高血压等心血管疾病、非酒精性脂肪肝以及某些癌症的主要危险因素[54]。到目前还没有有效的治疗方法。而通过促进棕色和米色脂肪发育或激活已成为治疗肥胖的新研究方向。
人具有产热性脂肪 婴幼儿利用棕色脂肪维持正常体温[6,23,29]。PET-CT (positron emission tomography and X-ray computed tomography)显示成年人也含有UCP-1阳性的产热脂肪细胞[7-10,55]。成人棕色脂肪主要是指“米色脂肪”,散落在成人体内脊柱两侧以及锁骨附近的皮肤[15]。体外实验显示,人棕色和米色脂肪细胞可以由棕色和白色脂肪组织的SVF分化而来,在体移植研究表明,这些早期的产热脂肪细胞前体能被激活并发挥燃烧脂肪的作用[27-28,55-56]。Min等[27]发现,激活体外人SVF分化而来的米色细胞在体内保留其产热功能,而且将人原代的米色脂肪细胞移植能改善正常饮食和高脂饮食诱导的肥胖小鼠的代谢稳态。基础脂肪细胞培养液中加入cAMP、 forskolin或去甲肾上腺素,能诱导和激活由成人脂肪块前体细胞发育来的产热脂肪细胞[28,55-56]。以上关于人原代脂肪细胞的激活和产热功能提示米色脂肪细胞可用于体内治疗肥胖和相关代谢疾病。
人体内产热脂肪细胞可被冷暴露激活[7,9-10]。中等程度的冷暴露 (16 ℃)情况下,96%志愿者的BAT也被激活,瘦的个体BAT活性比肥胖个体更高[10]。选择性β3-肾上腺素能受体激动剂米拉贝隆(Mirabegron)能激活BAT,改善成人代谢稳态[8]。冷暴露人血循环中irisin(鸢尾素)和FGF21水平增加,并进一步激活人BAT的产热功能[31]。有研究发现NAD+/sirtuin (SIRT) 通路能调控脂肪生成和产热脂肪细胞[57-61]。2012年,Cantó等[57]发现烟酰胺核糖(nicotinamide riboside,NR) 能增加小鼠NAD+水平,激活 SIRT信号通路,提高棕色脂肪的氧化功能、能量消耗和减少饮食诱导的肥胖。2型糖尿病小鼠模型中,NR能提高小鼠葡萄糖耐量和减轻体重[62]。另外,Kahn等[61]也发现NR通过诱导线粒体功能促进产热。而NR临床实验显示,NR增加细胞能量产生,并且没有任何严重的不良反应[63]。以上结果表明激活BAT形成和活性的激活剂有可能被用于治疗肥胖和超重。
产热脂肪细胞的临床应用潜能
运动可诱导产热脂肪形成 运动训练能提高全身葡萄糖稳态和胰岛素敏感性,在临床上广泛应用于预防糖尿病和降低2型糖尿病患者血糖,主要负责消耗葡萄糖的骨骼肌的改变是这种作用的核心[64]。尽管骨骼肌对运动所致有利的代谢稳态是最重要的,运动还会导致许多其他组织包括脂肪组织的改变。规律运动训练能引起脂肪组织脂肪细胞变小,脂含量降低[65-66],线粒体蛋白增加,导致皮下脂肪中米色脂肪细胞增加[67-71]。将小鼠暴露在含有转轮的丰富环境中3~4周,米色脂肪细胞明显增加,表现为UCP1、PRDM16和其他棕色或米色脂肪标志基因增加[70-71]。小鼠短期转轮运动训练就可导致棕色和米色脂肪标志基因明显上调[67]。大多数非运动诱导的米色化(冷暴露,许多药物等),可能通过热量散失和代偿性的肾上腺素能激活,导致产热需求增加,交感紧张度增加,进而Ucp1增加以提高产热[72]。然而运动训练导致米色化的功能目前尚不清楚。主要有以下几种假说:运动训练使皮下脂肪细胞变小,脂含量降低会导致身体的绝缘效果下降,必需通过皮下脂肪米色化产热[72-73];运动能增加皮下脂肪神经支配可能与皮下脂肪米色化有关[72,74];运动通过其他组织的改变导致白色脂肪米色化,例如下丘脑来源的神经营养因子分泌增加与运动诱导的米色化有关[70],骨骼肌释放的运动因子对米色化有关[75],包括鸢尾素[70]、meteorin样蛋白1[48]、肌肉生长抑制素(myostatin,MSTN)[48]和 β-氨基异丁酸[76]等。运动诱导的皮下脂肪米色化机制还需进一步阐明。无论通过哪种方式激活产热脂肪,利用运动增加产热脂肪生成已成为治疗肥胖及相关代谢性疾病提供有效、经济的方法。
产热脂肪激活的药物开发 肥胖发生的根本原因是能量摄入长期大于能量支出。预防或治疗肥胖症则要减少能量摄入,增加能量支出。肥胖症的治疗包括生活方式干预,药物治疗和手术治疗。当生活方式干预不能有效降低体重,患者身体状况又不适合手术时,则需要考虑用药物治疗[77]。目前美国食品药品监督管理局(Food and Drug Administration,FDA)批准的可以长期使用的减肥药有5种,分别为Orlistat,Lorcaserin,Phentermine/topiramate,Naltrexone/bupropion和Liraglutide,但是这些药物具有不同程度的不良反应,极大地限制了它们在临床上的应用[78]。因此,减肥的药物治疗远远没有达到理想的临床效果。开发新药迫在眉睫。总的来说,人体的产热性脂肪组织具有良好的消耗多余能量的潜力,并且能在一定条件下激活;激活产热性脂肪组织,不管是增强棕色脂肪的功能,还是促进白色脂肪棕色化,都能有效地消耗多余能量,达到控制体重和改善代谢的目的。这使得产热性脂肪组织成为治疗肥胖症的理想靶点[79]。目前,FDA批准的减肥药都是针对限制能量摄入开发的,通过促进产热性脂肪组织增加能量消耗发挥作用的减肥药目前还没有。已有研究发现可以激活产热性脂肪组织的化合物,如辣椒素及其类似物[80],黄连素[81],紫铆因[82],白藜芦醇[83],水杨酰水杨酸[84]等(图2)。进一步说明了产热性脂肪组织可通过药物化学手段激活,具有作为治疗靶点的可行性。但是以上化合物均不是针对产热性脂肪组织开发的。迄今为止,没有开展针对产热性脂肪组织进行的药物筛选工作。
我们课题组发现青蒿素衍生物青蒿素甲醚能够促进白色脂肪米色化,同时增强米色脂肪的功能而预防肥胖,该研究发表在国际著名学术期刊CellResearch上[85]。青蒿素是古老中药的一笔宝藏,几十年来它为数以百万计的疟疾患者带来了益处。我们筛选了3 000个化合物,并鉴定出了一个候选化合物青蒿素甲醚。暴露于青蒿素甲醚的3T3-L1细胞体积更小,并包含多个小脂滴,这是产热脂肪细胞的典型特征。一步式qPCR显示,在青蒿素甲醚处理后,米色脂肪相关基因(如PRDM16、PGC1a和UCP1)的相对mRNA水平有所升高。在C3H10T1/2细胞(一种间充质干细胞系,可被诱导成脂肪细胞)也有类似结果,表现出产热脂肪细胞的典型形态(体积更小,包含多室的脂滴)。青蒿素甲醚以剂量依赖性的方式上调米色相关基因(如UCP1、PGC1α和PRDM16)以及线粒体基因Cyto C的表达水平。为了进一步验证青蒿素甲醚的促进米色化的效应,我们从雄性C57BL6/J小鼠的腹股沟脂肪组织中分离出了包含脂肪前体细胞的基质血管组分(stromal vasvular fraction cells,SVFs),暴露于青蒿素、甲醚的SVFs发育成为棕色样脂肪细胞。而青蒿素甲醚诱导的C3H10T1/2 细胞棕色化过程中,p38 MAPK/ATF2轴被激活,Akt/mTOR通路去活化。这表明,在脂肪形成过程中,青蒿素衍生物可能通过调节两个通路来调节脂肪棕色化,进而预防肥胖。我们随后通过皮下注射观察青蒿素甲醚的体内效果,并通过腹腔注射探索青蒿素甲醚的全身效应,发现青蒿素甲醚在啮齿动物模型上,同样能促进白色脂肪棕色化,抑制体重增长及改善代谢,有良好的安全性和有效性。这是首次发现青蒿素甲醚类药物有改善代谢的作用(图2)。总之,青蒿素衍生物可在啮齿类动物模型中预防肥胖,并改善与肥胖相关的代谢性疾病,相信这种化合物及其衍生物在未来将有益于更多的人。
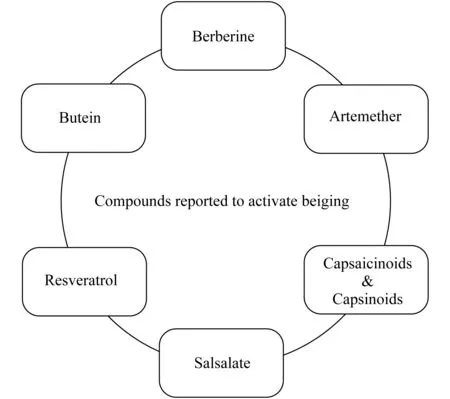
These compounds were found to elicit beneficial effects on metabolism and enhancing thermogenesis.
图2已知可以激活米色脂肪的小分子化合物
Fig2Afewcompoundshavebeenreportedtoactivatebeiging
结语适量的脂肪组织为人体所必须,肥胖患者因含有过多的白色脂肪组织产生慢性炎症而引起肥胖相关的代谢性疾病;人体具有产热性的脂肪组织,产热性脂肪组织具有良好的消耗多余能量的潜力,并且能在一定条件下激活;激活产热性脂肪组织,不管是增强棕色脂肪的功能,还是促进白色脂肪棕色化,都能有效地消耗多余能量,达到控制体重和改善代谢的目的。这使得产热性脂肪组织成为治疗肥胖症及相关代谢性疾病的理想靶点。
[1] LAGO F,DIEGUEZ C,GOMEZ-REINO J,etal.Adipokines as emerging mediators of immune response and inflammation[J].NatClinPractRheum,2007,3(12):716-724.
[2] LAGO F,DIEGUEZ C,GOMEZ-REINO J,etal.The emerging role of adipokines as mediators of inflammation and immune responses[J].CytokineGrowthFR,2007,18(3-4):313-325.
[3] LAGO F,GOMEZ R,GOMEZ-REINO JJ,etal.Adipokines as novel modulators of lipid metabolism[J].TrendsBiochemSci,2009,34(10):500-510.
[4] LANCHA A,FRUHBECK G,GOMEZ-AMBROSI J.Peripheral signalling involved in energy homeostasis control[J].NutrResRev,2012,25(2):223-248.
[5] AHIMA RS.Adipose tissue as an endocrine organ[J].Obesity,2006,14 (S8) :242S-249S.
[6] CANNON B,NEDERGAARD J.Brown adipose tissue: function and physiological significance[J].PhysiolRev,2004,84(1):277-359.
[7] SAITO M,OKAMATSU-OGURA Y,MATSUSHITA M,etal.High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity[J].Diabetes,2009,58(7):1526-1531.
[8] CYPESS AM,LEHMAN S,WILLIAMS G,etal.Identification and importance of brown adipose tissue in adult humans[J].NEnglJMed,2009,360(15):1509-1517.
[9] VAN MARKEN LICHTENBELT WD,VANHOMMERIG JW,SMULDERS NM,etal.Cold-activated brown adipose tissue in healthy men[J].NEnglJMed,2009,360(15):1500-1508.
[10] VIRTANEN KA,LIDELL ME,ORAVA J,etal.Functional brown adipose tissue in healthy adults[J].NEnglJMed,2009,360(15):1518-1525.
[11] NEDERGAARD J,BENGTSSON T,CANNON B.Unexpected evidence for active brown adipose tissue in adult humans[J].AmJPhysiolEndocrinolMetab,2007,293(2):E444-E4452.
[12] GUERRA C,KOZA RA,YAMASHITA H,etal.Emergence of brown adipocytes in white fat in mice is under genetic control.Effects on body weight and adiposity[J].JClinInvest,1998,102(2):412-420.
[13] ALMIND K,MANIERI M,SIVITZ WI,etal.Ectopic brown adipose tissue in muscle provides a mechanism for differences in risk of metabolic syndrome in mice[J].ProcNatlAcadSciUSA,2007,104(7):2366-2371.
[14] SCHULZ TJ,HUANG TL,TRAN TT,etal.Identification of inducible brown adipocyte progenitors residing in skeletal muscle and white fat[J].ProcNatlAcadSciUSA,2011,108(1):143-148.
[15] WU J,BOSTROM P,SPARKS LM,etal.Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human[J].Cell,2012,150(2):366-376.
[16] PETROVIC N,WALDEN TB,SHABALINA IG,etal.Chronic peroxisome proliferator-activated receptor gamma (PPARgamma) activation of epididymally derived white adipocyte cultures reveals a population of thermogenically competent,UCP1-containing adipocytes molecularly distinct from classic brown adipocytes[J].JBiolChem,2010,285(10):7153-7164.
[17] FRONTINI A,CINTI S.Distribution and development of brown adipocytes in the murine and human adipose organ[J].CellMetab,2010,11(4):253-256.
[18] CINTI S.The adipose organ at a glance[J].DisModelMech,2012,5(5):588-594.
[19] CINTI S.Between brown and white: novel aspects of adipocyte differentiation[J].AnnMed,2011,43(2):104-115.
[20] COHEN P,SPIEGELMAN BM.Brown and beige fat: molecular parts of a thermogenic machine[J].Diabetes, 2015,64(7):2346-2351.
[21] PFEIFER A,HOFFMANN LS.Brown,beige,and white: the new color code of fat and its pharmacological implications[J].AnnuRevPharmacolToxicol, 2015,55:207-227.
[22] ATIT R,SGAIER SK,MOHAMED OA,etal. Beta-catenin activation is necessary and sufficient to specify the dorsal dermal fate in the mouse[J].DevBiol,2006,296(1):164-176.
[23] HARMS M,SEALE P.Brown and beige fat: development,function and therapeutic potential[J].NatMed,2013,19(10):1252-1263.
[24] SEALE P,BJORK B,YANG W,etal.PRDM16 controls a brown fat/skeletal muscle switch[J].Nature,2008,454(7207):961-967.
[25] TIMMONS JA,WENNMALM K,LARSSON O,etal.Myogenic gene expression signature establishes that brown and white adipocytes originate from distinct cell lineages[J].ProcNatlAcadSciUSA,2007,104(11):4401-4406.
[26] PEIRCE V,CAROBBIO S,VIDAL-PUIG A.The different shades of fat[J].Nature,2014,510(7503):76-83.
[27] MIN SY,KADY J,NAM M,etal.Human ‘brite/beige’ adipocytes develop from capillary networks,and their implantation improves metabolic homeostasis in mice[J].NatMed,2016,22(3):312-318.
[28] JESPERSEN NZ,LARSEN TJ,PEIJS L,etal.A classical brown adipose tissue mRNA signature partly overlaps with brite in the supraclavicular region of adult humans[J].CellMetab,2013,17(5):798-805.
[29] LIDELL ME,BETZ MJ,DAHLQVIST LEINHARD O,etal. Evidence for two types of brown adipose tissue in humans[J].NatMed,2013,19(5):631-634.
[30] STANFORD KI,MIDDELBEEK RJ,GOODYEAR LJ.Exercise effects on white adipose tissue: beiging and metabolic adaptations[J].Diabetes,2015,64(7):2361-2368.
[31] LEE P,LINDERMAN JD,SMITH S,etal.Irisin and FGF21 are cold-induced endocrine activators of brown fat function in humans[J].CellMetab,2014,19(2):302-309.
[32] HUANG HY,SONG TJ,LI X,etal.BMP signaling pathway is required for commitment of C3H10T1/2 pluripotent stem cells to the adipocyte lineage[J].PNatlAcadSciUSA,2009,106(31):12670-12675.
[33] QIAN SW,TANG Y,LI X,etal.BMP4-mediated brown fat-like changes in white adipose tissue alter glucose and energy homeostasis[J].PNatlAcadSciUSA, 2013,110(9):E798-E807.
[34] TANG Y,QIAN SW,WU MY,etal.BMP4 mediates the interplay between adipogenesis and angiogenesis during expansion of subcutaneous white adipose tissue[J].JMolCellBiol,2016,8(4):302-312.
[35] YUBERO P,MANCHADO C,CASSARD-DOULCIER AM,etal. CCAAT/enhancer binding proteins alpha and beta are transcriptional activators of the brown fat uncoupling protein gene promoter[J].BiochemBiophysResCommun,1994,198(2):653-659.
[36] YUBERO P,BARBERA MJ,ALVAREZ R,etal. Dominant negative regulation by c-Jun of transcription of the uncoupling protein-1 gene through a proximal cAMP-regulatory element:a mechanism for repressing basal and norepinephrine-induced expression of the gene before brown adipocyte differentiation[J].MolEndocrinol,1998,12(7):1023-1037.
[37] CASSARD-DOULCIER AM,GELLY C,FOX N,etal.Tissue-specific and beta-adrenergic regulation of the mitochondrial uncoupling protein gene: control by cis-acting elements in the 5’-flanking region[J].MolEndocrinol,1993,7(4):497-506.
[38] KOZAK UC,KOPECKY J,TEISINGER J,etal.An upstream enhancer regulating brown-fat-specific expression of the mitochondrial uncoupling protein gene[J].MolCellBiol,1994,14(1):59-67.
[39] SEARS IB,MACGINNITIE MA,KOVACS LG,etal. Differentiation-dependent expression of the brown adipocyte uncoupling protein gene: regulation by peroxisome proliferator-activated receptor gamma[J].MolCellBiol,1996,16(7):3410-3419.
[40] SEALE P,KAJIMURA S,YANG W,etal.Transcriptional control of brown fat determination by PRDM16[J].CellMetab,2007,6(1):38-54.
[41] PUIGSERVER P,WU Z,PARK CW,etal.A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J].Cell,1998,92(6):829-839.
[42] ULDRY M,YANG W,ST-PIERRE J,etal.Complementary action of the PGC-1 coactivators in mitochondrial biogenesis and brown fat differentiation[J].CellMetab,2006,3(5):333-341.
[43] 蒲慕明,吴家睿,杜久林,等.新生物学年鉴2014[M].北京:科学出版社,2015:104-140.
[44] MOSSER DM,EDWARDS JP.Exploring the full spectrum of macrophage activation[J].NatRevImmunol, 2008,8(12):958-969.
[45] LUMENG CN,BODZIN JL,SALTIEL AR.Obesity induces a phenotypic switch in adipose tissue macrophage polarization[J].JClinInvest,2007,117(1):175-184.
[46] QIU Y,NGUYEN KD,ODEGAARD JI,et al.Eosinophils and type 2 cytokine signaling in macrophages orchestrate development of functional beige fat[J].Cell,2014,157(6):1292-1308.
[47] NGUYEN KD,QIU Y,CUI X,etal.Alternatively activated macrophages produce catecholamines to sustain adaptive thermogenesis[J].Nature, 2011,480(7375):104-108.
[48] RAO RR,LONG JZ,WHITE JP,etal.Meteorin-like Is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis[J].Cell,2014,157(6):1279-1291.
[49] LIU PS,LIN YW,LEE B,etal.Reducing RIP140 expression in macrophage alters ATM infiltration,facilitates white adipose tissue browning,and prevents high-fat diet-induced insulin resistance[J].Diabetes,2014,63(12):4021-4031.
[50] MARTINEZ FO,HELMING L,GORDON S.Alternative activation of macrophages: an immunologic functional perspective[J].AnnuRevImmunol,2009,27:451-483.
[51] HUANG Z,ZHONG L,LEE JTH,etal.The FGF21-CCL11 axis mediates beiging of white adipose tissues by coupling sympathetic nervous system to type 2 immunity[J].CellMetab,2017,26(3):493-508.
[52] CHANG YH,HO KT,LU SH,etal.Regulation of glucose/lipid metabolism and insulin sensitivity by interleukin-4[J].IntJObes(Lond), 2012,36(7):993-998.
[53] LEE MW,ODEGAARD JI,MUKUNDAN L,etal.Activated type 2 innate lymphoid cells regulate beige fat biogenesis[J].Cell,2015,160(1-2):74-87.
[54] HOTAMISLIGIL GS.Inflammation and metabolic disorders[J].Nature,2006,444(7121):860-867.
[55] CYPESS AM,WHITE AP,VERNOCHET C,etal. Anatomical localization,gene expression profiling and functional characterization of adult human neck brown fat[J].NatMed,2013,19(5):635-639.
[56] SHINODA K,LUIJTEN IH,HASEGAWA Y,etal. Genetic and functional characterization of clonally derived adult human brown adipocytes[J].NatMed, 2015,21(4):389-394.
[58] FU T,SEOK S,CHOI S,etal.MicroRNA 34a inhibits beige and brown fat formation in obesity in part by suppressing adipocyte fibroblast growth factor 21 signaling and SIRT1 function[J].MolCellBiol,2014,34(22):4130-4142.
[59] HOUTKOOPER RH,PIRINEN E,AUWERX J.Sirtuins as regulators of metabolism and healthspan[J].NatRevMolCellBio,2012,13(4):225-238.
[60] JUKARAINEN S,HEINONEN S,RAMO JT,etal.Obesity is associated with low NAD(+)/SIRT pathway expression in adipose tissue of BMI-discordant monozygotic twins[J].JClinEndocrinolMetab,2016,101(1):275-283.
[61] KHAN NA,AURANEN M,PAETAU I,etal.Effective treatment of mitochondrial myopathy by nicotinamide riboside,a vitamin B3[J].EMBOMolMed,2014,6(6):721-731.
[62] TRAMMELL SA,WEIDEMANN BJ,CHADDA A,etal.Nicotinamide riboside opposes type 2 diabetes and neuropathy in mice[J].SciRep,2016,6:26933.
[63] TRAMMELL SA,SCHMIDT MS,WEIDEMANN BJ,etal.Nicotinamide riboside is uniquely and orally bioavailable in mice and humans[J].NatCommun,2016,7:12948.
[64] BONADONNA RC,SACCOMANI MP,SEELY L,etal.Glucose transport in human skeletal muscle.Theinvivoresponse to insulin[J].Diabetes,1993,42(1):191-198.
[65] GOLLISCH KS,BRANDAUER J,JESSEN N,etal.Effects of exercise training on subcutaneous and visceral adipose tissue in normal- and high-fat diet-fed rats[J].AmJPhysiolEndocrinolMetab, 2009,297(2):E495-E504.
[66] CRAIG BW,HAMMONS GT,GARTHWAITE SM,etal.Adaptation of fat cells to exercise: response of glucose uptake and oxidation to insulin[J].JApplPhysiolRespirEnvironExercPhysiol,1981,51(6):1500-1506.
[67] STANFORD KI,MIDDELBEEK RJ,TOWNSEND KL,etal.A novel role for subcutaneous adipose tissue in exercise-induced improvements in glucose homeostasis[J].Diabetes,2015,64(6):2002-2014.
[68] SUTHERLAND LN,BOMHOF MR,CAPOZZI LC,etal.Exercise and adrenaline increase PGC-1{alpha} mRNA expression in rat adipose tissue[J].JPhysiol,2009,587(Pt 7):1607-1617.
[69] TREVELLIN E,SCORZETO M,OLIVIERI M,etal.Exercise training induces mitochondrial biogenesis and glucose uptake in subcutaneous adipose tissue through eNOS-dependent mechanisms[J].Diabetes,2014,63(8):2800-2811.
[70] BOSTROM P,WU J,JEDRYCHOWSKI MP,etal.A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature,2012,481(7382):463-468.
[71] CAO L,CHOI EY,LIU X,etal.White to brown fat phenotypic switch induced by genetic and environmental activation of a hypothalamic-adipocyte axis[J].CellMetab,2011,14(3):324-338.
[72] NEDERGAARD J,CANNON B.The browning of white adipose tissue: some burning issues[J].CellMetab,2014,20(3):396-407.
[73] HIRATA M,SUZUKI M,ISHII R,etal.Genetic defect in phospholipase C delta1 protects mice from obesity by regulating thermogenesis and adipogenesis[J].Diabetes,2011,60(7):1926-1937.
[74] RANALLO RF,RHODES EC.Lipid metabolism during exercise[J].SportsMed,1998,26(1):29-42.
[75] PEDERSEN BK,FEBBRAIO MA.Muscles,exercise and obesity: skeletal muscle as a secretory organ[J].NatRevEndocrinol,2012,8(8):457-465.
[76] ROBERTS LD,BOSTROM P,O’SULLIVAN JF,etal. Beta-aminoisobutyric acid induces browning of white fat and hepatic beta-oxidation and is inversely correlated with cardiometabolic risk factors[J].CellMetab,2014,19(1):96-108.
[77] PATEL D.Pharmacotherapy for the management of obesity[J].Metabolism,2015,64(11):1376-1385.
[78] ARCH JR.Horizons in the pharmacotherapy of obesity[J].CurrObesRep,2015,4(4):451-459.
[79] DIAZ MB,HERZIG S,VEGIOPOULOS A.Thermogenic adipocytes: from cells to physiology and medicine[J].Metabolism,2014,63(10):1238-1249.
[80] WHITING S,DERBYSHIRE E,TIWARI BK.Capsaicinoids and capsinoids[J].A potential role for weight management? A systematic review of the evidence[J].Appetite, 2012,59(2):341-348.
[81] ZHANG Z,ZHANG H,LI B,etal.Berberine activates thermogenesis in white and brown adipose tissue[J].NatCommun,2014,5:5493.
[82] SONG NJ,CHOI S,RAJBHANDARI P,etal.Prdm4 induction by the small molecule butein promotes white adipose tissue browning[J].NatChemBiol,2016,12(7):479-481.
[83] ANDRADE JM,FRADE AC,GUIMARAES JB,etal. Resveratrol increases brown adipose tissue thermogenesis markers by increasing SIRT1 and energy expenditure and decreasing fat accumulation in adipose tissue of mice fed a standard diet[J].EurJNutr,2014,53(7):1503-1510.
[84] VAN DAM AD,NAHON KJ,KOOIJMAN S,etal.Salsalate activates brown adipose tissue in mice[J].Diabetes,2015,64(5):1544-1554.
[85] LU P,ZHANG FC,QIAN SW,etal.Artemisinin derivatives prevent obesity by inducing browning of WAT and enhancing BAT function[J].CellRes,2016,26(10):1169-1172.
Therapeuticpotentialofthermogenicadiposetissue
HUANG Hai-yan1,2, TANG Qi-qun1,2△
(1DepeartmentofBiochemistryandMolecularBiology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai20032,China;2KeyLaboratoryofMetabolismandMolecularMedicine,MinistryofEducation,FudanUniversity,Shanghai200032,China)
Adipose tissue plays a critical role in regulating whole-body energy homeostasis.There are three types of adipose tissues in humans: white,brown and beige.Both beige and brown adipose burn lipid by dissipating energy in the form of heat and are uniformly referred to as thermogenic adipose tissue.In this review,we will summarize the recent findings in the activation of thermogenic adipose tissue and its therapeutic potential to counteract obesity and its related disorders.
thermogenic adipose tissue; energy metabolism; obesity; metabolic disorders
Q71,R589
A
10.3969/j.issn.1672-8467.2017.06.012
国家自然科学基金(31271489,81170781,31030048C120114)
△Corresponding author E-mail:qqtang@shmu.edu.cn
*ThisworkwassurpportedbytheNationalNaturalScienceFoundationofChina(31271489,81170781,31030048C120114).
2017-10-01;编辑:张秀峰)

