铝掺杂针铁矿的制备、表征及吸附氟的特性
朱朝菊 向文军 罗和青 魏世勇*,
铝掺杂针铁矿的制备、表征及吸附氟的特性
朱朝菊1向文军1罗和青2魏世勇*,2
(1四川文理学院化学化工学院,达州 635000)
(2湖北民族学院化学与环境工程学院,恩施 445000)
水热条件下制备了针铁矿(Goe)和几种铝掺杂针铁矿(Goe-Al0.1,Goe-Al0.2和 Goe-Al0.4),用 X射线衍射(XRD)、扫描电镜(SEM)、氮气物理性吸附、酸碱滴定等手段对样品进行了表征,并研究了它们对氟离子的吸附特性。结果表明,随着铝掺杂量的增加,铝掺杂针铁矿的结晶度不断减弱、颗粒的长度不断减小。4种样品的微孔表面积、孔体积和表面分形度都表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4,而孔径分布表现为相反的顺序。 Goe、Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4的电荷零点(PZC)分别为 8.2、8.3、8.5和8.7,pH=5.0时它们的表面电荷量分别为0.66、0.83、1.03和1.19 mmol·g-1。准二级动力学模型适合描述4种样品对氟的吸附动力学过程,表明化学吸附是主要作用机制。一位Langmuir模型可较好的拟合等温吸附数据(R2为0.967~0.981),二位Langmuir模型对等温吸附数据的拟合度更高(R2为0.982~0.995),而Freundlich模型的拟合度较低(R2为0.877~0.912)。初始pH=5.0时,Goe、Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4对氟的最大吸附容量分别为 8.83、10.24、11.72 和 12.86 mg·g-1。 可见,铝掺杂针铁矿对土-水环境中氟的吸附容量高于纯针铁矿。
针铁矿;铝掺杂针铁矿;表面性质;吸附;氟
0 引 言
氟是人类和动物必需的微量元素之一,但生物体内摄入过量的氟可导致氟斑牙、骨骼变形、生长发育不良等氟中毒症状[1-5]。世界上受到氟污染威胁的人口多达几亿,我国大部分地区都存在氟污染,氟病患者达一千多万[3,6-10]。高氟土壤及水体是造成人类和动物体内氟含量过高的主要因素之一[3-6,10]。土壤/沉积物中的氧化铁对氟有较高的亲和力,它们可有效吸附环境体系中的氟,从而影响氟的赋存形态和生物有效性[11-15]。土壤中的氧化铁普遍存在铝掺杂现象,土壤发育的程度越深氧化铁中铝掺杂的比例往往越高。因此,研究纯氧化铁和铝掺杂产物的表面性质及对氟的吸附特性,有助于理解土壤/沉积物中活性金属氧化物与环境氟之间的界面作用过程,这对土-水体系中氟污染的控制有重要意义。
针铁矿是土壤中最常见的晶质氧化铁,广泛分布于各类土壤中。在黄壤、黄棕壤和我国南方山地土壤中,针铁矿是主要的金属氧化物;在红壤和砖红壤中针铁矿的含量也可达10%以上[16-18]。针铁矿的化学结构式为α-FeOOH,结构中八面体结构单元FeO3(OH)3以共棱方式平行c轴连接成双链,八面体双链通过共用角顶氧和氢键连接成空心通道结构。针铁矿晶体沿c轴呈针状或平行(010)面成薄板状,晶面常呈现出凹凸纵纹[16-17]。不同条件下形成的针铁矿的比表面积(SSA)差异较大,自然环境中的针铁矿和人工合成针铁矿的 SSA一般在 8~200 m2·g-1间变化[11,16-21]。针铁矿表面功能团主要是两性铁羟基(≡Fe-OH)和边缘不饱和的铁原子;表面电荷零点(PZC)较高,一般在pH=7~9,具体数值与其形成条件、测试方法、相伴离子的种类等因素有关[17,19-20]。在悬浮液体系中,针铁矿表面可变电荷强烈依赖于介质溶液的pH值和离子强度[16,21]。在相同pH值和离子强度条件下,针铁矿表面电荷量随着表面羟基含量的增多而升高[16,22-23]。针铁矿对溶液中氟离子的吸附能力较强,可有效净化氟污染土壤和水体,其作用机制主要有离子交换、表面配位、静电引力等[11,12,19-20,22]。初始pH=5~6时,常温条件下2.0 g·L-1的针铁矿对氟的最大吸附量为10 mg·g-1左右,其等温吸附数据与Langmuir方程拟合的相关系数达显著水平[11-12,20]。在悬浮液体系中,针铁矿对氟的吸附反应可在4 h内达到平衡,吸附容量除了与矿物的基本性质有关外,也与介质溶液的pH值、离子强度、温度、反应时间、矿物浓度等因素密切相关[13,15,19-20]。
土壤中针铁矿是最容易发生铝同晶替代的晶质氧化铁,发育良好的黄壤中针铁矿的nAl/nFe可高达33%[16,18]。研究表明,铝掺杂后针铁矿的结晶度变差、颗粒变小,比表面积和吸附磷的能力都随铝掺杂量的增加而升高[16,18,24-25]。可见,铝掺杂对针铁矿的形成和表面性质都有明显影响。我国贵州、云南、重庆、广西等西南地区土壤氟污染比较普遍,这些区域内的黄壤、黄棕壤、红壤、棕壤等土壤中都有较高含量的铝同晶替代针铁矿。因此,铝掺杂针铁矿与氟的相互作用将明显影响土壤氟的赋存形态和迁移转化。然而,迄今还未见铝掺杂针铁矿与氟离子的作用过程和吸附机制方面的文献。本研究制备了几种不同含量的铝掺杂针铁矿,用X射线衍射(XRD)、扫描电镜(SEM)、比表面分析、质子电位滴定等手段分析了铝掺杂针铁矿的微观结构和表面性质,并设计系列吸附试验研究了样品与氟离子的界面作用特性。这些研究有助于深入理解土壤/沉积物中铝掺杂氧化铁对氟的吸附过程、吸附容量和吸附机制,其结果可为土-水体系中氟的地球化学循环和污染治理提供基础资料。
1 实验部分
1.1 样品制备
根据文献[23]中的方法合成针铁矿(Goe),主要步骤为:磁力搅拌状态下,将360 mL 5 mol·L-1的KOH溶液加入盛有 200 mL 1 mol·L-1的Fe(NO3)3溶液的聚乙烯烧杯中,用蒸馏水将反应悬浮液的总体积稀释至2 L,然后密闭烧杯,置于70℃油浴中静止老化60 h。离心悬浮液、沉淀物用超纯水清洗至电导率小于6 μS·cm-1。样品70℃烘干,碾磨过60目筛,保存于硅胶干燥器中备用。为了制备铝掺杂针铁矿,在制备针铁矿的体系中,分别用20、40和80 mL的1 mol·L-1Al(NO3)3溶液取代等体积的Fe(NO3)3溶液,其它程序按照合成针铁矿的操作步骤进行。基于反应体系中的初始物质的量之比nAl/(nAl+nFe),3种铝掺杂针铁矿分别记为Goe-Al0.1、Goe-Al0.2和Goe-Al0.4。
1.2 样品分析
用电感耦合等离子体(ICP)法测定样品中Fe和Al的含量,其主要操作步骤为:取20 mg粉末样品于 50 mL 聚乙烯离心管中,加入 10 mL、6 mol·L-1的盐酸溶液,震荡8 h后在12 000 r·min-1的转速下离心,上清液中Fe和Al的浓度在Varian Vista-MPX ICP-OES上测定。实验重复3次取平均值。样品的X射线衍射(XRD)分析采用粉末压片法,仪器型号为德国布鲁克公司D8 ADVANCE。测试条件为:Cu Kα 辐射(λ=0.154 06 nm),管电压为 40 kV,管电流为 40 mA,扫描速度为 2°·min-1,步长为 0.01°。 粉末样品的扫描电镜(SEM)分析在JEOL-场发射扫描电子显微镜(JSM.6700F,日本电子)上进行。真空镀铂后做SEM分析,测试加速电压为5 kV。
样品的比表面积和孔性分析在Quantachrome Autosorb-1型全自动比表面及孔径分布分析仪上进行。样品在120℃脱气处理约12 h,除去水分和其它吸附质。然后在77 K条件下进行N2等温吸附-脱附实验。样品的微孔径分布用Horvath-Kawazoe(HK)方法分析,微孔表面积用t方法微孔分析计算,总孔体积根据相对压力接近饱和(p/p0≈0.998)时的N2吸附量计算,微孔体积用Dubinin-Radushkevich(DR)方法计算,表面分形度用Frenkel-Halsey-Hill(FHH)方法计算。
采用质子电位滴定测定样品表面的电荷零点(PZC)及电荷量(qH),所用仪器为836 Titrando(Metrohm,Swiss)自动电位滴定仪。主要操作过程为:称取0.05 g样品于滴定瓶中,加入0.005 mol·L-1KCl溶液50 mL。悬浮液超声波分散60 min后,置于磁力搅拌台上,持续通入氮气并水浴恒温至25℃左右,用0.05 mol·L-1KOH或HCl溶液将悬浮液pH值调至4.0。悬浮液在磁力搅拌状态下平衡1 h后,逐滴加入0.05 mol·L-1KOH溶液至pH值升到10.0。再次平衡1 h,然后滴加0.05 mol·L-1HCl至pH值降到4.0。向悬浮液中添加KCl固体使KCl浓度依次达到0.01和0.02 mol·L-1,重复上述酸碱滴定。空白的操作步骤与样品悬浮液的相同。酸碱滴定操作由计算机通过自编程序控制,主要参数设置为:滴定液以每次0.05 mL等份加入,搅拌2 min后测定悬浮液电位,当电位漂移率lt;0.5 mV·min-1时继续下次滴定,当两次滴定间隔时间超过20 min后则达到滴定终点。本研究选用将悬浮液从pH=10.0调到pH=4.0的实验数据,计算各离子强度条件下样品从pH=10.0降到pH=4.0所消耗的H+量,即样品悬浮液在该pH值范围内所消耗的H+量减去空白在该pH值范围内所消耗的H+量。根据改进的Davies方程[26],得到不同离子强度条件下样品的pH-qH关系曲线,3种不同离子强度的滴定曲线相交处的pH值即为样品的PZC。
1.3 样品对氟的吸附
储备液制备:称取2.0 g样品于1 L聚乙烯烧杯中,加入 200 mL、0.01 mol·L-1KCl溶液,超声分散后用0.01 mol·L-1KCl溶液将悬浮液体积调至800 mL,搅拌条件下用0.01 mol·L-1KOH 或 HCl溶液将悬浮液的pH值调至5.0,然后用0.01 mol·L-1KCl溶液定容至1 L,获得2.0 g·L-1样品悬浮液。称取0.884 g分析纯NaF于1 L聚乙烯烧杯中,加入800 mL、0.01 mol·L-1KCl溶液,搅拌条件下用0.01 mol·L-1KOH或 HCl溶液将其pH值调至5.0,总体积定容至1 L,获得F-浓度为 400 mg·L-1的NaF储备溶液。
吸附动力学实验:取100 mL、2.0 g·L-1的样品悬浮液于500 mL聚乙烯烧杯中,搅拌条件下加入100 mL、400 mg·L-1的 F-储备溶液。 反应体系中矿物样品浓度为 1.0 g·L-1,F-初始浓度为 200 mg·L-1。在设定的时间定期取样,立即在12 000 r·min-1的转速下离心分离,取上清液,用F-选择电极法测定过滤液中F-的平衡浓度(ce)。根据吸附前后溶液中F-浓度之差计算样品对F-的吸附量(qe)。实验重复3次取平均值。
等温吸附实验:取若干份2.0 g·L-1的样品悬浮液10 mL注入50 mL聚乙烯离心管中,加入不同体积的NaF储备溶液,用0.01 mol·L-1KCl溶液调至总体积为20 mL,使悬浮液中样品浓度均为1.0 g·L-1,F-初始浓度依次为 2、5、10、20、30、50、100 和 200 mg·L-1。 在 25 ℃、转速 250 r·min-1条件下震荡 24 h。其余程序参照动力学吸附实验的操作步骤进行。
2 结果与讨论
2.1 样品元素含量
针铁矿(Goe)样品中Fe含量为54.34%。标准针铁矿的化学式通常表示为FeOOH,其中Fe含量为62.92%。可见,Goe样品Fe含量低于标准针铁矿的含量,其原因可归属为:(1)Goe样品表面存在一定量的物理吸附水,(2)Goe样品中有少量非晶质或弱晶质氧化铁。3种铝掺杂针铁矿(Goe-Al0.1、Goe-Al0.2和Goe-Al0.4)中含Fe量分别为49.03%、45.21%和37.18%,含Al量分别为2.46%、4.54%和7.97%。可见,随着铝掺杂量的升高,样品的含Fe量不断下降,而含Al量持续升高。Goe-Al0.1、Goe-Al0.2和Goe-Al0.4中nAl/(nAl+nFe)分别为0.094、0.172和0.308。 可见,3种铝掺杂产物中nAl/(nAl+nFe)都小于反应体系中初始的nAl/(nAl+nFe),这说明反应体系中一部分Al没有掺进产物中。
2.2 X射线衍射分析
4种样品的XRD图见图1。针铁矿(Goe)的XRD图与其标准卡片(PDF-810464)高度吻合,说明Goe样品结晶度良好且不含杂质。3种铝掺杂针铁矿(Goe-Al0.1、Goe-Al0.2和Goe-Al0.4)的XRD图中都只有针铁矿的衍射峰,没有出现其它衍射峰,表明铝掺杂体系中没有形成新的晶体矿物。与Goe样品比较,随着铝掺杂量的增加,铝掺杂针铁矿衍射峰的强度逐渐减弱,且峰半高宽略微增加。这表明铝掺杂降低了针铁矿的结晶度和晶粒大小,这与文献[16,18,23]的报道结果一致。
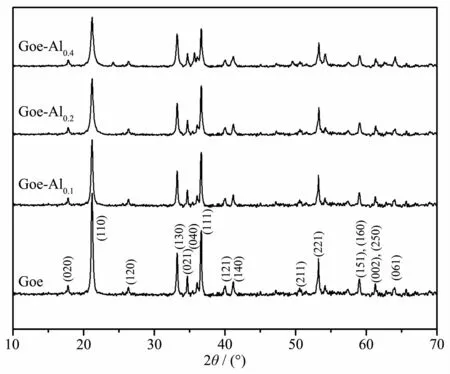
图1 样品的XRD图Fig.1 XRD patterns of the samples
2.3 扫描电镜分析

图2 样品的SEM图像Fig.2 SEM micrographs of the samples
图2 为样品的扫描电镜(SEM)图像。Goe样品为长度1 μm左右的针状单粒或微团聚体,这种形貌与强碱性条件下合成针铁矿的常见形貌一致,说明Goe样品具有良好的代表性。铝掺杂针铁矿(Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4)都为短棒状形貌,随着铝掺杂量的增加其长度不断减小。此外,Goe-Al0.4样品中还出现了少量无规则形貌的微小颗粒物。可见,样品的SEM图像也表明铝掺杂抑制了针铁矿晶体的生长发育,这与XRD分析的结果一致。
2.4 比表面及孔性分析
图3为样品的氮气等温吸附-解吸曲线。4种样品的等温吸附-脱附曲线的变化趋势相似,但对氮气的吸附量有一定差异,其大小关系为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。相对气压较低(p/p0=0~0.1)时,随着气压的增加氮气吸附量急剧增加;在p/p0=0.1~0.9时,随着气压的增加氮气吸附量缓慢增加;当p/p0接近1时,由于颗粒外表面毛细管中氮气的凝聚而导致吸附曲线略微上翘。此外,当p/p0gt;0.5时,解吸曲线与吸附曲线之间存在一个明显的回滞环。这类等温吸附/脱附曲线的变化趋势表明:样品的孔隙以微孔为主,含有一定比例的中孔和少量的大孔。
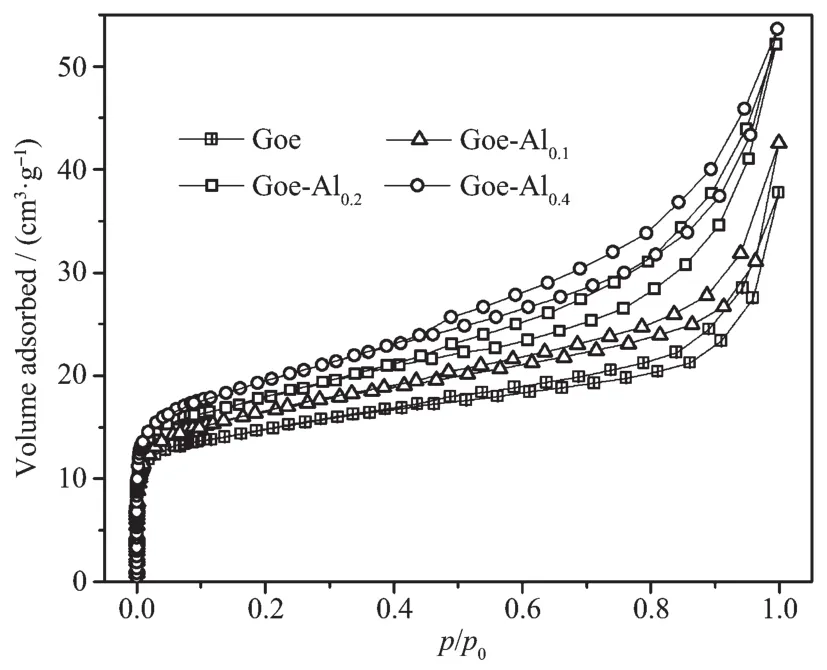
图3 样品的氮气等温吸附-解吸曲线Fig.3 Adsorption-desorption isotherms for nitrogen by the samples

图4 样品的微孔径分布曲线Fig.4 Micropore size distribution of the samples
根据HK方法计算的样品微孔径分布见图4。Goe、Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4的微孔径分布曲线中都有一个强的分布峰和一个较弱的峰,其中强峰的峰位分别在0.49、0.45、0.43和0.39 nm附近,弱峰的峰位分别在 1.59、1.53、1.50和 1.49 nm附近。可见,随着铝掺杂量的升高,产物孔径分布曲线的峰位略有降低。4种样品的孔径分布数据显示,随着铝掺杂量的升高,1.0 nm以下的微孔含量不断升高,而1.2 nm以上的微孔含量不断减少。这表明铝掺杂减小了针铁矿样品的孔径大小。根据文献[16-18],针铁矿结构内部没有孔隙,其孔隙主要来自于颗粒之间。颗粒间的孔隙与颗粒尺寸密切相关,样品的颗粒尺寸越小其孔径将变得越小[11,14,16]。图2中样品的SEM分析显示,随着铝掺杂量的升高,产物的颗粒尺寸逐渐减小。因此,4种样品的孔径和颗粒尺寸的变化相吻合。
根据样品对氮气的等温吸附-解吸数据,计算样品的微孔表面积、孔体积和表面分形度,结果列于表1。4种样品的微孔表面积、总孔体积和微孔体积都表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。可见,铝掺杂升高了针铁矿的表面积和孔体积,其原因也可以归属于样品的颗粒尺寸改变。矿物样品的表面分形度可反映其表面的光滑度和匀质性;表面分形度(D)通常在2~3间,当样品的D值接近2时则其表面光滑、均匀,D值升高则表明其表面粗糙度增加、异质性增强[16,21]。4种样品的D值介于2.23~2.67间,其相对大小表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。可见,铝掺杂升高了针铁矿的表面粗糙度和表面异质性。
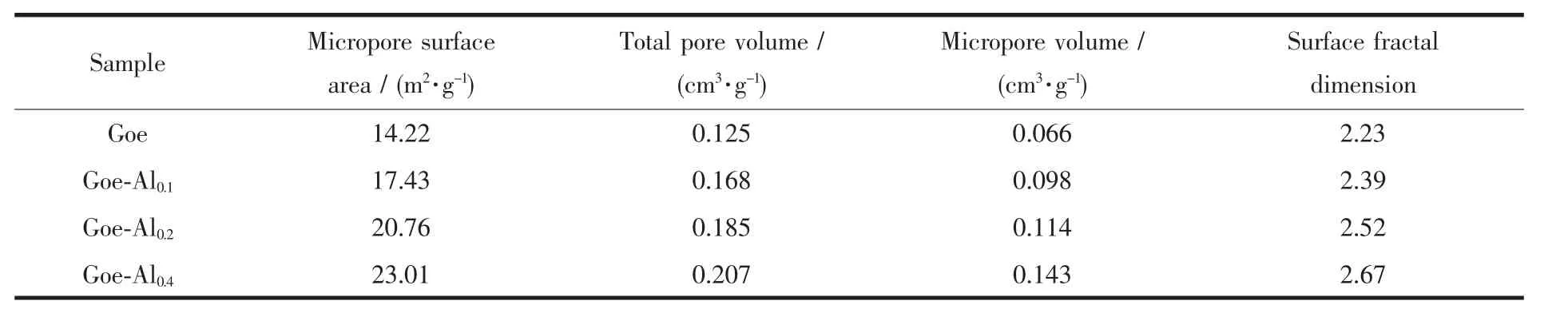
表1 样品的孔性结构参数及表面分形度Table 1 Pore structural properties and surface fractal dimension of the samples
2.5 表面电荷分析
在不同的pH值和离子强度条件下,样品的表面质子电荷量(qH)见图5。3种不同的KCl浓度条件下,样品的pH-qH曲线相交处的pH值为其表面电荷零点(PZC)。当溶液的pH值低于样品的PZC时,样品表面的正电荷量随pH值的降低而增加;当溶液的pH值高于样品的PZC时,样品表面的负电荷量随pH值的升高而增加。可见,样品表面的电荷性质和电荷量都随介质溶液pH值的变化而改变,这可归因于样品表面两性羟基的质子化与去质子作用[16,19,21]。当溶液的离子强度不变时,降低pH值,样品表面的羟基将发生质子化作用;相反,pH值升高时样品表面的羟基将发生去质子化反应。在介质溶液pH值不变的条件下,离子强度也可影响样品表面的质子电荷量。若溶液的pH值低于样品的PZC时,样品表面的质子正电荷量随离子强度的升高而增加;若溶液的pH值高于样品的PZC时,样品表面的负电荷量也随离子强度的升高而增加;介质溶液的pH值等于样品的PZC时,样品表面的质子电荷量为0,且不受离子强度的影响。
样品质子电位滴定的部分数据见表2。Goe、Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4的 PZC 分 别 为 8.2、8.3、8.5和8.7。根据文献[11,16,22-23],强碱性条件下人工合成针铁矿的PZC通常在pH=7.0~9.0,铝氧化物的PZC通常在pH=9.0左右。可见,Goe的PZC在文献报道范围内。由于铝氧化物的PZC通常高于针铁矿,所以铝掺杂针铁矿的PZC随着掺杂量的增加而缓慢升高。样品悬浮液从pH=10.0降到pH=4.0时,消耗的H+量与样品表面羟基含量正相关[19,21]。当KCl浓度为10 mmol·L-1时,样品从pH=10.0降到pH=4.0消耗的H+量表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。可见,随着铝掺杂量的增加样品表面羟基密度不断增加,这与样品的结晶度和比表面积的变化密切相关。在KCl浓度为10 mmol·L-1和pH=5.0条件下,Goe、Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4的表面正电荷量分别为 0.66、0.83、1.03 和 1.19 mmol·g-1。可见,在相同的离子强度和pH值条件下,样品表面的正电荷量随着铝掺杂量的增加而略微升高。

表2 样品的质子电位滴定结果Table 2 Results of proton potentiometric titrations of the samples
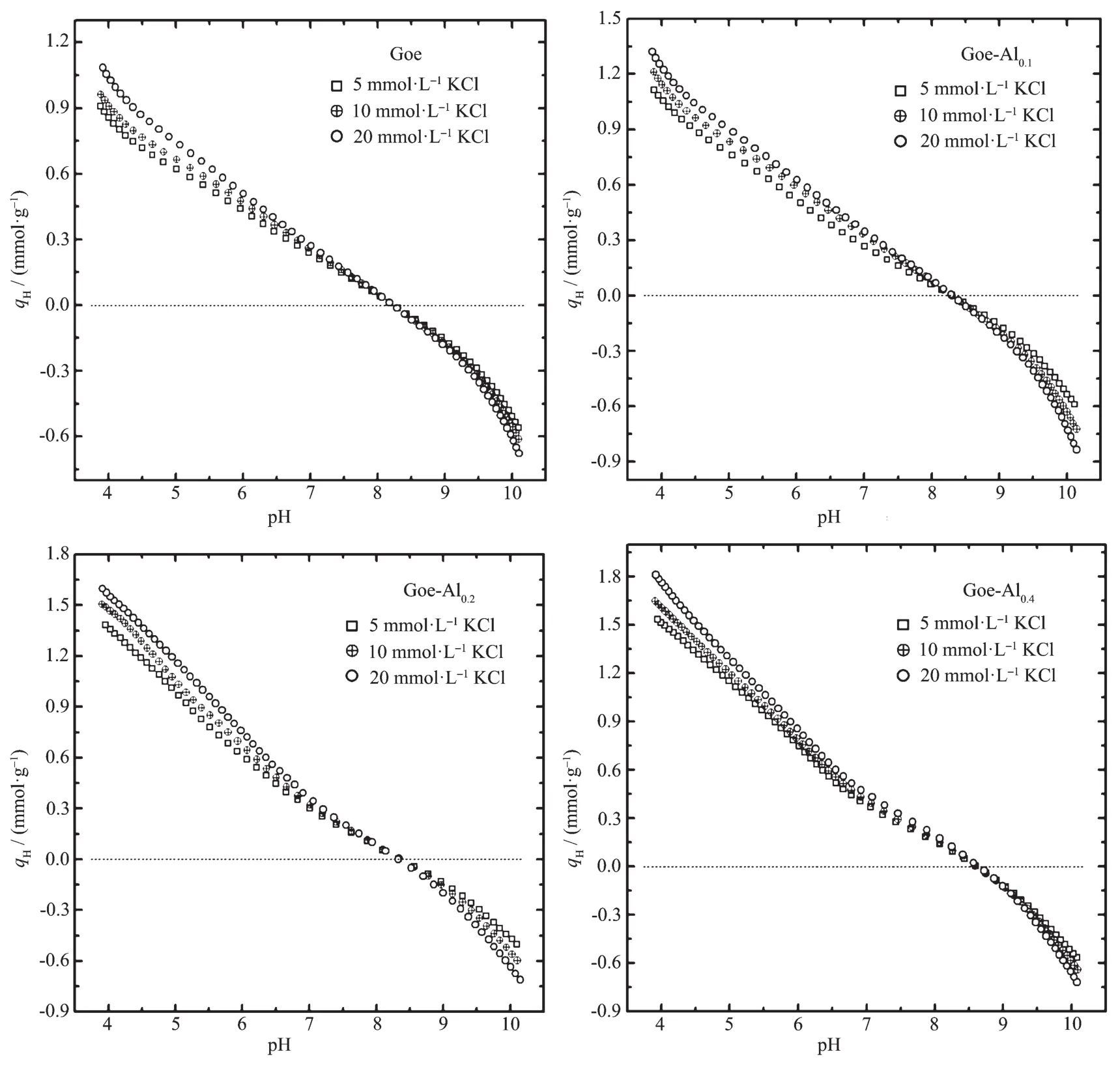
图5 不同离子强度时样品的pH-qH关系曲线Fig.5 Proton binding isotherms of the samples as a function of pH value at different KCl concentrations
2.6 样品对氟的吸附特性
2.6.1 吸附动力学
图6为样品吸附氟离子的动力学曲线。可见,4种样品对氟的吸附量随反应时间延长而变化的趋势比较类似。在最初50 min内,样品对氟的吸附容量随时间延长而急剧升高;反应时间在50~100 min间,吸附容量随时间延长仍然不断升高,但其变化趋势逐渐变缓。吸附时间达100 min以后,吸附反应趋于平衡状态,进一步延长反应时间吸附容量没有明显变化。为了使吸附过程达到充分的平衡状态,本研究中的等温吸附实验设定吸附时间为24 h。
选用准一级和二级动力学模型对样品吸附氟离子的动力学数据进行了拟合。2种模型的表达式分别见方程(1)和(2):
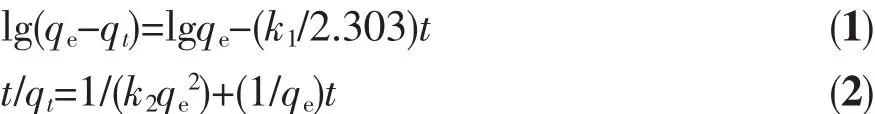
式中,qt表示反应时间t(min)时样品的吸附量(mg·g-1);qe表示吸附达饱和时的平衡吸附量 (mg·g-1);k1(min-1)和 k2(g·mg-1·min-1)分别为准一级和二级吸附动力学速率常数[13,27-30]。
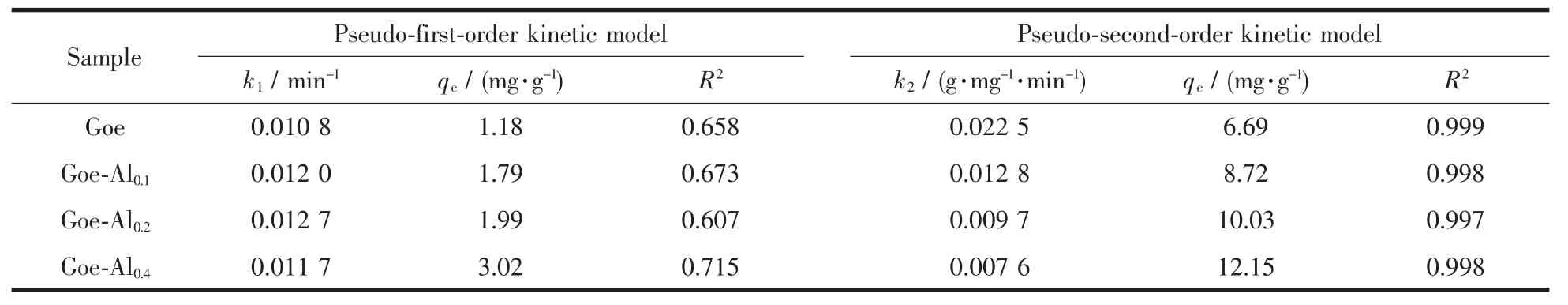
表3 样品吸附氟离子的动力学模型拟合参数Table 3 Kinetic parameters of fluoride adsorption by the samples
样品对氟离子的吸附动力学数据的模型拟合参数见表3。准一级动力学模型拟合结果中,4种样品对氟的平衡吸附量qe在1.18~3.02,拟合的qe都明显低于吸附趋于平衡时的吸附量;拟合相关系数都较低(R2=0.607~0.715)。可见,准一级动力学模型不能较好地描述样品对氟的吸附动力学过程。准二级模型拟合的4种样品的qe在6.69~12.15,其拟合值较接近对应样品吸附趋于平衡时的吸附量;拟合相关系数R2=0.997~0.999。这表明4种样品对氟离子的吸附动力学过程符合准二级吸附动力学机制。
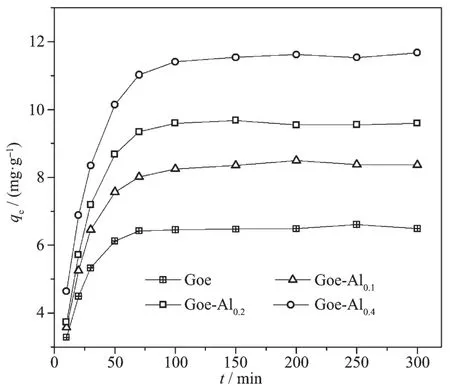
图6 样品对氟离子的吸附动力学曲线Fig.6 Adsorption kinetic data of fluoride by the samples
2.6.2 等温吸附
4种样品的悬浮液对氟离子的等温吸附曲线见图7。当氟的平衡浓度相同时,不同样品对氟的吸附量表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。当氟的平衡浓度小于15 mg·L-1时,吸附量随氟平衡浓度的升高而明显增加;氟的平衡浓度在15~90 mg·L-1范围时,吸附量随氟平衡浓度的升高而缓慢增加;氟的平衡浓度高于90 mg·L-1时,样品的吸附量趋于稳定,并逐渐达到吸附饱和状态。
选用一位Langmuir、 二位Langmuir和Freundlich吸附模型对等温吸附数据进行拟合。3种模型的表达式分别见方程(3)、(4)和(5):

式中,qe表示单位质量样品对氟离子的吸附量(mg·g-1),ce是吸附体系中氟的平衡浓度(mg·L-1);一位Langmuir模型中 qmax表示最大吸附容量(mg·g-1),b 为与吸附结合能及亲和力相关的常数 (L·mg-1);二位Langmuir模型中q1和q2分别表示高能量吸附位和低能量吸附位的吸附容量(mg·g-1),总吸附容量(qt,mg·g-1)为 q1与 q2之和,b1和 b2分别为高、低能量吸附位的吸附亲和力常数(L·mg-1);Freundlich模型中k为与吸附容量有关的常数(mg1-(1/n)·L1/n·g-1),1/n为吸附量随氟的平衡浓度增加而升高的强度系数[11-13,27-31]。
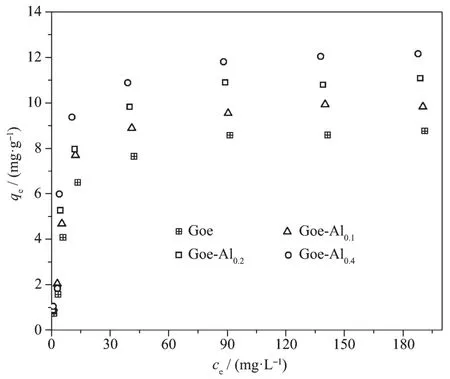
图7 样品对氟离子的等温吸附曲线Fig.7 Adsorption isotherms of fluoride by the samples
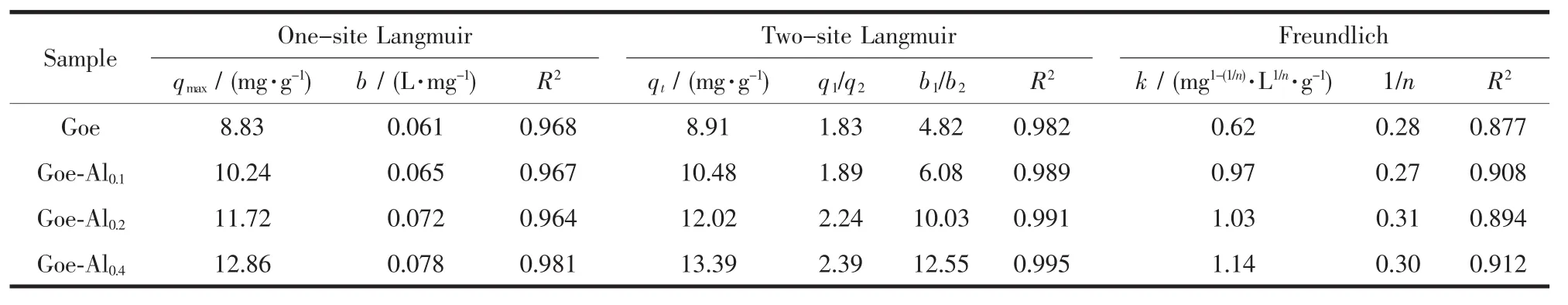
表4 样品吸附氟离子的等温模型拟合参数Table 4 Equilibrium isotherm parameters of fluoride adsorption by the samples
3种等温吸附模型对样品等温吸附氟离子的拟合结果见表4。一位Langmuir模型拟合结果中,4种样品对氟的最大吸附量qmax在8.83~12.86 mg·g-1、吸附亲和力常数b在0.061~0.078 L·mg-1,它们都随样品中铝掺杂量的增加而不断增加。拟合相关系数R2较高(0.964~0.981),表明一位Langmuir模型比较适合拟合4种样品对氟离子的等温吸附数据。二位Langmuir模型拟合结果中,样品的吸附总量qt都略高于一位Langmuir模型拟合结果中的qmax。4种样品高、低能量位的吸附容量比(q1/q2)在1.83~2.39变化,吸附氟时的b1/b2值在4.82~12.55,它们也都随样品中铝掺杂量的增加而不断增加。4种样品对氟的等温吸附数据的拟合相关系数R2在0.982~0.995,表明二位Langmuir模型可很好地拟合样品对氟离子的等温吸附数据。Freundlich模型拟合结果中,4种样品的吸附容量常数k在0.62~1.14 mg1-(1/n)·L1/n·g-1,不同样品的吸附容量常数k的相对大小与Langmuir模型拟合的最大吸附容量qmax和吸附总量qt一致。4种样品的Freundlich吸附强度系数略有差异(1/n为0.27~0.31),但其数值没有表现出规律性的变化趋势,说明4种样品对氟的吸附容量随平衡浓度增加而升高的强度比较接近。4种样品对氟的等温吸附数据的Freundlich模型拟合相关系数都比较低(R2为0.877~0.912),表明样品对氟离子的等温吸附过程不适合用Freundlich模型拟合。
2.6.3 讨 论
4种样品吸附氟离子时,在最初30 min内吸附量急剧增加,达到吸附平衡状态需要约100 min左右。根据文献[27,29~31],悬浮液体系中固液界面的物理吸附较快,通常可在30 min内完成,而化学吸附是一个相对缓慢的作用过程。4种样品对氟离子的动力学吸附数据不适合用准一级动力学模型拟合,而准二级模型可很好地描述样品对氟的动力学吸附过程。这些结果表明,样品与氟离子相互作用的重要机制涉及到表面物理吸附和化学专属吸附,其吸附速率控制步骤主要是颗粒内部扩散,而不是界面液膜扩散[27,30,31]。表面张力、静电引力等是样品吸附氟离子的物理作用机制,其速率控制步骤通常是界面扩散过程。Goe和铝掺杂样品(Goe-Al0.1、Goe-Al0.2和Goe-Al0.4)表面的Fe、Al金属原子均可与氟离子形成配位键,发生专属吸附作用;样品表面的Fe、Al羟基可与氟离子发生阴离子交换作用,实现固液界面的离子交换吸附[11,15,24-25]。可见,表面配位和阴离子交换是样品吸附氟离子的主要化学作用机制,其速率控制步骤主要是颗粒内部扩散过程[13,27,30]。
与 Goe 样品比较,Goe-Al0.1、Goe-Al0.2和 Goe-Al0.4对氟的吸附容量(qmax)逐渐升高。其主要原因可归纳为:(1)XRD、SEM和比表面分析显示,随着铝掺杂量的增加,样品的结晶度不断减弱、颗粒尺寸变小、比表面积增大,因此它们对氟的物理吸附容量不断升高。(2)质子电位滴定表明,样品的表面羟基密度和pH=5.0时的表面正电位量表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。这意味着样品与溶液中氟离子间的阴离子交换能力和静电引力也随着铝掺杂量的增加而增强。(3)根据文献[12,20,29],(氢)氧化铝表面的Al比氧化铁表面的Fe原子对氟具有更高的吸附亲合力。因此,随着铝掺杂量的增加样品表面对氟的吸附亲和力也在升高。(4)样品的氮气物理吸附分析显示,4种样品的表面分形度D值表现为Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4。 根据文献[16,21,25],固相样品的表面分形度升高可增强其表面吸附作用。可见,4种样品对氟离子吸附容量的差异与它们的理化性质密切相关。土壤中针铁矿普遍存在铝掺杂现象,因此Goe-Al0.1、Goe-Al0.2和Goe-Al0.4的表面性质及对氟的吸附行为能够反映自然土壤中针铁矿的真实特性。
3 结 论
在水热条件下成功制备了纯针铁矿(Goe)和几种不同含量的铝掺杂针铁矿 (Goe-Al0.1、Goe-Al0.2和Goe-Al0.4)。铝掺杂对针铁矿的表面性质和吸附氟的特性都产生了影响,且铝掺杂量越高影响作用越明显。与Goe比较,随着铝掺杂量增加样品的结晶度不断降低、颗粒尺寸逐渐减小。Goe、Goe-Al0.1、Goe-Al0.2和Goe-Al0.4的微孔表面积、孔体积和表面分形度都表现为依次升高的趋势,而孔径分布表现为相反的变化趋势。4种样品的表面电荷零点和pH=5.0时的表面正电荷量也随着铝掺杂量的增加而逐渐升高。准一级动力学模型对4种样品吸附氟离子的动力学数据拟合度较低,而准二级动力学模型适合描述样品对氟的吸附动力学过程。二位Langmuir模型可很好的拟合样品对氟离子的等温吸附数据,一位Langmuir模型也可较好地描述样品的等温吸附过程,但Freundlich模型对等温吸附数据的拟合度较差。 初 始 pH=5.0 时 ,Goe、Goe-Al0.1、Goe-Al0.2和Goe-Al0.4对氟的最大吸附容量逐渐升高。可见,铝掺杂量越高的针铁矿对土-水体系中的氟离子有更强的吸附固定能力。
[1]Ghosh A,Mukherjee K,Ghosh S K,et al.Res.Chem.Intermed.,2013,39:2881-2915
[2]Ozsvath D L.Rev.Environ.Sci.Biotechnol.,2009,8:59-79
[3]Zhang B,Hong M,Zhao Y,et al.Environ.Geochem.Health,2003,25:421-431
[4]Jha S K,Nayak A K,Sharma Y K.Chemosphere,2009,76:353-356
[5]Shu W S,Zhang Z Q,Lan C Y,et al.Chemosphere,2003,52:1475-1482
[6]Choubisa S L,Choubisa D.Environ.Sci.Pollut.Res.,2016,23(8):7244-7254
[7]Gizaw B.J.Afr.Earth Sci.,1996,22:391-402
[8]Subba R N,Devadas D J.Environ.Geol.,2003,45:243-51
[9]Wang G X,Cheng G D.J.Arid Environ.,2001,49:601-14
[10]Zhu L,Zhang H H,Xia B,et al.Environ.Int.,2007,33:302-308
[11]Hiemstra T,Van-Riemsdijk W H.J.Colloid Interface Sci.,2000,225:94-104
[12]Sujana M G,Pradhan H K,Anand S.J.Hazard.Mater.,2009,161:120-125
[13]Patel S C,Khalkho R,Patel S K,et al.Environ.Earth Sci.,2014,72:2033-2049
[14]Zhao X,Wang J,Wu F,et al.J.Hazard.Mater.,2010,173(1):102-109
[15]Nur T,Loganathan P,Nguyen T C,et al.Chem.Eng.J.,2014,247:93-102
[16]Cornell R M,Schwertmann U.The Iron Oxides:Structure,Properties,Reactions Occurences,Uses.Weinheim:Wiley-VCH,2003:42-73,101-124
[17]Krishnamurti G S R.Soil Componnents with Variable Charge with Special Reference to Iron Oxides.Naples:University di Napoli FedericoⅡ,1997:7-32,90-93
[18]Guo H,Barnard A S.J.Mater.Chem.,2013,1(1):27-42
[19]Tang Y L,Guan X H,Wang J M,et al.J.Hazard.Mater.,2009,171:774-779
[20]Harrington L F,Cooper E M,Vasudevan D.J.Colloid Interface Sci.,2003,267:302-313
[21]Wei S Y,Tan W F,Liu F,et al.Geoderma,2014,213:478-484
[22]WEI Shi-Yong(魏世勇),WANG Rui(王锐),NIU Peng-Ju(牛鹏举),et al.Chinese J.Inorg.Chem.(无机化学学报),2016,32(9):1619-1628
[23]Schwertmann U,Cornell R M.Iron Oxides in the Laboratorypreparation and Characterization.Weinheim:Wiley-VCH,1991:61-80
[24]Liu R,Zhu L,He Z,et al.Colloid Surf.A,2015,466:147-153
[25]Belelli P G,Fuente S A,Castellani N J.Comp.Mater.Sci.,2014,85:59-66
[26]Davies C W.Ion Interactions.London:Butterworth,1962:43
[27]Guo X,Yang C,Dang Z,et al.Chem.Eng.J.,2013,223:59-67
[28]Kemer B,Ozdes D,Gundogdu A,et al.J.Hazard.Mater.,2009,168(2):888-894
[29]Chen N,Feng C P,Li M.Clean Technol.Environ.Policy,2014,16:609-617
[30]Velazquez-Pea G C,Solache-Ríos M,Martínez-Miranda V.Water Air Soil Pollut.,2015,226(1):2236
[31]Kebede B,Beyene A,Fufa F,et al.Appl.Water Sci.,2016,6(1):57-65
Preparation,Characterization and Fluoride Adsorption Characteristics of Goethite and Al-Doped Goethite
ZHU Zhao-Ju1XIANG Wen-Jun1LUO He-Qing2WEI Shi-Yong*,2
(1School of Chemistry and Chemical Engineering,Sichuan University of Arts and Science,Dazhou,Sichuan 635000,China)
(2Department of Chemistry and Environmental Engineering,Hubei University for Nationalities,Enshi,Hubei 445000,China)
Pure goethite (Goe)and Al-doped goethite (Goe-Al0.1,Goe-Al0.2and Goe-Al0.4)were prepared under hydrothermal conditions,and the surface properties and fluoride adsorption characteristics of the samples were investigated using X-ray diffraction (XRD),scanning electron microscopy (SEM),nitrogen physical adsorption,potentiometric titrations and batch adsorption experiments.The results show that both the crystallinity of the samples and the length of rod nanoparticles decrease with increasing the Al contents.The micropore surface areas,pore volumes and surface fractal dimension D values of the samples follow the order of Goelt;Goe-Al0.1lt;Goe-Al0.2lt;Goe-Al0.4,and the pore size distributions of the four samples show the opposite order.The points of zero charge (PZC)of Goe,Goe-Al0.1,Goe-Al0.2and Goe-Al0.4appear around 8.2,8.3,8.5 and 8.7,respectively.At pH=5.0,the surface charges of the four samples are 0.66,0.83,1.03 and 1.19 mmol·g-1,respectively.The adsorption kinetic data for fluoride by the samples were well fitted using the pseudo-second-order kinetic model,suggesting that chemisorption is important in the adsorption process.One-site Langmuir model is suitable to describe the isotherm adsorption data (R2=0.967~0.981).Compared to the correlation coefficients (R2)fitted using one-siteLangmuir model,the R2fitted using two-site Langmuir model are higher(R2=0.982~0.995),but the R2fitted using Freundlich model are lower(R2=0.877~0.912).At pH=5.0,Langmuir adsorption capacities(qmax)of Goe,Goe-Al0.1,Goe-Al0.2and Goe-Al0.4are 8.83,10.24,11.72 and 12.86 mg·g-1,respectively.This indicates that the adsorption capacity for fluoride onto Al-doped goethite is higher than that onto Goe.
goethite;Al-doped goethite;surface properties;adsorption;fluoride
O614.81+1
A
1001-4861(2017)12-2215-10
10.11862/CJIC.2017.266
2017-03-10。收修改稿日期:2017-06-20。
国家自然科学基金(No.41561053,41261060)、四川省教育厅科研项目(No.15ZA0317)和达州市科技局应用基础研究项目(No.KJJ201403)资助。
*通信联系人。 E-mail:xiangju12345@126.com

