阿卡波糖干预新诊断2型糖尿病患者 肠道菌群分布及血清GDF-15水平的研究
朱雅欣,杨建荣,谢荣迪
阿卡波糖干预新诊断2型糖尿病患者 肠道菌群分布及血清GDF-15水平的研究
朱雅欣,杨建荣,谢荣迪
目的探讨阿卡波糖对新诊断 2 型糖尿病(T2DM)患者肠道菌群分布及血清生长分化因子-15(GDF-15)水平的干预情况。
方法选择我院新诊断的 120 例 T2DM 患者为研究对象,随机分为试验组(n = 60)和对照组(n = 60),对照组予以安慰剂,试验组受试者服用阿卡波糖,连续治疗 14 d。比较两组受试者血糖以及血脂相关指标。采用酶联免疫吸附双抗夹心法(ELISA)测定两组血清 GDF-15 的表达水平。对粪便样本中所有细菌的 16SrRNA-V3 区进行 DNA 测序,对肠道菌群中的分布及丰度进行分析,同时做聚类分析。对肠道菌群通过实时定量 PCR 进行定量检测。
结果治疗后,试验组和对照组受试者血糖及血脂相关指标、肠道菌群的分布以及 GDF-15 的表达水平均存在明显差异(P< 0.05)。治疗后,试验组受试者肠道菌群发生明显变化,且菌群改善组与未改善组血糖及血脂相关指标存在明显差异(P< 0.05);血清中 GDF-15 表达水平与拟杆菌属、IV 型梭菌属、韦荣球菌属丰度呈正相关(P< 0.05),与厚壁菌门、放线菌门、普雷沃菌属、乳杆菌属、Blautia 球菌-直肠真杆菌属丰度呈负相关(P< 0.05)。
结论阿卡波糖可通过影响患者肠道菌群的分布以及GDF-15 的表达水平,对新诊断 T2DM 患者起到有效的治疗作用。
糖尿病,2 型; 阿卡波糖; 生长分化因子 15; 肠道菌群
2 型糖尿病(type 2 diabetes mellitus,T2DM)是一种内分泌代谢性疾病,胰岛素分泌不足以及胰岛素抵抗是其病理及生理基础[1]。临床流行病学资料显示,在全球范围内 T2DM 病人增长迅速[2]。肠道菌群由于可以影响能量和营养吸收,在一定程度上与糖尿病的发生相关[3-4]。有报道表明,T2DM病人的肠道菌群存在中度紊乱[5]。而 α-糖苷酶抑制剂类降糖药物,如阿卡波糖,可以延迟葡萄糖的吸收、更改肠道吸收葡萄糖的位置而产生降糖效果。肠道菌群也会影响糖尿病患者的代谢情况[6-8]。本研究以新诊断的 T2DM 患者为研究对象,用以探究肠道菌群和肠道激素对于糖尿病患者代谢的影响及阿卡波糖的治疗作用。
1 资料与方法
1.1 一般资料
以 2013 年版《中国 2 型糖尿病防治指南》中的诊断标准选择我院新确诊的 120 例 T2DM患者为研究对象,年龄 30 ~ 70 周岁。排除标准:①肝、肾功能严重受损者;②短期内服用影响血糖药物者;③患有甲状腺等内分泌疾病者;④大便常规检测异常者;⑤短期内严重腹泻者。受试者及家属均签署知情同意书。实验人员依据临床指南的相关原则充分保障受试者的治疗安全,对诊疗记录保密,保护受试者的隐私权。如受试者退出试验或转院治疗,遵照入选和排除标准按 1∶1 比例补充。
1.2 方法
1.2.1 分组 遵循临床试验的双盲原则,将 120 例T2DM 患者随机分为试验组和对照组,各 60 例。对照组予以安慰剂,安慰剂使用本院自制的与试验药物外形一致的无药理特性的淀粉制品;试验组受试者连续服用阿卡波糖 14 d,3 次/d,50 mg/次。
1.2.2 指标
⑴治疗后,比较两组受试者血糖以及血脂相关指标。血糖相关指标包括:空腹血糖(FPG)、餐后2 h 血糖(2hPG)以及糖化血红蛋白 A1c(HbA1c)。血脂相关指标包括:甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)以及高密度脂蛋白胆固醇(HDL-C)。
⑵比较两组受试者治疗前后肠道菌群分布的差异,并对菌群发生改善的与未发生改善的试验组受试者间血糖、血脂等指标进行比较。
1.2.3 肠道菌群检测方法 对粪便样本中所有细菌的 16SrRNA-V3 区通过 Illumina MiSeq 高通量测序平台进行 DNA 测序,对肠道菌群的分布及丰度进行分析,同时做聚类分析。通过实时定量 PCR法进行定量检测。荧光定量 PCR:以标准菌种(浓度 101~ 108拷贝/μl)16SrRNA 基因片段的质粒DNA 建立标准曲线,两组中全部个体细菌数量以每克粪便中 16SrRNA 基因拷贝数的对数值来表示。样本定量数据通过 log10 转换后经由 SPSS19.0统计软件做出系统分析。
1.2.4 ELISA 法测定 GDF-15 水平 早 7 点提取空腹肘前静脉血 3.0 ml,自然静置 1 h 后3000 r/min 离心 15 min,采集血清,于 -20 ℃ 冰箱保存等候批量检测。通过 ELISA 法检测血清GDF-15 含量,解冻后血清进行 1∶4 稀释,建立标准曲线图。96 孔板中每孔注入 100 μl 的测定稀释剂(RD1-9),包含阴性对照及标准曲线。之后于每孔注入 50 μl 的待测样品、标准品或空白试剂,胶带覆盖后置于水平摇床室温 50 r/min 培育2 h。缓冲液洗板 3 次,添加 GDF-15 特异性抗体,水平摇床室温 50 r/min 培育 1 h,洗板 3 次。注入 200 μl底物溶液,室温避光培育 30 min。添加 50 μl 终止反应液,直至溶液颜色由蓝色变为黄色。30 min 内通过酶标仪 450 nm 波长检测各孔吸光度值。
1.3 统计学处理
采用统计学软件 SPSS19.0 对数据进行分析,计量资料采用±s表示,采用t检验比较分析,计数资料采用χ2检验比较分析,通过单因素相关分析探讨肠道菌群变化与 GDF-15 水平的相关性,P< 0.05 代表差异存在统计学意义。
2 结果
2.1 治疗后两组受试者血糖、血脂相关指标比较
两组受试者血糖以及血脂相关指标均存在明显差异(P< 0.05),其中对照组 FPG、2hPG、HbA1c、TC、TG、LDL-C 明显高于试验组,对照组 HDL-C明显低于试验组(表 1)。
表 1 治疗后两组受试者血糖、血脂相关指标比较(±s )(n = 60)Table 1 Comparison of blood glucose and blood lipid indexes between the two groups after treatment (±s ) (n = 60)

表 1 治疗后两组受试者血糖、血脂相关指标比较(±s )(n = 60)Table 1 Comparison of blood glucose and blood lipid indexes between the two groups after treatment (±s ) (n = 60)
FPG(mmol/L) 10.52 ± 1.38 4.83 ± 0.67 8.552 0.001 2hPG(mmol/L) 15.73 ± 0.55 9.27 ± 0.64 7.636 0.005 HbA1c(%) 10.72 ± 0.79 5.81 ± 0.36 10.221 0.000 TC(mmol/L) 5.51 ± 0.62 3.28 ± 0.44 11.384 0.000 TG(mmol/L) 2.47 ± 0.31 1.15 ± 0.15 9.067 0.000 LDL-C(mmol/L) 4.26 ± 0.29 2.87 ± 0.22 8.549 0.000 HDL-C(mmol/L) 0.70 ± 0.09 1.43 ± 0.12 7.247 0.001
2.2 治疗后两组受试者肠道菌群丰度比较
实时荧光定量 PCR 结果显示,治疗后对照组受试者拟杆菌属、IV 型梭菌属、韦荣球菌属丰度显著高于试验组(P< 0.05),对照组受试者厚壁菌门、放线菌门、普雷沃菌属、乳杆菌属、Blautia 球菌-直肠真杆菌属丰度明显低于试验组(P< 0.05);两组间变形杆菌门、梭形杆菌门不存在显著相关性(P> 0.05)(表 2)。
表 2 治疗后两组受试者肠道菌群丰度比较(±s )(n = 60)Table 2 Comparison of intestinal flora abundance between the two groups after treatment (±s ) (n = 60)

表 2 治疗后两组受试者肠道菌群丰度比较(±s )(n = 60)Table 2 Comparison of intestinal flora abundance between the two groups after treatment (±s ) (n = 60)
肠道菌群 Intestinal flora 对照组 Control group 试验组 Experimental group t P拟杆菌属 Bacteroides 10.86 ± 1.83 9.11 ± 1.70 7.263 0.011厚壁菌门 Phylum firmicutes 11.96 ± 1.12 13.20 ± 1.21 6.158 0.006放线菌门 Actinomyces 5.97 ± 0.42 7.10 ± 0.49 7.349 0.005变形杆菌门 Proteobacteria 8.50 ± 1.23 8.22 ± 1.22 1.017 0.167梭形杆菌门 Fusiform bacillus 7.46 ± 1.02 7.31 ± 1.11 1.003 0.235普雷沃菌属 Prevotella 6.22 ± 0.87 7.18 ± 1.20 8.557 0.002 IV 型梭菌属 Clostridium IV 7.58 ± 0.63 6.11 ± 0.82 10.374 0.000乳杆菌属 Lactobacillus 4.18 ± 0.36 5.10 ± 0.41 9.209 0.001韦荣球菌属 Veillonella 8.90 ± 0.77 5.80 ± 0.60 8.156 0.003 Blautia 球菌 Blautia cocci 6.31 ± 0.90 7.00 ± 0.65 7.159 0.007双歧杆菌属 Bifidobacterium 4.80 ± 0.62 7.12 ± 1.00 9.662 0.000
表 3 治疗前后试验组受试者肠道菌群变化情况(±s )(n = 60)Table 3 Changes of intestinal flora in the experimental group before and after treatment (±s ) (n = 60)

表 3 治疗前后试验组受试者肠道菌群变化情况(±s )(n = 60)Table 3 Changes of intestinal flora in the experimental group before and after treatment (±s ) (n = 60)
拟杆菌属 B a c t e r o i d e s 9 . 3 5 ± 1 . 6 3 9 . 1 1 ± 1 . 7 0 6 . 0 3 8 0 . 0 0 3厚壁菌门 P h y l u m f i r m i c u t e s 1 2 . 7 8 ± 1 . 0 5 1 3 . 2 0 ± 1 . 2 1 7 . 2 2 1 0 . 0 0 7放线菌门 A c t i n o m y c e s 6 . 3 3 ± 0 . 4 1 7 . 1 0 ± 0 . 4 9 7 . 3 5 6 0 . 0 0 5变形杆菌门 P r o t e o b a c t e r i a 8 . 3 4 ± 1 . 1 9 8 . 2 2 ± 1 . 2 2 1 . 3 3 9 2 . 0 2 9梭形杆菌门 F u s i f o r m b a c i l l u s 7 . 4 0 ± 1 . 0 6 7 . 3 1 ± 1 . 1 1 1 . 0 4 2 1 . 5 6 3普雷沃菌属 P r e v o t e l l a 6 . 7 9 ± 0 . 9 6 7 . 1 8 ± 1 . 2 0 7 . 0 2 2 0 . 0 0 6 I V 型梭菌属 C l o s t r i d i u m I V 7 . 0 5 ± 0 . 7 2 6 . 1 1 ± 0 . 8 2 1 0 . 3 4 7 0 . 0 0 0乳杆菌属 L a c t o b a c i l l u s 4 . 6 9 ± 0 . 3 6 5 . 1 0 ± 0 . 4 1 9 . 2 0 8 0 . 0 0 0韦荣球菌属 V e i l l o n e l l a 7 . 1 6 ± 0 . 6 8 5 . 8 0 ± 0 . 6 0 8 . 3 5 4 0 . 0 0 0 B l a u t i a 球菌 B l a u t i a c o c c i 6 . 8 6 ± 0 . 7 0 7 . 0 0 ± 0 . 6 5 8 . 2 9 9 0 . 0 0 0双歧杆菌属 B i f i d o b a c t e r i u m 5 . 9 0 ± 0 . 5 8 7 . 1 2 ± 1 . 0 0 1 1 . 0 6 4 0 . 0 0 0
表 4 菌群改善与菌群无改善患者血糖及血脂相关指标比较(±s )Table 4 Comparison of indexes of blood glucose and blood lipid between flora improvement and no improvement of flora (±s )

表 4 菌群改善与菌群无改善患者血糖及血脂相关指标比较(±s )Table 4 Comparison of indexes of blood glucose and blood lipid between flora improvement and no improvement of flora (±s )
指标Observed indicator菌群改善组(n = 28)Flora improvement group (n = 28)菌群无改善组(n = 32)Group with no improved flora (n = 32) t P FPG(mmol/L) 7.15 ± 0.31 10.35 ± 0.52 8.521 0.003 2hPG(mmol/L) 8.42 ± 0.42 15.55 ± 0.87 7.036 0.001 HbA1c(%) 7.07 ± 0.46 10.54 ± 1.02 6.225 0.006 TC(mmol/L) 4.32 ± 0.42 5.53 ± 0.78 8.012 0.000 TG(mmol/L) 1.72 ± 0.24 2.45 ± 0.36 10.337 0.000 LDL-C(mmol/L) 3.10 ± 0.25 4.28 ± 0.44 9.250 0.000 HDL-C(mmol/L) 1.60 ± 0.21 0.72 ± 0.06 8.177 0.000
2.3 治疗前后试验组受试者肠道菌群变化情况
治疗后,试验组受试者拟杆菌属、IV 型梭菌属、韦荣球菌属丰度明显降低(P< 0.05),厚壁菌门、放线菌门、普雷沃菌属、乳杆菌属、Blautia 球菌-直肠真杆菌属丰度明显升高(P< 0.05);变形杆菌门、梭形杆菌门丰度未发生显著变化(P> 0.05)(表 3)。
2.4 菌群改善与菌群无改善患者血糖相关指标比较
根据治疗后菌群改善情况,将试验组受试者进一步分为菌群改善组以及菌群无改善组,检测结果显示,两组受试者血糖以及血脂相关指标均存在明显差异(P< 0.05),其中菌群改善组 FPG、2hPG、HbA1c、TC、TG、LDL-C 明显低于菌群无改善组,HDL-C 明显高于菌群无改善组(表 4)。
2.5 对照组与试验组 GDF-15 表达水平比较
治疗后,对照组受试者 GDF-15 表达水平明显高于试验组[(3.03 ± 0.39)vs(2.87 ± 0.22),P< 0.05]。
2.6 肠道菌群丰度与血清中 GDF-15 表达水平的相关性分析
单因素相关分析结果(表 5)显示,血清中GDF-15 表达水平与拟杆菌属、IV 型梭菌属、韦荣球菌属丰度呈正相关(P< 0.05),与厚壁菌门、放线菌门、普雷沃菌属、乳杆菌属、Blautia 球菌-直肠真杆菌属丰度呈负相关(P< 0.05);与变形杆菌门、梭形杆菌门无关(P> 0.05)。
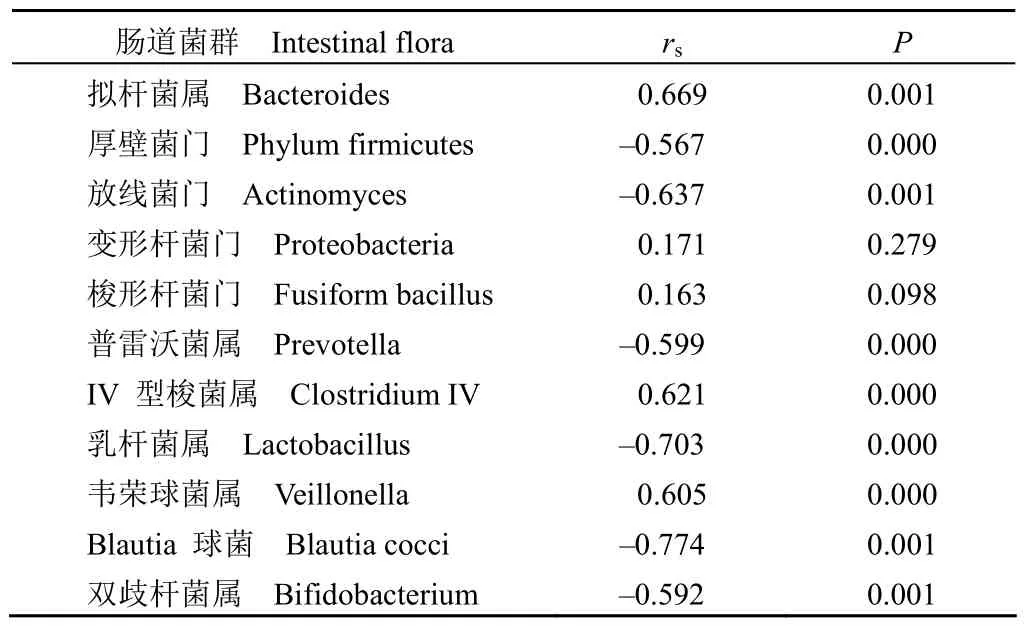
表 5 肠道菌群丰度与血清中GDF-15表达水平的相关性分析Table 5 Correlation between the abundance of intestinal flora and the expression level of GDF-15 in serum
3 讨论
当前,研究人员普遍认为环境以及遗传等众多因素的作用下产生的胰岛 β细胞功能受损是引起T2DM 的主因[9]。肠道菌群能够影响胆汁酸盐代谢、宿主体重、激素、自身免疫反应,从而影响T2DM 的发生、发展。在许多研究中发现,T2DM同肠道菌群间联系紧密[10-12]。阿卡波糖属于 α 葡萄糖苷酶抑制剂的一种,其能抑制小肠边缘上皮细胞上的 α 葡萄糖苷酶,进而减少、延缓葡萄糖吸收从而产生调节血糖作用,广泛用于 T2DM 治疗[13-14]。最近有研究发现,采取分子生物学的方法在食物中添加寡糖能够大幅增加糖尿病大鼠肠道双歧菌产生,减低肠道 pH 值,提高粪便中短链脂肪酸含量,胰岛素分泌和糖耐量得到提高,体内的炎症和内毒素血症情况也得到改善[15]。因此若能提高下消化道的寡糖含量便能够影响肠道菌群,从而影响糖代谢。本研究结果显示,治疗后,两组受试者血糖及血脂相关指标、肠道菌群的分布均存在明显差异(P< 0.05);治疗后,试验组中菌群改善者与未改善者血糖及血脂相关指标存在明显差异(P<0.05),证实了糖尿病的发生受到肠道菌群的影响。
转化生长因子 β(TGF-β)超家族成员中的GDF-15 在健康的成人体内的表达存在显著的组织特异性,其在前列腺及胎盘中表达高,在胰脏及肾脏中的表达仅可以检测到,而在其余器官及组织中的表达量较低或几乎不表达[16-17]。在相关实验中观察到,T2DM 和肥胖病人体内 GDF-l5 含量提高。脂肪因子和胰岛素可以影响脂肪细胞生成GDF-l5,在如恶性肿瘤、氧化应激、组织损伤等病理条件下,病灶部位的 GDF-l5 表达明显提高,血浆 GDF-l5 含量也明显提高[18-20]。糖尿病和糖尿病前期病人体内 GDF-l5 含量都有所提高,在空腹血糖受损以及正常糖耐量人群中其表达水平的差异十分明显。相关报道表明,GDF-l5 可以作为检测空腹血糖受损的新指标[21]。GDF-l5 可以活化磷脂酰肌醇 3 激酶/蛋白激酶 B/内皮型一氧化氮合酶信号路径,对核因子-κB/c-Jun 氨基末端激酶信号路径抵抗人脐静脉内皮细胞的细胞凋亡过程进行抑制。因此可以猜测,GDF-l5 通过负反馈而使高糖诱导的活性氧簇表达降低,进而使胰岛素抵抗情况得到间接改善。通过 GDF-l5 转基因小鼠做胰岛素耐量试验和腹腔内葡萄糖耐量试验,发现转基因小鼠的血糖大幅降低,可见 GDF-l5 能够增加胰岛素的敏感性使糖耐量得到改善。本研究表明,治疗后,对照组受试者 GDF-15 表达水平明显高于试验组,证实 T2DM 的发展同 GDF-l5 之间存在关联性[22]。
单因素相关分析结果显示,血清中 GDF-15 表达水平与拟杆菌属、IV 型梭菌属、韦荣球菌属丰度呈正相关(P< 0.05),与厚壁菌门、放线菌门、普雷沃菌属、乳杆菌属、Blautia 球菌-直肠真杆菌属丰度呈负相关(P< 0.05)。双歧杆菌属以及乳杆菌属可以生成乳酸,均有益生菌的特点。在动物实验中观察到,高水平的双歧杆菌属、乳杆菌属可以产生改善糖尿病的效果,但是 IV 型梭菌属能加速糖尿病的产生。肠道内一些细菌可以利用其他细菌生成的乳酸,将其转变为丁酸,丁酸有利于肠道合成黏蛋白,维持肠黏膜的健康。Blautia 球菌-直肠真杆菌属是重要的产丁酸菌种之一,而普雷沃菌属的重要作用是分解黏蛋白。韦荣球菌属和 IV 型梭菌属能够通过乳酸及葡萄糖最终分解为短链脂肪酸,当该类短链脂肪酸无法合成为黏蛋白时,会引起肠道黏膜的通透性的提高,引发炎症。
综上所述,阿卡波糖可通过影响患者肠道菌群的分布以及 GDF-15 的表达水平,对新诊断T2DM 患者起到有效的治疗作用,具有在临床推广应用的前景。
[1] Wei YY, Liu X, Yu LP. Diagnosis, treatment and prevention of type 2 diabetes mellitus in patients over 65 years of age. E-J Translational Med, 2016, 3(7):94-95. (in Chinese)韦瑛瑛, 刘潇, 俞柳萍. 65岁以上 2型糖尿病患者的诊治及预防.转化医学电子杂志, 2016, 3(7):94-95.
[2] Renner S, Römisch-Margl W, Prehn C, et al. Changing metabolic signatures of amino acids and lipids during the prediabetic period in a pig model with impaired incretin function and reduced β-cell mass. Diabetes, 2012, 61(8):2166-2175.
[3] Cani PD, Geurts L, Matamoros S, et al. Glucose metabolism: focus on gut microbiota, the endocannabinoid system and beyond. Diabetes Metab, 2014, 40(4):246-257.
[4] Karlsson FH, Tremaroli V, Nookaew I, et al. Gut metagenome in european women with normal, impaired and diabetic glucose control. Nature, 2013, 498(7452):99-103.
[5] Qin QN, Chen HX, Li SL. Correlation betwween intestnal flora and type 2 diabetes mellttus in traditional Chinese medicine and western medicine. Asia-Pac Traditional Med, 2017, 13(5):59-62. (in Chinese)覃俏娜, 陈红霞, 李双蕾. 肠道菌群与2型糖尿病的中西医相关性研究. 亚太传统医药, 2017, 13 (5):59-62.
[6] Ding XY. Analysis on efficacy and safety of acarbose combined metformin in treatment of type 2 diabetes. China Pharm, 2012, 21(15):97-98. (in Chinese)丁祥云. 阿卡波糖联合二甲双胍治疗 2 型糖尿病的疗效和安全性分析. 中国药业, 2012, 21(15):97-98.
[7] Hostalek U, Gwilt M, Hildemann S. Therapeutic use of metformin in prediabetes and diabetes prevention. Drugs, 2015, 75(10):1071-1094.
[8] Hu YQ, Chen XW. Clinical comparative reseach of saxagliptin and acarbose on poor - controlled type 2 diabetes with overweight. Chin J Clin Rational Drug Use, 2016, 9(4):13-15. (in Chinese)胡艺琼, 陈晓文. 沙格列汀与阿卡波糖治疗血糖控制不佳伴超重2型糖尿病患者的临床疗效比较. 临床合理用药杂志, 2016, 9(4):13-15.
[9] Lucas R, Parikh SJ, Sridhar S, et al. Cytokine profiling of young overweight and obese female African American adults with prediabetes. Cytokine, 2013, 64(1):310-315.
[10] Markle JG, Frank DN, Mortin-Toth S, et al. Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity. Science, 2013, 339(6123):1084-1088.
[11] Zhang XY, Han XY, Chen YL, et al. Effect of acarbose on intestinal flora in patients with pre diabetes.//Proceedings of the Fifteenth National Academic Conference of diabetes branch of Chinese Medical Association, 2012:343-344. (in Chinese)张秀英, 韩学尧, 陈颖丽, 等. 阿卡波糖对糖尿病前期患者肠道菌群的影响.//中华医学会糖尿病学分会第十五次全国学术会议论文集, 2012:343-344.
[12] Xu J, Su BL, Guan YF. Effect of acarbose on diabetic patients with intestinal bifidobacteria. Chin Med Innovation, 2013, 10(9):37-38. (in Chinese)徐杰, 苏本利, 关玉峰. 阿卡波糖对糖尿病患者肠道双歧杆菌的影响. 中国医学创新, 2013, 10(9):37-38.
[13] Guo XD, Liu YY, Cheng JF, et al. Effects of acarbose versus fenofibrate on insulin sensitivity and β cell secretion in impaired glucose tolerance with hypertrigtyceridemia. Chin J Geriatr, 2012, 31(5):406-409. (in Chinese)郭行端, 刘衍宇, 成俊芬, 等. 阿卡波糖和非诺贝特对糖耐量低减伴高脂血症患者胰岛素敏感性和 β细胞分泌功能的影响. 中华老年医学杂志, 2012, 31(5):406-409.
[14] Deng GJ. To compare the clinical effect of acarbose and metformin in treating pre diabetes. Chin Foreign Med Res, 2015, 13(18):120-122. (in Chinese)邓广江. 阿卡波糖与二甲双胍治疗糖尿病前期的临床效果对比.中外医学研究, 2015, 13(18):120-122.
[15] Liu B, Liu WS, Han BQ, et al. Effect of chitooligosaccharides and its derivatives on regulating plasma lipid and improving antioxidant ability in diabetic mouse induced by STZ. J Shandong Univ (Nat Sci), 2006, 41(4):158-163. (in Chinese)刘冰, 刘万顺, 韩宝芹, 等. 壳寡糖及其衍生物对实验性糖尿病大鼠调节血脂和抗氧化作用. 山东大学学报(理学版), 2006, 41(4):158-163.
[16] Lu JM, Wang CY, Hu C, et al. GDF-15 enhances intracellular Ca2+ by increasing Cav1.3 expression in rat cerebellar granule neurons. Biochem J, 2016, 473(13):1895-1904.
[17] Bloch SA, Lee JY, Syburra T, et al. Increased expression of GDF-15 may mediate ICU-acquired weakness by down-regulating muscle microRNAs. Thorax, 2015, 70 (3):219-228.
[18] Fisher OM, Levert-Mignon AJ, Lord SJ, et al. MIC-1/GDF15 in Barrett’s oesophagus and oesophageal adenocarcinoma. Br J Cancer, 2015, 112(8):1384-1391.
[19] Lee J, Fricke F, Warnken U, et al. Reconstitution of TGFBR2-mediated signaling causes upregulation of GDF-15 in HCT116 colorectal cancer cells. PLoS One, 2015, 10(6):e0131506.
[20] Liu DD, Lu JM, Zhao QR, et al. Growth differentiation factor-15 promotes glutamate release in medial prefrontal cortex of mice through upregulation of T-type calcium channels. Sci Rep, 2016, 6:28653.
[21] Fiorentino TV, Suraci E, Arcidiacono GP, et al. Duodenal sodium/glucose co-transporter 1 expression under fasting conditions is associated with post-load hyperglycemia. J Clin Endocrinol Metab, 2017, 102(11):3979-3989.
[22] Li DH, Xu X, Yang XF. Effects on growth differentiation factor 15 and hs-CRP in patients with aged type 2 diabetics with coronary heart disease by different treatment. Chin J Evid Based Cardiovasc Med, 2016, 8(9):1053-1055. (in Chinese)李道鸿, 徐晓, 杨旭枫. 不同治疗方法对老年冠心病合并2型糖尿病患者血糖控制前后生长分化因子15、hs-CRP的影响. 中国循证心血管医学杂志, 2016, 8(9):1053-1055.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(6):539-544
2017中国生物制品年会胜利召开
由中国医药企业发展促进会、中国药学会生物药品与质量研究专业委员会、中华预防医学会生物制品分会、中国医药生物技术协会疫苗专业委员会、中国微生物学会生物制品专业委员会共同主办,由《中国新药杂志》有限公司、成都生物制品研究所有限责任公司承办的“2017中国生物制品年会暨第十七次全国生物制品学术研讨会”于11月20-21日在成都胜利召开。来自国内外的 1500 余名代表参会。
本次大会旨在积极推进生物医药领域技术、市场、资金、人才、管理等要素有效融合,展示我国生物医药发展成果,为参会的各位专家学者搭建沟通桥梁。会议期间,数十位海内外专家学者带来60场高质量的前沿专题报告,内容涉及生物医药领域的最新进展、国内外相关领域的最新研究成果以及我国生物医药研发政策法规等。
大会开幕式由中华预防医学会生物制品分会副主任委员沈心亮研究员主持。成都市人民政府副市长、成都高新区党工委书记范毅、中国食品药品检定研究院副院长王佑春研究员和成都天府国际生物城的代表致开幕词。
简明的开幕式后,由桑国卫院士、刘昌孝院士、林东昕院士、魏于全院士和王军志研究员五位国内著名专家分别带来了精彩纷呈的主题报告。大会主题报告由中国药学会生物药品与质量研究专业委员会主任委员王军志与中国医药企业发展促进会会长封多佳主持。报告期间会场掌声不断。
20-21日的分会场报告群英荟萃,55 位专家分别在“新型疫苗研发与评价”、“新型生物技术药研发与评价”、“基因与细胞治疗”3个分会场进行精彩演讲。
每一场学术报告都精彩纷呈,观众听众热情高涨,掌声跌宕起伏,整个会场学术氛围相当浓厚。
本次盛会多学科并进,不仅大大开拓了科技人员的科研思路,更为基础研究单位与应用单位加强合作交流搭建了良好的平台。
Study of the distribution of intestinal flora and serum levels of GDF-15 in patients with newly diagnosed type 2 diabetes by taking acarbose
ZHU Ya-xin, YANG Jian-rong, XIE Rong-di
ObjectiveTo investigate the distribution of intestinal flora and serum levels of GDF-15 in patients with newly diagnosed type 2 diabetes (T2DM) by taking acarbose.
MethodsWe selected 120 newly diagnosed T2DM patients in our hospital, who were randomly divided into the experimental group (n = 60) and the control group (n = 60). The patients in the control group were given placebo. The subjects in the experimental group were taken acarbose for 14 d. The blood glucose and lipid indexes of the two groups were compared. Enzyme linked immunosorbent assay (ELISA) was used to determine the level of serum GDF-15 in the control group and the experimental group. The 16SrRNA-V3 region of all bacteria in fecal samples was sequenced. The distribution and abundance of intestinal flora were analyzed, and cluster analysis was carried out at the same time in DNA. The intestinal flora was quantitatively detected by real-time quantitative PCR.
ResultsAfter treatment, the blood glucose and lipid, intestinal flora and the expression level of GDF-15 were significantly different between the two groups (P< 0.05). The intestinal flora of the experimental group changed obviously, and there was a significant difference between the improvement group and the no improvement group in blood glucose and blood lipid (P< 0.05). The expression level of GDF-15 in serum was positively related to the abundance of Bacteroides, Clostridium IV and Veillonella (P<0.05). It was negatively correlated with abundance of phylum firmicutes, Actinomyces, Prevotella, Lactobacillus, and Blautia cocci (P< 0.05).
ConclusionAcarbose can be effective in treating patients with newly diagnosed type 2 diabetes by affecting the distribution of intestinal flora and serum levels of GDF-15.
Diabetes mellitus, type 2; Acarbose; Growth differentiation factor 15; Intestinal flora
Author Affiliation:Department of Endocrinology, The Third People's Hospital of Longgang District, Shenzhen 518115, China
ZHU Ya-xin, Email: zhuyaxinsz84@163.com
10.3969/j.issn.1673-713X.2017.06.008
深圳市龙岗区经济与科技发展专项资金医疗卫生科技计划项目(2017040310345068)
518115 深圳市龙岗区第三人民医院内分泌科
朱雅欣,Email:zhuyaxinsz84@163.com
2017-09-11
www.cmbp.net.cn 中国医药生物技术, 2017, 12(6):539-544

