MiRNA-373在皮肤鳞状细胞癌的表达及对侵袭的影响
夏永华 侯慧芳 李敏 张彩凤 刘冬 胡华 张孟杰 程赛
453100河南卫辉,新乡医学院第一附属医院皮肤科(夏永华、李敏、刘冬、胡华、张孟杰、程赛),消化内科(张彩凤);新乡医学院基础医学院病理生理教研室(侯慧芳)
MiRNA-373在皮肤鳞状细胞癌的表达及对侵袭的影响
夏永华 侯慧芳 李敏 张彩凤 刘冬 胡华 张孟杰 程赛
453100河南卫辉,新乡医学院第一附属医院皮肤科(夏永华、李敏、刘冬、胡华、张孟杰、程赛),消化内科(张彩凤);新乡医学院基础医学院病理生理教研室(侯慧芳)
目的 分析microRNA-373(miR-373)在皮肤鳞状细胞癌(鳞癌)组织和细胞中的表达,探讨对皮肤鳞癌细胞侵袭的影响。方法 实时PCR检测皮肤鳞癌组织和细胞中miR-373的表达,将miR-373模拟物、miR-373抑制剂以及阴性对照miRNA转染皮肤鳞癌A431细胞,采用细胞侵袭实验分析miR-373表达下调对细胞侵袭的影响,采用Western印迹分析miR-373表达下调对MMP-2和MMP-9蛋白表达的影响。结果 皮肤鳞癌组织(2.465±0.218)和SCL-1细胞及A431细胞(1.864±0.178,2.919±0.277)中miR-373的表达水平显著高于瘤旁组织和细胞(1.000±0.000),差异有统计学意义(P<0.05)。在转移性的皮肤鳞癌患者(3.323±0.344)中,miR-373的表达显著高于非转移组(1.914±0.161),差异有统计学意义(t=4.158,P<0.01)。与未处理组和阴性对照组相比,miR-373模拟物显著增加皮肤鳞癌A431细胞中miR-373的表达水平和细胞的侵袭能力,而miR-373的抑制剂显著下调皮肤鳞癌A431细胞中miR-373的表达水平和细胞的侵袭,差异有统计学意义(均P<0.05)。结论 MiR-373表达下调显著抑制皮肤鳞癌A431细胞的侵袭,并能显著下调MMP-2和MMP-9蛋白的表达。
肿瘤,鳞状细胞;皮肤;微RNAs;肿瘤转移;microRNA-373
MiRNAs(miRNA)最初鉴定为一类短的单链小分子RNA[1],能调控许多靶基因的表达参与多种细胞生物学过程的调控[2-3]。由于miRNA具有重要的生物学功能,因此,异常miRNA的表达涉及人类疾病的发病机制,特别是肿瘤的发生发展[4]。近来,研究集中在miR-373与肿瘤发生发展的研究上,包括食道鳞状细胞癌(鳞癌)[5]、宫颈癌[6]、非小细胞肺癌[7]、胃癌[8]等。因此,我们用实时 PCR检测皮肤鳞癌组织和细胞中miR-373的表达,并分析其表达下调对皮肤鳞癌侵袭的影响,旨在为以miR-373为靶点的皮肤鳞癌的分子靶向治疗提供依据。
资料与方法
一、组织标本和细胞株
23例皮肤鳞癌组织和23例瘤旁组织均取自新乡医学院第一附属医院头面部皮肤外科手术切除标本,直径0.5~3 cm,鳞癌标本经组织病理学诊断为皮肤鳞癌。患者术前均未接受放疗、化疗和免疫治疗等。皮肤鳞癌中男15例,女8例;年龄41~75岁,年龄(55.6±8.67)岁;23例中鳞癌Ⅰ级14例,Ⅱ级8例,Ⅲ级1例;9例有淋巴结转移。对照组为外科手术切缘瘤旁组织。皮肤鳞癌细胞株(SCL-1)由德国柏林自由大学本杰明·富兰克林医学中心惠赠,皮肤鳞癌细胞株(A431)购于美国ATCC公司,HaCaT细胞购于德国CLS中心。本研究通过新乡医学院第一附属医院医学伦理委员会批准,患者均签署知情同意书。
二、实验材料
MiR-373模拟物、miR-373抑制剂以及阴性对照miRNA从上海吉玛公司购买;脂质体2000转染试剂购于美国Invitrogen公司;胎牛血清购于美国Gibco公司;实时PCR试剂盒购于天根生化科技(北京)有限公司;蛋白裂解液购于宝生物工程(大连)有限公司;鼠抗人单克隆抗体基质金属蛋白酶(MMP)2和MMP-9购于美国Santa Cruz公司。
三、细胞培养、转染及分组
SCL-1、A431和HaCaT细胞均培养在含10%的胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养液中,将上述细胞置于37℃,5%CO2相对饱和的培养箱中传代培养,上述实验细胞处于对数生长期。将MiR-373模拟物、miR-373抑制剂以及阴性对照miRNA分别转染皮肤鳞癌A431细胞中,于48 h进行实验。实验分组:未处理组(A431细胞不进行任何处理)、阴性对照组、miR-373模拟物组和miR-373抑制剂组。
四、实时PCR检测组织和细胞中miR-373的表达
按照Trizol试剂说明书,提取组织和细胞的总RNA,利用miR-373和U6反转录引物。miR-373 RT引物:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGG CAATTGCACTGGATACGACACACCC-3′,U6 RT 引物 5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCG CACTGGATACGACAAAATA-3′,均由吉凯生物公司合成)按操作说明进行反转录,采用实时PCR试剂盒的说明书分别扩增细胞中miR-373基因,并用U6基因作为内参照。hsa-miR-373-3p正向引物:5′-GGGAAGTGCTTCGATTTTG-3′,反 向 引 物 :5′-CAGTGCGTGTCGTGGAGT-3′;U6 正向引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′。MiR-373的相对表达量用2-△△Ct计算[9]。
五、细胞侵袭实验
将miR-373模拟物、miR-373抑制剂以及阴性对照miRNA转染皮肤鳞癌A431细胞中,将基底膜基质原液置于4℃冰箱过夜融化,将基底膜基质原液和预冷的无血清DMEM按照1∶3的比例配制侵袭小室的上室凝胶液,每孔50 μl包被侵袭小室的上室,放置37℃孵育箱孵育2 h使其成胶。Transwell小室上室每孔接种200 μl不含血清细胞悬液,下室加入含10%胎牛血清的DMEM培养基500 μl。 将Transwell板置于培养箱中继续培养24 h后用结晶紫染色。通过显微镜观察被染色细胞,并进行计数。实验重复3次取均值。
六、Western印迹检测MMP-2、MMP-9蛋白的表达
将miR-373模拟物、miR-373抑制剂以及阴性对照miRNA转染皮肤鳞癌A431细胞后48 h,收集4组不同处理的A431细胞,采用细胞裂解液提取总蛋白,进行SDS-PAGE电泳,并将凝胶上的蛋白电转移到硝酸纤维素(NC)膜上。用含5%脱脂奶粉的TBST封闭NC膜2 h,加入一抗(MMP-2、MMP-9和β肌动蛋白)1∶200,于4℃摇床孵育过夜。加入二抗室温孵育2 h。将NC膜置于ECL(增强化学发光试剂)中反应1~3 min,于暗室中曝光,并通过显影和定影进而显示特异的蛋白信号。蛋白表达的灰度值用Image-Pro Plus5.0软件进行分析,蛋白相对表达为目的基因与内参基因的比值,β肌动蛋白作为内参照。
七、统计学处理
结 果
一、MiR-373在皮肤鳞癌组织中的表达
皮肤鳞癌组织中miR-373的表达水平(2.465±0.218)显著高于瘤旁组织(1.000±0.000),差异有统计学意义(t=6.713,P<0.01)。转移组(9例)和非转移组(14例)中miR-373的表达,有淋巴结转移的皮肤鳞癌组织中miR-373的表达水平(3.323±0.344)显著高于非转移组(1.914±0.161),差异有统计学意义(t=4.158,P=0.0004)。见表1。
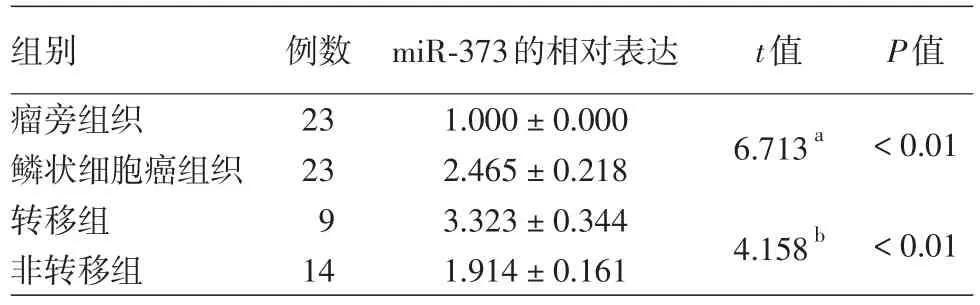
表1 miR-373在瘤旁组织和皮肤鳞状细胞癌组织中的表达
二、MiR-373在皮肤鳞癌细胞中的表达
2株皮肤鳞癌细胞株中miR-373的表达水平显著高于HaCaT细胞miR-373的表达,差异有统计学意义(P<0.05)。皮肤鳞癌A431细胞中miR-373的表达水平也显著高于另一株皮肤鳞癌SCL-1细胞,差异有统计学意义(P<0.05),见表2。miR-373模拟物、抑制剂以及阴性对照用来转染A431细胞,转染后48 h采用实时PCR检测不同组别的细胞中miR-373的表达结果表明,与未处理组和阴性对照组相比,miR-373模拟物显著增加皮肤鳞癌A431细胞中miR-373的表达水平,而miR-373的抑制剂显著下调皮肤鳞癌A431细胞中miR-373的表达水平,差异有统计学意义(均P<0.05)。见表2。

表2 MiR-373在不同皮肤细胞系及各组不同处理A431细胞的中的相对表达水平
三、MiR-373表达下调显著抑制A431细胞的侵袭能力
用Transwell小室分析miR-373表达下调对皮肤鳞癌A431细胞侵袭能力的影响,与未处理组和阴性对照组相比,miR-373的过表达显著增加A431细胞的侵袭能力,而抑制miR-373的表达显著降低A431细胞的侵袭能力,差异有统计学意义(P<0.05)。见表3。

表3 MiR-373表达水平的变化对皮肤鳞癌A431细胞侵袭细胞数的影响

图1 Western印迹检测不同处理组皮肤鳞状细胞癌A431细胞中MMP-2和MMP-9蛋白的表达 1:未处理组;2:阴性对照组;3:miR-373模拟物;4:miR-373抑制剂
四、MiR-373表达下调对MMP-2和MMP-9表达的影响
与未处理组和阴性对照组相比,miR-373的过表达显著增加MMP-2和MMP-9蛋白的表达,而miR-373表达下调显著抑制MMP-2和MMP-9蛋白的表达(图1)。
讨 论
研究表明,miR-373参与细胞增殖、凋亡、衰老、中内胚层分化、侵袭和转移等生物学调控作用。在一些肿瘤中,miR-373发挥癌基因的功能,而在另一些肿瘤中发挥抑癌基因的功能,包括:胆管癌[10]、结肠癌[11]、胰腺癌[12],miR-373的过表达显著抑制肿瘤的生长和增殖。可以推测miR-373在不同的肿瘤发生发展中具有不同的功能,可能与肿瘤的类型密切相关,因而阐明不同肿瘤中miR-373的表达模式,可能为肿瘤的早期诊断和靶向治疗奠定基础。本研究采用实时PCR检测23例皮肤鳞癌组织和对应的瘤旁组织中miR-373的表达,结果显示,皮肤鳞癌中miR-373的表达水平显著高于瘤旁组织,最为重要的是,miR-373在转移性的皮肤鳞癌患者中的表达水平显著高于非转移的皮肤鳞癌患者,提示miR-373在皮肤鳞癌中发挥癌基因的功能,可能成为皮肤鳞癌患者转移的预测指标之一。
最近研究表明,miRNAs是细胞迁移和侵袭的关键调节子[13],许多miRNAs有望开发成为肿瘤转移的预测因子。Zhao等[14]研究表明,miR-4775被鉴定为结肠癌转移和复发的高风险因子,在对544个结肠癌患者的研究中发现,miR-4775的高表达预示患者预后不佳。阐明miRNAs在肿瘤中侵袭和转移中的作用及其详细的分子机制有望为以miRNAs的肿瘤分子靶向治疗提供实验证据。miR-373首次在乳腺癌中被鉴定为促转移miRNA,采用正向基因筛选技术,Huang等[15]用miRNA表达文库转导乳腺癌MCF-7细胞,通过transwell细胞迁移分析其细胞迁移能力,从而鉴定miR-373作为促转移miRNA分子。最近研究显示,miR-373的过表达显著增强Eca109细胞的增殖,促进该细胞的迁移和侵袭,相关抑制miR-373的表达显著降低KYSE410细胞的增殖,并抑制该细胞的迁移和侵袭,这与TIMP3的表达密切相关[5]。为了证实miR-373在皮肤鳞癌迁移和侵袭中的作用,我们发现miR-373表达下调显著抑制皮肤鳞癌细胞的迁移和侵袭,进一步发现miR-373表达下调能抑制MMP-2和MMP-9的表达,提示miR-373可能在皮肤鳞癌的侵袭和转移中发挥作用,后续尚需进一步证实其调控皮肤鳞癌侵袭和转移的详细的分子机制。
综上所述,miR-373在皮肤鳞癌组织和细胞中高表达,其表达下调显著抑制皮肤鳞癌细胞的迁移和侵袭能力,可能与MMP-2和MMP-9表达下调密切相关,因而可能成为皮肤鳞癌潜在的新的治疗靶点。
[1]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[2]D′Angelo B,Benedetti E,Cimini A,et al.MicroRNAs:a puzzling tool in cancer diagnostics and therapy[J].Anticancer Res,2016,36(11):5571-5575.DOI:10.21873/anticanres.11142.
[3]Shah MY,Ferrajoli A,Sood AK,et al.microRNA therapeutics in cancer-an emerging concept[J].EBio Medicine,2016,12:34-42.DOI:10.1016/j.ebiom.2016.09.017.
[4]Berindan-Neagoe I,Monroig PC,Pasculli B,et al.MicroRNAome genome:a treasure for cancer diagnosis and therapy[J].CA Cancer J Clin,2014,64(5):311-336.DOI:10.3322/caac.21244.
[5]Liu W,Li M,Chen X,et al.MicroRNA-373 promotes migration and invasion in human esophageal squamous cell carcinoma by inhibiting TIMP3 expression[J].Am J Cancer Res,2016,6(1):1-14.
[6]Wang LQ,Zhang Y,Yan H,et al.MicroRNA-373 functions as an oncogene and targets YOD1 gene in cervical cancer[J].Biochem Biophys Res Commun,2015,459(3):515-520.DOI:10.1016/j.bbrc.2015.02.138.
[7]Seol HS,Akiyama Y,Shimada S,et al.Epigenetic silencing of microRNA-373 to epithelial-mesenchymal transition in non-small cell lung cancer through IRAK2 and LAMP1 axes[J].Cancer Lett,2014,353(2):232-241.DOI:10.1016/j.canlet.2014.07.019.
[8]Zhang X,Li X,Tan Z,et al.MicroRNA-373 is upregulated and targets TNFAIP1 in human gastric cancer,contributing to tumorigenesis[J].Oncol Lett,2013,6(5):1427-1434.DOI:10.3892/ol.2013.1534.
[9]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod[J].Methods,2001,25(4):402-408.DOI:10.1006/meth.2001.1262.
[10]Chen Y,Luo J,Tian R,et al.miR-373 negatively regulates methyl-CpG-binding domain protein 2(MBD2)in hilar cholangiocarcinoma[J].Dig Dis Sci,2011,56(6):1693-1701.DOI:10.1007/s10620-010-1481-1.
[11]Tanaka T,Arai M,Wu S,et al.Epigenetic silencing of microRNA-373 plays an important role in regulating cell proliferation in colon cancer[J].Oncol Rep,2011,26(5):1329-1335.DOI:10.3892/or.2011.1401.
[12]Nakata K,Ohuchida K,Mizumoto K,et al.Micro RNA-373 is down-regulated in pancreatic cancer and inhibits cancer cell invasion[J].Ann Surg Oncol,2014,21 Suppl 4:S564-574.DOI:10.1245/s10434-014-3676-8.
[13]Pencheva N,Tavazoie SF.Control of metastatic progression by microRNA regulatory networks[J].Nat Cell Biol,2013,15(6):546-554.DOI:10.1038/ncb2769.
[14]Zhao S,Sun H,Jiang W,et al.miR-4775 promotes colorectal cancer invasion and metastasis via the Smad7/TGFβ-mediated epithelial to mesenchymal transition[J].Mol Cancer,2017,16(1):12.DOI:10.1186/s12943-017-0585-z.
[15]Huang Q,Gumireddy K,Schrier M,et al.The microRNAs miR-373 and miR-520c promote tumour invasion and metastasis[J].Nat Cell Biol,2008,10(2):202-210.DOI:10.1038/ncb1681.
Expression of microRNA-373 in cutaneous squamous cell carcinoma and its effect on cell invasion
Xia Yonghua,Hou Huifang,Li Min,Zhang Caifeng,Liu Dong,Hu Hua,Zhang Mengjie,Cheng Sai
Department of Dermatology,The First Affiliated Hospital of Xinxiang Medical University,Weihui 453100,Henan,China(Xia YH,Li M,Liu D,Hu H,Zhang MJ,Cheng S);Department of Gastroenterology,The First Affiliated Hospital of Xinxiang Medical University,Weihui 453100,Henan,China(Zhang CF);Department of Pathophysiology,School of Basic Medical Sciences,Xinxiang Medical University,Weihui 453100,Henan,China(Hou HF)
Xia Yonghua,Email:751195651@qq.com
Objective To investigate the expression of microRNA-373(miR-373)in cutaneous squamous cell carcinoma(CSCC)tissues and cells,and to explore its effects on cell invasion.Methods Real-time PCR was performed to determine the expression of miR-373 in CSCC tissues and paralesional normal skin tissues,as well as in CSCC cell lines(A431 and SCL-1)and HaCaT cells.A431 cells were divided into 4 groups:miR-373 mimic group,miR-373 inhibitor group and negative control group which were transfected with miR-373 mimic,miR-373 inhibitor and negative control miRNA respectively,and untreated group receiving no treatment.Cell invasion assay was performed to evaluate effects of miR-373 downregulation on cell invasion.Western blot analysis was conducted to assess effects of miR-373 downregulation on the protein expression of matrix metalloproteinase-2(MMP-2)and MMP-9.Results Expression of miR-373 was significantly higher in the CSCC tissues(2.465 ± 0.218) than in the paralesional normal skin tissues(1.000 ± 0.000,P < 0.05),and higher in SCL-1 cells(1.864 ± 0.178)and A431 cells(2.919 ± 0.277)than in HaCaT cells(1.000 ± 0.000,P < 0.05).Most notably,miR-373 expression was also markedly higher in metastatic CSCC tissues than in non-metastatic CSCC tissues(3.323 ±0.344 vs.1.914 ± 0.161,t=4.158,P=0.000 4).Compared with the untreated group and negative control group,the miR-373 mimic group showed significantly increased miR-373 expression and invasive ability,while the miR-373 inhibitor group showed markedly decreased miR-373 expression and invasive ability(all P < 0.05).Conclusion MiR-373 downregulation can significantly suppress the invasion of A431 cells,and obviously decrease the protein expression of MMP-2 and MMP-9.
Neoplasms,squamous cell;Skin;MicroRNAs;Neoplasm metastasis;MicroRNA-373
夏永华,Email:751195651@qq.com
10.3760/cma.j.issn.0412-4030.2017.10.005
河南省教育厅科学技术研究重点项目(2011A320017);新乡医学院科研培育基金(2013QN118)
Fund programs:Key Program for Science and Technology Research of Henan Educational Committee (2011A320017);Scientific Research Cultivation Fund of Xinxiang Medical University(2013QN118)
2016-12-23)
(本文编辑:吴晓初)

