桑葚浓缩汁对D-半乳糖诱导氧化损伤大鼠肾脏的保护作用
黄 磊,彭新颜,*,于海洋,李华敏,毛慧敏,张 辉,邱静茹
(1.鲁东大学食品工程学院,山东 烟台 264025;2.山东商务职业学院食品工程系,山东 烟台 264670)
桑葚浓缩汁对D-半乳糖诱导氧化损伤大鼠肾脏的保护作用
黄 磊1,彭新颜1,*,于海洋2,李华敏1,毛慧敏1,张 辉1,邱静茹1
(1.鲁东大学食品工程学院,山东 烟台 264025;2.山东商务职业学院食品工程系,山东 烟台 264670)
研究桑葚浓缩汁对氧化损伤大鼠肾脏的保护作用。采用D-半乳糖(D-galactose,D-Gal)建立衰老模型,将实验大鼠随机分为6 组:空白对照组、阴性对照组(D-Gal模型)、阳性对照组(D-Gal+VE)、桑葚浓缩汁低、中、高剂量组。通过检测大鼠肾脏组织匀浆中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力、丙二醛(malondialdehyde,MDA)含量,测定大鼠血清一氧化氮(nitric oxide,NO)、血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,Scr)浓度、总抗氧化能力(total antioxidant capacity,T-AOC)及B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2-associated X protein,Bax)基因的表达,并通过病理组织学切片评价桑葚浓缩汁对氧化损伤蛋白的影响。结果表明:与阴性对照组相比,桑葚浓缩汁中、高剂量组可以显著提高肾组织SOD、GSH-Px、CAT活力和T-AOC(p<0.05);降低MDA、BUN及Scr浓度;抑制NO浓度升高(p<0.05),并成一定量效依赖关系;Bax表达降低;其中桑葚浓缩汁高剂量效果最好,GSH-Px活力为150.33 U、Scr浓度为34.54 μmol/L、BUN浓度为8.96 mmol/L,均达到了阳性对照组水平(P>0.05);NO浓度为29.78 μmol/L,达到空白对照组水平(P>0.05)。病理学组织切片显示,与阴性对照组相比,桑葚处理组症状明显减轻,尤其中、高剂量组,极少量肾小管上皮细胞胞浆疏松、淡染,无明显的充血、出血。综上所述,桑葚浓缩汁对D-Gal诱导氧化损伤大鼠肾脏有较好的保护作用。
桑葚浓缩汁;D-半乳糖;氧化损伤;肾脏保护作用
衰老是随着年龄增长机体自身结构和功能衰退,也是机体适应性和抵抗力下降的一个自发过程[1]。引起衰老的因素有很多种,包括端粒缩短、癌基因激活及活性氧自由基引起的DNA损伤等,其中最为关键的因素是自由基代谢失衡[2]。自由基学说认为,由于机体自由基过量产生,组织器官结构和功能发生紊乱,引起机体衰老。为了延缓衰老,最理想的方法是向食物中添加抗氧化剂,抑制氧化的发生[3]。目前,合成抗氧化剂虽被广泛用于食品,但是其安全性受到质疑,如将二叔丁基羟基甲苯及其代谢产物注射到雄性幼鼠腹膜内,会使大鼠肺细胞增生、肺组织质量增加。因此,国外不少发达国家已明令禁止在食品或部分食品中使用合成抗氧化剂[4]。可见,开发天然、安全、高效的食品抗氧化剂具有广阔发展前景。
桑葚富含VC、多酚、花青素、胡萝卜素、黄酮、硒等成分[5],并且具有防衰老、抗氧化、调节免疫、降脂、降血糖的生理功效[6],是天然抗氧化剂的良好来源。目前,国内外对于桑葚的研究多集中在桑葚花青素、多酚、多糖、花色苷等单独成分的作用效果[7],而对桑葚全果实或全果汁的抗氧化研究鲜有报道。2000年,Eberhardt等[8]提出了“全食品”对健康有益的新理念。有研究表明D-半乳糖(D-galactose,D-Gal)能使大鼠肾小球球体缩小、肾小球稀疏且形状不规则、肾小囊囊腔明显扩大、组织病理改变,类似人类肾脏衰老[9]。因此,本课题以建立D-Gal衰老模型为切入点,以桑葚全浓缩果汁为研究对象,探讨浓缩汁对氧化应激大鼠肾脏的保护作用。这将对实际生产和开发天然功效产品具有重要的现实意义。
1 材料与方法
1.1 材料与试剂
新鲜无籽大十桑葚(Fructus Mori) 烟台惠安市场。
清洁级2 月龄健康Wistar雄性大鼠,由北京维通利华实验动物中心提供,共82 只,体质量280~320 g,合格证号:SCXK(京)2011-0011,使用许可证号:SYXK(鲁)20160022。
VE、D-Gal粉剂(原装) 上海伯奥生物科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、一氧化氮(nitric oxide,NO)试剂盒、血尿素氮(blood urea nitrogen,BUN)试剂盒、血清肌酐(serum creatinine,Scr)试剂盒 南京建成生物工程研究所;B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2-associated X protein,Bax)免疫组化试剂盒 美国Bioworld Technology公司。
1.2 仪器与设备
YB-P50001型电子天平 北京长拓锐新科技发展有限公司;722型紫外-可见分光光度计 上海光谱仪器有限公司;101A型电热鼓风干燥箱 德国Leica公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;HTZ-1013榨汁机 江门市恒天科技有限公司出品;XD811F型快速生化分析仪 武汉三丰医疗设备有限公司;DY89Ⅱ电动玻璃匀浆机 浙江宁波新芝生物科技股份有限公司;CK40型光学显微镜 日本Olympus公司。
1.3 方法
1.3.1 桑葚浓缩汁的制备流程
新鲜桑葚→洗净晾干→榨汁(出汁率约70%~80%)→4、8 层纱布分别过滤3 次→0.45 μm膜过滤→桑葚原汁→浓缩2 倍→4 ℃冷藏保存备用
1.3.2 D-Gal致衰老模型大鼠的建立
将大鼠分笼、给予标准饮食,饲养1 周后,随机分为6 组:空白对照组、阴性对照组(D-Gal模型)、阳性对照组(D-Gal+VE)、桑葚浓缩汁低、中、高剂量组,期间有淘汰,最终每组10 只。空白对照组大鼠颈背部皮下注射生理盐水并于第2周给予50 mg/kg双蒸水。其他5 组于第2周颈背部注射D-Gal(120 mg/kg),每日注射1 次,连续注射8 周建立衰老模型;并于第2周每日分别灌胃50 mg/kg双蒸水,50 mg/kg VE,2.5、5.0、10.0 mL/kg桑葚浓缩汁(以体质量计)。
1.3.3 血清的制备和生化指标测定
灌胃56 d后,摘眼球取血,血样于4 ℃冰箱放置12 h,3 000 r/min离心10 min,取上清液,即为血清样品。严格参照试剂盒说明书步骤分别测定血清中Scr(Jeff法[10])浓度、BUN(脲酶法[10])浓度、T-AOC(比色法[11],单位定义为在37 ℃,每分钟每毫升血清使反应体系的吸光度增加0.01)和NO(硝酸还原酶法[12])浓度的变化。
1.3.4 肾脏组织制备和生化指标测定
断椎处死大鼠,解剖取出肾脏,剔除表面脂肪及筋膜,用生理盐水洗去多余血液(4 ℃),滤纸吸收水分,天平称质量并匀浆,用生理盐水稀释成10%肾脏匀浆液,按试剂盒说明书的方法测定肾脏组织中相关指标。GSH-Px活力使用比色法[11]测定,每0.1 mL血清在37 ℃反应5 min,扣除非酶促反应作用,使体系中谷胱甘肽浓度降低1 μmol/L为一个酶活力单位。SOD活力使用黄嘌呤氧化酶比色法[12]测定,以反应体系产生的超氧阴离子的自由基清除率定义为一个酶活力单位。CAT活力使用紫外法[11]测定,每克血红蛋白中CAT每秒钟分解吸光度为0.50~0.55底物中的过氧化氢相对量为一个酶活力单位。MDA含量使用硫代巴比妥酸法[12]测定。
1.3.5 病理组织学检查
采用石蜡切片观察病理变化,取大鼠肾组织,体积约为2.0 cm×2.0 cm×0.3 cm。经甲醛固定后,再经80%、90%、95%、100%乙醇脱水、石蜡包埋、切片机切片、苏木素-伊红法(hematoxylin-eosin,HE)染色、封片等步骤制成切片,在光学显微镜下观察病理变化。
1.3.6 免疫组化检测肾组织Bax蛋白表达
大鼠肾组织经常规脱蜡、水化后,滴加一抗(Bax单克隆抗体(1∶50 稀释))、二抗(生物素化羊抗兔IgG(1∶100 稀释)),按试剂盒方法对切片标本进行染色,3,3-四盐酸二氨基联苯胺显色,蒸馏水洗、染色、脱水、封片,显微镜观察,免疫组化阳性产物定位于细胞质,表现为棕黄色颗粒。
1.4 数据统计分析
实验结果表示为 ±s。采用Excel 6.0和Sigmaplot 12.0软件作图,采用Statistix 8.1软件包中Linear Models程序进行统计,差异显著性(p<0.05)分析使用Tukey HSD程序。
2 结果与分析
2.1 桑葚浓缩汁对D-Gal致衰老大鼠肾脏SOD活力的影响
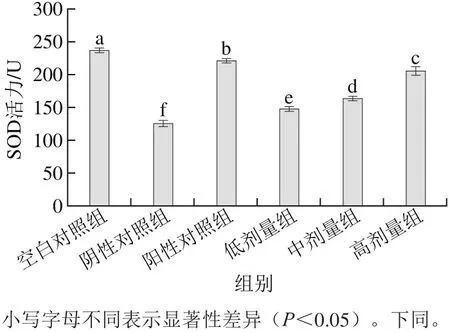
图1 桑葚浓缩汁对D-Gal致衰老大鼠肾脏SOD活力的影响Fig. 1 Effect of mulberry juice concentrate on SOD activity in kidney tissue of aging rats
造模后,阴性对照组大鼠肾组织SOD活力明显低于空白对照组(p<0.05)(图1),说明造模成功。在桑葚浓缩汁处理组中,以桑葚浓缩汁高剂量组的SOD活力为最好,其活力为204.07 U,比低、中剂量组分别提高了39.3%和24.9%,但没有达到空白对照组和阳性对照组效果(p<0.05)。
多元社会思潮的影响。当前,社会上各种自由主义、功利主义蔓延至大学校园,对大学生的思想道德进行侵蚀,对主流教育思想构成了威胁,部分大学生对传统文化进行了全盘否定,一味追求“符号化”“快餐化”的文化价值观。这是导致大学生文化自信不足直接原因。
2.2 桑葚浓缩汁对D-Gal致衰老大鼠肾脏GSH-Px活力的影响
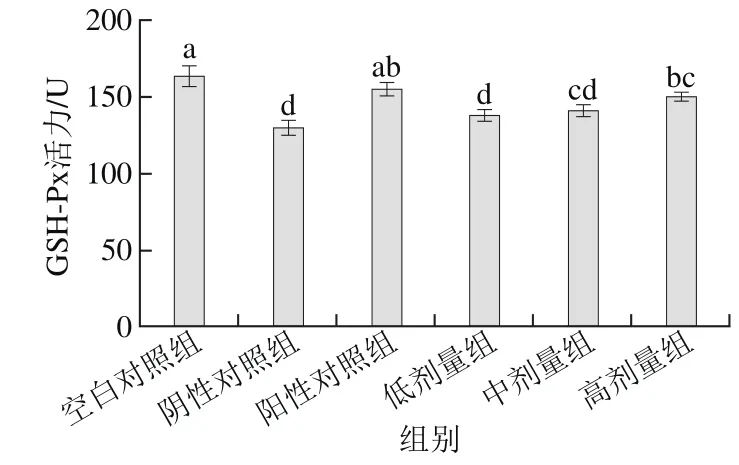
图2 桑葚浓缩汁对D-Gal致衰老大鼠肾脏GSH-Px活力的影响Fig. 2 Effect of mulberry juice concentrate on GSH-Px activity in aging rats
如图2所示,桑葚浓缩汁的低、中、高剂量组GSH-Px活力分别为137.60、140.63、150.33 U。高剂量组效果最好,与阴性对照组相比差异显著(p<0.05),且比低、中剂量组和阴性对照组分别提高了9.3%、6.9%和15.9%,达到阳性对照组水平(P>0.05)。
2.3 桑葚浓缩汁对D-Gal致衰老大鼠肾脏CAT活力的影响
由图3可以看出,低、中、高剂量组的CAT活力分别为252.93、277.40、314.20 U,与阴性对照组相比均有明显提高(p<0.05),表明通过添加桑葚浓缩汁可以提高CAT活力;其中以高剂量组的提高效果最佳,比低、中剂量组CAT活力分别高了61.27、36.80 U,但未达到阳性对照组和空白对照组水平(P>0.05)。
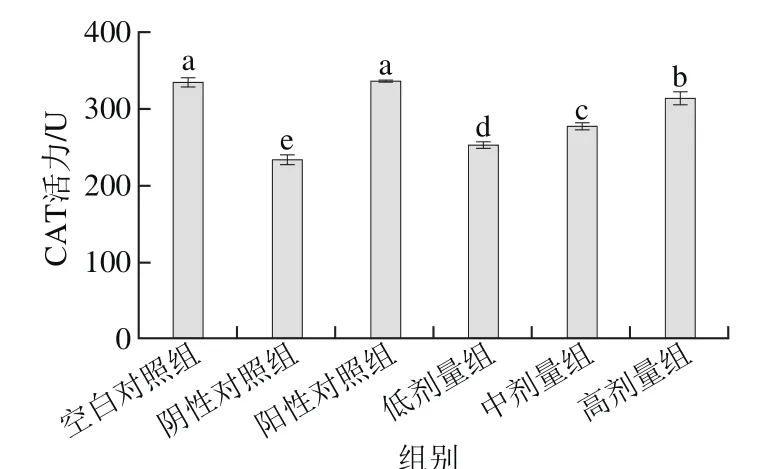
图3 桑葚浓缩汁对D-Gal致衰老大鼠肾脏CAT活力的影响Fig. 3 Effect of mulberry juice concentrate on CAT activity in aging rats
2.4 桑葚浓缩汁对D-Gal致衰老大鼠肾脏MDA含量的影响
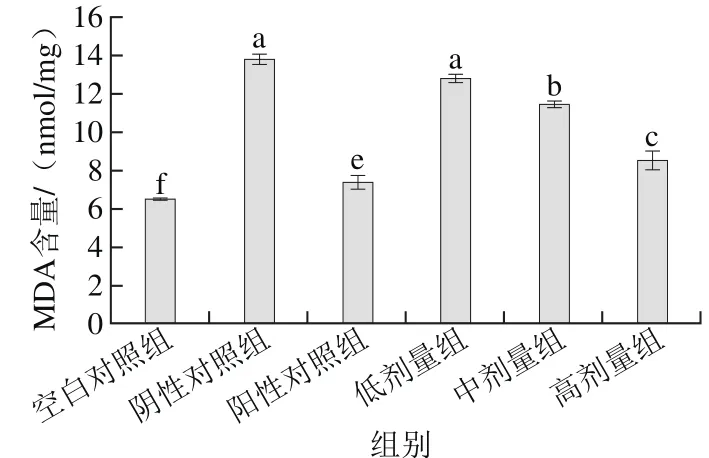
图 4 桑葚浓缩汁对D-Gal致衰老大鼠肾脏MDA含量的影响Fig. 4 Effect of mulberry juice concentrate on MDA level in aging rats
由图4可以看出,与空白对照组比,阴性对照组衰老大鼠肾脏MDA含量显著增加(p<0.05),表明MDA含量与大鼠肾脏氧化应激反应有一定联系;低、中、高剂量组MDA含量分别为12.86、11.47 nmol/mg和8.54 nmol/mg,与阴性对照组相比,分别降低了7.1%、17.2%和38.3%,表明高剂量组桑葚浓缩汁效果最佳;但均未达到阳性对照组和空白对照组的水平(p<0.05)。
2.5 桑葚浓缩汁对D-Gal致衰老大鼠血清NO浓度的影响
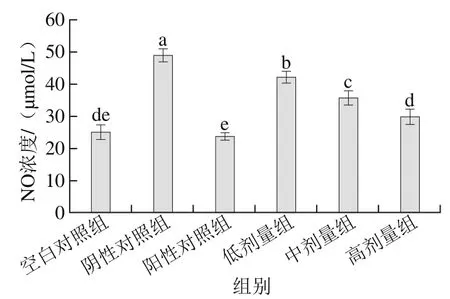
图5 桑葚浓缩汁对D-Gal致衰老大鼠血清NO浓度的影响Fig. 5 Effect of mulberry juice concentrate on serum NO level in aging rats
如图5所示,桑葚浓缩汁低、中、高剂量组均具有降低血清中NO浓度的作用,并且呈一定的剂量依赖关系(p<0.05)。高剂量组比阴性对照组降低了39.4%,并显著低于低、中剂量组(p<0.05),表明高剂量桑葚浓缩汁能明显降低D-Gal致衰老大鼠血清中NO浓度。
2.6 桑葚浓缩汁对D-Gal致衰老大鼠血清T-AOC的影响
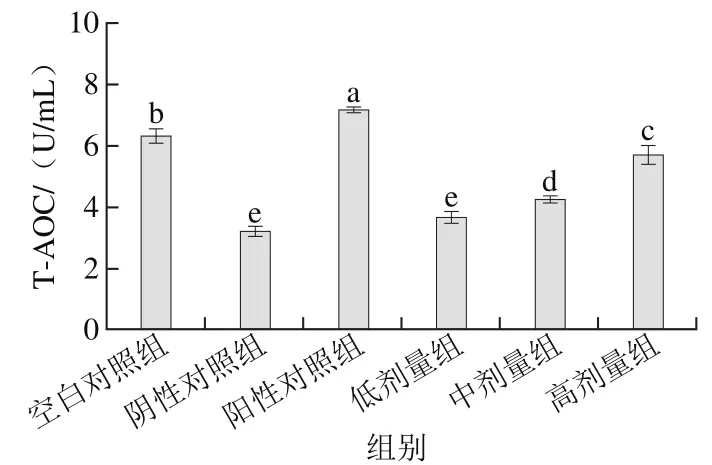
图6 桑葚浓缩汁对D-Gal致衰老大鼠血清T-AOC的影响Fig. 6 Effect of mulberry juice concentrate on serum T-AOC in aging rats
如图6所示,桑葚浓缩汁的低、中、高剂量组的T-AOC分别为3.66、4.23、5.67 U/mL,其中高剂量组比低、中剂量组和阴性对照组分别增加了54.9%、31.4%和77.7%,但未达到阳性对照组和空白对照组的水平(p<0.05),说明高剂量桑葚浓缩汁对D-Gal致衰老大鼠血清T-AOC的影响最为显著(p<0.05)。
2.7 桑葚浓缩汁对D-Gal致衰老大鼠Scr浓度的影响
如图7所示,桑葚浓缩汁的低、中、高剂量组均能显著抑制Scr浓度升高(p<0.05)。其中,中、高剂量组比阴性对照组分别降低了55.1%和54.4%,其中高剂量组Scr浓度为34.54 μmol/L,均达到了阳性对照组及空白对照组效果水平(P>0.05),结果表明桑葚浓缩汁在一定剂量范围内具有抑制Scr浓度升高的作用。
2.8 桑葚浓缩汁对D-Gal致衰老大鼠血清BUN浓度的影响
如图8所示,与阴性对照组相比,桑葚浓缩汁的低、中、高剂量组均能显著抑制BUN浓度升高(p<0.05),分别比阴性对照组降低了32.85%、59.03%、65.85%,其中高剂量组为8.96 mmol/L,已达到阳性对照组和空白对照组水平(P>0.05),表明高剂量组桑葚浓缩汁效果最佳。
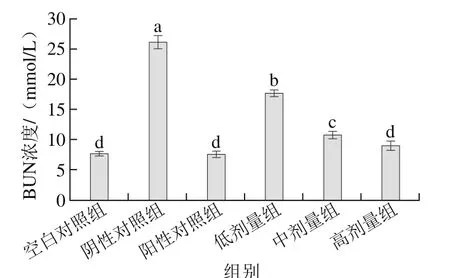
图8 桑葚浓缩汁对D-Gal致衰老大鼠血清BUN浓度的影响Fig. 8 Effect of mulberry juice concentrate on serum BUN in aging rats
2.9 HE染色显微镜观察肾脏组织结构

图9 各处理组大鼠肾脏病理学切片Fig. 9 Histopathological examination of kidney tissues
由图9可以看出,空白对照组大鼠肾脏的结构完整,肾皮质部肾小球及其周围肾小管结构清晰,球囊腔清晰可见,间质无充血、水肿。阴性对照组大鼠肾脏的皮质部肾小管上皮细胞体积增大,胞浆疏松淡染、浊肿,部分区域肾间质淤血、出血,炎细胞浸润。桑葚浓缩汁低、中、高剂量组与阴性对照组比较,症状明显减轻,尤其中、高剂量组,极少量肾小管上皮细胞胞浆疏松、淡染,无明显的充血、出血。阳性对照组与空白对照组比较无明显差异。
2.10 桑葚浓缩汁对D-Gal致衰老大鼠肾脏Bax蛋白表达的影响
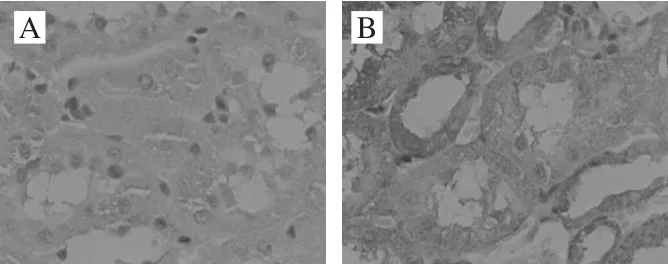
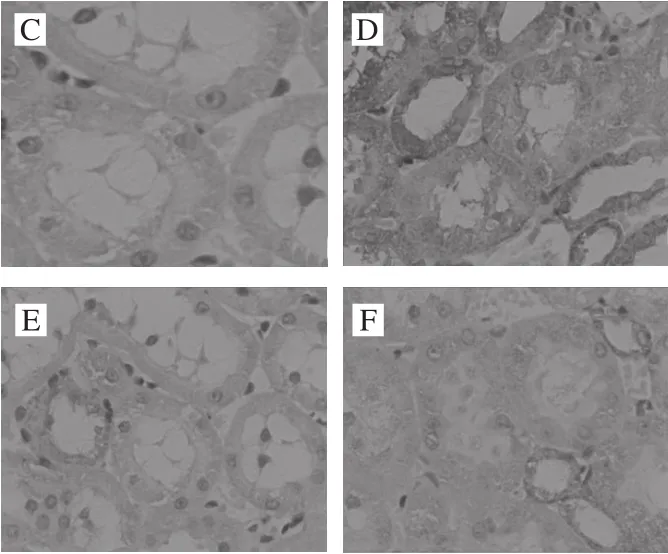
图10 各处理组大鼠肾脏组织Bax表达Fig. 10 Bax expression in kidney tissues
Bax是促凋亡因子,参与组织细胞的凋亡。由图10可见,其阳性表达部位主要是肾小管上皮细胞的胞浆,出现棕黄色颗粒。在正常组中,Bax的表达率低。而阴性对照组与空白对照组比较,具有明显差异,Bax的阳性表达明显增高,出现深棕黄色颗粒。而与阴性对照组比较,中、高剂量组Bax表达明显减少,低剂量组差异不明显。
3 讨 论
外源性的D-Gal可有效诱导细胞内大量活性氧自由基的生成,造成组织器官的氧化性损害,是加速衰老的重要诱因,也是目前公认的衰老动物造模方法[13]。抗氧化酶系统是机体抗自由基损伤的重要防御体系,其中SOD能消除超氧阴离子自由基(),在机体内可使歧化为O2和H2O2,若机体SOD活力降低,就会造成组织细胞的损伤,并导致疾病的发生[14];GSH-Px在体内的主要作用是催化还原型谷胱甘肽变成氧化型谷胱甘肽[15],从而保护细胞膜结构和功能不受过氧化物的干扰损害[16]。CAT是一种中心酶,可以将H2O2分解为H2O和O2-·,从而防止H2O2积累,降低氧化对生物的危害[17]。MDA是脂质氧化分解的产物,其含量反映了氧自由基水平和过氧化反应强度和速率,因此MDA可以间接反映细胞和组织损伤程度[18]。本实验结果表明,桑葚浓缩汁能提高肾脏组织SOD、GSH-Px、CAT活力、降低MDA浓度,高剂量效果最好。这表明桑葚浓缩汁在消除自由基方面可发挥作用,进而延缓机体衰老。与之相似,目前已发现很多具有抗氧化活性的植物提取物能够提高抗氧化酶活力和降低MDA含量。如Fan Jing等[19]发现川楝素多糖可以通过提高大鼠肾脏中SOD、GSH-Px的活力,降低MDA的含量,提高大鼠机体抗氧化活性,减轻氧化损伤。Vranješ等[20]报道,实验组大鼠在用荷兰芹和熊果叶等植物提取物饲养后,与正常组的大鼠相比,大鼠肾脏中抗氧化酶活力明显升高,表现出良好的抗氧化活性。Jiang Yan等[21]也发现,蓝莓花青素可以通过增强CAT等抗氧化酶活力,对氧化损伤的大鼠肾脏起到保护作用。Zhang Zifeng等[22]的研究表明,大鼠经D-Gal诱导造成肾脏氧化损伤后,若灌胃紫甘薯色素则可以减轻损伤的症状;Momeni等[23]经实验后也发现,姜黄色素可以降低肾脏中MDA含量,从而起到抗氧化的作用。
BUN和Scr是临床上用于检查肾功能的主要指标之一[24]。血清BUN是蛋白质和氨基酸代谢的最终产物,Scr经常被用于表征肾衰、尿毒症等病理指标,因此肾脏机能与BUN和Scr水平有着密切的联系[25]。另外,NO是体内重要的信号分子和内源性血管扩张物质,在正常生理情况下,少量NO对肾脏有一定的保护作用,而病理状态时,过量NO是造成组织细胞氧化应激损伤的主要原因[26]。本实验表明,与阴性对照组比,3 种剂量的桑葚浓缩汁均能显著降低血清BUN、Scr和NO水平(p<0.05),表明桑葚浓缩汁能有效抑制D-Gal所致肾细胞损伤,具有改善大鼠肾功能的作用,而且呈一定的量效关系。Al-Attar等[27]研究发现,如果给大鼠灌胃一定剂量具有抗氧化功能的橄榄叶和杜松叶提取物可以显著地降低大鼠血清BUN水平,减少氧化SS损伤。Ouyang Mingzi等[28]也证明,灵芝提取物同样也能够降低大鼠血清中Scr水平,有效地抑制D-Gal所致肾细胞损伤并保护肾脏。Huang Yi等[29]也报道山姜素同样可以降低大鼠血清BUN和Scr水平。Momeni等[23]研究发现姜黄素可以降低亚砷酸钠大鼠模型肾脏中NO含量,起到抗氧化、保护肾脏的作用。Shan Qun等[30]证明,如果给高脂饮食大鼠灌胃适当剂量紫甘薯色素,能够显著降低高脂饮食大鼠NO生成,起到保护肾脏作用。
Bax是细胞凋亡调控的关键信号介质,Bax具有促凋亡作用,因此通过测定生物体Bax蛋白水平可以间接反映生物体的抗氧化性能[31]。在D-Gal致衰老模型大鼠的模型组中,Bax的表达率较高,但经灌胃楔叶茶蔍后,Bax的表达明显下降,说明楔叶茶蔍对于抑制细胞凋亡具有较好效果,具有抗氧化功能[32]。本实验病理切片也同样说明,不同剂量桑葚浓缩汁能减轻肾脏破坏程度,尤其中、高剂量组,只有极少数肾小管上皮细胞胞浆疏松、淡染,无明显的充血、出血,改善效果明显。
近年来,众多蔬菜水果表现出良好的抗氧化活性,其有效成分几乎涉及各类植物成分,包括维生素类(VC、VE、类胡萝卜素)、多酚类(酚酸、黄酮、单宁)、多糖类、皂苷类和生物碱类等。桑葚富含大量具有抗氧化活性的生物活性物质,如类黄酮、类柠檬苦素、香豆素类、类胡萝卜素等,而且在预防心脑血管疾病、癌症以及炎症等方面具有突出的效果。Yue Chanjuan等[17]研究发现,桑葚果实的抗氧化能力随品种而异,其抗氧化活性与可溶性固体、滴定酸、酚醛树脂和花青素含量有关。Wang Lihua等[33]分析桑葚中总酚、总黄酮、总花青素等成分及含量,发现这些成分含量决定着其抗氧化活性,而且桑葚多酚可作为清除剂和还原剂[34]。Jiang Dongqing等[5]也报道,桑葚中花青素与VC或5 种花青素单体的1,1-二苯基-2-三硝基苯肼自由基清除率相同。邓秀婷等[35]用不同剂量的桑葚提取液灌胃大鼠40 d,发现其血清及肝脏中SOD、GSH-Px活力升高,MDA含量下降。可见,桑葚含有总酚、黄酮、东莨菪素、花青素多种抗氧化成分。本实验中桑葚浓缩汁能够对D-Gal所致衰老大鼠肾脏有保护作用,可能是由于桑葚各种不同的抗氧化成分之间存在相互补充、互相协调的关系,在体内通过作用于抗氧化和氧化酶系统、影响Bax表达、减少脂质过氧化物含量、降低BUN和Scr水平等多种途径联合发挥抗氧化、防衰老作用。
桑葚浓缩汁对D-Gal氧化损伤大鼠有保护作用,这可能与其通过多途径清除体内代谢紊乱所产生的自由基相关。表现为提高肾脏组织抗氧化酶系CAT、SOD和GSH-Px活力、降低NO、MDA、BUN和Scr水平、抑制Bax的表达,而且大鼠肾脏病理学切片也证实,桑葚浓缩汁可以在一定程度上保护肾组织结构,对延缓D-Gal引起肾脏的损伤、改善衰老状态起到良好的作用。
[1] WANG Meixian, ZHANG Yuxuan, GUO Peiyong. Effect of florfenicol and thiamphenicol exposure on the photosynthesis and antioxidant system of Microcystis fl os-aquae[J]. Aquatic Toxicology,2017, 186: 67-76. DOI:10.1016/j.aquatox.2017.02.022.
[2] VULETA A, JOVANOVIĆ M S, TUCIĆ B. Adaptive flexibility of enzymatic antioxidants SOD, APX and CAT to high light stress:the clonal perennial monocot Iris pumila as a study case[J]. Plant Physiology and Biochemistry, 2016, 100: 166-173. DOI:10.1016/j.plaphy.2016.01.011.
[3] AKPINAR O, NAZIROĞLU M, AKPINAR H. Different doses of dexmedetomidine reduce plasma cytokine production, brain oxidative injury, PARP and caspase expression levels but increase liver oxidative toxicity in cerebral ischemia-induced rats[J]. Brain Research Bulletin,2016, 130: 1-9. DOI:10.1016/j.brainresbull.2016.12.005.
[4] SUHAJ M. Spice antioxidants isolation and their antiradical activity: a review[J]. Journal of Food Composition and Analysis, 2006, 19(6/7):531-537. DOI:10.1016/j.jfca.2004.11.005.
[5] JIANG Dongqing, GUO Ying, XU Dianhong, et al. Antioxidant and anti-fatigue effects of anthocyanins of mulberry juice purification(MJP) and mulberry marc purif i cation (MMP) from different varieties mulberry fruit in China[J]. Food and Chemical Toxicology, 2013, 59:1-7. DOI:10.1016/j.fct.2013.05.023.
[6] SHIH P H, CHAN Y C, LIAO J W, et al. Antioxidant and cognitive promotion effects of anthocyanin-rich mulberry (Morus atropurpurea L.)on senescence-accelerated mice and prevention of Alzheimer’s disease[J]. The Journal of Nutritional Biochemistry, 2010, 21(7): 598-605. DOI:10.1016/j.jnutbio.2009.03.008.
[7] CHEN Yao, ZHANG Weijie, ZHAO Ting, et al. Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J]. Food Chemistry, 2016, 194: 712-722. DOI:10.1016/j.foodchem.2015.08.084.
[8] EBERHARDT M V, LEE C Y, LIU R H. Antioxidant activity of fresh apples[J]. Nature, 2000, 405(6789): 903-904.
[9] 龚玉芳, 于晓敏, 关丽华, 等. 灯盏花素对D-半乳糖引起小鼠记忆障碍及肝、肾异常变化的影响[J]. 中药药理与临床, 2012, 28(1): 73-76.
[10] 尚立芝, 崔明霞, 王建人. 川芎嗪预处理对大鼠肾脏缺血再灌注损伤的保护作用[J]. 河南医学研究, 2006(3): 215-217.
[11] 宋家乐, 周燕园, 赵超超, 等. 六堡茶总黄酮对老龄小鼠抗氧化功能的影响[J]. 食品研究与开发, 2016, 37(20): 173-176.
[12] 宋春梅, 马洪波, 王长文, 等. 老龄大鼠心脏和脑组织中NO、SOD和MDA含量与衰老的关系[J]. 吉林医药学院学报, 2005(3): 130-131.
[13] 陈贵堂, 赵立艳, 赵霖, 等. 花生肽对半乳糖致大鼠肝损伤的抑制作用[J]. 食品科学, 2011, 32(5): 296-300.
[14] YOSHIOKA Y, FUJIBAYASHI H, KAMEDA K, et al. Induction of apoptosis in Caco-2 cells by exogenously addedproduced by a nanodevice[J]. Experimental Cell Research, 2015, 331(2): 408-415.DOI:10.1016/j.yexcr.2014.12.007.
[15] MACIEJCZYK M, MIKOLUC B, PIETRUCHA B, et al. Oxidative stress, mitochondrial abnormalities and antioxidant defense in Ataxiatelangiectasia, Bloom syndrome and Nijmegen breakage syndrome[J].Redox Biology, 2017, 11: 375-383. DOI:10.1016/j.redox.2016.12.030.
[16] KONG Youqin, DING Zhili, ZHANG Yixiang, et al. Dietary selenium requirement of juvenile oriental river prawn Macrobrachium nipponense[J]. Aquaculture, 2017, 476: 72-78. DOI:10.1016/j.aquaculture.2017.04.010.
[17] YUE Chanjuan, CHEN Jin, HOU Ranran, et al. The antioxidant action and mechanism of selenizing Schisandra chinensis polysaccharide in chicken embryo hepatocyte[J]. International Journal of Biological Macromolecules, 2017, 98: 506-514. DOI:10.1016/j.ijbiomac.2017.02.015.
[18] MARTINI D, ROSSI S, BIASINI B, et al. Claimed effects, outcome variables and methods of measurement for health claims proposed under European Community Regulation 1924/2006 in the framework of protection against oxidative damage and cardiovascular health[J].Nutrition Metabolism and Cardiovascular Diseases, 2017, 27(6): 473.DOI:10.1016/j.numecd.2017.01.008.
[19] FAN Jing, FENG Haibo, YU Yu, et al. Antioxidant activities of the polysaccharides of Chuanminshen violaceum[J]. Carbohydrate Polymers, 2017, 157: 629-636. DOI:10.1016/j.carbpol.2016.10.040.
[20] VRANJEŠ M, POPOVIĆ B M, ŠTAJNER D, et al. Effects of bearberry, parsley and corn silk extracts on diuresis, electrolytes composition, antioxidant capacity and histopathological features in mice kidneys[J]. Journal of Functional Foods, 2016, 21: 272-282.DOI:10.1016/j.jff.2015.12.016.
[21] JIANG Yan, DAI Min, NIE Wenjing, et al. Effects of the ethanol extract of black mulberry (Morus nigra L.) fruit on experimental atherosclerosis in rats[J]. Journal of Ethnopharmacology, 2017, 200:228-235. DOI:10.1016/j.jep.2017.02.037.
[22] ZHANG Zifeng, LU Jun, ZHENG Yuanlin, et al. Purple sweet potato color protects mouse liver against d-galactose-induced apoptosis via inhibiting caspase-3 activation and enhancing PI3K/Akt pathway[J].Food and Chemical Toxicology, 2010, 48(8/9): 2500-2507.DOI:10.1016/j.fct.2010.06.023.
[23] MOMENI H R, ESKANDARI N. Effect of curcumin on kidney histopathological changes, lipid peroxidation and total antioxidant capacity of serum in sodium arsenite-treated mice[J]. Experimental and Toxicologic Pathology, 2017, 69(2): 93-97. DOI:10.1016/j.etp.2016.08.006.
[24] CONG Guangting, CUI Lei, ZANG Meng, et al. Attenuation of renal ischemia/reperfusion injury by a polysaccharide from the roots of Dipsacus asperoides[J]. International Journal of Biological Macromolecules, 2013, 56: 14-19. DOI:10.1016/j.ijbiomac.2012.12.024.
[25] WU Xin, GUO Xiaoyun, XIE Chunyan, et al. Effects of a two-meal daily feeding pattern with varied crude protein levels on growth performance and antioxidant indexes in pigs[J]. Animal Nutrition,2016, 2(4): 267-270. DOI:10.1016/j.aninu.2016.08.002.
[26] LI Xinpeng, WANG Jing, ZHANG Hong, et al. Renoprotective effect of low-molecular-weight sulfated polysaccharide from the seaweed Laminaria japonica on glycerol-induced acute kidney injury in rats[J].International Journal of Biological Macromolecules, 2017, 95: 132-137. DOI:10.1016/j.ijbiomac.2016.11.051.
[27] AL-ATTAR A M, ALROBAI A A, ALMALKI D A. Protective effect of olive and juniper leaves extracts on nephrotoxicity induced by thioacetamide in male mice[J]. Saudi Journal of Biological Sciences,2017, 24(1): 15-22. DOI:10.1016/j.sjbs.2015.08.013.
[28] OUYANG Mingzi, LIN Lizhu, LÜ Wenjiao, et al. Effects of the polysaccharides extracted from Ganoderma lucidum on chemotherapy-related fatigue in mice[J]. International Journal of Biological Macromolecules, 2016, 91: 905-910. DOI:10.1016/j.ijbiomac.2016.04.084.
[29] HUANG Yi, ZHOU Lishan, YAN Li, et al. Alpinetin inhibits lipopolysaccharide-induced acute kidney injury in mice[J].International Immunopharmacology, 2015, 28(2): 1003-1008.DOI:10.1016/j.intimp.2015.08.002.
[30] SHAN Qun, ZHENG Yuanlin, LU Jun, et al. Purple sweet potato color ameliorates kidney damage via inhibiting oxidative stress mediated NLRP3 inflammasome activation in high fat diet mice[J].Food and Chemical Toxicology, 2014, 69: 339-346. DOI:10.1016/j.fct.2014.04.033.
[31] MA Gaoxing, YANG Wenjian, FANG Yong, et al. Antioxidant and cytotoxicites of Pleurotus eryngii residue polysaccharides obtained by ultraf i ltration[J]. LWT-Food Science and Technology, 2016, 73: 108-116. DOI:10.1016/j.lwt.2016.05.049.
[32] TILYEK A, CHAI C, HOU X, et al. The protective effects of Ribes diacanthum Pall on cisplatin-induced nephrotoxicity in mice[J].Journal of Ethnopharmacology, 2016, 178: 297-306. DOI:10.1016/j.jep.2015.10.003.
[33] WANG Lihua, SUN Xiangyu, LI Fan, et al. Dynamic changes in phenolic compounds, colour and antioxidant activity of mulberry wine during alcoholic fermentation[J]. Journal of Functional Foods, 2015,18: 254-265. DOI:10.1016/j.jff.2015.07.013.
[34] NATIĆ M M, DABIĆ D Č, PAPETTI A, et al. Analysis and characterisation of phytochemicals in mulberry (Morus alba L.) fruits grown in Vojvodina, North Serbia[J]. Food Chemistry, 2015, 171:128-136. DOI:10.1016/j.foodchem.2014.08.101.
[35] 邓秀婷, 罗姮, 李彦彬, 等. 桑葚提取液对D-半乳糖致衰老小鼠抗氧化能力的影响[J]. 中国老年学杂志, 2016(1): 36-37.
Protective Effect of Mulberry Juice Concentrate on D-Galactose-Induced Oxidative Stress in Kidney of Rats
HUANG Lei1, PENG Xinyan1,*, YU Haiyang2, LI Huamin1, MAO Huimin1, ZHANG Hui1, QIU Jingru1
(1. College of Food Engineering, Ludong University, Yantai 264025, China;2. Department of Food Engineering, Shandong Business Institute, Yantai 264670, China)
To study the protective effect of mulberry juice concentrate on oxidative injury in the kidney of rats, an aging rat model was established by injection of D-galactose (D-Gal) and the experimental rats were divided into six groups,including normal control, negative control, positive control group (D-Gal + VE), D-Gal + mulberry juice concentrate low-,middle- and high-dose groups. Superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-Px) activities and malondialdehyde (MDA) content in liver homogenate, nitric oxide (NO), urea nitrogen (BUN), creatinine (Scr) and total antioxidant capacity (T-AOC) in serum, and the expression of B-cell lymphoma-2-associated X protein (Bax) gene in kidney were measured. Besides, hematoxylin-eosin stained kidney sections were histopathologically examined. The results showed that compared with the negative control group, mulberry juice concentrate at middle and high doses could signif i cantly increase the activities of SOD, GSH-Px, CAT and T-AOC in renal tissue (P < 0.05), decrease MDA level in renal tissue, serum BUN and Scr levels and repress the increase in serum NO (P < 0.05) in a dose-dependent manner. In addition, the expression of Bax was signif i cantly reduced (P < 0.05), and the best result was observed at high dose, where GSH-Px activity was 150.33 U and serum Scr and BUN were 34.54 μmol/L and 8.96 mmol/L, respectively, which were close to the levels of the positive control group (P > 0.05), and serum NO was 29.78 μmol/L, which was similar to that of the blank control group (P > 0.05). Histopathological examination showed that compared with the model group, the symptomsof kidney injury in the treatment groups were obviously alleviated, especially in the middle- and high-dose groups, where few renal tubular epithelial cells were loose and pale, without obvious congestion or bleeding. In summary, mulberry juice concentrate has a good protective effect on D-Gal-induced oxidative stress in the kidney of rats.
mulberry juice concentrate; D-galactose; oxidative damage; renal protection
2017-06-01
国家自然科学基金青年科学基金项目(31401491);城新创新奖学金项目;大学生创新创业训练计划项目(7422)
黄磊(1995—),男,本科,研究方向为天然产物功能因子。E-mail:912878985@qq.com
*通信作者:彭新颜(1976—),女,副教授,博士,研究方向为天然产物功能因子。E-mail:pengxinyan2006@163.com
10.7506/spkx1002-6630-201723029
TS255.2
A
1002-6630(2017)23-0184-07
黄磊, 彭新颜, 于海洋, 等. 桑葚浓缩汁对D-半乳糖诱导氧化损伤大鼠肾脏的保护作用[J]. 食品科学, 2017, 38(23):184-190.
10.7506/spkx1002-6630-201723029. http://www.spkx.net.cn
HUANG Lei, PENG Xinyan, YU Haiyang, et al. Protective effect of mulberry juice concentrate on D-galactose-induced oxidative stress in kidney of rats[J]. Food Science, 2017, 38(23): 184-190. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723029. http://www.spkx.net.cn

