超声-离子液体处理对乳清蛋白酶解动力学及其产物抗氧化活性的影响
匡 聪,贾俊强,2,*,吴琼英,2,*,张雪纷,桂仲争,2
(1.江苏科技大学生物技术学院,江苏 镇江 212018;2.中国农业科学院蚕业研究所,江苏 镇江 212018)
超声-离子液体处理对乳清蛋白酶解动力学及其产物抗氧化活性的影响
匡 聪1,贾俊强1,2,*,吴琼英1,2,*,张雪纷1,桂仲争1,2
(1.江苏科技大学生物技术学院,江苏 镇江 212018;2.中国农业科学院蚕业研究所,江苏 镇江 212018)
为了阐明超声-离子液体处理后乳清蛋白酶解动力学特性,研究初始底物质量浓度、酶质量浓度和酶解时间对乳清蛋白水解度的影响,在此基础上建立了乳清蛋白-碱性蛋白酶酶解动力学模型,并通过清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基法、螯合Fe2+法和还原力法研究了超声-离子液体处理对乳清蛋白酶解产物抗氧化活性的影响。结果表明:超声-离子液体处理后,乳清蛋白的酶解动力学模型发生了改变,其酶解反应所需的临界酶质量浓度降低了43.1%,这表明超声-离子液体处理促使了乳清蛋白酶解。抗氧化实验表明,超声-离子液体处理后,乳清蛋白酶解产物清除DPPH自由基活性和螯合Fe2+能力分别提高了14.4%和28.4%,其还原力也得到了改善。体积排阻色谱分析表明,超声-离子液体处理显著提高了乳清蛋白酶解产物中>1~5 ku组分的含量(p<0.05),比未处理组提高了12.2%。
乳清蛋白;酶解;动力学;离子液体;超声处理
酶解技术是制备生物活性肽的主要方法,科研工作者已利用酶解技术从食源蛋白质中获得了具有抗氧化[1]、降血压[2]、提高免疫力[3]和抗菌[4]等作用的生物活性肽。研究发现,生物活性肽的活性往往与蛋白质水解度密切相关,蛋白质水解度过低或过高均可导致酶解产物中生物活性肽的活性降低[5]。蛋白质酶解动力学能够反映出水解度、反应速率随酶解时间的变化规律,可有效预测和控制酶解产物的分子质量分布,从而提高目标产物的得率[6]。传统的酶解动力学Michaelis-Menten模式主要用于均相反应体系中[7],而蛋白质酶解是一个非均相系统反应,反应过程中会伴随出现产物抑制、底物抑制以及蛋白酶失活等现象[8],酶解过程极其复杂。因此,建立酶解过程动力学模型,可实现蛋白质的可控酶解,以最大限度地获得所需的生物活性肽。
离子液体是一类由体积相对较大、结构不对称的有机阳离子和体积相对较小的无机阴离子构成的盐类物质[9]。离子液体具有良溶性、不挥发、热稳定和化学惰性等特点,已被用于医药、化妆品、制药以及食品等领域[10]。研究表明,离子液体作用于蛋白后会引起蛋白分子发生伸展和重新折叠与聚集,蛋白聚集体变得疏松[11],疏松的蛋白聚集体在酶解时增加了蛋白质底物与蛋白酶的结合率,从而增加了蛋白质酶解效率[12],现已与酶法联合使用改善蛋白的功能性[13]。随着超声波辅助酶解技术的发展,超声波与离子液体联合处理已被用于促进酶解反应,Zhang Danni等[14]将超声-离子液体法用于酶法修饰虫草酸,将虫草酸转化为具有高溶解度的5’-O-乙酰基-虫草素,不仅提高了酶解反应的速率,而且提高了产物转化率。课题组前期也将超声-离子液体处理用于制备蚕蛹蛋白血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽,发现蚕蛹蛋白酶解产物的转化率和ACE抑制活性都得到了提高[12]。然而,迄今为止,超声-离子液体在蛋白质酶解中应用的研究并不多。
碱性蛋白酶(alcalase protease,AP)是一种肽链内切酶,酶切位点主要是肽链中疏水性氨基酸残基的羧基端,已成为制备生物活性肽常用的蛋白酶[15]。研究表明,乳清蛋白经AP酶解后,其酶解产物表现出较强的抗氧化活性[16-17]。本实验在前人研究的基础上,选择AP作为水解酶,研究超声-离子液体处理对乳清蛋白酶解动力学及其产物抗氧化活性的影响,以期为超声-离子液体处理技术在蛋白质酶解中进一步应用提供理论依据。
1 材料与方法
1.1 材料与试剂
乳清蛋白 郑州皇朝化工产品有限公司;AP(EC3.4.21.14,酶活力为60 000 U/g) 诺维信(中国)生物技术有限公司;1-丁基-3-甲基六氟磷酸盐(1-butyl-3-methylimidazolium hexafluorophosphate,[BMIM]PF6) 上海御略化工有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma-Aldrich公司;菲洛嗪 美国Alfa Aesar公司;牛血清白蛋白(分子质量66 446 u)、胃蛋白酶(分子质量35 000 u,酶活力3 000~3 500 U/mg)、乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,EDTA-2Na) 生工生物工程(上海)股份有限公司;细胞色素c(分子质量12 400 u)、胰蛋白酶抑制剂(分子质量6 511 u)、人血管紧张素Ⅱ(分子质量1 045.5 u)、乙氨酰-乙氨酰-乙氨酸(分子质量189.1 u)上海源叶生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
FDU-2100冷冻干燥机 日本东京理化器械;H205DR-1高速冷冻离心机 长沙湘仪离心机仪器有限公司;BSA124S分析天平 赛多利斯科学仪器(北京)有限公司;SevenMulti型pH计 梅特勒-托利多仪器公司;DF-101B集热式磁力加热搅拌器 金坛市医疗仪器厂;UV-2450紫外-可见分光光度计 日本岛津公司;SSY-H型恒温水浴锅 上海三申医疗器械有限公司。
1.3 方法
1.3.1 超声-离子液体处理乳清蛋白
将乳清蛋白用去离子水配制成1.0 g/100 mL溶液,然后加入等体积[BMIM]PF6溶液,将超声探头浸入水相中,在超声功率300 W下处理15 min,处理结束后,3 000 r/min离心10 min,离心后的样品溶液体系分为3 层,上层为蒸馏水,中层为乳清蛋白,下层为离子液体。除掉水相,取乳清蛋白层,回收下层离子液体,乳清蛋白层用蒸馏水洗涤、离心,反复数次以除去残留离子液体,蛋白经冷冻干燥后用于后续研究。
1.3.2 乳清蛋白的酶解
乳清蛋白的基本酶解条件:蛋白酶选用AP,酶解温度55 ℃,酶解pH 8.0。
1.3.2.1 初始底物质量浓度对乳清蛋白水解度变化的影响
在加酶量(酶比活力为60 000 U/g)为0.5 g/L条件下,研究乳清蛋白在不同底物质量浓度(20、40、60、80、100 g/L)下分别酶解20、40、60、80、100 min后的水解度(degree of hydrolysis,DH)。
1.3.2.2 AP质量浓度对乳清蛋白DH变化的影响
在初始底物质量浓度为60 g/L时,研究乳清蛋白在不同AP质量浓度(0.3、0.4、0.5、0.6、0.7 g/L)下分别酶解20、40、60、80、100 min后的DH。
1.3.3 DH的测定
采用pH-stat法[18]测定蛋白质的DH,按照公式(1)计算。
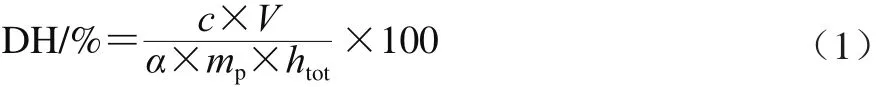
式中:c为NaOH溶液浓度/(mol/L);V为消耗NaOH溶液的体积/L;α为α-NH2的解离度,为0.44;mp为底物蛋白的质量/g;htot是底物蛋白的肽键总数/(meqv/g),为8.8 meqv/g。
1.3.4 乳清蛋白可控酶解动力学模型的建立
根据林伟锋等[6]报道的方法研究乳清蛋白可控酶解动力学。依据酶反应中间复合物学说,酶促反应式见式(2)。

式中:E为酶;S为底物;k1和k2为正反应速率常数/min-1;k-1为反向反应速率常数/min-1;ES为酶-底物复合物;P为酶解产物。
由于反应速率R是由不可逆反应阶段的速率来决定的,其与初始底物质量浓度[S0]之间的关系用式(3)表示。

式中:R为反应速率/(g/(L·min));[S0]为初始底物质量浓度/(g/L);t为反应时间/min;[ES]为酶-底物复合物质量浓度/(g/L)。
通过方程(3)推导出方程(4)。

式中:[E0]为初始酶质量浓度/(g/L);ρ为初始酶失活质量浓度/(g/L);k3为限制性酶解反应速率常数/min-1;kM为半饱和常数/(g/L)。
假设动力学参数a值为k2([E0]/[S0]-ρ),动力学参数b值为k3kM/k2,则方程(4)可推导出式(5)。

依据实验,可以得到不同酶解时间t下相应的DH,通过回归分析可以得到t与DH之间的对数方程,然后利用该方程确定动力学参数a和b,最后带入方程(5)确定出乳清蛋白的酶解动力学模型。
1.3.5 抗氧化活性分析
1.3.5.1 清除DPPH自由基活性
取乳清蛋白酶解产物冻干粉,用去离子水配制成不同质量浓度(1、2、3、4、5 mg/mL)的溶液,分别取2 mL乳清蛋白酶解产物溶液和2 mL质量浓度为0.04 mg/mL的DPPH溶液混合均匀,在25 ℃静置30 min,在517 nm波长处测吸光度[19]。按公式(6)计算DPPH自由基清除率。

式中:A0是DPPH溶液和95%乙醇溶液混合后的吸光度;A1是DPPH溶液和乳清蛋白酶解产物溶液混合后的吸光度;A2是乳清蛋白酶解产物溶液和95%乙醇溶液混合后的吸光度。
1.3.5.2 Fe2+螯合能力的测定
将乳清蛋白酶解产物冻干粉用去离子水配制成不同质量浓度(1、2、3、4、5 mg/mL)的溶液,分别取3 mL乳清蛋白酶解产物溶液,依次加入0.05 mL 2 mmol/L FeCl2和0.1 mL 5 mmol/L菲洛嗪,混匀后在25 ℃反应10 min,在562 nm波长处测其吸光度[20]。以蒸馏水代替样品,作为空白组。按公式(7)计算Fe2+螯合率。

式中:A0为空白组的吸光度;A1为样品组的吸光度。
1.3.5.3 还原力的测定
将乳清蛋白酶解产物冻干粉用0.2 mol/L磷酸盐缓冲液(pH 6.6)配制成不同质量浓度(1、2、3、4、5 mg/mL)的溶液,分别取2 mL乳清蛋白酶解产物溶液,加入2 mL质量分数为1%的铁氰化钾溶液,混合均匀后在50 ℃反应20 min,加入2 mL质量分数10%三氯乙酸终止反应,于5 000 r/min离心10 min后取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL质量分数0.1%三氯化铁溶液,混合均匀后静置10 min,在700 nm波长处测定吸光度,以表示还原力[21]。
1.3.6 乳清蛋白酶解产物中肽分子质量分布分析
用体积排阻色谱法分析乳清蛋白酶解产物中肽分子质量分布[22]。
分子质量标准品的配制:将不同分子质量标准品(牛血清白蛋白、胃蛋白酶、细胞色素c、胰蛋白酶抑制剂、人血管紧张素Ⅱ、乙氨酰-乙氨酰-乙氨酸)用乙腈-水(10∶90,V/V)配制成1 mg/mL溶液,用0.45 μm聚四氟乙烯膜过滤后进样分析。以保留时间对分子质量对数作线性回归,即可得到分子质量校正曲线方程。
高效液相色谱分析条件:色谱柱:GPC/SEC-PL aquagel-OH MIXED-H(300 mm×7.5 mm,8 μm);流动相:乙腈-水(10∶90,V/V);流速:0.5 mL/min;柱温:25 ℃;检测波长:220 nm;进样体积:20 μL。
1.4 数据统计分析
每个实验重复3 次,采用Excel 2007软件进行数据处理和绘图,利用SPSS 19.0统计软件对数据进行方差分析,p<0.05表示差异显著。
2 结果与分析
2.1 超声-离子液体处理对乳清蛋白酶解动力学的影响
2.1.1 乳清蛋白酶解动力学的建立
2.1.1.1 初始底物质量浓度和AP质量浓度对乳清蛋白DH的影响

图1 不同[S0]下乳清蛋白的水解曲线Fig. 1 Hydrolysis curves of whey protein at different substrate concentrations
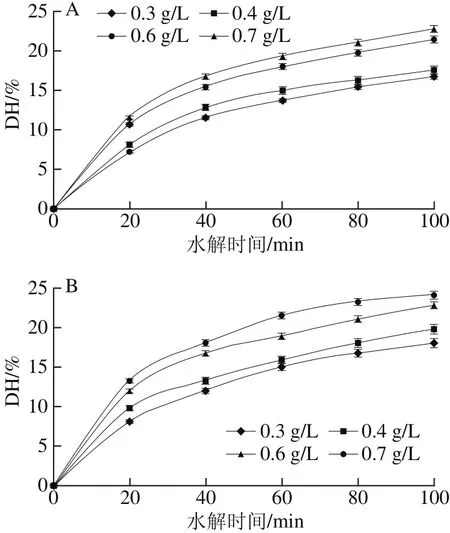
图2 不同[E0]下乳清蛋白的水解曲线Fig. 2 Hydrolysis curves of whey protein at different AP concentrations
为了利用方程(5)确定乳清蛋白酶解动力学参数,研究了[S0]和[E0]对乳清蛋白DH的影响,结果如图1、2所示。在相同酶解时间下,乳清蛋白DH随着[S0]增大而减小(图1),而随着[E0]增大而增大,这表明乳清蛋白DH与加酶量(酶与底物的比率)呈正相关性,乳清蛋白DH随着加酶量的增加而增大,这与Guo Yuxing等[23]利用乳清蛋白酶解制备ACE抑制肽时研究的结果一致。从图1、2也可以看出,乳清蛋白在酶解100 min期间,前40 min的DH增幅较大,随后DH增幅逐渐平缓,这可能是因为乳清蛋白酶解过程中产生了产物抑制、蛋白酶失活和酶解位点减少,最终导致乳清蛋白DH增幅较慢[24]。此外,与未处理乳清蛋白相比,超声-离子液体处理后乳清蛋白DH得到了提高,比未处理组提高了3.7%~27.8%。
2.1.1.2 乳清蛋白酶解动力学模型参数

表1 [E0]和[S0]对乳清蛋白水解动力学参数a和b值的影响Table 1 Effect of enzyme and substrate concentrations on kinetic parameters a and b values for whey protein hydrolysis
利用方程(5)分别使用Origin8.0软件对图1、2各水解曲线进行回归拟合,得到了[E0]和[S0]的酶解动力学参数a和b值(表1)。动力学参数a值随着[E0]增加而明显增大,随着[S0]增加而明显减小,这表明参数a值并不是一个常数。动力学参数b值很小,基本在0.09~0.16范围内,而且在不同[E0]和[S0]下变化不明显,接近一个常数,相似的现象也在其他蛋白的酶解动力学研究中被发现。廖丹葵等[25]研究发现,蓝圆鲹蛋白的酶解动力学参数b值基本保持在0.154左右;张治国等[26]研究发现,鳗鱼蛋白的酶解动力学参数b值基本保持在0.061 9左右。因此,本研究将参数b值设定为常数,用平均值表示。最终确定未处理乳清蛋白的酶解动力学参数b值为0.137 9,超声-离子液体处理乳清蛋白的酶解动力学参数b值为0.135 1。根据表1的数据,分别对参数a值与[E0]/[S0]作图,结果如图3所示。参数a值与[E0]/[S0]呈现良好的线性关系,未处理乳清蛋白酶解时参数间的关系曲线为a=133.8[E0]/[S0]-0.076(R2=0.996);超声-离子液体处理乳清蛋白酶解时参数间的关系曲线为a=166.8[E0]/[S0]-0.054(R2=0.995)。
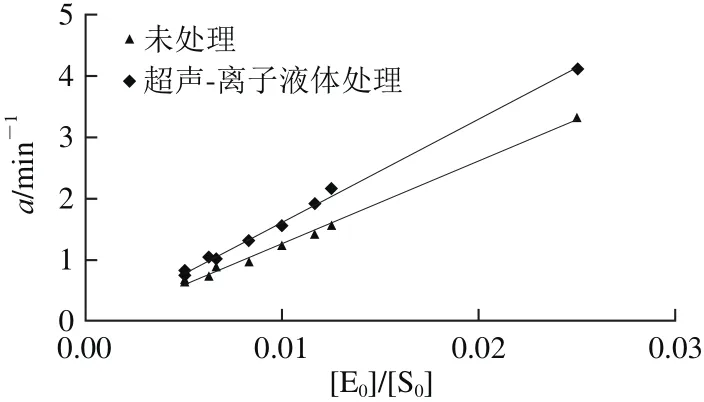
图3 [E0]/[S0]值与动力学参数a的线性回归Fig. 3 Linear regression of [E0]/[S0] value versus kinetic parameter a
从方程(4)可以看出,在蛋白酶解反应中,a>0是蛋白质酶解发生的必要条件,若a≤0,则有反应速率R≤0,蛋白酶解将不能进行[6,26]。因此,理论上未处理乳清蛋白要发生酶解反应时,其[E0]应高于其[Emin],为5.68×10-4[S0];超声-离子液体处理乳清蛋白要发生酶解反应时,其[E0]应高于其[Emin],为3.23×10-4[S0]。不同[S0]对应的[Emin]见表2。

表2 不同[S0]对应的临界酶质量浓度[Emin]Table 2 Critical enzyme concentrations [Emin] at different substrate concentrations
从表2可知,相同[S0]下,超声-离子液体处理乳清蛋白若要发生酶解反应时,所需的[Emin]比未处理乳清蛋白的低了约43.1%,这说明超声-离子液体处理的乳清蛋白更易酶解。
将a与[E0]/[S0]之间的关系式以及b值带入方程(5),得到AP酶解未处理乳清蛋白的动力学模型(8)。

得到AP酶解超声-离子液体处理乳清蛋白的动力学模型(9)。

由方程(8)和(9)可以看出,乳清蛋白DH与[S0]、[E0]和反应时间t密切相关;当[E0]不变时,乳清蛋白水解度随着[S0]的升高而降低;当[S0]不变时,乳清蛋白水解度随着[E0]升高而增加,这与图1、2结果一致。
2.1.1.3 酶解动力学模型的验证
为了验证乳清蛋白处理前后的酶解动力学模型可靠性,在60 g/L底物、0.5 g/L AP、酶解温度55 ℃和pH 8.0的条件下,利用实验的方法测定乳清蛋白在酶解20、40、60、80、100 min时的DH,并与理论值作比较,结果如图4所示。

图 4 乳清蛋白水解度的理论值与实际值的相关性Fig. 4 Correlation between the predicted and experimental DHs of whey protein
从图4可知,处理前(y=0.900x+0.039)、后(y=0.912x+0.063)乳清蛋白DH的实际值和理论值基本一致,且呈现良好的线性关系(R2=0.999),这表明所建立的酶解动力学模型可靠,能较好地模拟AP酶解乳清蛋白的酶解过程,具有良好的实际应用价值。
2.2 DH对乳清蛋白酶解产物抗氧化活性的影响

图5 不同DH的乳清蛋白对DPPH自由基清除活性Fig. 5 DPPH radical-scavenging activity of hydrolysate from whey protein with different DHs
以DPPH自由基清除率为评价指标,研究了DH对乳清蛋白酶解产物抗氧化活性的影响(图5)。对于未处理组和超声-离子液体处理组来说,DH对乳清蛋白酶解产物抗氧化活性的影响趋势一致,均随着DH增大,乳清蛋白酶解产物清除DPPH自由基活性逐渐增高,在10% DH时DPPH自由基清除率达到最高,当进一步增大DH,乳清蛋白酶解产物清除DPPH自由基活性反而降低。大豆蛋白酶解产物[27]和麦胚蛋白酶解产物[28]的DPPH自由基清除活性也都具有类似的变化规律,这说明蛋白DH与其酶解产物自由基清除活性密切相关,只有适宜的DH才能使蛋白酶解产物呈现良好的抗氧化活性。因此,本研究选择10% DH的乳清蛋白酶解产物进行后续抗氧化活性研究。
2.3 超声-离子液体处理对乳清蛋白酶解产物抗氧化活性的影响
由图6可知,乳清蛋白酶解产物清除DPPH自由基活性比VC的低;在乳清蛋白酶解产物质量浓度为1~5 mg/mL时与DPPH自由基清除率呈现良好的正相关性,利用Excel软件对乳清蛋白酶解产物质量浓度与DPPH自由基清除率进行多项式回归,得到了未处理组、超声处理组和超声-离子液体处理组的回归方程,分别为y=-2.313x2+24.70x-0.637(R2=0.997)、y=-2.358x2+25.74x-0.685(R2=0.997)和y=-2.554x2+27.17x+0.042(R2=0.998),各回归方程的R2均在0.99以上,表明各回归方程拟合程度良好。依据这些回归方程确定了未处理组、超声处理组和超声-离子液体处理组乳清蛋白酶解产物清除DPPH自由基的IC50值分别为(2.77±0.02)、(2.58±0.01)、(2.37±0.02)mg/mL,超声-离子液体处理后乳清蛋白酶解产物的DPPH自由基清除活性显著提高(p<0.05),分别比未处理组和超声处理组高了14.4%和8.1%。

图6 超声-离子液体处理对乳清蛋白酶解产物清除DPPH自由基活性的影响Fig. 6 Effect of ultrasound-ionic liquid treatment on DPPH radical scavenging activity of whey protein hydrolysate

图7 超声-离子液体处理对乳清蛋白酶解产物螯合Fe2+能力的影响Fig. 7 Effect of ultrasound-ionic liquid treatment on Fe2+ chelating capacity of whey protein hydrolysate
从图7可知,在质量浓度为1~5 mg/mL时,乳清蛋白酶解产物对Fe2+螯合能力随着质量浓度的增加而增加。在3 组实验中,超声-离子液体处理组的Fe2+螯合能力最强,其次为超声处理组,未处理组的Fe2+螯合能力最低。利用Excel软件对实验组的质量浓度与Fe2+螯合率进行多项式回归,得到了未处理组、超声处理组和超声-离子液体处理组的回归方程,分别为y=0.334x3-6.175x2+36.54x-0.922(R2=0.994)、y=0.499x3-7.877x2+41.49x-0.270(R2=0.999)和y=0.857x3-11.12x2+49.45x-0.707(R2=0.996),回归方程的R2均在0.99以上,表明各回归方程拟合程度良好。从这些回归方程可以得到未处理组、超声处理组和超声-离子液体处理组的乳清蛋白酶解产物螯合Fe2+的IC50值分别为(2.01±0.04)、(1.71±0.01)、(1.44±0.02)mg/mL。乳清蛋白经超声-离子液体处理后,其酶解产物的Fe2+螯合能力分别比未处理组和超声处理组提高了28.4%和15.8%。尽管乳清蛋白酶解产物具有良好的Fe2+螯合能力,但低于EDTA-2Na的Fe2+螯合能力。

图8 超声-离子液体处理对乳清蛋白酶解产物还原力的影响Fig. 8 Effect of ultrasound-ionic liquid treatment on reducing power of whey protein hydrolysate
由图8可知,未处理组、超声处理组和超声-离子液体处理组的乳清蛋白酶解产物还原力均随着酶解产物质量浓度的增大而增强,呈现出良好的剂量依赖性。相同酶解产物质量浓度下,超声-离子液体处理组的乳清蛋白酶解产物还原力最强,其次为超声处理组的乳清蛋白酶解产物,未处理组的乳清蛋白酶解产物的还原力最小。
本研究分别采用DPPH自由基清除法、螯合Fe2+法和还原力法评价乳清蛋白酶解产物的抗氧化活性。结果表明超声-离子液体处理后乳清蛋白酶解产物的抗氧化活性最强。这主要是因为超声与离子液体联合处理能够强化超声处理效果,使埋藏在乳清蛋白内部的活性部位充分暴露,更好地与酶结合,有利于酶解释放出活性更强的抗氧化肽,从而提高了酶解产物的抗氧化活性[14,29-30]。
2.4 乳清蛋白酶解产物分子质量分布
由于10% DH的乳清蛋白酶解产物具有良好的抗氧化活性,因此本研究对其分子质量分布进行了初步研究。分子质量分布利用体积排阻色谱法分析,以保留时间(x)和分子质量对数值(y)进行拟合回归,最终得到分子质量校正曲线方程y=-0.352x+9.159(R2=0.962),呈现良好的线性关系,可以用于分析乳清蛋白酶解产物的分子质量分布。

表3 10% DH的乳清蛋白酶解产物的分子质量分布Table 3 Molecular weight distribution of whey protein hydrolysate with DH of 10%%
从表3可以看出,超声-离子液体处理显著提高了乳清蛋白酶解产物中分子质量>1~5 ku的肽含量(p<0.05),但分子质量在>5~10 ku之间和≤1 ku的肽含量变化不显著(P>0.05),这表明超声-离子液体处理显著提高了乳清蛋白酶解产物中分子质量在>1~5 ku之间的肽含量(p<0.05)。结合上述抗氧化活性分析,可以初步推断出超声-离子液体处理后乳清蛋白酶解产物抗氧化活性的增强可能与提高酶解产物中>1~5 ku组分含量有关。
3 结 论
在酶解温度55 ℃和pH 8.0的条件下,分别建立了乳清蛋白在超声-离子液体处理前后的AP酶解动力学模型分别为DH=7.25×ln(1+(18.45×[E0]/[S0]-0.010 5)×t)和DH=7.40×ln(1+(22.53×[E0]/[S0]-0.007 3)×t);AP酶解乳清蛋白存在[Emin];超声-离子液体处理后,乳清蛋白要发生酶解反应时所需的[Emin]降低,表明超声-离子液体处理使乳清蛋白更易酶解。
对比未处理组、超声处理组和超声-离子液体处理组的乳清蛋白酶解产物抗氧化活性,发现超声-离子液体处理组的乳清蛋白酶解产物抗氧化活性最强;乳清蛋白经超声-离子液体处理后,其酶解产物清除DPPH自由基活性和螯合Fe2+能力分别提高了14.4%和28.4%,其酶解产物的还原力也得到了改善。同时,超声-离子液体处理后乳清蛋白酶解产物中分子质量>1~5 ku的肽含量也显著提高(p<0.05)。
[1] TORRES-FUENTES C, DE MAR CONTRERAS M, RECIO I, et al.Identification and characterization of antioxidant peptides from chickpea protein hydrolysates[J]. Food Chemistry, 2015, 180: 194-202. DOI:10.1016/j.foodchem.2015.02.046.
[2] WU Q Y , JIA J Q, YAN H, et al. A novel angiotensin-I converting enzyme (ACE) inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa (Bombyx mori) protein: biochemical characterization and molecular docking study[J]. Peptides, 2015, 68:17-24. DOI:10.1016/j.peptides.2014.07.026.
[3] 何佳易, 徐鑫, 刘国艳, 等. 小黄鱼免疫肽制备条件的响应面优化[J].食品科学, 2012, 33(3): 151-156.
[4] 吴琼英, 徐金玲. 酶解反应和膜分离耦合制备乳源抗菌肽[J]. 江苏科技大学学报(自然科学版), 2010, 24(4): 386-390. DOI:10.3969/j.issn.1673-4807.2010.04.017.
[5] 朱振宝, 周慧江, 易建华, 等. 响应面法优化核桃ACE抑制肽的制备工艺研究[J]. 陕西科技大学学报(自然科学版), 2012, 30(5): 67-72.DOI:10.3969/j.issn.1000-5811.2012.05.017.
[6] 林伟锋, 赵谋明, 彭志英, 等. 海洋鱼蛋白可控酶解动力学模型的研究[J]. 食品与机械, 2005, 21(3): 10-13. DOI:10.3969/j.issn.1003-5788.2005.03.003.
[7] YANG C Y, FANG T J. Kinetics of enzymatic hydrolysis of rice straw by the pretreatment with a bio-based basic ionic liquid under ultrasound[J]. Process Biochemistry, 2015, 50(4): 623-629.DOI:10.1016/j.procbio.2015.01.013.
[8] VALENCIA P, ESPINOZA K, CEBALLOS A, et al. Novel modeling methodology for the characterization of enzymatic hydrolysis of proteins[J]. Process Biochemistry, 2015, 50(4): 589-597. DOI:10.1016/j.procbio.2014.12.028.
[9] 张合彩, 陈广文. 离子液体生物毒性研究进展[J]. 安徽大学学报(自然科学版), 2015, 39(3): 82-87. DOI:10.3969/j.issn.1000-2162.2015.03.015.
[10] 汪亚美, 王新承, 李顺杰, 等. 聚合离子液体在催化转化果糖制备乳酸中的应用[J]. 有机化学, 2015, 35(2): 404-410. DOI:10.6023/cjoc201408034.
[11] BYRNE N, ANGELL C A. Protein unfolding, and the “tuning in”of reversible intermediate states, in protic ionic liquid media[J].Journal of Molecular Biology, 2008, 378(3): 707-714. DOI:10.1016/j.jmb.2008.02.050.
[12] 吴琼英, 贾俊强, 杜金娟, 等. 超声波-离子液体耦合预处理制备蚕蛹蛋白质ACE抑制肽的工艺优化[J]. 食品与生物技术学报, 2014,33(6): 633-640.
[13] 袁久刚, 范雪荣, 王强, 等. 离子液体预处理对羊毛蛋白酶水解性能的影响[J]. 化学学报, 2010, 68(2): 187-193.
[14] ZHANG Danni, GUO Xiaoyu, YANG Qiuhuizi, et al. An efficient enzymatic modif i cation of cordycepin in ionic liquids under ultrasonic irradiation[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1682-1687.DOI:10.1016/j.ultsonch.2014.02.023.
[15] 贾俊强, 马海乐, 王振斌, 等. 降血压肽的构效关系研究[J]. 中国粮油学报, 2009, 24(5): 110-114.
[16] PENG X Y, KONG B H, XIA X F, et al. Reducing and radicalscavenging activities of whey protein hydrolysates prepared with alcalase[J]. International Dairy Journal, 2010, 20(5): 360-365.DOI:10.1016/j.idairyj.2009.11.019.
[17] LIN S J, TIAN W N, LI H, et al. Improving antioxidant activities of whey protein hydrolysates obtained by thermal preheat treatment of pepsin, trypsin, alcalase and flavourzyme: improve antioxidant activities of whey protein[J]. International Journal of Food Science and Technology, 2012, 47(10): 2045-2051. DOI:10.1111/j.1365-2621.2012.03068.x.
[18] DONG X H, ZHAO M M, SHI J, et al. Effects of combined highpressure homogenization and enzymatic treatment on extraction yield,hydrolysis and function properties of peanut proteins[J]. Innovative Food Science and Emerging Technologies, 2011, 12(4): 478-483.DOI:10.1016/j.ifset.2011.07.002.
[19] CUMBY N, ZHONG Y, NACZK M, et al. Antioxidant activity and water-holding capacity of canola protein hydrolysates[J].Food Chemistry, 2008, 109(1): 144-148. DOI:10.1016/j.foodchem.2007.12.039.
[20] ZHU K X, ZHOU H M, QIAN H F. Antioxidant and free radicalscavenging activities of wheat germ protein hydrolysates (WGPH)prepared with alcalase[J]. Process Biochemistry, 2006, 41(6): 1296-1302. DOI:10.1016/j.procbio.2005.12.029.
[21] 贾俊强, 马海乐, 曲文娟, 等. 超声预处理大米蛋白制备抗氧化肽[J]. 农业工程学报, 2008, 24(8): 288-293. DOI:10.3321/j.issn:1002-6819.2008.08.064.
[22] 陈星, 李晓磊, 吴琼. 不同蛋白酶酶解产物活性大豆肽分子量分布状态的研究[J]. 西南大学学报(自然科学版), 2010, 32(7): 1-7.DOI:10.1592/phco.30.7.632.
[23] GUO Yuxing, PAN Daodong, TANOKURA M. Optimisation of hydrolysis conditions for the production of the angiotensin-1 converting enzyme (ACE) inhibitory peptides from whey protein using response surface methodology[J]. Food Chemistry, 2009, 114(1): 328-333. DOI:10.1016/j.foodchem.2008.09.041.
[24] 贾俊强, 吴琼英, 桂仲争, 等. 碱性蛋白酶酶解家蚕蛹蛋白过程中的产物抑制效应研究[J]. 蚕业科学, 2014, 40(1): 103-106.
[25] 廖丹葵, 黄伟, 蒋海萍, 等. 蓝圆鲹蛋白的酶解过程动力学研究[J]. 高校化学工程学报, 2013, 27(5): 836-841. DOI:10.3969/j.issn.1003-9015.2013.05.018.[26] 张治国, 王君虹, 陈新峰, 等. 鳗鱼蛋白酶解动力学模型[J]. 浙江大学学报(农业与生命科学版), 2013, 39(2): 227-232. DOI:10.3785/j.issn.1008-9209.2012.11.618.
[27] 豆康宁, 石晓, 王飞. 大豆蛋白水解度与大豆肽抗氧化力关系研究[J].中国油脂, 2013, 38(10): 20-22.
[28] 徐宁, 吴定, 黄卉卉, 等. 麦胚蛋白水解度与麦胚抗氧化肽活性关系[J]. 粮食与饲料工业, 2015(6): 36-40. DOI:10.7633/j.issn.1003-6202.2015.06.009.
[29] 贾俊强, 马海乐, 赵伟睿, 等. 超声波处理对小麦胚芽球蛋白理化和功能性质的影响[J]. 农业机械学报, 2009, 40(8): 105-110.
[30] 孙英, 刘国琴, 阎乃珺. 超声预处理提高茶籽粕多肽抗氧化活性的研究[J]. 食品工业科技, 2012, 33(5): 52-55; 58.
Effect of Ultrasound-Ionic Liquid Treatment on Kinetics of Enzymatic Hydrolysis and Antioxidant Activities of Hydrolysates from Whey Protein
KUANG Cong1, JIA Junqiang1,2,*, WU Qiongying1,2,*, ZHANG Xuefen1, GUI Zhongzheng1,2
(1. College of Biotechnology, Jiangsu University of Science and Technology, Zhenjiang 212018, China;2. Sericultural Research Institute, Chinese Academy of Agricultural Sciences, Zhenjiang 212018, China)
In order to elucidate the kinetic characteristics of the enzymatic hydrolysis of whey protein that had been subjected to ultrasound-ionic liquid (UIL) treatment, the effects of initial substrate concentration, enzyme concentration and hydrolysis time on the degree of hydrolysis of whey protein were studied, and a kinetic model for the hydrolysis of whey protein by alcalase was established. In addition, the effect of UIL treatment was evaluated on antioxidant activities of whey protein hydrolysates such as 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity, Fe2+chelating activity and reducing power. Results showed that UIL treatment changed the kinetic model for enzymatic hydrolysis of whey protein.After UIL treatment, the critical enzyme concentration was decreased by 43.1%, suggesting that UIL treatment could promote the enzymatic hydrolysis of whey protein. Antioxidant assays showed that UIL treatment caused a 14.4% increase in the DPPH radical scavenging activity and a 28.4% increase in the Fe2+chelating capacity of whey protein hydrolysate.Moreover, the reducing power was improved after UIL treatment. Size exclusion chromatography analysis showed that UIL treatment signif i cantly increased the > 1-5 ku fraction from whey protein hydrolysate by 12.2% compared to untreated whey protein (P < 0.05).
whey protein; enzymatic hydrolysis; kinetics; ionic liquid; ultrasonic treatment
10.7506/spkx1002-6630-201723006
TS201.1
A
1002-6630(2017)23-0032-07
匡聪, 贾俊强, 吴琼英, 等. 超声-离子液体处理对乳清蛋白酶解动力学及其产物抗氧化活性的影响[J]. 食品科学, 2017,38(23): 32-38.
10.7506/spkx1002-6630-201723006. http://www.spkx.net.cn
2016-09-28
国家自然科学基金青年科学基金项目(31401641)
匡聪(1991—),男,硕士研究生,研究方向为生物资源学。E-mail:rzkuangcong@163.com
*通信作者:贾俊强(1973—),男,副研究员,博士,研究方向为天然活性物质的提取及生物活性。E-mail:junqiangjia2008@163.com吴琼英(1975—),女,副教授,博士,研究方向为生物活性成分的分离提取及加工新技术。E-mail:wuqy1@163.com
KUANG Cong, JIA Junqiang, WU Qiongying, et al. Effect of ultrasound-ionic liquid treatment on kinetics of enzymatic hydrolysis and antioxidant activities of hydrolysates from whey protein[J]. Food Science, 2017, 38(23): 32-38. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723006. http://www.spkx.net.cn

