四氧化三铁制备及其催化水合肼还原硝基苯活性*
蔡可迎,周颖梅,陶 伟,周 磊
(徐州工程学院化学化工学院,江苏徐州221018)
四氧化三铁制备及其催化水合肼还原硝基苯活性*
蔡可迎,周颖梅,陶 伟,周 磊
(徐州工程学院化学化工学院,江苏徐州221018)
铁化合物对水合肼还原硝基苯制备芳胺具有较高的活性,但重复性不好。以氯化铁和硫酸亚铁为原料采用共沉淀法制备了四氧化三铁,在制备过程中加入聚乙二醇(PEG)、十六烷基三甲基溴化铵(CTAB)和聚乙烯吡咯烷酮(PVP)3种表面活性剂对四氧化三铁进行改性。用X射线衍射仪(XRD)、透射电镜(TEM)和傅里叶变换红外光谱仪(FT-IR)对催化剂进行表征。结果表明,加入表面活性剂能够提高四氧化三铁粒子的分散性。以水合肼还原硝基苯为模型反应测试了加入表面活性剂前后制备的催化剂的活性,结果表明PVP改性的四氧化三铁具有较高的活性和较好的重复性,重复使用11次后其活性基本不变。催化剂具有磁性,便于回收。
四氧化三铁;硝基苯;水合肼
芳胺是重要的化工中间体,可用于生产药物、农药、染料和助剂等。还原芳香族硝基化合物是制备芳胺的主要方法。传统的还原方法有铁粉/酸还原、硫化碱还原和催化加氢[1]。铁粉/酸还原和硫化碱还原污染较严重,难以满足环保要求;催化加氢使用易燃易爆的氢气作为还原剂,具有较大的危险性,且其选择性较差,只能用于大规模简单芳胺的生产,不适于多官能团芳胺的生产。氢转移还原法是以水合肼、硼氢化钠、异丙醇、甲酸及其盐作为供氢试剂,在催化剂存在下还原芳硝基制备芳胺。水合肼活性较高、价格适中,其在工业生产和实验室中均有应用。催化水合肼还原芳硝基常用的催化剂有金属催化剂如镍[2]、钯[3]、银[4]、铑[5]和金[6]等,也有非金属催化剂如碳材料[7-8]、铁化合物[9-11]等。 铁化合物催化剂制备简单、价格低廉、活性较高,作为催化剂具有很大的优势。其中,无定形FeO(OH)制备过程简单、具有较高的活性,但其不稳定,容易转变成 α-Fe2O3而失活[9];Fe3O4较稳定、有磁性,易与物料分离,但其活性低于无定形 FeO(OH)。 将 Fe3O4与石墨烯[10]或氧化石墨烯[11]共沉淀得到的复合材料具有较高的催化活性,但石墨烯和氧化石墨烯的制备过程复杂,不利于该法的推广。在制备铁化合物催化剂的过程中加入表面活性剂能使其粒径较小、分布更均匀,催化剂的活性也显著提高[12]。前期,笔者研究了几种PEG修饰的Fe3O4对水合肼还原硝基苯的催化活性,发现PEG20000和PEG6000均能明显提高Fe3O4的催化活性和稳定性[13]。为进一步提高Fe3O4的性能,笔者在前期研究基础上选择PVP、CTAB、PEG20000 3种表面活性剂对Fe3O4进行修饰,发现加入表面活性剂能显著提高Fe3O4的催化性能。此方法操作简单,原料廉价易得,催化剂有磁性易回收。
1 实验部分
1.1 试剂与仪器
试剂:PVP(K-30)、PEG20000、CTAB、水合肼(质量分数≥50%)、FeCl3·6H2O、FeSO4·7H2O、硝基苯,均为分析纯;自制去离子水。
仪器:GC-2014A型气相色谱仪(GC),FID检测器,毛细管柱;UltimaⅣ型X射线衍射仪(XRD);JEM-2010型透射电子显微镜(TEM);ALPHA型红外光谱仪(FT-IR)。
1.2 催化剂制备和表征
采用共沉淀法制备Fe3O4,在制备过程中分别加入 PVP、PEG20000、CTAB以提高其性能。以加入PVP为例,称取0.30 g PVP(PVP与Fe3O4质量比为30%,下同)放入烧杯中,加入20 mL水搅拌溶解。称取 2.33 g FeCl3·6H2O、1.20 g FeSO4·7H2O 加入上述溶液中,搅拌至完全溶解。逐滴加入浓氨水,直至pH=10,室温下搅拌1 h。静置2 h,离心分离得到黑色沉淀,用蒸馏水洗涤至中性,放入烘箱中于80℃干燥4 h。将干燥后的催化剂研磨后放在干燥器中,记作Fe3O4-PVP。加入PEG20000和CTAB制备催化剂的方法与此法相同,表面活性剂的加入量均为0.3 g,所得催化剂分别记作Fe3O4-PEG和Fe3O4-CTAB。为作对比,不加表面活性剂用同样的方法制备了Fe3O4。
用XRD、TEM、FT-IR对催化剂的物相、形貌及结构进行表征。
1.3 催化剂活性评价
称取1.23 g(10 mmol)硝基苯加入三口烧瓶中,加入10 mL无水乙醇和0.01 g催化剂,开动搅拌,加热至回流。缓慢滴加水合肼溶液(20 mmol水合肼溶于5 mL乙醇)。用GC监测反应进程,用校正面积归一化法进行定量。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD分析
图1为加入表面活性剂前后制备催化剂XRD谱图。由图1看出,4种样品XRD谱图基本一致,与立方晶系 Fe3O4(JCPDS 65-3107)XRD 谱图吻合。2θ为 29.82、34.93、42.54、53.07、56.62、62.45°分别对应Fe3O4的(220)(311)(400)(422)(511)(440)晶面[10],说明采用共沉淀法制备Fe3O4时加入表面活性剂不会影响产物的物相。由谢乐公式根据XRD谱图中最强峰计算出 4 种 Fe3O4的粒径:Fe3O4,18.4 nm;Fe3O4-PEG,14.1 nm;Fe3O4-PVP,12.9 nm;Fe3O4-CTAB,12.9 nm。

图1 加入表面活性剂前后制备催化剂XRD谱图
2.1.2 TEM分析
图2为加入表面活性剂前后制备催化剂TEM照片。由图2可知:Fe3O4颗粒黏连较严重,Fe3O4-PEG黏连不太严重,Fe3O4-CTAB和Fe3O4-PVP黏连程度较轻。这是由于表面活性剂对颗粒的聚集起到一定的阻碍作用。Fe3O4微粒表面具有亲水特征,其表面容易羟基化而带有负电荷。CTAB为阳离子表面活性剂,PVP在水溶液中带有微弱的正电荷[14],由于静电和氢键的共同作用,它们与Fe3O4的作用较强,粒子聚集程度较轻;PEG与Fe3O4之间通过氢键连接,作用较弱,粒子聚集较严重;没有表面活性剂存在,Fe3O4粒子聚集最严重。由图2可知,4种催化剂的颗粒大小相差不大,颗粒直径约为10 nm。这一数值与用谢乐公式估算的粒径有一定差别,主要是由于颗粒聚集导致的。Fe3O4颗粒较小的原因是由于反应时间较短,小颗粒没有足够的时间熟化长成大颗粒。

图2 加入表面活性剂前后制备的催化剂TEM照片
2.1.3 FT-IR分析
图3为加入表面活性剂前后制备催化剂FT-IR图。由图3看出4条谱线差别不大。在3 514 cm-1处的强吸收峰为—OH的伸缩振动峰,表明4种样品中有大量羟基,即从水溶液中沉淀出的Fe3O4表面吸附了较多的水,通过低温干燥并不能将其完全除去;1 645 cm-1处的峰为O—H的弯曲振动峰,峰强度也较强,进一步证明样品中含较多的水。除Fe3O4外,其余3条谱线在3 031 cm-1处均有1个微弱的峰,为C—H的伸缩振动,表明样品中存在有机物,即加入的表面活性剂没有完全洗掉;在Fe3O4-PVP和Fe3O4-CTAB的谱线中在1 226 cm-1处出现一个新的吸收峰为C—N伸缩振动,说明PVP和CTAB均已成功修饰 Fe3O4[15]。 4条谱线在 609 cm-1处的吸收峰为Fe—O键的伸缩振动峰,是Fe3O4的特征吸收峰,4个样品中都有Fe3O4存在;487 cm-1和417 cm-1处的峰则对应于Fe2O3中Fe—O的伸缩振动,表明样品中含有Fe2O3。以上分析表明,样品中既有Fe3O4,也有Fe2O3。样品XRD谱图表明几个样品的主要成分为Fe3O4,但样品FT-IR图表明Fe2O3峰较强、Fe3O4峰较弱,二者信息不一致。这可能是由于表面的铁化合物在后处理过程中被氧化为Fe2O3。另外干燥后样品的颜色为褐色,但是有较强的磁性,也进一步证明样品的主要成分为Fe3O4,而表面则有Fe2O3生成。

图3 加入表面活性剂前后制备的催化剂FT-IR图
2.2 催化剂活性
2.2.1 表面活性剂对催化剂活性的影响
以10 mmol硝基苯为底物,以水合肼(20 mmol)为氢转移试剂,考察了4种催化剂(0.01 g)的性能,结果见图4。由图4可知,加入表面活性剂制备Fe3O4的催化活性均有一定程度的提高。Fe3O4-PEG的活性提高幅度较小;Fe3O4-PVP和Fe3O4-CTAB的活性提高幅度较大,二者活性相差很小,其中Fe3O4-PVP的性能更优。
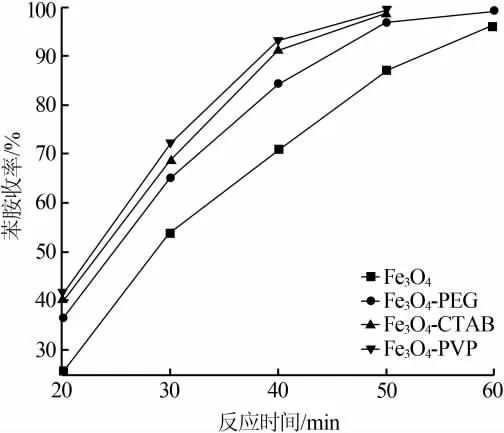
图4 表面活性剂对催化剂活性的影响
2.2.2 PVP用量对催化剂活性的影响
由于添加PVP制备的Fe3O4具有较好的催化活性,因此进一步研究了PVP用量对催化剂活性的影响,结果见图5。随着PVP用量增加催化剂的活性逐渐提高,当PVP用量达到30%时催化剂的活性最高,之后继续增加PVP用量催化剂的活性明显降低。其原因可能是:PVP用量较少时制备的催化剂易聚集导致活性较低;PVP用量较多时催化剂粒子外包覆较多的PVP阻碍反应的进行。可见,PVP用量为30%较适宜。

图5 PVP用量对催化剂活性的影响
2.3 催化剂重复性
催化剂的重复性是催化剂的一个重要性能。在反应完成后用磁铁分离催化剂,用无水乙醇洗涤3次后重复使用,考察Fe3O4-PVP的重复性,结果见图6。由图6可知,催化剂在使用11次后其活性有一定程度的降低,说明催化剂能够重复使用多次,具有很好的稳定性,稳定性高于PEG修饰的Fe3O4[13]。

图6 催化剂重复性
3 结论
采用共沉淀法制备了Fe3O4,在制备过程中加入PEG、CTAB、PVP表面活性剂能够减少粒子间的黏连。几种催化剂均在水合肼还原硝基苯制备苯胺的反应中表现出较高的活性。其中,加入PVP制备的Fe3O4具有更高的活性和较好的稳定性。在制备催化剂过程中,加入PVP质量为Fe3O4质量的30%较适宜。
[1] 龚灵,周少东,陈新志.氢转移反应的研究概述[J].化工进展,2010,29(3):478-483,489.
[2] Singla M L,Negi A,Mahajan V,et al.Catalytic behavior of nickel of nanoparticles stabilized by lower alkylammonium bromide in aqueous medium[J].Appl.Catal.A:Gen.,2007,323:51-57.
[3] Shil A K,Sharma D,Guba N R,et al.Solid supported Pd(0):an efficient recyclable heterogeneous catalyst for chemoselective reduction of nitroarenes[J].Tetrahedron Lett.,2012,53:4858-4861.
[4] Hernández-Gordillo A,González V R.Silver nanoparticles loaded on Cu-doped TiO2for the effective reduction of nitro-aromatic contaminants[J].Chem.Eng.J.,2015,261:53-59.
[5] Guha N R,Bhattacherjee D,Das P.Solid supported rhodium(0) nanoparticles:anefficientcatalystforchemo-andregio-selectivetransfer hydrogenation of nitroarenes to anilines under microwave irradiation[J].Tetrahedron Lett.,2014,55:2912-2916.
[6] Gkizis P L,Stratakis M,Lykakis I N.Catalytic activation of hydrazine hydrate by gold nanoparticles:Chemoselective reduction of nitro compounds into amines[J].Catal.Commun.,2013,36:48-51.
[7] Wu S C,Wen G D,Zhong B W,et al.Reduction of nitrobenzene catalyzedbycarbonmaterials[J].ChineseJ.Catal.,2014,35:914-924.
[8] Fujita S,Watanabe H,Katagiri,A,et al.Nitrogen and oxygen-doped metal-free carbon catalyst for chemoselective transfer hydrogenation of nitrobenzene,styrene,and 3-nitrostyrene with hydrazine[J].J.Mol.Catal.A:Chem.,2014,393:257-262.
[9] Lauwiner M,Rys P,Wissmann J.Reduction of aromatic nitro compounds with hydrazine hydrate in the presence of aan iron oxide hydroxide catalyst.Ⅰ.The reduction of monosubstituted nitroben zenes withhydrazinehydrateinthepresenceofferrihydrite[J].Appl.Catal.A:Gen.,1998,172:141-148.
[10] He G Y,Liu W F,Sun X Q,et al.Fe3O4@graphene oxide composite:A magnetically separable and efficient catalyst for the reduction of nitroarenes[J].Mater.Res.Bull.,2013,48:1885-1890.
[11] Feng C,Zhang H Y,Shang N Z,et al.Magnetic graphene nanocomposite as an efficient catalyst for hydrogenation of nitroarenes[J].Chinese Chem.Lett.,2013,24:539-541.
[12] 石丽丽,陈刚,孙琪,等.FeCl3/PVP胶体催化水合肼还原硝基苯[J].石油化工,2010,39(7):789-793.
[13] 蔡可迎,刘玉胜,马方沛,等.聚乙二醇修饰的Fe3O4催化水合肼还原硝基苯[J].科学技术与工程,2016,16(15):257-259,272.
[14] 杨延莲,栾玉霞,庞玢,等.PVP/HEC分子间缔合作用机理探讨[J].化学物理学报,2002,15(2):141-145.
[15] 涂志江,张宝林,冯凌云,等.聚乙二醇/聚乙烯吡咯烷酮修饰的纳米 Fe3O4粒子的制备与表征[J].化工学报,2012,63(12):4089-4095.
Preparation of Fe3O4particles and their activity in reduction of nitrobenzene with hydrazine hydrate
Cai Keying,Zhou Yingmei,Tao Wei,Zhou Lei
(School of Chemistry and Chemical Engineering,Xuzhou Institute of Technology,Xuzhou 221018,China)
Iron compounds show high activity in the reduction of nitrobenzene with hydrazine hydrate,but their reusability is poor.The Fe3O4particles were prepared by co-precipitation method of ferric chloride and ferrous sulfate.Some surfactants,such as polyethylene glycol(PEG),cetyltrimethyl ammonium bromide(CTAB) and polyvinyl pyrrolidone(PVP) were used to modify Fe3O4particles to improve their performances.The as-prepared composites were characterized by X-ray powder diffraction(XRD),transmission electron microscope(TEM) and Fourier transform infrared spectroscopy(FT-IR).The results showed that the surfactants can improve the dispersity of the Fe3O4particles.The catalytic performances of as-prepared composites were investigated in the reduction of nitrobenzene with hydrazine hydrate.The results showed that the Fe3O4composite modified with PVP had higher activity and better reusability,and no appreciable loss of catalytic activity was observed after the Fe3O4-PVP composite was recycled for eleven times.The composites can be easily recovered due to its magnetism.
Fe3O4;nitrobenzene;hydrazine hydrate
TQ138.11
A
1006-4990(2017)12-0065-04
江苏省重大科技支撑项目(BE2015041)。

