温度对薄壳山核桃种子萌发的影响及其机制初探
薛婷婷 ,刘 嘉 ,沈永宝 ,2,刘广勤
(1.南京林业大学 林学院,江苏 南京 210037;2.南方现代林业协同创新中心,国家林业局南方林木种子检验中心,江苏 南京 210037;3.江苏省农业科学院 园艺研究所,江苏 南京 210014)
温度对薄壳山核桃种子萌发的影响及其机制初探
薛婷婷1,刘 嘉1,沈永宝1,2,刘广勤3
(1.南京林业大学 林学院,江苏 南京 210037;2.南方现代林业协同创新中心,国家林业局南方林木种子检验中心,江苏 南京 210037;3.江苏省农业科学院 园艺研究所,江苏 南京 210014)
将薄壳山核桃的完整种子与去壳种子在不同温度条件下进行发芽试验,并测定了温度对淀粉酶活性的影响,菜豆素(淀粉酶抑制剂)对完整种子萌发的影响,以及不同温度对种子萌发初期中,淀粉、可溶性糖、粗脂肪、可溶性蛋白和游离氨基酸变化的影响。结果表明:薄壳山核桃种子在30、35℃条件下,种子萌发率分别为84%、82%,显著高于15、25和40℃3个温度下的情况,且所需的萌发时间较15、25℃条件下更短;因此薄壳山核桃种子适宜的萌发温度为30~35℃的高温条件,而超过该温度区间容易对种子造成伤害。同时,生理研究的结果显示,15~30℃时,温度越高,薄壳山核桃种子淀粉酶活力也越高,而淀粉酶活性抑制剂能够显著降低薄壳山核桃种子在30℃中的萌发率,这表明在一定温度范围内,温度变化可改变淀粉酶活性,从而调控薄壳山核桃种子萌发;同时,其它生理指标测定表明,糖类的代谢与蛋白质的代谢在种仁响应温度变化的过程中具有重要的作用。
薄壳山核桃;种子萌发;温度;淀粉酶
薄壳山核桃Carya illinoensis为胡桃科山核桃属高大乔木,原产美国以及墨西哥北部,既为果用、油用、 材用树种,又可作为庭园绿化树种,具有重要的经济价值[1],我国进行了大量的引种栽培实验[2-4]。前人研究表明[5-6],温度是薄壳山核桃种子萌发的主要限制条件,并且薄壳山核桃种子萌发最适温度较高。
温度作为一种重要的环境因子,对调控植物种子的休眠与萌发起着重要的作用,因此人们已对种子萌发响应温度的生理机理进行了长期而深入的研究,并取得了丰富的研究成果,但目前研究涉及的植物种子最适萌发温度往往在10~25℃等中低温区,如莴苣Lactuca sativa种子[7],并且温度较高时还会引起热休眠(thermoinhibition)[8-9]。目前我们对植物高温(30℃以上)萌发的生理机制还知之甚少。因此本文选择具有高温萌发特性的薄壳山核桃种子为研究材料,对这种萌发的机制进行初步探究。
本文通过对薄壳山核桃的完整种子及去壳种子在不同温度的发芽条件下进行萌发试验,以探索薄壳山核桃种子的最适萌发温度,并判断温度对种子萌发的作用部位是在种壳或是种仁。还通过对不同温度下薄壳山核桃种子萌发初期内含物的变化,为进一步探究薄壳山核桃种子高温萌发机制提供基础。
另外,前人对大豆Glycine max与豌豆Pisum sativum种子的研究表明[10-11],棉籽糖能够显著促进胚根突破被覆物;而许多研究表明,GA3能够促进薄壳山核桃种子萌发[6],而GA3能够提高α-淀粉酶的活力[12-13],而温度又是影响淀粉酶活力的重要原因,并且许多淀粉酶的最适温度都较高(如唾液淀粉酶的最适温度为37℃)。因此,我们假设淀粉酶在核桃高温萌发过程中发挥了重要的作用,并进行试验验证。
1 材料与方法
1.1 材 料
薄壳山核桃新鲜种子品种为“金华”,由江苏省农科院园艺所提供,于2015年11月初采自江苏泗洪,种子采收后自然风干,实验自2015年11月20日开始。经测定,种子横径(19.63±1.00)mm,纵径(32.58±3.00) mm,千粒重(5.64±0.50)kg;种子含水量7.1%,其中种壳含水量12.5%,种仁含水量3.5%。
1.2 方 法
1.2.1 种子萌发
首先对种子进行如下两组处理:
a)完整种子:随机抽取5组4×50粒完整种子,在室温(10~25 ℃)条件下于水中浸泡10d(此时种子充分吸胀,结果未发表)。
b)去壳种子:随机抽取5组4×50粒完整种子,用胡桃夹子将薄壳山核桃夹出环形裂口,拔下胚根两端种壳,取完整种仁,在室温(10~25 ℃)条件下于水中浸泡1 d(此时种仁充分吸胀,结果未发表)。
将完整种子与去壳种子放置在铺有湿润棉床的发芽盒中,其上用湿润脱脂棉覆盖,分别放至15、25、30、35、40 ℃5个温度的恒温培养箱中培养。
从置床开始,每日统计种子萌发情况,以胚根突破种壳(去壳种子以胚根突破种皮)为发芽标准[14-18]。萌发结束后,解剖种子,统计腐烂种子以及既未萌发也未腐烂的种子的数量。
1.2.2 种子萌发过程中内含物的含量测定
随机抽取3组3×100粒完好的种子,在室温条件下于水中浸泡吸胀10 d,而后放置在铺有湿润棉床的发芽盒中,分别放至15、25、35℃的恒温培养箱内。浸泡时取样3次,分别在吸胀0(干种子)、5、10 d时取样;放入恒温培养箱后,每个温度各取样6次,分别在吸胀12、14、16、18、20、22 d时取样。每次取3×10粒种子,剥去种壳,取出种仁,切碎混合均匀后,保存于-70 ℃冰箱中备用。
由于吸胀过程中水分会导致总重变化,因此,测定内含物时,同时测定种仁的含水量,然后将测得的内含物含量换算为每g干种仁中的含量。
每个生理指标均从3×10粒薄壳山核桃混合样品中取3×4 g进行测定。可溶性糖含量的测定采用蒽酮比色法[19];淀粉含量的测定采用碘显色法[20];粗脂肪含量的测定采用索氏提取法[21];可溶性蛋白含量的测定采用考马斯亮蓝 G-250 染色法[19];游离氨基酸测定采用 氨基酸与茚三酮显色反应[19]的测定方法.
1.2.3 温度对淀粉酶活性的影响
称取10 g薄壳山核桃样品,按照[23]中所述的方法进行酶液的提取后分成3份,分别转移至15、25、35 ℃的恒温培养箱中按照[23]淀粉酶作用淀粉生成还原糖与 3,5- 二硝基水杨酸的显色反应来测定酶活性。实验进行3个重复。
1.2.4 淀粉酶抑制剂对薄壳山核桃种子萌发的影响
按照1.2中的方法取2组4×50粒完整种子与2组4×50粒去壳种子,将种子放置在铺有湿润棉床的发芽盒中,其上用湿润脱脂棉覆盖,加4 mg/L α-淀粉酶抑制剂(菜豆素溶液),以加无菌水发芽种子为对照实验,放至30 ℃的恒温培养箱中培养。从置床开始,每日统计种子萌发情况,以胚根突破种壳(去壳种子以胚根突破种皮)为发芽标准。
1.2.5 数据处理
试验数据用Excel 2003处理和数据分析采用SPSS 17.0软件进行Duncan多重比较。
2 结果与分析
2.1 温度对完整种子与去壳种子萌发的影响
完整薄壳山核桃种子在5个温度中的萌发情况如图1所示。薄壳山核桃种子在30 ℃时萌发率最高,为84%;在35 ℃萌发温度时萌发率其次,为82%;而在25 ℃萌发温度下,萌发率仅为48%;在40和15 ℃萌发条件下种子萌发率仅为3%和0。种子在35 ℃萌发条件下,最早开始萌发且萌发速度最快;30 ℃萌发温度下其次;而在25 ℃条件下萌发,种子置床15 d才开始萌发,且直到60 d后,萌发仍未结束。根据萌发情况,30 ℃为最适宜薄壳山核桃种子萌发的温度。
去壳薄壳山核桃种子在5个温度中的萌发情况如图2所示。薄壳山核桃种子在30℃时萌发率最高,为89%;在35℃萌发温度时萌发率其次,为83%;而在25℃萌发温度下,萌发率为72%;在40℃萌发温度下,萌发率为36%;而在15℃萌发温度下,种子始终不萌发。种子在35℃萌发条件下,最早开始萌发且萌发速度最快,30℃萌发温度其次;而在40℃条件下萌发,种子仅萌发4天即停止萌发;在25℃条件下萌发,种子开始萌发最迟且萌发速度最慢。
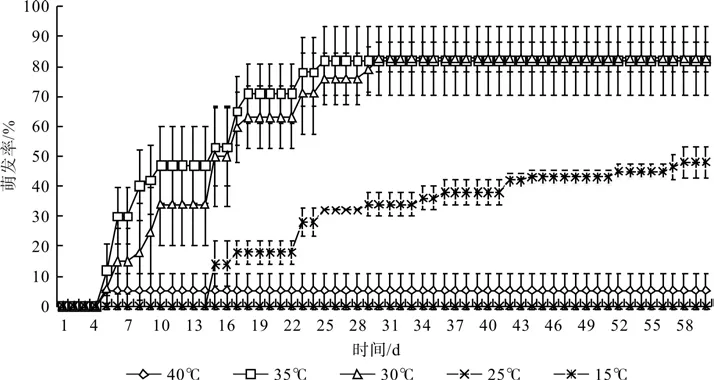
图1 完整薄壳山核桃种子在5个温度下的萌发情况Fig.1 The germination of whole pecan seed under fi ve different temperatures
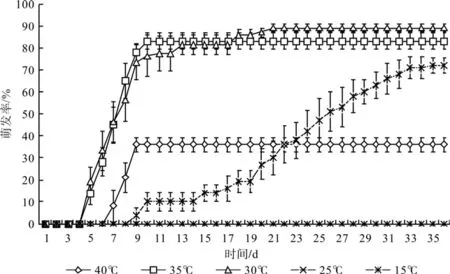
图2 去壳的薄壳山核桃种子在5个温度下的萌发情况Fig.2 The germination of pecan seed without shell under fi ve different temperatures
对不同温度下完整种子与去壳种子的萌发率、腐烂率、有生活力但未萌发率进行多重比较(见表1)可知,完整种子与去壳种子萌发,在萌发温度为30、35 ℃时萌发率均显著高于25 ℃的萌发率,而25 ℃的萌发率则显著高于40 ℃的萌发率。
另外30、35 ℃时去壳与完整种子的萌发率、腐烂率均无显著差异,且不存在未萌发也未腐烂的种子;40 ℃时,去壳种子萌发率显著高于完整种子,而腐烂率显著低于完整种子,也不存在有生活力但未萌发的种子;25 ℃时,去壳种子萌发率显著高于完整种子,腐烂率显著低于完整种子,完整种子中有23%的种子有生活力但未萌发,而去壳种子中没有这种情况;15℃时,种子均未萌发,腐烂率也无显著差异。
虽然30与35 ℃种子萌发率与腐烂率并无显著差异,但是在35 ℃中萌发率的腐烂率的标准差较大,即35 ℃中萌发率并不够稳定,且部分更容易腐烂。因此,对于活力较低的薄壳山核桃种子可能在35 ℃中更容易腐烂,而更适合在30 ℃条件下萌发。

表1 温度与去壳处理对薄壳山核桃种子萌发的影响†Table 1 Effects of decladding and incubation temperature on pecan seed germination
表2可以看出不同温度下完整种子与去壳种子的萌发速率的差异,由于在40 ℃条件下萌发,腐烂的种子极多,而15℃萌发温度时,种子均未萌发,因此主要分析25、30、35 ℃的情况。无论是萌发终止时间、萌发率达到最大萌发率一半所需要的时间,均显示25>30>35℃,而萌发开始的时间表现为25>30与35 ℃(标准差均为0,无法进行多重比较)。因此,在一定范围内,随着温度的升高薄壳山核桃种子萌发速率显著提高。
种子去壳以后,在25、30、35 ℃时,萌发终止时间均显著的少于完整种子;25 ℃时,种子去壳以后萌发开始时间比完整种子少了6 d;而30 ℃时,去壳种子的萌发率达到最大萌发率一半所需要的时间显著少于完整种子。并且,这里的萌发时间均从种子充分吸胀以后置床的时间算起,也就是说这种种壳引起的萌发速率显著的降低并不是由种壳限制种子吸胀速率引起的。
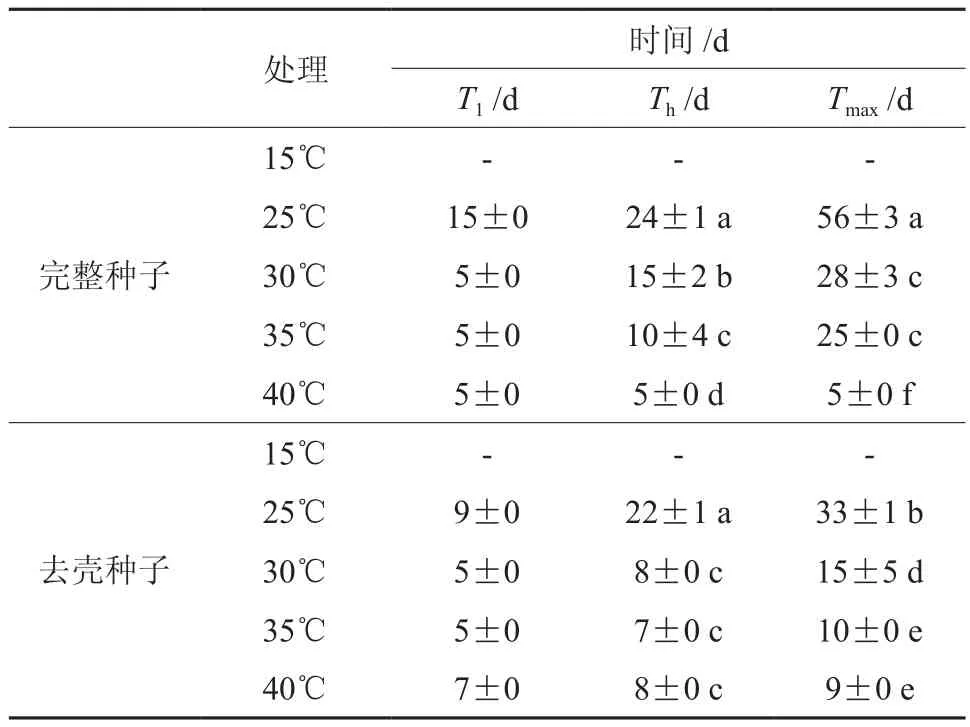
表2 温度对去壳薄壳山核桃种子萌发速率的影响†Table 2 Effects of temperature on speed of pecan seed germination
2.2 种子萌发初始阶段种子内含物变化
2.2.1 可溶性糖含量的变化
种子萌发时呼吸速率加快,所需要的直接呼吸底物就是可溶性糖。在种子的萌发过程中,可溶性糖一方面作为能量来源被快速分解,另一方面又为胚细胞的生长和分裂提供了原料,是种子萌发整个过程中的重要营养物质。图3为不同温度下薄壳山核桃种子萌发初始阶段可溶性糖含量的变化:在室温吸胀10 d内,种子中的可溶性糖含量不断上升,由27.3 mg/g上升到37.6 mg/g;而后,放入不同温度的恒温培养箱,在15 ℃萌发温度下,可溶性糖含量一直下降,最终含量下降至25.0 mg/g;在25 ℃萌发温度下,可溶性糖先下降至21.7 mg/g,从18~22 d又有少量的上升;在35 ℃萌发温度下,可溶性糖先迅速下降至25.8 mg/g,之后可溶性糖又回升至29.2 mg/g。
2.2.2 淀粉含量的变化
淀粉是种子中贮藏的最重要和最广泛的碳水化合物,种子萌发时,淀粉在淀粉酶的作用下降解为小分子的可溶性物质,同时释放出大量的能量供胚吸收利用,其含量的变化是种子代谢状况的重要指标。图4为不同温度下薄壳山核桃种子萌发初始阶段淀粉含量的变化情况:室温吸胀阶段,种子中的淀粉含量缓慢上升,由1.91 mg/g上升到2.22 mg/g;而后放入不同温度的恒温培养箱,在15 ℃萌发温度下,淀粉含量先持续上升至4.42 mg/g,之后含量又下降到3.29 mg/g,呈现很明显的先升后降的趋势;在25 ℃萌发温度下,一开始,淀粉含量下降至1.56 mg/g,然后上升至2.16 mg/g,之后下降至1.33 mg/g,淀粉含量呈现出先下降后上升然后又下降的趋势;在35 ℃萌发温度时,在10~16 d,淀粉含量变化不大,而从16~22 d含量下降至0.89 mg/g。

图3 不同温度下薄壳山核桃种子萌发初始阶段可溶性糖含量的变化Fig.3 Changes on soluble sugar content of the pecan seeds during initial germinating stages

图4 不同温度下薄壳山核桃种子萌发初始阶段淀粉含量的变化Fig.4 Changes on starch content of the pecan seeds during initial germinating stages
2.2.3 粗脂肪含量的变化
脂肪是种子主要的贮藏物质之一,它与糖和蛋白质共同构成细胞的组成物质。种子萌发过程中,脂肪在脂肪酶的作用下水解成脂肪酸和甘油,再进一步转化为糖类,供胚利用。薄壳山核桃种子初始粗脂肪含量极高,达77.3%±6.2%(即773±62 mg/g)。图5为不同温度下薄壳山核桃种子萌发初始阶段粗脂肪含量的变化情况:无论是室温吸胀,还是在后期3个温度中,种子中的粗脂肪含量变化很小,尤其是15与25 ℃中,22 d时粗脂肪含量为751 mg/g与732 mg/g,降低的量不足原含量的5%;在35℃中,粗脂肪含量下降最多,但也有649 mg/g,降低的量仅约原含量的15%。从图中还可以看出,即使中间的时间点,粗脂肪含量存在微弱的波动,但波动的幅度较小。
2.2.4 可溶性蛋白含量的变化
蛋白质是种子内贮藏的重要营养物质,在种子萌发时蛋白质水解产生氨基酸,用于新蛋白质的合成,为种子萌发和幼苗的生长提供氮素营养。另外,植物体内的可溶性蛋白部分是参与各种代谢的酶类,其含量的变化是了解植物代谢状况的一个重要指标。图6为不同温度下薄壳山核桃种子萌发初始阶段可溶性蛋白含量的变化情况:室温吸胀阶段,种子中的可溶性蛋白含量由9.97 mg/g上升到25.57 mg/g;而后放入不同温度的恒温培养箱,15与25 ℃条件下,可溶性蛋白变化的趋势基本一致,均为简单的先上升后下降的趋势,且转折点都在16 d,而35 ℃时可溶性蛋白的变化与之截然不同,表现出先上升后下降再上升的趋势,其上升点出现在18 d,这可能是由于,原本作为贮藏的可溶性蛋白在萌发准备阶段先降解为氨基酸,而与薄壳山核桃种子萌发相关的代谢已启动后,新的蛋白质又被大量合成,用于胚根与胚芽的生长发育。

图5 不同温度下薄壳山核桃种子萌发初始阶段粗脂肪含量的变化Fig.5 Changes on fat contents of the pecan seeds during initial germinating stages

图6 不同温度下薄壳山核桃种子萌发初始阶段可溶性蛋白含量的变化Fig.6 Changes on soluble protein contents of the pecan seeds during initial germinating stages
2.2.5 游离氨基酸含量的变化
在种子萌发过程中,贮藏蛋白质在蛋白酶的作用下逐渐分解为氨基酸,使游离氨基酸含量迅速增加,氨基酸运至种胚,构成新细胞的原生质。图7为不同温度下薄壳山核桃种子萌发初始阶段游离氨基酸含量的变化情况:从室温吸胀开始,以及种子放入3个温度的恒温培养箱中的萌发,薄壳山核桃中的游离氨基酸均大幅上升,至第22 d,在35 ℃中,游离氨基酸从最初的110.8 μg/g上升至408.6 μg/g;在 25 ℃中上升至 347.3 μg/g;在 15 ℃中273.6 μg/g,但相较于室温吸胀第10 d的含量264.9 μg/g 变化很小。
2.3 温度对薄壳山核桃种子中淀粉酶活性的影响
由图8可见看出,温度对同一粒薄壳山核桃种子中的淀粉酶活性具有极显著(P<0.01)或显著(P<0.05)的影响,在30 ℃时,淀粉酶活性高达21 μ/g,是25 ℃中淀粉酶活性的6.3倍,是15 ℃中淀粉酶活性的17.9倍。
2.4 α淀粉酶抑制剂对薄壳山核桃种子萌发的影响
图9和图10反应出α淀粉酶抑制剂—菜豆素能够显著抑制薄壳山核桃种子在30℃中萌发,加入菜豆素以后,完整种子的萌发率从83%降低至61%,而去壳种子的萌发率也从89%降低至64%。
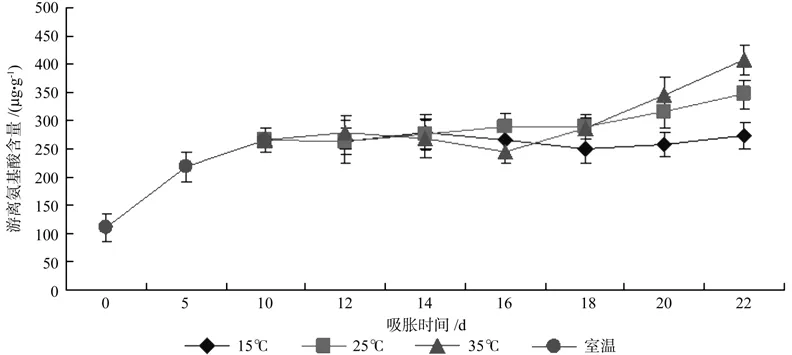
图7 不同温度下薄壳山核桃种子萌发初始阶段游离氨基酸含量的变化Fig.7 Changes on free amino acid contents of the pecan seeds during initial germinating stages

图8 不同温度对薄壳山核桃种子中淀粉酶活性的影响Fig.8 Effects of temperature on amylase activity in pecan seed
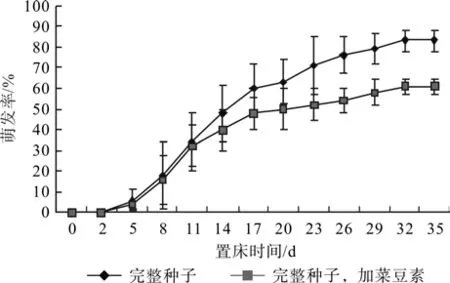
图9 菜豆素对完整薄壳山核桃种子在30℃中萌发的影响Fig.9 Effects of phaseolamin on pecan seed germination at 30℃
3 结论与讨论
3.1 萌发最适条件
完整薄壳山核桃种子在5个温度中的萌发结果显示,在30、35 ℃条件下,种子萌发率分别为84%、82%,显著高于15、25和40 ℃3个温度下的情况;而30、35 ℃条件下无论初始萌发时间、达到最大萌发率一半的时间、以及达到最大值所需时间都大幅低于于15、25 ℃条件下。因此30~35 ℃是最适宜薄壳山核桃种子萌发的温度,这与前人的[24-26]的研究结果一致。
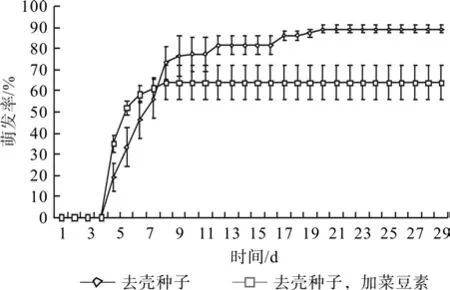
图10 菜豆素对去壳薄壳山核桃种子在30 ℃中萌发的影响Fig.10 Effect of phaseolamin on germination of pecan seeds without shell at 30℃
另外,在40 ℃时,虽然萌发初始时间与萌发结束时间均早于30、35 ℃条件下,但萌发率很低。此时极高的种子腐烂率反应出超过35 ℃以后,高温对种子造成了显著的伤害,导致种子活力降低,难以萌发成苗。
需要指出的是,《林木种苗标准汇编》中给出的薄壳山核桃种子萌发方法“种子吸胀2~3d后,低温层积2个月后在25 ℃中萌发”,但按照这一方法,最终萌发率仅能达到70%左右,且耗时很长,因此该方法并不可取。此方法不仅选错了适宜的萌发温度,且萌发前的吸胀时间过短。李近雨等对核桃Juglans regia种子的研究表明[27],不完全吸胀的核桃种子更容易腐烂;而薄壳山核桃种子完全吸胀需要10 d,因此2~3 d的吸胀时间也可能会导致了薄壳山核桃种子腐烂,萌发率降低。
3.2 种壳的作用
在去壳条件下,不同温度对种子萌发的影响具有显著的差异,30、35℃条件下的萌发率显著高于15、25和40 ℃3个温度下的情况,这就说明种仁的生理代谢对温度的响应影响了种子的萌发。
在25、30与35 ℃条件下,去壳显著降低了种子萌发所需的时间,这表明种壳对种子的萌发速率是具有限制作用的。有趣的是,在25 ℃下,去壳能够显著提高薄壳山核桃种子的萌发率,而在30与35 ℃条件下,去壳薄壳山核桃种子的萌发率无显著影响;这表明较高的温度(30~35 ℃)能够解除种壳对种子萌发率的限制作用,即温度能够直接或间接的作用于种壳以调控种子的萌发。
3.3 高温萌发的生理机制
3.3.1 糖代谢
3个温度下可溶性糖表现出截然不同的变化:在15 ℃中可溶性糖始终降低,而35与25 ℃中可溶性糖的含量在下降一段时间后又先后出现了较大回升。可能是由于萌发过程中可溶性糖作为重要的能源物质需求量很大,因此前期均在消耗;而后期淀粉等高分子物质科转化为小分子糖,使可溶性糖得到了补充。
这一推测在淀粉与淀粉酶活性的测定结果中得到了证实:(1)15~30 ℃时,温度越高,薄壳山核桃种子淀粉酶活力也越高;(2)15℃中,淀粉的含量在相当长的一段时间中都持续升高;而在25与35 ℃中,淀粉含量维持不变一段时间后,在16~18 d开始显著降低,这与可溶性糖含量上升的转折时间基本一致。因此认为,糖代谢与薄壳山核桃种子高温萌发的机制存在极大的联系。
另外,温度能够直接影响淀粉酶的活性,而淀粉酶活性抑制剂(菜豆素)能够显著降低薄壳山核桃种子在30 ℃中的萌发率。这表明在一定温度范围内,温度可通过改变淀粉酶活性来调控薄壳山核桃种子的萌发。
前人研究也表明了糖类对种子萌发具有非常重要的作用:棉籽糖[28-29](也是一类可溶性糖)有利于胚根突破种皮;绿豆萌发初期,与糖类代谢相关的化合物——蔗糖、单糖、棉籽糖家族寡糖,与莽草酸代谢相关的羧酸和氨基酸等化合物含量均发生了显著性的改变,而棉籽糖家族寡糖的降解可能是绿豆萌发最主要的能量来源[30]。
3.3.2 蛋白质代谢
此外,蛋白质的代谢同样与温度存在一定的相关性。15与25 ℃条件下,可溶性蛋白变化的趋势基本一致,均为简单的先上升后下降的趋势,且转折点都在16 d,而35 ℃时可溶性蛋白的变化与之截然不同,表现出先上升后下降再上升的趋势,其上升点出现在18 d,这可能是由于,原本作为贮藏的可溶性蛋白在萌发准备阶段先降解为氨基酸,而与薄壳山核桃种子萌发相关的代谢已启动后,新的蛋白质又被大量合成,用于胚根与胚芽的生长发育。
虽然种子中的游离氨基酸含量在3个温度中有一定的差异,但是其变化趋势基本一致,并且在前期游离氨基酸含量差异不大;而随着萌发的进程的推进,游离氨基酸含量均提高,且温度越高游离氨基酸含量越高。这表明游离氨基酸也参与了对温度的响应。
3.3.3 脂肪代谢
在不同温度中,粗脂肪的变化很小。同样的,前人对白皮松Pinus bungdan[31]种子在萌发过程粗脂肪含量前期变化幅度不大,种子突破种皮后才开始大量利用脂肪,并且脂肪降解生成大量的糖。而阿月浑子Pistacia vera[32]、欧洲榛子Corylus avellana[33]等种子萌发过程也表现出相似的情况。因此,薄壳山核桃在高温中的萌发机制可能与油脂代谢无太大关联。
[1]王 静,吕芳德. 我国山核桃属植物研究进展[J].经济林研究,2012,30(1):138-142.
[2]常 君,姚小华,邵慰忠,等.薄壳山核桃不同砧木对嫁接成活率及生长指标的影响[J]. 中南林业科技大学学报,2016,36(2):56-60.
[3]何小艳,殷 巧,马 平,等.安农系列薄壳山核桃良种在安徽的引种表现[J].经济林研究,2013,31(2):104-108.
[4]朱海军,刘广勤,生静雅,等.促进薄壳山核桃种子萌发研究进展[J].江苏农业科学,2011(4):233-236.
[5]van Staden J, Dimalla G G. Regulation of germination of pecan,Carya illinoensis[J]. Zeitschrift Für P flanzenphysiologie, 1976,78(1): 66-75.
[6]Dimalla G G,van Staden J. The effect of temperature on the germination and endogenous cytokinin and gibberellin levels of pecan nuts[J]. Zeitschrift Für P flanzenphysiologie, 1977, 82(3):274-280.
[7]Gonai T, Kawahara S, Tougou M,et al.Abscisic acid in the thermoinhibition of lettuce seed germination and enhancement of its catabolism by gibberellin[J]. Journal of Experimental Botany,2004, 55(394): 111-18
[8]Berrie AMM. The effect of temperature and light on the germination of lettuce seeds[J]. Physiologia Plantarum,1966,19,429-436.
[9]Thompson PA. Geographical adaptation of seeds[C]//In Heydecker W, ed. Seed ecology. London, UK: Butterworths,1973: 31-58.
[10]Dierking E C, Bilyeu K D. Raf fi nose and stachyose metabolism are not required for efficient soybean seed germination[J].Journal of Plant Physiology,2009,15,16(12):29-35.
[11]Andreas Blöchl, Thomas Peterbauer, Andreas Richter.Inhibition of raffinose oligosaccharide breakdown delays germination of pea seeds[J].Journal of Plant Physiology,2007,164:1093-1096.
[12]王 宏,项时康,陈建华,等.棉花种子发芽过程中生理生化变化及赤霉素(GA3)的调节Ⅱ棉花子叶中酶活性及内源激素的变化[J].棉花学报,1997,9(3):126-131.
[13]Sun T P,Gubler F. Molecular mechanism of gibberellin signaling in plants [J]. Annu. Rev. Plant Biology,2004,55:197-223.
[14]Atwater BR. Germination, dormancy and morphology of the seeds of herbaceous ornamental plants[J]. Seed Science Technology, 1980,8,523-573.
[15]Corbineau F, Come D. Some particularities of the germination ofOldenlandia corymbosaL. seeds (tropical Rubiaceae) [J]. Israel Journal of Bot., 1981,29:157-167.
[16]Bewley J D, Black M. Seeds, Physiology of Development and Germination[M]. second ed. New York and London:Plenum Press, 1994.
[17]Figueroa R, Doohan D, Cardina J,et al. Common groundsel(Senecio vulgaris) seed longevity and seedling emergence[J].Weed Science, 2007,55:187-192.
[18]Leon RG, Bassham DC, Owen MDK. Thermal and hormonal regulation of the dormancy-germination transition in Amaranthus tuberculatus seeds[J].Weed Res. ,2007,47, 335 344.
[19]李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[20]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社, 2006.
[21]中华人民共和国国家标准. GB/T14772-2008 食品中粗脂肪的测定[P]. 2008.
[22]王文平.植物样品中游离氨基酸总量测定方法的改进[J].北京农学院学报, 1998, 13(3): 9-13.
[23]徐昌杰,陈文峻,陈昆松,等.淀粉含量测定的一种简便方法—碘显色法[J].生物技术, 1998, 8(2): 41-43.
[24]van der ValkA G, RosburgT R. Seed bank composition along a phosphorus gradient in the northern Florida everglades[J].Wetlands,1997,17:228-236.
[25]van Staden J,Dimalla GG. Regulation ofgermination ofpecan,Carya illinoensis[J]. Z. P flanzen physiology, 1976,78:66-75.
[26]Rehman N, Hussain L, Nisa Z U. Germination study on five different varieties of pecan nut[J]. Pakistan Journal of Biology Science,1999, 2(3):917-918
[27]李近雨.核桃种子烂种原因及发芽条件的研究[J].林业科学,1994,30(1):18-24.
[28]Dierking E C, Bilyeu K D.Raf fi nose and stachyose metabolism are not required for ef fi cient soybean seed germination[J].Journal of Plant Physiology, 2009, 16(12):1329-35.
[29]Andreas Blöchl, Thomas Peterbauer, Andreas Richter.Inhibition of raffinose oligosaccharide breakdown delays germination of pea seeds[J].Journal of Plant Physiology,2007,164(8):1093-1096.
[30]吴香玉.绿豆萌发的动态代谢组学研究[D].武汉:中国科学院研究生院(武汉物理与数学研究所),2014.
[31]尚 杰,王文章,赵垦田,等.白皮松种子萌发过程中有机质代谢的研究[J].东北林业大学学报,1992,20(2):40-45.
[32]刘忠华,董 源,路丙社,等.阿月浑子种子萌发过程中贮藏物质含量的初步研究[J].种子,2002,21(6):28-30.
[33]韩克杰,孙 霞,邢世岩,等.欧洲榛子贮藏及萌发生理特性研究[J].武汉植物学研究,2006,25(5):435-440.
Study on the seed germination characteristic ofCarya illinoensis
XUE Tingting1, LIU Jia1, SHEN Yongbao1,2, LIU Guangqin3
(1. College of Forestry, Nanjing Forestry University,Nanjing Forestry University, Nanjing 210037, Jiangsu, China; 2. Co-innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University; Southern Tree Seed Inspection Center National Forestry Administration, Nanjing 210037, Jiangsu, China; 3. Jiang Su Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China)
A germination test of complete, shelledCarya illinoinensisseeds at different incubation temperature. And during the initial germinating stages of pecan seeds, the soluble sugar content, starch content, fat content, soluble protein content and free amino acid content was determined at different temperatures. Results showed that the germination percentages were 84% and 82% at 30℃ and 35℃respectively, which were signi fi cantly higher than that at 15℃ , 25℃ and 40℃ and need less germination time. However, high incubation temperature is harmful to pecan seeds,so the optimal incubation temperature is 30 to 35℃ for pecan seed(especially for pecan seeds in low vigor); At 15-30 ℃, the higher the temperature, the pecan seed amylase activity is also higher. And the amylase activity inhibitor can signi fi cantly reduce the germination rate of Pecan seed at 30 ℃. This shows that in a certain temperature range, the temperature can change the activity of amylase, thereby regulating pecan seed germination. In addition, physiological results shows that soluble sugar content and soluble protein content play a important role in pecan seed germination in respond to different temperatures.
Carya illinoensis; seed germination; temperature; amylase
S722.1
A
1673-923X(2017)11-0042-09
10.14067/j.cnki.1673-923x.2017.11.008
2016-08-30
江苏高校优势学科建设工程资助项目(PAPD)
薛婷婷,博士研究生
沈永宝,教授,博士;E-mail:ybshen@njfu.com.cn
薛婷婷,刘 嘉,沈永宝,等.温度对薄壳山核桃种子萌发的影响及其机制初探[J].中南林业科技大学学报,2017,37(11): 42-50.
[本文编校:吴 毅]

