慢性阻塞性肺疾病急性加重期患者血尿酸水平、住院时间与营养不良的相关性
王红 李文慧 何志红 陈庆娜 张红红 袁梦琪 王利军 金颖 毕文淼 张国宏
·论著·
慢性阻塞性肺疾病急性加重期患者血尿酸水平、住院时间与营养不良的相关性
王红 李文慧 何志红 陈庆娜 张红红 袁梦琪 王利军 金颖 毕文淼 张国宏
目的探讨在营养状态不同的慢性阻塞性肺疾病急性加重期(AECOPD)患者之间,血尿酸水平与病情严重程度及住院时间的关系。方法将122例AECOPD患者根据其白蛋白水平分为3组,检测并比较3组患者尿酸、住院天数。结果低白蛋白组尿酸及住院天数明显高于其他2组(Plt;0.01)。结论AECOPD 患者尿酸水平可能成为病情严重程度评估指标及预测住院时间长短的影响因素。
血清白蛋白;慢性阻塞性肺疾病急性加重期;营养不良;尿酸;住院天数
慢性阻塞性肺疾病(chronic obstructive pulmonarydisease)是临床上呼吸科的常见病、多发病,具有严重危害人类健康,明显影响患者生存质量的特点,其致残率、致死率明显高于其他常见呼吸系统疾病,对患者本人、其家庭以及社会造成沉重的经济负担。我国在对7个地区20 245名成人进行的COPD相关情况调查中发现,在我国40岁以上的人群中,COPD的患病率可高达8.2%。根据“全球疾病负担研究项目(the global burden of disease study)”估计,到2020年COPD将成为全球死亡原因排行第三的疾病。在世界银行和世界卫生组织做的一项调查研究中指出,至2020年,COPD将在世界疾病经济负担的排列中位居第五[1]。研究发现,在COPD患者中,营养不良者的发生比例较其他疾病升高,其发生率高达20%~60%[2]。目前营养不良已被认为是COPD重要的预后指标之一[2]。COPD患者发生营养不良的机制目前尚未能完全明确,近年有研究表明,营养不良在COPD的发生、发展过程中起到重要作用,对COPD的病程及进展产生影响。我们就此方面进行一些探讨。
1 资料与方法
1.1 一般资料 选取2013年1月至2014年12月在我院就诊的慢阻肺急性加重期(AECOPD)患者122例,其中男84例,女38例;年龄52~86岁,平均年龄(73±11)岁;吸烟93例,平均吸烟指数710(50~2 000)。COPD诊断符合2011年中华医学会呼吸病学会制定的COPD诊断标准。患者近期内咳嗽、咳痰、气短和(或)喘息加重,可伴有发热,需改变常规药物治疗方案为急性加重。排除恶性肿瘤,活动性结核,合并痛风、糖尿病、高血压、肾脏疾病等导致慢性肾功能不全。将所有入选患者按照血清白蛋白进行分组,lt;30 g/L组,≥35 g/L组,≥30 g/L、lt;35 g/L组。3组年龄、性别比、吸烟指数等方面差异无统计学意义(Pgt;0.05)。
1.2 方法
1.2.1 血清白蛋白:所有入选患者于入院24 h内,取清晨空腹静脉血约3 ml,分离血清,使用全自动生化仪测定血清白蛋白。按血清白蛋白水平分组:lt;30 g/L定为1组,≥30 g/L、lt;35 g/L为2组,≥35 g/L为3组。
1.2.2 尿酸:所有入选患者于入院24 h内,取清晨空腹静脉血约3 ml,分离血清,使用全自动生化仪测定血尿酸。正常值95~357 μmol/L。
1.2.3 住院时间:收集所有入选患者住院天数。
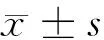
2 结果
2.1 随着血清白蛋白数值的升高,住院天数及尿酸逐渐下降。血清白蛋白lt;30 g/L时,住院天数(12.55±8.29)d,尿酸(230.52±113.20)μmol/L;血清白蛋白≥30 g/L、lt;35 g/L时,住院天数(9.33±5.46)d,尿酸(285.06±97.43)μmol/L;血清白蛋白≥35 g/L时,住院天数(8.86±4.16)d,尿酸(313.39±107.41)μmol/L。见表1。
2.2 血清白蛋白lt;30 g/L时住院天数与血清白蛋白≥30 g/L、lt;35 g/L时住院天数比较,差异有统计学意义(Plt;0.05),血清白蛋白lt;30 g/L时住院天数与血清白蛋白≥35 g/L时住院天数比较,差异有统计学意义(Plt;0.05),血清白蛋白≥30 g/L、lt;35 g/L时住院天数与血清白蛋白≥35 g/L时住院天数比较,差异无统计学意义(Pgt;0.05)。见表1。
2.3 血清白蛋白lt;30 g/L时尿酸水平与血清白蛋白≥30 g/L、lt;35 g/L时尿酸水平比较,差异有统计学意义(Plt;0.05),血清白蛋白lt;30 g/L时尿酸水平与血清白蛋白≥35 g/L时尿酸水平比较,差异有统计学意义(Plt;0.05),血清白蛋白≥30 g/L、lt;35 g/L时尿酸水平与血清白蛋白≥35 g/L时尿酸水平比较,差异无统计学意义(Pgt;0.05)。见表1。
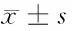
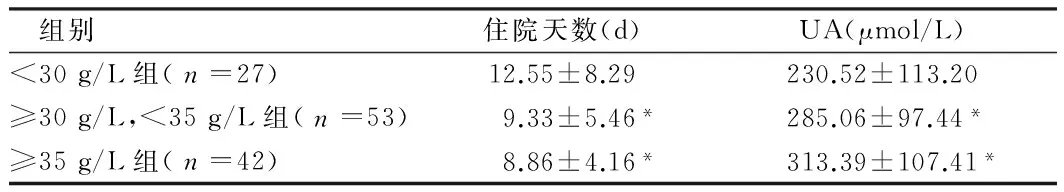
组别住院天数(d)UA(μmol/L)lt;30g/L组(n=27)12.55±8.29230.52±113.20≥30g/L,lt;35g/L组(n=53)9.33±5.46*285.06±97.44*≥35g/L组(n=42)8.86±4.16*313.39±107.41*
注:与lt;30 g/L组比较,*Plt;0.05
3 讨论
COPD是临床的常见病及多发病,其发病率及死亡率呈逐年上升趋势,对患者的生存质量产生严重影响,并且会给患者家庭及社会造成严重的经济负担。据预计到2020年COPD即将成为世界导致死亡的第三位原因。到目前为止,尚未能发现有效的治疗方法,能够治愈COPD,并且随着患者年龄的增加,病程的延长,反复发生的急性加重导致患者住院率及死亡率大幅提高,并增加了患者及其家庭的经济负担,同时患者的肺功能在反复的急性加重过程中进行性下降,最终造成无可挽回的后果。除主要累及肺脏外,COPD还伴有明显的肺外效应,其中营养不良和体重减轻是COPD较为常见的全身效应[3]。有研究显示在COPD患者中,营养不良的发生率可达20%~60%[2],随着营养不良的出现,患者的生活能力逐渐下降,最终可严重影响其生活质量。其中,在肺气肿、肺心病患者中更为突出,呈现蛋白-热量营养不良状态。现有研究发现,营养不良的严重程度与气流阻塞程度具有明显相关性,营养不良的程度越重,其发生急性呼吸衰竭和死亡的倾向就越明显,因而营养状况被视为COPD患者重要的预后指标[2]。许多COPD患者由于各种原因会出现营养不良的状况,常见的由于能量需求与饮食摄入不平衡导致BMI降低的原因有:(1)COPD患者常处于长期低氧和(或)高碳酸血症状况,并可能伴有右心功能不全,导致胃肠道淤血、消化功能紊乱,造成消化系统功能紊乱,营养物质的消化、吸收及利用受到影响;(2)患者常伴有心肺功能不全,进食时出现呼吸困难加重,食欲下降或进食量减少,因此造成营养物质摄入减少;(3)患者经常使用的茶碱类药物及糖皮质激素会引起消化道的不良反应,刺激胃肠道,甚至出现消化性溃疡、出血等严重的胃肠道并发症;(4)COPD 患者反复急性加重、合并感染、应激及高代谢状态,引起能量需求增加,气道阻力增加,呼吸肌做功增加,使得消耗增加,二者共同引起负氮平衡。气道阻力升高、呼吸肌负荷增重,引起耗氧量增加,基础代谢升高,据文献报道COPD 患者在静息时能量消耗较正常人可增加10%~20%,基础代谢则增加30%,急性加重时增加程度会更高;(5)患者因病活动受限,胃肠蠕动减弱,造成腹部饱胀感,食欲差;(6)糖皮质激素的长期应用:一部分患者因病情需长期应用糖皮质激素,激素具有促进蛋白质的分解,抑制蛋白质合成的作用,导致肌肉萎缩,体重下降;(7)细胞因子产生增加:COPD在长期慢性病程中,由于慢性炎症及缺氧的因素影响,引起某些细胞因子产生增加,其中肿瘤坏死因子(TNF-α)、IL-6 等因子具有引起肌组织蛋白高分解状态和肌纤维合成障碍的作用,也可能是COPD 患者BMI下降的主要原因[4]。
肌肉组织减少是COPD患者体重下降的主要危害,特别是膈肌和呼吸肌受累时[4]。当部分呼吸肌出现萎缩及功能减退时,早期会由其他呼吸肌代偿性作功,以补偿因呼吸肌萎缩而造成的呼吸功能降低,但由于代偿呼吸肌长时间超负荷做工,最终可能因呼吸肌疲劳而导致呼吸衰竭的发生,甚至引起死亡。营养不良可引起各种营养成分的缺失及水、电解质、酸碱平衡紊乱,引起患者免疫功能受损,消弱肺泡上皮细胞的修复功能,对病原微生物抵抗能力下降,患者极易发生感染,从而出现病情急性加重、严重的呼吸衰竭,引起高死亡率。另外营养不良可促进肌蛋白分解和肌纤维结构改变,呼吸肌萎缩、肌力下降而导致淋巴细胞、巨噬细胞活力不足,免疫球蛋白和补体生成减少,引起呼吸道纤毛清除能力下降,最终出现全身以及呼吸道局部免疫功能下降,呼吸道感染机会增加,加重呼吸系统疾病进展,形成恶性循环。在COPD患者的疾病发展过程中,营养不良随处可见,COPD患者的营养状态对其临床症状严重程度及预后而言是一项重要因素,并能影响其病情最终转归。
目前用于营养状态评估的指标众多,其中以测量体重指数、皮下脂肪厚度、生化检查、免疫学检查以及身体构成评估等方法常用,本研究结合临床实际情况,选择易操作、易测量、准确度高的血清白蛋白作为营养状态的评估指标。
近年来有观点认为,体内氧化剂增多以及抗氧化剂减少,由此造成体内氧化/抗氧化失衡,被看做是 COPD形成及进行性加重的重要原因之一[5]。AECOPD肺功能明显下降,血氧分压显著降低,造成氧化/抗氧化平衡出现失调,并对呼吸系统产生显著损害,从而促进炎性反应[6,7]。UA是一种极为可贵的抗氧化物质,具有清除自由基、抗脂蛋白氧化、保护细胞膜等功效,是人体内重要的抗氧化剂之一。氧化应激程度越重,UA生成越多。UA在血液中以较高的浓度存在,可对抗机体不良反应的发生,维护人体正常生理效应的运行。可以认为UA在一定程度上可反映机体氧化应激反应的程度,两者之间存在相关性,研究发现,血清尿酸(serum uric acid,SUA)在缺氧状态下是增高的,且高尿酸水平与全身炎性反应是相关的[8,9]。炎性反应加重使血中尿酸值越来越高,与有关报道[10]相一致。在 AECOPD 患者的研究中已有报道 GOLD 分级越高尿酸水平就越高;SUA 水平与患者病情评分、住院时间呈明显正相关关系,与肺功能值、PO2/FIO2呈明显负相关[11]。从我们目前的研究对 AECOPD 患者中 SUA 升高的可能机制做出以下解释:(1)呼吸系统气道及血管的病变以及结构重塑,导致低氧血症;肺气肿时,正常生理通换气功能减弱,使组织缺氧。这两者共同促进了 ATP 的降解,导致尿酸生成增多;(2)氧化应激和炎症导致肺组织损伤,减少氧气的摄入,导致尿酸水平升高,这种氧化应激诱导的肺部炎症,最终导致气道重塑;(3)长期反复的缺氧、感染,可致造血系统活跃,加之内环境的紊乱,使红细胞的生成及破坏不断增加,最终尿酸值升高;(4)缺氧直接影响肾脏微细血管的伸缩,血液流速下降,流量减少,致肾小球滤过功能降低,影响了尿酸的代谢;(5)水、电解质、酸碱平衡失衡,引起尿酸排泄受阻,致血清尿酸水平升高。
研究表明,AECOPD血清尿酸水平明显高于健康对照组,差异有统计学意义(Plt;0.05),间接表明血尿酸水平的升高有可能参与了COPD疾病的发病过程,且结果表明了血清尿酸水平与 COPD严重程度有关,即 COPD分级越重、血清尿酸水平及高尿酸血症检出率也越高,差异有统计学意义(Plt;0.05)。说明血尿酸与病情严重度有相关性,这与有关文献的报道[12]相一致。原因可能是不同级别的 COPD 其肺功能及低氧血症程度也不同,COPD分级越严重、肺功能越差、低氧血症就越明显,其炎性反应与氧化应激越严重、ATP 降解越多,导致血尿酸生成也会越多。符合有关报道[10]。
提示尿酸是 AECOPD患者风险评估和住院时间的病情监测因素。在对患者的病情监测上有极大的使用价值。重要的是 SUA 已被建议作为氧化代谢受损和预后受损的一个标志物,在AECOPD患者中,随着血清白蛋白指标的降低,住院天数及尿酸逐渐升高,其变化趋势显示住院天数及尿酸在不同的血清白蛋白水平之间其程度是不同的,差异有统计学意义(Plt;0.05),AECOPD患者的血清尿酸水平增高,与COPD患者病情严重程度有一定关联,在临床工作中需重视高尿酸血症与AECOPD的关系,同时在临床诊疗过程中,需注意关注血尿酸对于评估病情严重度的价值,并认识到血尿酸可能是判断COPD严重程度的一个简单、方便、经济的指标。
1 中华医学会呼吸病学会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版).中华结核和呼吸志志,2013,36:255-264.
2 余晓丹,汪俊.COPD 营养状况与炎症反应的关系研究.临床研究,2012,3:72-74.
3 陈国忠,曹霞,余昌平,等.慢性阻塞性肺疾病的炎症反应与体重指数密切相关.临床肺科杂志,2010,15:777-779.
4 李艳.低体重指数对慢性阻塞性肺疾病预后的影响.临床肺科杂志,2012,17:541-542.
5 Barnes PJ.Mediators of chronic obstructive pulmonary disease.Pharmacol Rev,2004,56:515-548.
6 Hoshino S,Yoshida M,Inoue K,et al.Cigarette smoke extract induces endothelial cell injuryvia JKN pathway.Biochem Biopys Res Commum,2005,329:58-63.
7 Marwick JA,Caramori G,Stevenson CS,et al.Inhibition of P13Kdelta restores glucocorticoid function in smoking-induced airway inflammation inmice.Am J Respir Crit Care Med,2009,179:542-548.
8 Garcia-Pachon E,Padilla-Navas I,Shum C.Serum uric acid to creatinine ratio in patients with chronic obstructive pulmonary disease.Lung,2007,185:21-24.
9 Ruqqiero C,Cherubini A,Ble A,et al.Uric acid and inflammatory markers.Eur Heart J.2006,27:1174-1181.
10 张娜莉,刘超.慢性阻塞性肺疾病急性加重期血尿酸的变化.中华全科医学,2008,6:780.
11 Bartziokas K,Papaioannou AI,Loukides S,et al.Serum uric acid as a predictor of mortality and future exacerbations of COPD.Eur Respir J,2014,43:43-53.
12 蒋萍.COPD 急发期患者血清尿酸水平的相关性研究.临床肺科杂志,2008,13:1565.
10.3969/j.issn.1002-7386.2017.23.034
050011 河北省石家庄市第一医院呼吸内二科
R 563
A
1002-7386(2017)23-3637-03
2017-07-27)

