大肠杆菌磷酸烯醇式丙酮酸-糖磷酸转移酶系统改造对产L-色氨酸的影响
吴涛,赵津津,毛贤军
大肠杆菌磷酸烯醇式丙酮酸-糖磷酸转移酶系统改造对产L-色氨酸的影响
吴涛,赵津津,毛贤军
梅花生物科技集团股份有限公司廊坊梅花生物技术开发有限公司,河北廊坊 065001

吴涛,赵津津,毛贤军. 大肠杆菌磷酸烯醇式丙酮酸-糖磷酸转移酶系统改造对产L-色氨酸的影响. 生物工程学报, 2017, 33(11): 1877–1882.Wu T, Zhao JJ, Mao XJ. Effect of PTS modifications on L-tryptophan production in Escherichia coli. Chin J Biotech, 2017, 33(11): 1877–1882.
L-色氨酸是芳香族氨基酸的一种,被广泛应用于医药、食品和饲料等领域。大肠杆菌磷酸烯醇式丙酮酸-糖磷酸转移酶系统 (PTS系统) 在葡萄糖转运和磷酸化过程中起重要作用,是糖代谢基因表达调控的核心。利用Red同源重组系统,构建包含两类典型PTS系统突变 (-+和-) 的L-色氨酸生产菌,并对相关菌株进行补料分批发酵研究。结果表明,不同类型PTS系统突变对菌体生长、L-色氨酸产量、糖酸转化率及副产物生成均有较大影响。与出发菌相比,-+突变株最高600达到125,提高47.0%,产酸38.5 g/L,提高25.9%,糖酸转化率16.7%,提高26.5%,乙酸生成略有增加;-突变株最高600达到100,提高17.6%,产酸33.4 g/L,提高9.4%,糖酸转化率15.5%,提高17.4%,乙酸生成略有减少。对葡萄糖转运系统的进一步研究将为大肠杆菌合成L-色氨酸效率的提升提供帮助。
大肠杆菌,L-色氨酸,PTS系统,补料分批发酵
L-色氨酸是芳香族必需氨基酸的一种,被广泛应用于饲料、医药和食品等领域。目前L-色氨酸的合成效率偏低,高昂的价格严重限制了其应用规模。提高L-色氨酸的生物合成效率、降低生产成本具有重要的应用价值。L-色氨酸生物合成途径复杂,前体来源于糖酵解途径、磷酸戊糖途径及三羧酸循环等多个基础代谢途径。每合成1 mol L-色氨酸需要 1 mol磷酸烯醇式丙酮酸 (PEP) 和1 mol 4-磷酸赤藓糖 (E4P) 作为起始前体,另外还需分别消耗PEP、谷氨酰胺、5-磷酸核糖焦磷酸 (PRPP) 和丝氨酸各 1 mol[1]。因此,研究色氨酸合成代谢对研究微生物代谢平衡具有重要的科学意义。
1979年,Tribe等[2]利用DNA重组技术首次将基因引入大肠杆菌,L-色氨酸产量达到1 g/L。此后,随着代谢工程改造的深入和发酵工艺的优化,利用重组大肠杆菌或谷氨酸棒杆菌发酵生产L-色氨酸的效率得到了数十倍的提升[3–7]。1996年,Berry[3]在大肠杆菌中高表达去除反馈抑制 (Feed-back resistance,fbr) 的fbr、fbr基因,发酵52 h产L-色氨酸近45 g/L,过程最高糖酸转化率约为22%。1999年,Ikeda等[4]在产L-色氨酸的谷氨酸棒杆菌pIK9960中高表达基因,增加L-色氨酸合成前体E4P的水平,从而提高L-色氨酸的合成效率,发酵80 h的L-色氨酸产量达到58 g/L。2012年,Cheng等[7]通过对产L-色氨酸大肠杆菌TRJH的发酵补料策略优化,发酵40 h左右,产量达到38.8 g/L,糖酸转化率高达19.9%。
大肠杆菌可通过多种途径转运并磷酸化葡萄糖生成6-磷酸葡萄糖,然后将其导入糖酵解途径。野生型大肠杆菌利用磷酸烯醇式丙酮酸-糖磷酸转移酶系统(简称PTS系统) 转运并磷酸化葡萄糖。PTS系统由EⅠ、HPr和EⅡs构成,EⅠ、HPr分别由、基因编码,为胞质可溶性蛋白;EⅡs包括EⅡMan、EⅡFru、EⅡBgl、EⅡAGlc、EⅡCBGlc等,多为蛋白复合体,对碳水化合物具有特异性,其中EⅡAGlc、EⅡCBGlc分别由、基因编码[8-9]。PTS系统转运1 mol葡萄糖需消耗1 mol PEP[9-10]。当大肠杆菌在以葡萄糖为碳源的限制性培养基中生长时,PTS系统消耗了约50%的PEP用于葡萄糖的转运和磷酸化[11],直接影响以PEP为前体的化合物 (如莽草酸、芳香族氨基酸、天冬氨酸族氨基酸等) 的合成。在PTS系统缺陷大肠杆菌中,葡萄糖可以通过半乳糖/氢离子协同转运蛋白 (D-Galactose/H+symporter,GalP) 和葡萄糖激酶 (Glucokinase,Glk)协同作用进入胞内[9-11],以ATP为磷酸基团供体,但以GalP、Glk协同作用磷酸化转运葡萄糖的效率较低[11]。另外,大肠杆菌也可通过引入外源高效的葡萄糖转运磷酸化系统,如运动假单胞菌来源的、基因,分别编码葡萄糖转运蛋白 (Glucose facilitator,Glf) 和葡萄糖激酶 (Glk),以ATP为磷酸基团供体,转运并磷酸化葡萄糖[11-12]。
PTS系统改造的大肠杆菌被广泛应用于多种化合物的发酵生产,如莽草酸、苯丙氨酸、乙醇等[11-12]。对于PTS系统的修饰改造可分为3类:-、PTS-Glc+(-突变菌经进化获得可在葡萄糖为碳源的限制性培养基上生长的Glc+表型) 和PTS-+(-突变菌通过表达外源、基因获得Glc+表型)[11]。本研究采用Red同源重组系统,构建了两类典型的PTS系统突变体-+和-,将其应用于产L-色氨酸生产菌的构建,PTS系统突变后,葡萄糖转运将不再消耗PEP,胞内色氨酸重要前体物PEP的水平提高1倍,色氨酸生产能力有望显著提高。本研究还对不同PTS系统改造菌株的生产性能进行了补料分批发酵初步研究,首次综合评价了不同类型PTS系统改造对大肠杆菌产L-色氨酸的影响。
1 材料与方法
1.1 菌株与质粒
本研究使用的菌株和质粒见表1。产L-色氨酸大肠杆菌MA01为出发菌,公开保藏于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),保藏编号为CGMCC No. 6863,根据专利WO8701130A1[13]及Mascarenhas等[14]描述的方法构建,其宿主菌SA01为K-12 CICC 10303衍生的K-12 CICC 10303 ∆∆,所含质粒pMG43为pBR322来源,包含有、fbr和fbr基因。
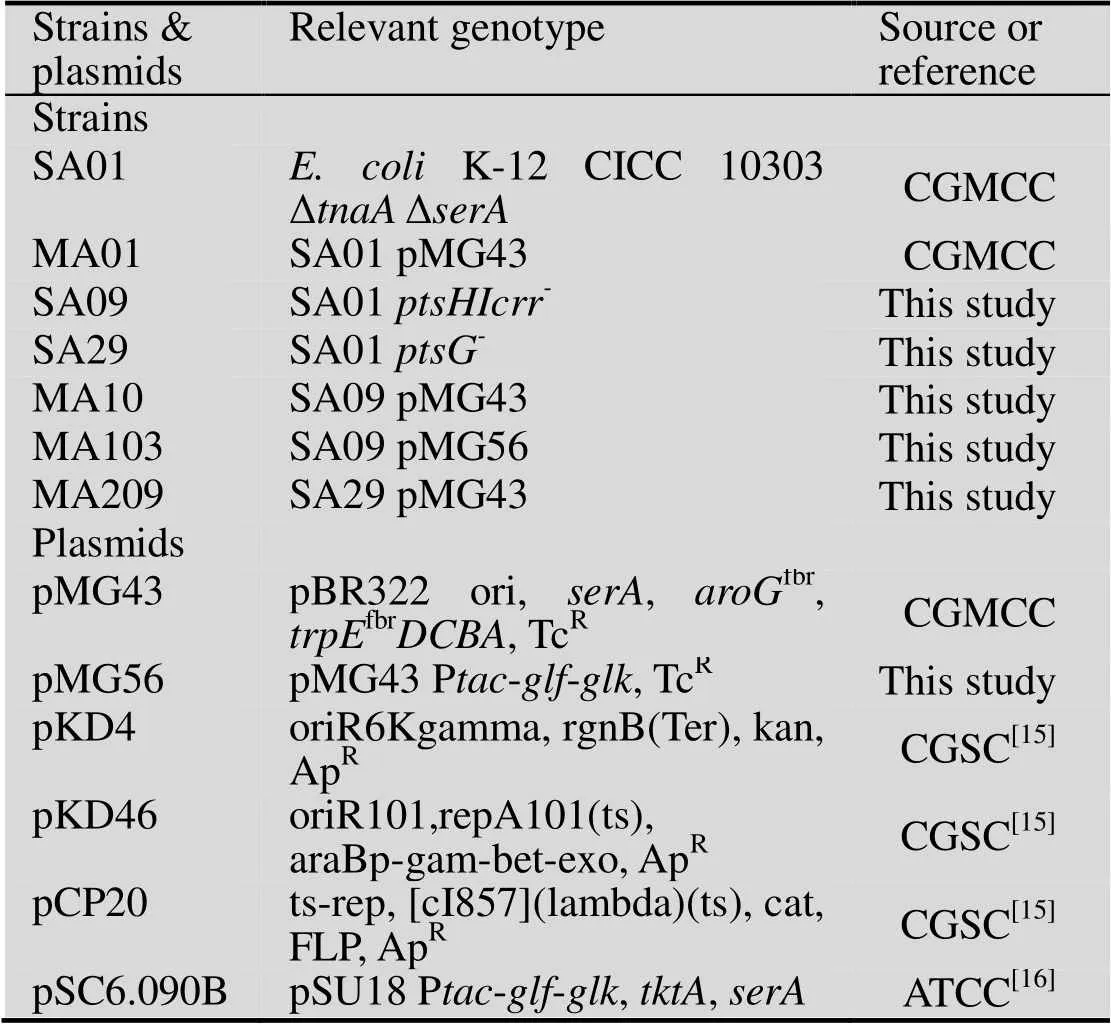
表1 本研究使用的菌株和质粒
1.2 培养基
种子培养基:20 g/L葡萄糖,15 g/L酵母浸粉,10 g/L (NH4)2SO4,0.5 g/L柠檬酸钠,5 g/L MgSO4·7H2O,1.5 g/L KH2PO4,15 mg/L FeSO4·7H2O,1.2 mg/L VB1,pH 7.0。
发酵培养基:10 g/L葡萄糖,1 g/L酵母浸粉,4 g/L (NH4)2SO4,2 g/L柠檬酸钠,5 g/L MgSO4·7H2O,2 g/L KH2PO4,0.1 g/L FeSO4·7H2O,6.3 mg/L MnSO4·H2O,7.4 mg/L ZnSO4·H2O,5.6 mg/L CoCl2·6H2O,0.8 mg/L CuSO4·5H2O,pH 7.0。
1.3 主要试剂
Phusion®High-Fidelity DNA聚合酶购于NEB公司,限制性内切酶和T4 DNA连接酶购于Fermentas公司,质粒提取试剂盒和DNA回收试剂盒购于Tiangen公司,L-色氨酸、有机酸标准品购于Sigma-Aldrich公司。其他化学试剂均为国产或进口分析纯。
1.4 质粒载体构建
采用常规分子克隆技术[17],如PCR扩增、酶切、连接和转化等构建重组质粒pMG56,具体方法如下,所用引物序列见表2。
1.4.1 质粒载体pET28-glfglk的构建
以质粒pSC6.090B为模板,用引物glfglk1和 glfglk2扩增约2.3 kb的FK1片段,用引物glfglk3和glfglk4扩增约1.0 kb的FK2片段。以FK1和FK2为模板,用引物glfglk1和glfglk4扩增约3.3 kb的DNA片段,产物用Ⅰ、Ⅰ双酶切,与经同样酶切的质粒pET28a连接,产物转化Top10感受态细胞,转化子用glfglk1和glfglk4为引物PCR鉴定,阳性约3.3 kb。提取重组质粒,用Ⅰ、Ⅰ双酶切鉴定,所得重组质粒pET28-glfglk约8.3 kb。
1.4.2 重组质粒pMG56的构建
质粒pET28-glfglk用Ⅰ、Ⅰ双酶切,回收约3.3 kb的DNA片段,与经同样酶切的质粒pMG43连接,产物转化Top10感受态细胞,转化子用glfglk1和glfglk4为引物PCR鉴定,阳性约3.3 kb。提取重组质粒,用Ⅰ、Ⅰ双酶切鉴定,所得重组质粒pMG56约15.8 kb。
1.5 突变菌的构建
采用Datsenko KA等[15]所述的Red同源重组方法构建突变菌株,具体方法如下。
1.5.1基因敲除菌的构建
以质粒pKD4为模板,pts1和pts2为引物,PCR扩增约1.5 kb的突变基因,电击转化100 μL含有质粒pKD46的SA01感受态细胞,30 ℃孵育 1–2 h,涂布含卡那霉素(25 μg/mL)的LB平板,30 ℃静置培养24 h,挑单克隆以pts3和pts4为引物菌落PCR鉴定,阳性约1.5 kb,所得菌株即为基因的突变菌株SA01 ∆::。

表2 本研究使用的引物
The coding region are underlined, the restriction sites are indicated by bold letters.
将质粒pCP20电击转化菌株SA01 ∆::,菌液涂布含氯霉素(25 μg/mL)的LB平板,30 ℃静置培养24 h。得到的单菌落转接无抗LB平板,42 ℃静置培养12 h,以pts3和pts6为引物进行菌落PCR鉴定,阳性约0.5 kb,所得菌株即为基因敲除的重组菌株SA01-。
1.5.2基因敲除菌的构建
与基因敲除菌的构建方法相同。
1.6 培养条件
摇瓶培养:从冻存管取菌种在LB平板上划线,37 ℃培养24 h;将菌体接种至装有20 mL发酵培养基的500 mL摇瓶中,37 ℃、240 r/min振荡培养48 h。
发酵培养:将过夜培养的菌液接种至50 mL种子培养基中,37 ℃、240 r/min振荡培养5–10 h,600控制在6–8;将菌液转接至装有10 L种子培养基的 20 L发酵罐,36 ℃培养9–18 h,600控制在13–18,溶氧控制在30%以上,pH控制在6.8–7.0;取2.2 L菌液转接至装有20 L发酵培养基的50 L发酵罐,35 ℃培养40–45 h,溶氧控制在10%–20%,转速200– 800 r/min,罐压0.05–0.10 MPa,pH 6.5–6.6,待初 糖耗尽后,流加60% (/) 葡萄糖,流加糖速率为3–17 g/(L·h)。
1.7 葡萄糖、L-色氨酸及其他有机酸含量的测定
取1 mL发酵液,12 000 r/min离心3 min,测定上清液中葡萄糖、L-色氨酸及有机酸的含量。葡萄糖采用SBA-40C生物传感分析仪 (山东省科学院) 进行测定。L-色氨酸及有机酸分别采用HPLC法进行测定[18–19]。
2 结果与分析
2.1 L-色氨酸生产菌的构建
按1.4所述方法,构建重组质粒pMG56。按1.5所述方法,分别构建了缺失突变株SA09和缺失突变株SA29。以SA09为宿主转化质粒pMG43或pMG56,分别构建了L-色氨酸生产菌MA10和MA103;以SA29为宿主转化质粒pMG43,构建了L-色氨酸生产菌MA209。
2.2 PTS系统改造对L-色氨酸生产菌生长的影响
MA01、MA10 (-)、MA103(-+) 、MA209 (-) 按1.6所述的方法进行摇瓶培养,每2 h取样,测定生长曲线 (图1),重复实验3次。与出发菌MA01相比,缺失突变株MA10葡萄糖摄入能力差,生长缓慢;在MA10内引入、基因,获得的菌株MA103生长旺盛,最高600值达到16.9,较MA01提高了35.6%;缺失突变株MA209,延滞期较出发菌MA01延长近4 h,但最终600值仍达到14.8,较MA01提高19.4%。
2.3 PTS系统改造对L-色氨酸生产菌发酵性能的影响
MA01、MA103和MA209按1.6所述的方法进行发酵培养,测定各菌株的生长曲线,发酵液中葡萄糖、L-色氨酸及其他有机酸含量的变化,最终产酸及糖酸转化率 (图2)。发酵过程采用葡萄糖限制补料分批发酵工艺,控制发酵液中葡萄糖浓度接近 0 g/L,见图2A。缺陷株MA103最高600值达到125,较出发菌MA01提高47.0%;缺陷株MA209虽然前期生长稍慢,最高600值也能达到100,较出发菌MA01提高17.6%,但32 h后600值有明显下降的趋势。
L-色氨酸合成过程及最终产酸、糖酸转化率如图2B和2D所示,与出发菌MA01相比,缺陷株MA103能够达到的最高产酸为38.5 g/L,提高25.9%,糖酸转化率为16.7%,提高26.5%;缺陷株MA209最高产酸为33.4 g/L,提高9.4%,糖酸转化率为15.5%,提高17.4%。
发酵液中的有机酸副产物,如乙酸、甲酸、乳酸、丙酮酸、柠檬酸、莽草酸的含量也进行了测定。结果表明,乙酸含量差别最大,变化趋势也最明显,如图2C所示。缺陷株MA103最高乙酸含量是MA01的2.1倍,达到4.1 g/L,而缺陷株MA209的乙酸含量较MA01低,最高值仅为1.5 g/L。其他有机酸含量偏低,且无显著变化。

图1 PTS系统改造L-色氨酸生产菌生长曲线
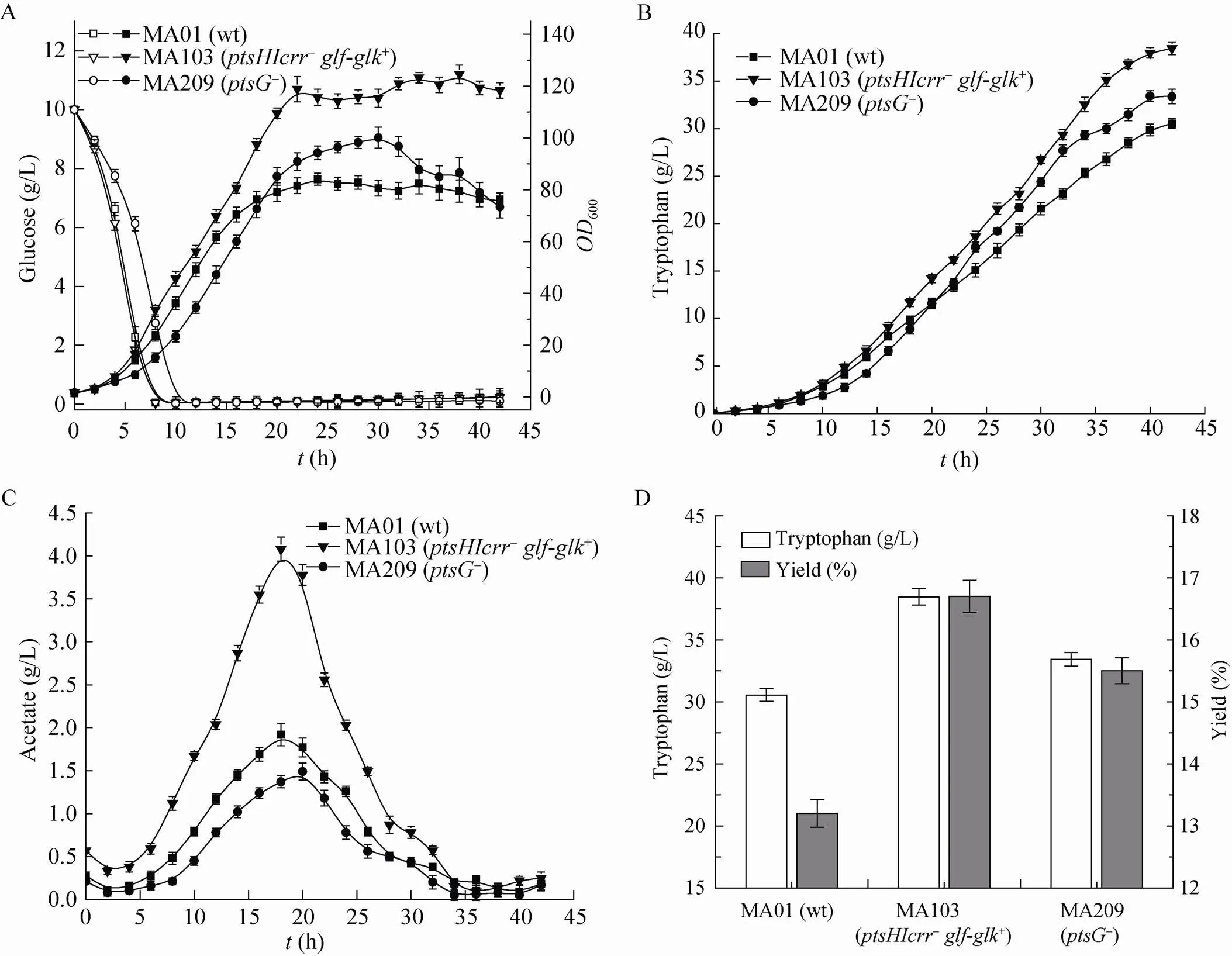
图2 PTS系统改造L-色氨酸生产菌的发酵性能
3 讨论
当大肠杆菌在以葡萄糖为碳源的限制性培养基中生长时,PTS系统消耗了约50%的PEP用于葡萄糖的转运和磷酸化,而用于合成3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸 (DAHP) 的PEP仅占3%[12,20],因此将PTS系统替换成利用ATP进行磷酸化的葡萄糖转运系统,对以PEP为前体的芳香族化合物的生物合成具有重要的应用价值。
然而大肠杆菌PTS系统与碳代谢总体调控蛋白CRP-cAMP紧密关联。腺苷酸环化酶环化ATP生成cAMP,其活性受磷酸化的EⅡAGlc(由基因编码)激活,因此不同类型的PTS系统改造会直接影响胞内cAMP的含量。一般认为-突变体因缺失基因,cAMP含量较低,而-突变体因含有磷酸化的EⅡAGlc,cAMP含量较高[9,12]。在RegulonDB和EcoCyc数据库(http://regulondb.ccg.unam.mx/ index.jsp和http://biocyc.org/ecocyc/index.shtml) 中,除糖(阿拉伯糖、木糖、乳糖等) 代谢相关基因外,还有131个“简单”或“复杂”的转录单元被CRP-cAMP激活、抑制或双重调控。这些调控单元与TCA循环、呼吸、渗透压调节、压力响应、生物膜形成、毒力、氮代谢、铁的吸收、感受态能力、多种药物抗性、非编码RNA等相关[12]。因此,不同类型PTS系统突变对于不同化合物生物合成的影响可能存在显著的差异。
本研究首次综合评价了不同类型PTS系统改造对于大肠杆菌产L-色氨酸的影响。结果表明,不同类型PTS系统突变对菌体生长、L-色氨酸产量、糖酸转化率及副产物生成均有较大影响,且表型存在较大差异。MA103 (-+) 在发酵罐中的最高600值能达到120以上,对高密度发酵产L-色氨酸非常有利,最高产酸达38.5 g/L。但发酵液中乙酸含量也相对偏高,达到4.1 g/L,这可能与引入的外源基因、的表达强度有关,调整合适的、基因表达水平,将有望降低乙酸的水平,得到L-色氨酸产量更高的重组菌株。或者通过优化发酵补料策略,降低乙酸水平[7, 21-22]。
MA209 (-) 因PTS系统被阻断,PEP不再作为葡萄糖磷酸化的磷酸供体[8-9],葡萄糖通过半乳糖/氢离子协同转运蛋白 (GalP) 和葡萄糖激酶(Glk) 协同作用进入胞内[9-11],以ATP为磷酸基团供体,但以GalP、Glk协同作用磷酸化转运葡萄糖的效率较低[11],故MA209菌的葡萄糖摄入系统较弱,延滞期较出发菌MA01偏长,进入对数中后期,蛋白表达系统已经建立,比生长速率和糖耗速率与MA01菌接近。但MA209菌的葡萄糖摄入水平较弱,不易积累乙酸,有利于发酵控制。通过增大接种量或优化培养基配方等手段可进一步缩短延滞期时长,获得更高的L-色氨酸产酸和糖酸转化率。另外,与MA103菌相比,MA209菌需激活自身另一套转运葡萄糖系统,涉及复杂的代谢调控,代谢调控过程中浪费较多的碳骨架和能量,故而生长速率、转化效率都会受到影响。
[1] Ikeda M. Towards bacterial strains overproducing-tryptophan and other aromatics by metabolic engineering. Appl Microbiol Biotechnol, 2006, 69(6): 615–626.
[2] Tribe DE, Pittard J. Hyperproduction of tryptophan by: genetic manipulation of the pathways leading to tryptophan formation. Appl Environ Microbiol, 1979, 38(2): 181–190.
[3] Berry A. Improving production of aromatic compounds inby metabolic engineering. Trends Biotechnol, 1996, 14(7): 250–256.
[4] Ikeda M, Katsumata R. Hyperproduction of tryptophan bywith the modified pentose phosphate pathway. Appl Environ Microbiol, 1999, 65(6): 2497–2502.
[5] Bongaerts J, Krämer M, Müller U, et al. Metabolic engineering for microbial production of aromatic amino acids and derived compounds. Metab Eng, 2001, 3(4): 289–300.
[6] Gosset G. Production of aromatic compounds in bacteria. Curr Opin Biotechnol, 2009, 20(6): 651–658.
[7] Cheng LK, Wang J, Xu QY, et al. Effect of feeding strategy on-tryptophan production by recombinant. Ann Microbiol, 2012, 62(4): 1625–1634.
[8] Deutscher J, Francke C, Postma PW. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria. Microbiol Mol Biol Rev, 2006, 70(4): 939–1031.
[9] Neidhardt FC, Curtiss III R, Ingraham JL, et al.and Salmonella. 2nd ed. Washington DC: ASM Press, 1996: 1824–1866.
[10] Hernández-Montalvo V, Martínez A, Hernández-Chavez G, et al. Expression ofandin aPTS mutant restores glucose transport and increases glycolytic flux to fermentation products. Biotechnol Bioeng, 2003, 83(6): 687–694.
[11] Gosset G. Improvement ofproduction strains by modification of the phosphoenolpyruvate: sugar phosphotransferase system. Microb Cell Fact, 2005, 4(1): 14.
[12] Escalante A, Cervantes AS, Gosset G, et al. Current knowledge of thephosphoenolpyruvate- carbohydrate phosphotransferase system: peculiarities of regulation and impact on growth and product formation. Appl Microbiol Biotechnol, 2012, 94(6): 1483–1494.
[13] Mascarenhas D. Tryptophan producing microorganism: WO, 8701130A1. 1985-08-15.
[14] Mascarenhas D, Ashworth DJ, Chen CS. Deletion ofalters tryptophan biosynthesis in a genetically engineered strain of. Appl Environ Microbiol, 1991, 57(10): 2995–2999.
[15] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes inK-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640–6645.
[16] Frost JW, Frost KM, Knop DR. Biocatalytic synthesis of shikimic acid: US, 6472169B1. 2002-10-29.
[17] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001: 2–110.
[18] Cheng LK, Xu QY, Xie XX, et al. Quick determination of-tryptophan in fermented broth by HPLC. J Tianjin Univ Sci Technol, 2010, 25(1): 9–12 (in Chinese). 程立坤, 徐庆阳, 谢希贤, 等. HPLC快速测定发酵液中-色氨酸. 天津科技大学学报, 2010, 25(1): 9–12.
[19] Suárez DC, Kilikian BV. Acetic acid accumulation in aerobic growth of recombinant. Process Biochem, 2000, 35(9): 1051–1055.
[20] Flores S, Gosset G, Flores N, et al. Analysis of carbon metabolism instrains with an inactive phosphotransferase system by13C labeling and NMR spectroscopy. Metab Eng, 2002, 4(2): 124–137.
[21] Eiteman MA, Altman E. Overcoming acetate inrecombinant protein fermentations. Trends Biotechnol, 2006, 24(11): 530–536.
[22] de Mey M, de Maeseneire S, Soetaert W, et al. Minimizing acetate formation in.fermentations. J Ind Microbiol Biotechnol, 2007, 34(11): 689–700.
(本文责编 郝丽芳)
Effect of PTS modifications on L-tryptophan production in
Tao Wu, Jinjin Zhao, and Xianjun Mao
Meihua Biotech (Langfang) Co., Ltd., Meihua Holdings Group, Langfang 065001, Hebei, China
L-tryptophan, one of the aromatic amino acids, is widely used in the fields of medicine, food and feed additives. The phosphoenolpyruvate-carbohydrate phosphotransferase system (PTS) plays an important role in glucose transport and phosphorylation in. PTS-mediated regulation dominates the carbohydrates’ uptake and metabolism in. We constructed L-tryptophan-producing bacteria containing two typical PTS mutations (-+and-) by Red homologous recombination system, and studied in 50 L jar fermenter using fed-batch fermentation. Both PTS system mutants had a great impact on the biomass (increasing 47.0% and 17.6%, respectively), L-tryptophan production (increasing 25.9% and 9.4%, respectively), glucose conversion rate (increasing 26.5% and 17.4%, respectively) and byproduct acetic acid generation (slightly increased and decreased,respectively).
, L-tryptophan, phosphotransferase system, fed-batch fermentation
November 28, 2016;
July 21, 2017
Jinjin Zhao. Tel: +86-316-2359999; E-mail: Zhaojinjin@meihuagrp.com
2017-11-07
网络出版地址:http://kns.cnki.net/kcms/detail/11.1998.Q.20171107.1128.001.html

