基于葡萄糖脉冲的同位素稀释质谱检测法标品制备
舒威,李超,刘晓云,夏建业,庄英萍
基于葡萄糖脉冲的同位素稀释质谱检测法标品制备
舒威,李超,刘晓云,夏建业,庄英萍
华东理工大学生物反应器工程国家重点实验室,上海 200237

舒威, 李超, 刘晓云, 等. 基于葡萄糖脉冲的同位素稀释质谱检测法标品制备. 生物工程学报, 2017, 33(11): 1869–1876.Shu W, Li C, Liu XY, et al. Preparation of Isotope Dilution Mass Spectrometry standards based on glucose pulse. Chin J Biotech, 2017, 33(11): 1869–1876.
同位素稀释质谱检测法 (IDMS) 是目前进行胞内代谢物浓度高通量检测精度最高的一种方法,这个方法的关键就是制备待检测代谢物对应的13C全标记的标品。传统制备13C全标记标品的方法是采用批培养的模式获取,但该方法所制备的胞内代谢物浓度通常较低。通过以13C全位标记葡萄糖作为唯一碳源培养毕赤酵母G/DSEL菌种,采用13C全位标记葡萄糖脉冲刺激法,结合快速取样淬灭方法的新方法,成功制备了带13C标记标品并提高了其浓度。经液质联用 (LC-MS) 与气质联用 (GC-MS) 结果分析,与传统制备方法相比,胞内大部分有机酸、磷酸糖、氨基酸和核苷酸类物质的浓度实现了约2–10倍的提高。因此底物脉冲法可以有效提高13C全标葡萄糖的单位利用率,并能实现对胞内部分含量低于仪器检测限的代谢物的检测。
毕赤酵母G/DSEL,IDMS标品,底物脉冲,快速取样,液质联用,气质联用
为高效获取微生物代谢工程改造所需信息,需要对其代谢途径及途径酶的胞内 () 动力学特性有全面的了解。可以通过恒化培养获得处于稳态期的细胞,利用底物脉冲结合快速取样淬灭和胞内代谢物提取技术,快速获取胞内代谢物浓度动态变化,从而获取催化相应代谢反应的酶的动力学信息[1-3]。然而如何快速准确测量胞内代谢物浓度是一个难题,主要是因为通常情况下胞内代谢物浓度较低,加之提取回收过程中胞内代谢物的稀释也加剧了检测的难度[4]。
在众多的检测方法之中,同位素稀释质谱检测法 (IDMS)[4]是目前进行胞内代谢物浓度高通量检测精度最高的一种方法。Wu等[5]在液质联用检测基础上,通过引入同位素稀释质谱检测技术,以13C全标葡萄糖培养的酵母细胞抽提物为内标,大大提高了胞内代谢物浓度的检测精度。该方法的关键就是待检测代谢物对应的13C标品。由于这些标品相对昂贵并且有些代谢物的对应标品甚至无商品化产品,因此13C胞内中间代谢物的制备成为IDMS方法的关键技术之一。
毕赤酵母由于其具有生长快、培养基成分明确简单的特点[6],在制备IDMS标品时被广泛采用。传统的IDMS标品制备方法是采用批发酵的模式,在发酵结束后收集菌体进行处理,但此时菌体处于饥饿状态,极易造成胞内磷酸糖类物质被消耗,导致浓度过低。通过外界瞬间高浓度底物脉冲,相应的胞内代谢物会产生动态响应[7-10],部分胞内代谢物浓度会出现短暂的升高。因此本文主要采用13C全标记葡萄糖脉冲来制备IDMS标品,在批发酵结束时,用一定浓度的底物脉冲,之后进行快速取样淬灭操作。这种方式极大地改善了传统培养方法引起的磷酸糖类物质和能量类物质浓度偏低的问题。
1 材料
1.1 培养基成分
培养基组成:13C全标葡萄糖20 g,K2SO418.2 g/L,CaCl20.93 g/L,KOH 4.13 g/L,MgSO4·7H2O 14.9 g/L,PTM1 12.0 mL/L,85% H3PO426.8 mL/L,消泡剂1 mL/L。
PTM1组成:CuSO4·5H2O 6.0 g/L,KI 0.08 g/L,CoCl20.5 g/L,NaMoO4·2H2O 0.2 g/L,MnSO4·H2O 3.0 g/L,H3BO30.02 g/L,ZnCl220.0 g/L,FeSO4·7H2O 65.0 g/L,生物素0.2 g/L,浓H2SO45 mL/g。
1.2 菌种
毕赤酵母G/DSEL为产β-半乳糖苷酶重组菌株,由本实验室自行构建,构建方法详见文献[11]报道。
2 方法
2.1 培养方法
本实验发酵罐使用国强公司1 L罐,装液量为0.6 L,接种量为1%,预先在220 r/min、30 ℃下将种子在摇瓶中培养24 h,取6 mL离心去除上清,加入6 mL生理盐水复溶,接入发酵罐,采用600测菌浓。整个过程使用NaOH溶液去除通气中CO2,通气量为0.6 L/min (1 vvm),批发酵搅拌转速为400 r/min,脉冲刺激实验前期搅拌转速为300 r/min,为避免后期出现氧限制情况,在15 h左右将搅拌转速调为400 r/min,控制发酵温度为30 ℃,采用氨水控制pH在5,罐压维持在0.05 MPa。对于整个发酵过程,使用biostar软件进行在线监控,使用过程质谱仪(MAX300-LG,Extrel) 测定尾气中O2和CO2的浓度。
本实验在批发酵的基础之上采用底物13C全标记葡萄糖分批脉冲。由于培养体积较大,单次取样样品后处理时间较长,为尽量减少样品与冷甲醇的接触时间,防止胞内代谢物大量泄露[12–14],本实验共分4次脉冲,单次脉冲13C全标葡萄糖浓度均为1.5 g/L。每次取样0.15 L,分4次取完。当溶氧DO开始回升OUR开始下降时进行13C全标记葡萄糖脉冲,5 min后开始快速取样操作。在OUR、CER再次下降时,进行第二次底物脉冲,后续脉冲重复该步骤。未进行底物脉冲实验的底物浓度等于进行底物脉冲刺激实验底物的浓度与脉冲所用底物之和,其余条件一致。
2.2 快速取样
胞内代谢物浓度一般很低,而对应的酶反应速度较快,因此需对取样的细胞进行快速淬 灭[15-17]。快速取样淬灭方法在文献报道[18-20]的基础上略微做了改进,具体如下:快速取出150 mL发酵液到750 mL –80 ℃的60%冷甲醇溶液中,并记录取样前后冷甲醇溶液质量。然后均匀分装至样品管,每个样品管装液量45 mL,置于–20 ℃离心机4 000 r/min离心5 min。
2.3 沸乙醇提取胞内代谢物
将离心好的样品去除上清,迅速加入到30 mL 75 ℃的75%乙醇溶液,漩涡振荡混匀,置于95 ℃水浴4 min。后冷却,低温离心收集上清。
2.4 浓缩分装
将离心后收集的上清液分别经旋转蒸发仪浓缩至1 mL后,混合定容至80 mL,然后分装至530个1.5 mL EP管中,每管装液量为150 μL,置于–80 ℃冰箱内保存,同时取部分制备的标品进样LC-MS/MS和GC-MS检测分析结果。
2.5 质谱分析方法
2.5.1 LC-MS分析
测定胞内有机酸、磷酸糖和核苷酸类采用LC-MS/MS (Thermal Ultimate 3000 UPLC+ Thermal TSQ QUANTUM ULTRA) 分析,使用文献报道的分析方法[21-22]并稍作修改。所用数据处理软件为Xcalibur (Thermo Scientific)。质谱采用负离子SRM (Selected Reaction Monitoring) 模式。用直接进样法获取待测物的离子对和最优质谱条件,其中毛细管温度为270 ℃,雾化温度 200 ℃,鞘气压力15 Arb,辅助气压力10 Arb,喷雾电压3 000 V。色谱部分:色谱柱ACQUITY UPLC BEH C18,1.7 μm,2.1 mm×150 mm,柱温25 ℃,流动相A为5%乙腈加5 mmol/L DBAA (二丁胺乙酸),流动相B为84%乙腈加5 mmol/L DBAA。洗脱梯度如下:0 min时B的比例为0%;0−20 min时,流动相B的比例从0%上升到20%维持2 min后再降到0%并维持10 min。流动相流速为0.2 mL/min。
2.5.2 GC-MS分析
胞内氨基酸的测定采用GC-MS,分析方法在文献[23]基础上稍作修改。具体如下:取100 µL处理好的样品到气相小瓶中并加入30 µL 100 mg/mL NaCl 放入–80 ℃冰箱30 min后冷冻抽干过夜。加入100 µL 乙腈和100 µL衍生剂N-(特丁基二甲基硅烷基)-N-甲基三氟乙酰胺+1%叔丁基二甲基氯硅烷 (MTBSTFA:TBDMSCL=99:1) 70 ℃维持60 min。冷却至室温后,离心取上清进样。使用的仪器是7890A GC (Agilent,Santa Clara,CA,USA) 串联5975C MSD 单级质谱 (Agilent,Santa Clara,CA,USA)。测定条件如下:进样量1 µL;使用的柱子:HP-5MS 30 m× 0.25 mm×0.25 µm (5% phenyl methyl siloxane)非极性弹性石英毛细管柱,升温程序:100 ℃维持1 min 后以10 ℃/min 的速度升温到300 ℃并维持10 min。载气高纯氦流速1 mL/min。传输线温度250 ℃,离子源温度230 ℃,四极杆温度150 ℃。EI源电压70 eV。为了准确定量采取SIM (Selected ion monitoring,SIM) 模式,质谱扫描范围为1–1 050 amu。
3 结果与讨论
3.1 发酵过程宏观数据分析
图1是未进行底物脉冲刺激实验和进行底物脉冲刺激实验的整个发酵过程DO的变化曲线,图中1、2、3、4分别代表4次底物脉冲,5处表示搅拌转速提高。为避免在培养过程中出现氧限制情况,故将搅拌转速从300 r/min提至400 r/min,此时DO上升。结合图2,CER和OUR在此时并未出现下降,因此DO的上升与菌体的生理状态无关。脉冲实验在18 h左右开始。此时DO开始回升,发酵罐内13C全标记葡萄糖基本耗尽。第一次底物脉冲,DO快速下降,约5 min后开始快速取样。待DO再次回升后进行第二次脉冲,依次类推,共进行4次脉冲。
图2是未进行底物脉冲刺激实验和进行底物脉冲刺激实验的整个发酵过程CER和OUR的变化曲线。从图中可以看出两批实验平行性良好,整个培养过程约为20 h,经过约10 h的延滞期后,CER和OUR开始快速增加。因进行底物脉冲的实验初始菌浓略低于未进行底物脉冲的实验 (初糖浓度分别为16.25 g/L和20 g/L),所以CER和OUR下降的时间略早于未进行底物脉冲的实验。通过600测出两批发酵液菌浓约为25 g/L。
3.2 胞内代谢物浓度分析
3.2.1 胞内有机酸
图3是测定得到的未进行底物脉冲和进行底物脉冲实验的胞内有机酸浓度对比情况。经过底物脉冲刺激后,胞内有机酸含量大幅提高,尤其是苹果酸提高约18倍,其余有机酸均有2–10倍 的提高。与传统未底物脉冲方法相比,在糖耗尽后进行底物脉冲,瞬间提高的底物浓度被细胞摄取,引起胞内代谢物含量迅速增加,在糖未耗尽前快速取样淬灭,细胞胞内代谢物浓度仍维持在较高水平。而传统方法是在发酵结束糖耗尽之后进行取样,因此造成胞内代谢物浓度较低。
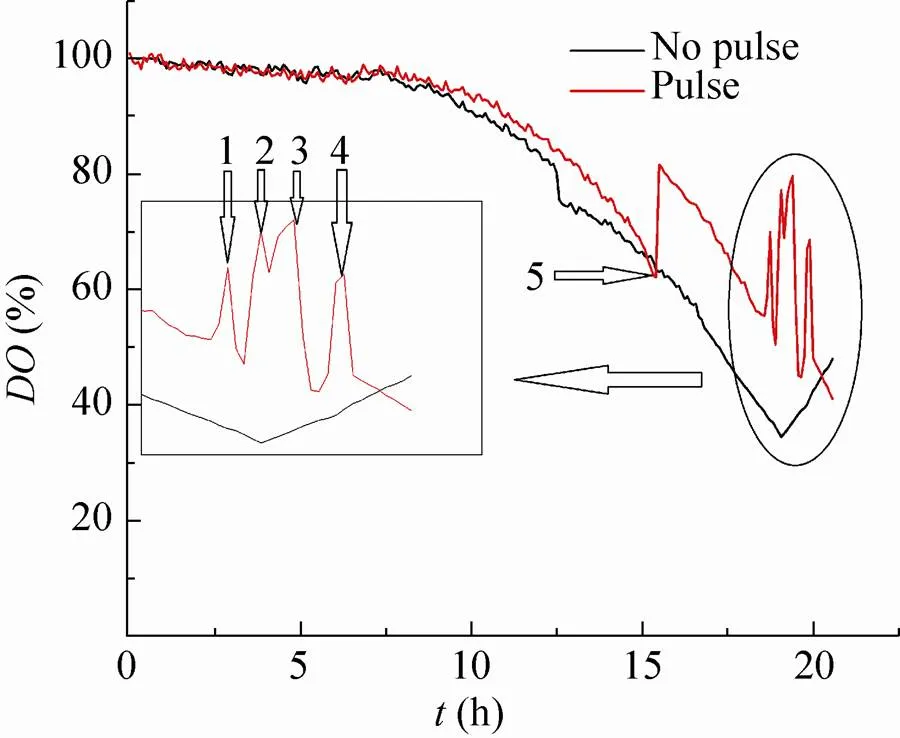
图1 毕赤酵母发酵过程DO随时间变化关系

图2 未底物脉冲与底物脉冲毕赤酵母发酵过程CER和OUR随时间变化情况
3.2.2 胞内磷酸糖
图4是测得的未进行底物脉冲和进行底物脉冲的胞内磷酸糖类物质浓度对比。其中赤藓 糖-4-磷酸提高幅度最大,约10倍左右,其他的物质也有不同程度的提高。13C全标记葡萄糖被细胞摄取之后,首先经EMP途径和PP途径,传统方法在糖耗尽后取样制备的标品中磷酸糖类物质优先被代谢,因此浓度较低,而在底物脉冲之后可使其维持浓度在较高水平。
3.2.3 胞内氨基酸
图5为测得的未进行底物脉冲和进行底物脉冲的胞内氨基酸含量对比情况。从图中可以看出,除天冬氨酸与组氨酸外,胞内大部分氨基酸含量在底物脉冲后都有大幅度提高,尤其脯氨酸和甘氨酸,均提高了约15倍。其余氨基酸含量均有2–5倍的提高。因为胞内氨基酸代谢偶联胞内中心碳代谢的部分代谢物,因此胞内磷酸糖类物质和有机酸类物质浓度的提高引起相应氨基酸浓度的增加。
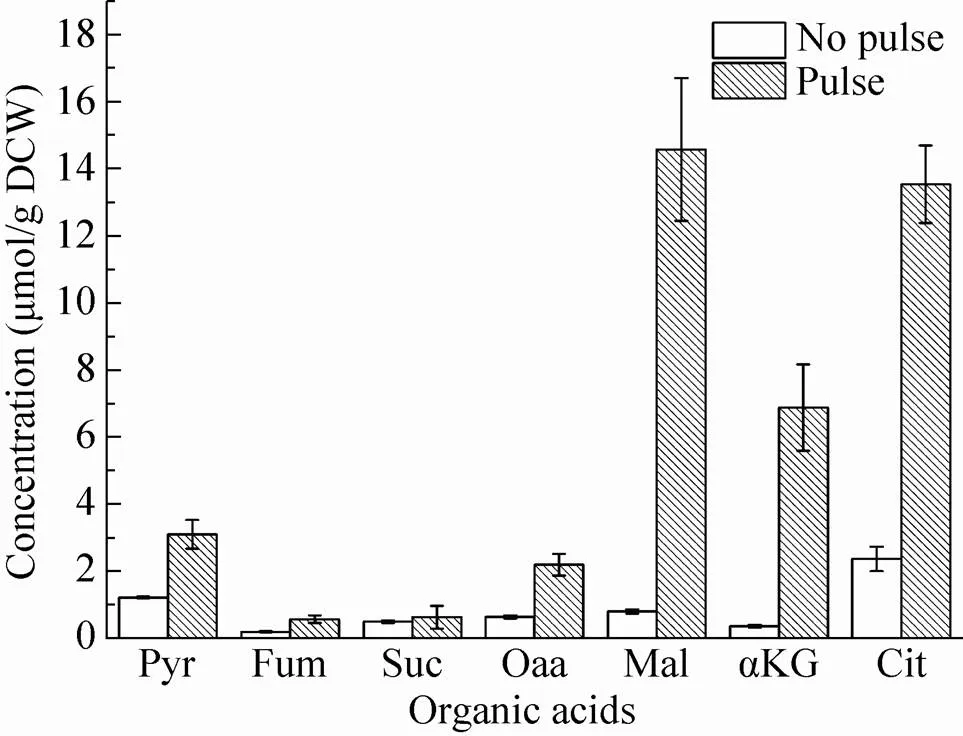
图3 底物脉冲与未底物脉冲胞内有机酸含量对比
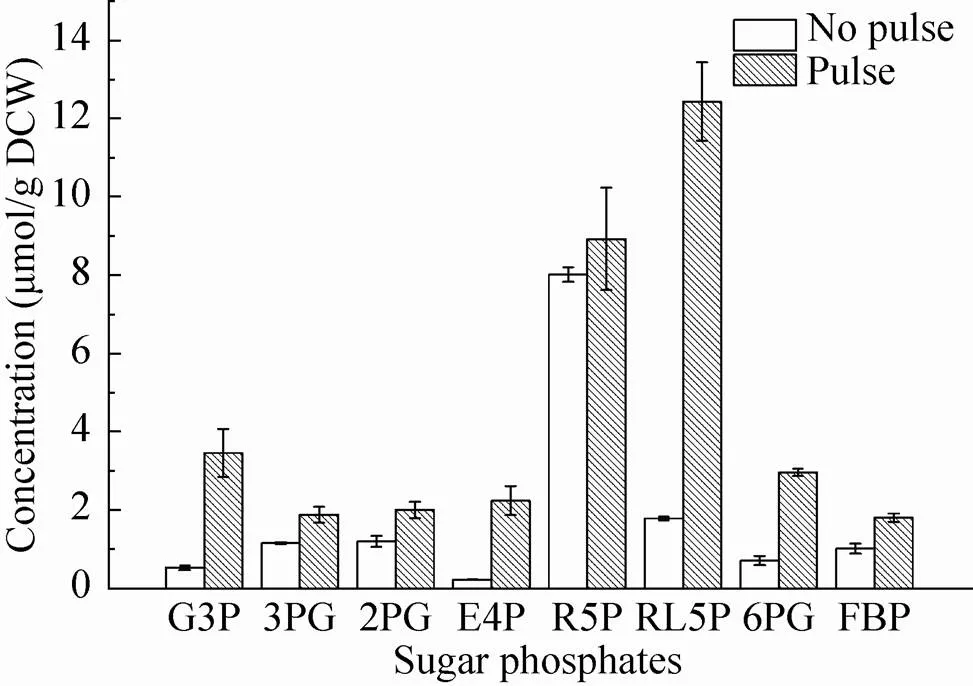
图4 底物脉冲与未底物脉冲胞内磷酸糖含量对比
3.2.4 胞内核苷酸
图6为测得的未进行底物脉冲和进行底物脉冲之后胞内核苷酸类物质浓度的对比情况。经底物脉冲后,胞内ATP、ADP、NADH和NAD的含量都大大提高,但AMP的浓度相对于未脉冲的实验出现了下降,其具体原因尚不清楚。

图5 底物脉冲与未底物脉冲胞内氨基酸含量对比
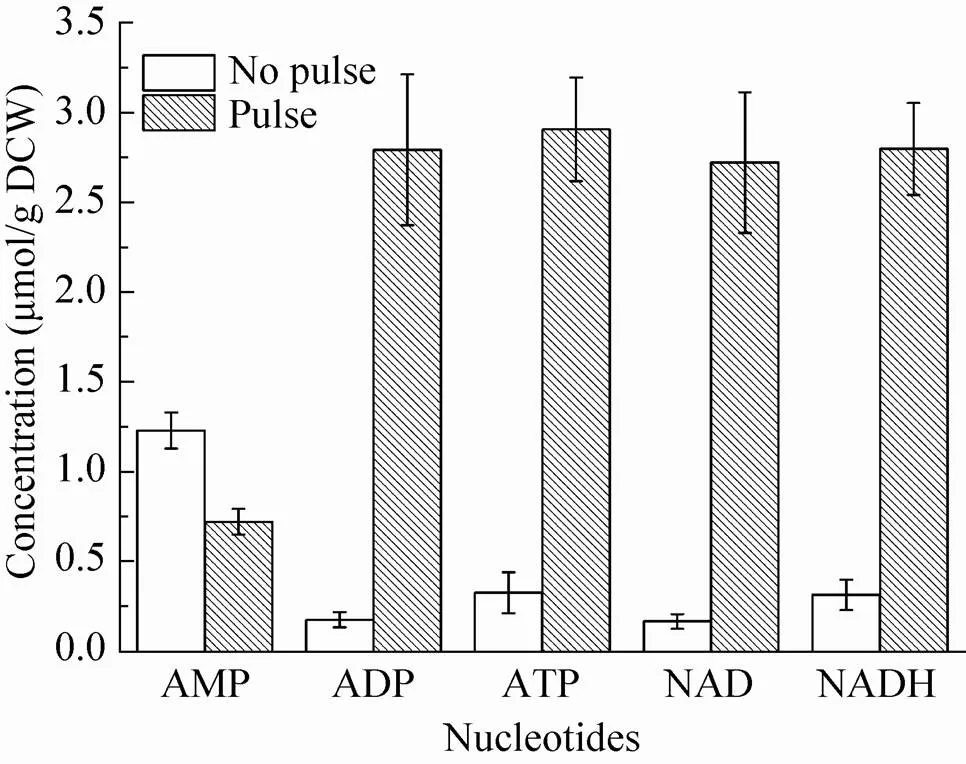
图6 底物脉冲与未底物脉冲胞内核苷酸类物质含量对比
3.3 结果讨论
通过以上结果的分析可见,经底物脉冲刺激后,胞内中心碳代谢途径的大部分代谢物浓度均有提高,与文献结果类似[24-25]。其原因分析为胞外葡萄糖浓度瞬间提高之后,细胞摄取的葡萄糖量迅速增加,经EMP途径,6-磷酸-葡萄酸、果糖-1,6-二磷酸、3-磷酸甘油醛、3-磷酸甘油酸、丙酮酸等代谢物浓度均有大幅提高;与此同时由于ATP的含量大大提高,为各种合成反应也提供了所需的能量。伴随着3-磷酸甘油酸和丙酮酸浓度的增加,分别与之偶联的丝氨酸、甘氨酸、丙氨酸和缬氨酸含量也大幅提高。由于胞内6-磷酸葡糖酸浓度的增加,因此PP途径的部分代谢物浓度也随之增加,其中核酮糖-5-磷酸和赤藓糖-4-磷酸浓度提升幅度较大,而核糖-5-磷酸浓度提升较小,因此以其为前体的组氨酸含量也仅有略微增加。最后,由于丙酮酸的浓度提高了2.5倍左右,因此TCA循环的代谢物浓度也随之增加,其中柠檬酸、α-酮戊二酸、草酰乙酸和苹果酸的浓度提高幅度较大,因此以苹果酸为前体的天冬氨酸、甲硫氨酸和苏氨酸浓度也相应提高,以α-酮戊二酸为前体的脯氨酸浓度得到极大的提高。
虽然经底物脉冲刺激之后,胞内中心碳代谢的大部分代谢物浓度都得到提高,但是也有部分代谢物的浓度出现了下降。图7为测得的未进行底物脉冲和进行底物脉冲后出现浓度下降的代谢物的对比情况。出现代谢物浓度下降的原因目前尚不清楚,分析可能是由于ATP含量大大提高,胞内某些处于抑制状态的合成途径被激活,造成作为前体的部分代谢物浓度迅速降低。对于部分代谢物浓度下降的真正原因需要进一步实验验证,将作为本课题下一步研究的内容。
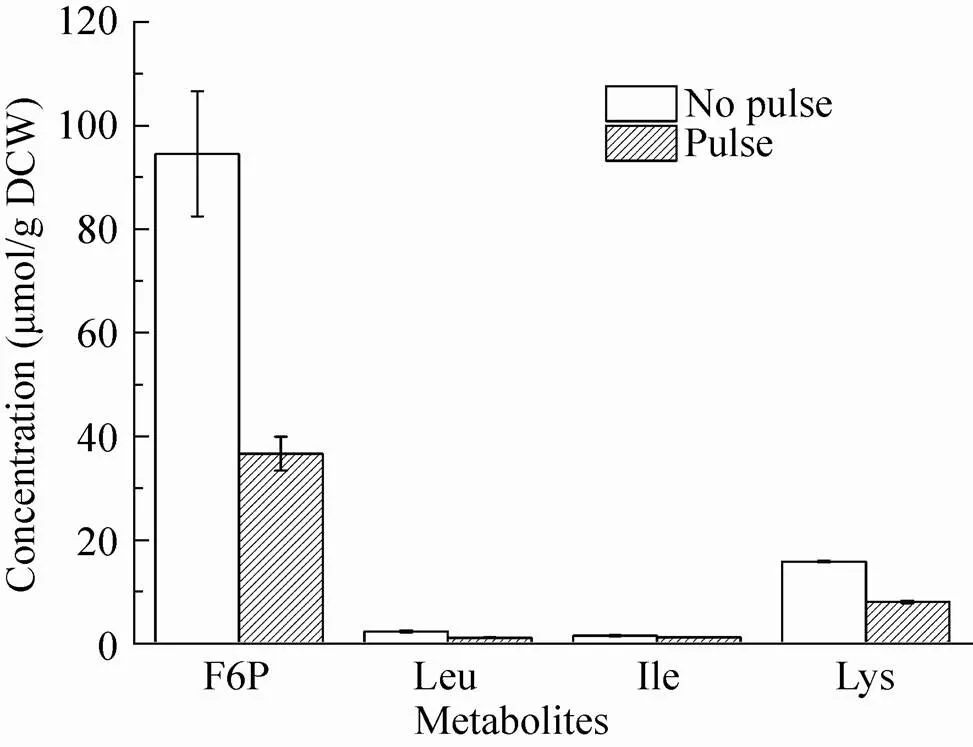
图7 经底物脉冲后胞内浓度降低的代谢物
4 结论
本文主要采用了13C全标记葡萄糖作为唯一碳源培养毕赤酵母G/DSEL,基于葡萄糖脉冲并结合快速取样淬灭技术制备13C标品。同时与传统未采用底物脉冲的批发酵模式进行了对比,通过LC-MS/MS与GC-MS的结果分析,主要比较了两种方法制备的标品浓度差异。
综上所述,进行底物脉冲制备IDMS13C标品可大幅提高标品的浓度,其快速取样点处于糖未完全耗尽时,因此胞内中心碳代谢大部分代谢物浓度均有大幅度的提高。因此,基于底物脉冲制备IDMS13C标品能极大改善传统批培养制备标品浓度较低的问题,同时也能节约成本,提高标品的利用率。此外,底物脉冲法对实现胞内部分含量低于当前仪器检测限的代谢物的检测具有重要的参考意义。
[1] van Dam JC, Eman MR, Frank J, et al. Analysis of glycolytic intermediates inusing anion exchange chromatography and electrospray ionization with tandem mass spectrometric detection. Anal Chim Acta, 2002, 460(2): 209–218.
2.单亲家庭等因素造成的留守儿童或隔代抚养的问题,成为不容忽视的难解困局。这些孩子只能由老人照看,老人本身文化层次较低,又缺乏指导方法,还要干农活,无暇管理孩子,只能放任自流。
[2] Theobald U, Mailinger W, Baltes M, et al.analysis of metabolic dynamics in: I. Experimental observations. Biotechnol Bioeng, 1997, 55(2): 305–316.
[3] Groussac E, Ortiz M, François J. Improved protocols for quantitative determination of metabolites from biological samples using high performance ionic-exchange chromatography with conductimetric and pulsed amperometricdetection. Enzyme Microb Technol, 2000, 26(10): 715–723.
[4] Mashego MR, Wu L, van Dam JC, et al. MIRACLE: mass isotopomer ratio analysis of U-13C-labeled extracts. A new method for accurate quantification of changes in concentrations of intracellular metabolites. Biotechnol Bioeng, 2004, 85(6): 620–628.
[5] Wu L, Mashego MR, van Dam JC, et al. Quantitative analysis of the microbial metabolome by isotope dilution mass spectrometry using uniformly13C-labeled cell extracts as internal standards. Anal Biochem, 2005, 336(2): 164–171.
[6] Li HM, Wang HN, Xu QK. Advance ofon high-density fermentation. Lett Biotechnol, 2005, 16(2): 210–212 (in Chinese). 李洪淼, 王红宁, 许钦坤. 毕赤酵母高密度发酵研究进展. 生物技术通讯, 2005, 16(2): 210–212.
[7] Taymaz-Nikerel H, van Gulik WM, Heijnen JJ.responds with a rapid and large change in growth rate upon a shift from glucose-limited to glucose-excess conditions. Metab Eng, 2011, 13(3): 307–318.
[8] Visser D, van Zuylen GA, van Dam JC, et al. Analysis ofkinetics of glycolysis in aerobicby application of glucose and ethanol pulses. Biotechnol Bioeng, 2004, 88(2): 157–167.
[9] Buchholz A, Hurlebaus J, Wandrey C, et al. Metabolomics: quantification of intracellular metabolite dynamics. Biomol Eng, 2002, 19(1): 5–15.
[10] Schmitz M, Hirsch E, Bongaerts J, et al. Pulse experiments as a prerequisite for the quantification ofenzyme kinetics in aromatic amino acid pathway of. Biotechnol Prog, 2002, 18(5): 935–941.
[11] Ding LM, Xiao CY, Chu J, et al. Secretory expression of CPC acylase mediated by endogenous signal sequence DSE4 in. J East China Univ Sci Technol: Nat Sci Ed, 2015, 41(4): 449–454 (in Chinese).丁璐妹, 肖慈英, 储炬, 等. 内源信号肽DSE4介导头孢菌素C酰化酶在毕赤酵母中的分泌表达. 华东理工大学学报: 自然科学版, 2015, 41(4): 449–454.
[12] Zakhartsev M, Vielhauer O, Horn T, et al. Fast sampling for quantitative microbial metabolomics: new aspects on cold methanol quenching: metabolite co-precipitation. Metabolomics, 2015, 11(2): 286–301.
[13] Canelas AB, Ras C, ten Pierick A, et al. Leakage-free rapid quenching technique for yeast metabolomics. Metabolomics, 2008, 4(3): 226–239.
[14] Carnicer M, Canelas AB, Pierick AT, et al. Development of quantitative metabolomics for. Metabolomics, 2012, 8(2): 284–298.
[15] Taymaz-Nikerel H, de Mey M, Ras C, et al. Development and application of a differential method for reliable metabolome analysis in. Anal Biochem, 2009, 386(1): 9–19.
[16] Mashego MR, van Gulik WM, Vinke JL, et al.kinetics with rapid perturbation experiments inusing a second-generation BioScope. Metab Eng, 2006, 8(4): 370.
[17] Lameiras F, Heijnen JJ, van Gulik WM. Development of tools for quantitative intracellular metabolomics ofchemostat cultures. Metabolomics, 2015, 11(5): 1253–1264.
[18] Canelas AB, ten Pierick A, Ras C, et al. Quantitative evaluation of intracellular metabolite extraction techniques for yeast metabolomics. Anal Chem, 2009, 81(17): 7379–7389.
[19] Tredwell GD, Edwards-Jones B, Leak DJ, et al. The development of metabolomics sampling procedures for, and baseline metabolome data. PLoS ONE, 2011, 6(1): e16286.
[20] Park C, Yun S, Lee SY, et al. Metabolic profiling of: evaluation of methods for extraction of intracellular metabolites using UPLC/Q-TOF-MS. Appl Biochem Biotechnol, 2012, 167(3): 425–438.
[21] Seifar RM, Ras C, van Dam JC, et al. Simultaneous quantification of free nucleotides in complex biological samples using ion pair reversed phase liquid chromatography isotope dilution tandem mass spectrometry. Anal Biochem, 2009, 388(2): 213–219.
[22] Luo B, Groenke K, Takors R, et al. Simultaneous determination of multiple intracellular metabolites in glycolysis, pentose phosphate pathway and tricarboxylic acid cycle by liquid chromatography-mass spectrometry. J Chromatogr A, 2007, 1147(2): 153–164.
[23] de Jonge LP, Buijs NAA, ten Pierick A, et al. Scale-down of penicillin production in. Biotechnol J, 2011, 6(8): 944–958.
[24] de Jonge LP, Buijs NAA, Heijnen JJ, et al. Flux response of glycolysis and storage metabolism during rapid feast/famine conditions inusing dynamic13C labeling. Biotechnol J, 2014, 9(3): 372–385.
[25] Suarez-Mendez CA, Sousa A, Heijnen JJ, et al. Fast “feast/famine” cycles for studying microbial physiology under dynamic conditions: a case study with. Metabolites, 2014, 4(2): 347–372.
(本文责编 陈宏宇)
Preparation of isotope dilution mass spectrometry standards based on glucose pulse
Wei Shu, Chao Li, Xiaoyun Liu, Jianye Xia, and Yingping Zhuang
State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China
Isotope Dilution Mass Spectrometry (IDMS) is the most accurate method for high-throughput detection of intracellular metabolite concentrations, and the key is getting the corresponding fully uniformly(U)13C-labeled metabolites to be measured. The conventional procedure for getting fully U13C-labeled metabolites is through batch cultivation, but intracellular metabolites concentrations by this method are generally low. By applying U13C-labeled glucose pulse, combined with fast sampling and quenching, mixture of fully U13C-labeled intracellular metabolites was successfully extracted with higher concentration fromG/DSEL fed with fully U13C-labeled glucose as only carbon source. Quantitative results from liquid chromatography tandem mass spectrometry (LC-MS) and gas chromatography tandem mass spectrometry (GC-MS) show that concentrations of organic acids, sugar phosphates, amino acids and nucleotides were 2–10 folds higher than those without glucose pulse. Therefore, the glucose pulse method can efficiently improve the usage of fully U13C-labeled glucose converting to13C-labeled metabolites, and achieve the detection of intracellular metabolites with lower concentrate than the instrument detection limit.
G/DSEL, IDMS standard, substrates pulse, fast sampling, LC-MS, GC-MS
February 16, 2017;
April 19, 2017
Jianye Xia. Tel: +86-21-64251946; E-mail: jyxia@ecust.edu.cn
Supported by: National Natural Science Foundation for Young Scholars of China (No. 21506052 ), the Fundamental Research Funds for the Central Universities (No. 222201414037).
国家自然科学基金青年基金 (No. 21506052),中央高校基本科研业务费专项基金 (No. 222201414037) 资助。
2017-05-03
网络出版地址:http://kns.cnki.net/kcms/detail/11.1998.Q.20170503.1459.004.html

