球形节杆菌A152产透明质酸酶的发酵优化及动力学模型的建立
姜言晖,张京良,江晓路,3,4
球形节杆菌A152产透明质酸酶的发酵优化及动力学模型的建立
姜言晖1,张京良2,3,江晓路1,3,4
1 中国海洋大学食品科学与工程学院,山东青岛 266003 2 中国海洋大学医药学院,山东青岛 266003 3 青岛海洋生物医药研究院,山东青岛 266071 4 青岛明月海藻集团有限公司,海藻活性物质国家重点实验室,山东青岛 266400

姜言晖, 张京良, 江晓路.球形节杆菌A152产透明质酸酶的发酵优化及动力学模型的建立. 生物工程学报, 2017, 33(11): 1883–1888.Jiang YH, Zhang JL, Jiang XL. Establishment of kinetics digital model for hyaluronate lyase productionbased on fermentation optimization of Arthrobacter globiformis A152. Chin J Biotech, 2017, 33(11): 1883–1888.
以制备高产量的透明质酸酶为出发点,利用5 L发酵罐对球形节杆菌A152发酵生产透明质酸酶的条件进行优化,并对其发酵动力学模型进行研究。研究结果表明,转速400 r/min、通气量3.5 L/min时,生物量和透明质酸酶酶活力最优,分别为5 g/L、16.4 U/mL;同时对发酵过程中菌体生长、产物生成及基质消耗的规律进行研究,应用Logistic方程、Luedeking-Piret方程和底物消耗的物料平衡方程建立了球形节杆菌A152发酵过程的动力学模型,并通过MATLAB软件进行最优参数估计和非线性拟合。模型的计算值与实验值能较好地拟合,表明所建的模型能较好地反映发酵过程,可为发酵过程的在线控制和预测提供理论基础。
透明质酸酶,发酵优化,动力学模型,非线性拟合
透明质酸酶 (Hyaluronidase,HAase) 是能够使透明质酸产生低分子化作用酶的总称。根据作用机制不同,分为哺乳动物及动物毒液来源的内切β-N-乙酰氨基葡糖苷酶,水蛭、十二指肠虫来源的内切-β-葡糖苷酸酶及细菌来源的透明质酸酶3类[1]。
透明质酸酶可改善药物的组织渗透性,促进药物扩散和吸收[2],它降解生成的低分子透明质酸寡糖具有促进骨和血管的生成[3]、促进创伤愈合[4]、抗肿瘤[5]及抗炎[6]等功效,在医药方面具有良好的应用前景。现阶段,透明质酸酶多从动物睾丸组织提取[7],由于原料有限、含量低等原因限制了它的开发应用,而微生物来源的透明质酸酶可避免这些缺陷。目前微生物来源的透明质酸酶的研究主要集中在菌株的选育方面[8],对产酶菌株发酵动力学方面的研究未见报道。
发酵罐发酵是实验室摇瓶发酵的放大,为工业化放大提供依据,有利于实现成果从实验室水平向工业化水平的转变。通过前期研究发现球形节杆菌A152发酵生产的透明质酸酶具有良好的温度和pH稳定性,在医药和生物化工方面具有良好应用价值。本文在摇瓶优化培养基配方的基础上,利用5 L发酵罐对其发酵条件进行优化,通过对通气量、转速及补料的研究,确定最适的发酵条件及控制参数。在发酵条件优化的基础上,建立A152生产透明质酸酶的动力学模型,探索发酵过程变化规律,为发酵过程的预测和控制提供理论方程,为其在线控制和自动化提供理论依据。
1 材料与方法
1.1 菌种及培养基
球形节杆菌A152,由食品科学与工程学院应用微生物学实验室提供。
种子培养基:K2HPO41 g/L、MgSO40.5 g/L、NaCl 0.5 g/L、CaCl20.01 g/L、牛肉膏5 g/L、蛋白胨1 g/L、HA 0.5 g/L,pH调至7.0,115 ℃灭菌30 min。
发酵培养基:K2HPO41.5 g/L、MgSO40.5 g/L、NaCl 0.5 g/L、CaCl20.01 g/L、牛肉膏5 g/L、蛋白胨1 g/L、HA 4 g/L,pH调至7.0,115 ℃灭菌30 min。
补料培养基:K2HPO41.5 g/L、MgSO40.5 g/L、NaCl 0.5 g/L、CaCl20.01 g/L、牛肉膏25 g/L、蛋白胨5 g/L、HA 20 g/L,pH调至7.0,115 ℃灭菌30 min。
1.2 仪器与设备
BLBIO-5GJ-4-H 5L四联自动发酵罐,上海百伦生物科技有限公司;LDZX-75KB立式压力蒸汽灭菌器,上海申安医疗器械厂;GL-20G-II高速冷冻离心机,上海安亭科学仪器厂;UV-6000PC紫外型可见分光光度计,上海元析仪器有限公司。
1.3 培养方法
取一环菌接种于装有25 mL种子培养基的250 mL三角瓶中,160 r /min、28 ℃培养24 h,得一级种子培养液。将一级种子培养液以5%的接种量接入装有25 mL种子培养基的250 mL三角瓶中,同种方式培养获得二级种子液。将二级种子液以5%的接种量接种至装有3.5 L发酵培养基的5 L发酵罐中,控制适宜的转速和通气量,于24 ℃条件下发酵培养。
1.3.1 发酵培养条件优化
控制其他条件相同,分别考察转速 (200、400、600、800 r /min)、通气量 (1.75、3.50、4.75 L/min)、补料对发酵体系的溶氧量 (DO)、透明质酸酶的产量和生物量的影响,筛选适宜的转速、通气量及补料条件。
1.4 分析方法
1.4.1 生物量的测定
在发酵条件优化实验中,以660 nm的吸光值 (660) 表征生物量[9];在动力学模型构建实验中,以菌体干重表示生物量[10]。
菌体干重 ():取10 mL发酵液于预先称重的离心管 (0) 中,8 000 r/min离心10 min,弃上清,加入10 mL蒸馏水离心洗涤2次,弃上清,沉淀于80 ℃烘箱烘干至恒重 (n)。
=n–0
1.4.2 酶活力的测定
酶活力单位定义[11]:37 ℃条件下,每分钟催化形成1 μmol不饱和双糖消耗的酶量。酶活力的测定:取20 μL经6 000 r/min离心10 min的发酵上清液、3.98 mL 0.02 mol/L Tris-HCL (pH 7.5) 和4 mL 0.2%透明质酸 (0.02 mol/L Tris-HCL配制,pH 7.5) 加入15 mL的比色管中,37 ℃水浴反应20 min后,置于沸水浴中煮沸5 min,对照管以相同的条件加入灭活的发酵上清液,测定232 nm处光吸收值。

式中,指232 nm处的吸光值;ɛ指毫摩尔消光系数,取5.5;d指比色皿的厚度,1 cm;指反应的时间 (min);t指反应的总体积 (mL);s指样品的体积 (mL)。
1.4.3 残糖量的测定
采用DNS法[12]测定发酵液中的残糖。
1.4.4 溶氧量的测定
采用溶氧电极测定发酵液中的溶氧量。
1.5 动力学模型
1.5.1 菌体生长动力学模型的建立
利用Logistic方程[9]建立A152的菌体生长动力学模型,描述菌体生长速率的Logistic微分方程为

式中,d/d为菌体的生长速率 (g/(L·h));为菌体浓度 (g/L);为发酵时间 (h);为比生长速率 (h–1);max为最大比生长速率 (h–1);max为最大菌体浓度 (g/L)。
初始条件=0时,得=0,积分式为

1.5.2 产物合成动力学模型的建立
采用Luedeking-Piret方程[9]建立A152的产物合成动力学模型,描述透明质酸酶合成速率的Luedeking-Piret微分方程为

式中,d/d为产物合成速率 (g/(L·h));为产物的浓度 (g/L);为与菌体生长速率有关联的产物合成常数 (g/(L·h)),为与菌体浓度关联的产物合成浓度 (g/(L·h))。≠0、=0时,产物合成与菌体生长相偶联;≠0、≠0时,产物合成与菌体生长部分偶联;=0、≠0时,产物合成与菌体生长非偶联。
初始条件=0时,得=0,积分式为
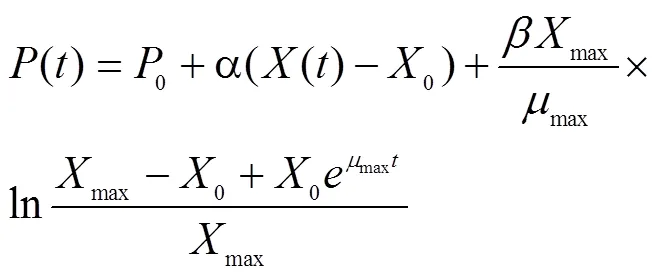
1.5.3 底物消耗动力学模型的建立
在发酵过程中,底物消耗主要用于菌体的生长、产物合成及细胞代谢的维持。根据基质平衡原理,建立底物消耗的物料平衡微分方程[9]为

式中,–/为底物消耗速率(g/(L·h)),为底物浓度(g/L),x/s为菌体对底物的得率(g/g),p/s为产物对底物的得率(g/g),m为菌体的维持因子(h–1)。
初始条件=0时,得=0,积分式为
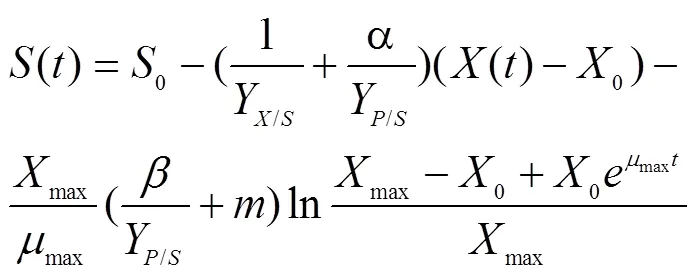
1.5.4 数据处理与分析
采用EXCEL 2010及MATLAB R2012a进行实验数据处理分析与模型拟合分析。
2 结果分析
2.1 发酵优化结果
2.1.1 转速对透明质酸酶发酵的影响
微生物发酵过程培养基组分的均匀和溶氧都与搅拌相关。由图1可知,200 r/min时,溶氧始终保持极低的水平,溶氧不足导致菌体生长缓慢,透明质酸酶的合成延滞,发酵周期延长。而在400 r/min时, 18 h达到产酶最高点,为8.68 U/mL,转速600 r/min与400 r/min的规律一致,在18 h达到产酶最高点,为8.66 U/mL,二者酶产量相差不大,而在800 r/min时,在14 h即可达到产酶最高点,酶产量较400 r/min和600 r/min低,为8.02 U/mL。综上,选择400 r/min作为发酵生产透明质酸酶的最适转速。

图1 转速对Arthrobacter globiformis A152产透明质酸酶发酵过程的影响(A:DO、OD660;B:酶活力)
2.1.2 通气量对透明质酸酶发酵的影响
通气量可以改变培养基中菌体细胞之间的氧传递系数而间接影响菌体对培养基组分的利用效率,适当的通气量有利于菌体细胞内外养分平衡、菌体浓度的积累以及目的产物的释放[13]。由图2可以看出,通气量越大,溶氧低水平期越短,通气量1.75 L/min时,生物量总体偏低,产酶最高点也略微延迟;通气量为3.50 L/min时,酶产量在18 h达到最大,为8.16 U/mL,通气量为4.75 L/min时,酶产量相对较低,为7.98 U/mL。通气量低影响菌体生长,生物量和酶产量偏低;通气量过高,培养基中的氧气处于过饱和状态,菌体代谢异常,酶产量略有下降。与通气量为1.75 L/min相比,通气量3.50 L/min和4.75 L/min生物量和酶活力均有提高,说明氧气供应充足,可以充分满足菌体生长,但通气过量,会抑制菌体产酶。从节省能源和酶产量两方面考虑,选择3.50 L/min作为发酵生产透明质酸酶的最适通气量。
2.1.3 补料对透明质酸酶发酵的影响
根据菌体的生长和初始培养基的特点,在发酵的某些阶段进行补加培养基,使菌体或其代谢产物的生产时间延长,使产物生成增加[14]。由图3可知,发酵前期,菌体生长迅速,底物消耗增加,残糖量减少,在12 h最低,限制菌体的生长。因此,选择在12 h补料600 mL。与未补料相比,补料后残糖量增加,为菌体生长提供充足的营养,生物量增加,但酶活力却有所降低,不利于产酶,后续发酵选择不补料。

图2 通气量对Arthrobacter globiformis A152产透明质酸酶发酵过程的影响(A:DO、OD660;B:酶活力)
2.2 Arthrobacter globiformis A152生产透明质酸酶的发酵过程曲线及分析
A152产透明质酸酶的发酵过程曲线如图4所示,残糖量先缓慢下降后快速下降最后趋于平稳,在发酵4 h内缓慢下降,4–12 h迅速下降,12 h之后维持在0.5 mg/mL以下,保持稳定。生物量与其变化趋势相反,12 h后稳定在5 g/L,生物量与残糖量的变化同步进行。产酶量的变化略有不同,0–6 h缓慢增加,6–18 h迅速升高,在18 h后维持在16.4 U/mL左右,达到最高。以上数据表明,发酵过程中菌体生长消耗底物,使基质中的残糖量持续降低,生物量逐渐增加,透明质酸酶酶活力逐渐升高,当残糖量在0.5 mg/mL以下时,不足以维持菌体的生长,此时生物量达到最大,pH降至最低,产酶量继续增加,在4 h后达到产酶最高点。pH在整个发酵的过程中呈先降低后升高的趋势,表明菌体在合成透明质酸酶的过程中产酸,在12 h生物量达到最大,此时pH和残糖量均下降至最低点,12 h后pH逐渐升高然后趋于稳定,pH的变化可能是由于残糖量不足引起的。酶产量在pH降至最低点后6 h达到最高点,可通过pH的变化对整个发酵终点进行控制,以获得高产量的透明质酸酶。
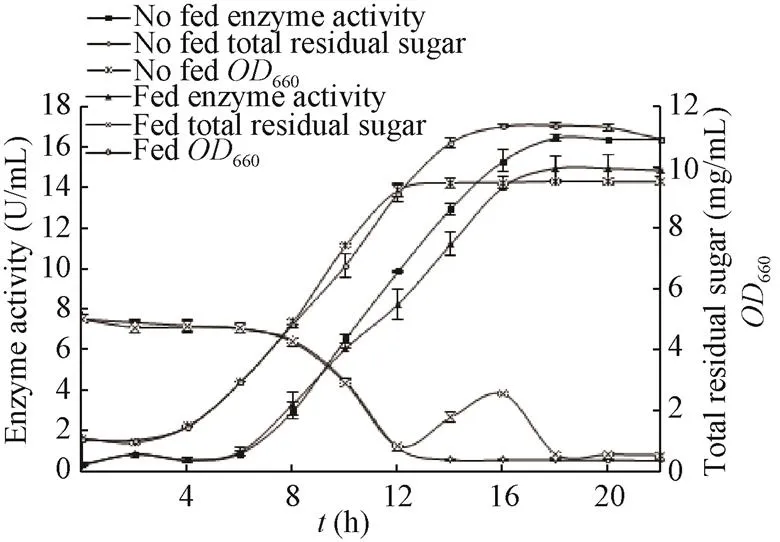
图3 补料对Arthrobacter globiformis A152生产透明质酸酶发酵过程的影响

图4 Arthrobacter globiformis A152生产透明质酸酶的发酵曲线
2.3 模型参数求解及数据拟合
采用MATLAB软件对球形节杆菌生产透明质酸酶的发酵动力学方程 (2)、(4)、(6) 进行非线性拟合,得到的动力学参数如表1所示。
将模型参数值代入 (2)、(4)、(6) 式,得到菌体生长、产物合成和底物消耗动力学方程分别为:



2.4 拟合曲线分析
A152发酵生产透明质酸酶的动力学曲线如图5所示,从图中可以看出,拟合值与实验值较为接近,曲线拟合度2分别为0.983 8、0.973 6和0.921 2,表明模型的拟合效果良好,能够较好地反映实际的发酵过程。

表1 发酵动力学模型参数值

3 讨论
发酵工程的理论和方法已广泛应用于工业微生物产品的生产及工艺优化,使现代工业微生物发酵取得了高速发展[15]。本文利用5 L发酵罐生产透明质酸酶,通过优化其培养条件,得到稳定的发酵工艺,在转速为400 r/min,通气量为3.5 L/min的条件下发酵培养18 h,其产酶高达16.4 U/mL,与摇瓶 (发酵周期为24 h,酶产量为12.8 U/mL) 相比,发酵周期缩短了25%,酶产量提高了28%。且通过浊度法测得透明质酸酶酶活力达1.36×104U/mL,远高于报道的轻型链球菌MTCC 2695[16]和噬尼古丁节杆菌[17]产的透明质酸酶的酶活力,且本文的发酵周期缩短,可降低生产成本,提高生产效率。此外,本研究的菌株易于培养,营养要求简单,可规模化应用于工业生产。
发酵动力对发酵工艺的分析、优化、放大和控制具有重要的指导意义。王莹等[18]对羊肚菌液体深层发酵动力学进行研究,对菌体生长、多糖产生和基质消耗模型进行了参数估计。本文对A152发酵产透明质酸酶的动力学进行了研究,通过建立发酵动力学模型,可以实时监控发酵过程中菌体生长、产物合成、底物消耗的变化规律。模型拟合结果表明,三条曲线的拟合度分别为0.983 8、0.973 6和0.921 2,拟合值与实验值相近,模型能较好地反映发酵过程规律,对A152发酵过程的在线控制及工业化生产具有重要指导意义。考虑到实验过程中不能进行全程自动化控制,人工抽样检测可能会对实验结果带来一定影响,需要进一步的实验对其进行深入研究。
[1] Meyer K, Rapport MM. Hyaluronidases. Adv Enzymol, 1952, 13: 199–236.
[2] Su K, Ji AG. Research of Hyaluronidases and Future Development. Biotechnol Bull, 2014, (3): 15–21 (in Chinese).苏康, 吉爱国. 透明质酸酶的研究进展. 生物技术通报, 2014, (3): 15–21.
[3] Wang YF, Wang FS, Guo XP. Preparation of low molecular weight hyaluronic acid and its angiogenesis effects. Chin J Biochem Pharm, 2007, 28(2): 107–109 (in Chinese).王彦厚, 王凤山, 郭学平. 低相对分子质量透明质酸的制备及其促血管生成作用. 中国生化药物杂志, 2007, 28(2): 107–109.
[4] Hu ZL. Effects of hyaluronic acid in healing of periodontal wound. China Pharm, 2005, 14(9): 23–24 (in Chinese).胡泽利. 透明质酸在牙周组织创伤愈合过程中的作用. 中国药业, 2005, 14(9): 23–24.
[5] Alaniz L, Rizzo M, Malvicini M, et al. Low molecular weight hyaluronan inhibits colorectal carcinoma growth by decreasing tumor cell proliferation and stimulating immune response. Cancer Lett, 2009, 278(1): 9–16.
[6] Zhang HW, Wei WR, Cheng XF, et al. To investigate the effect of biological activity of hyaluronic acid brushing treatment of gingivitis. J Clin Med, 2015, 2(23): 4808–4809 (in Chinese).张华伟, 魏旺荣, 程锡芳, 等. 探讨生物活性透明质酸刷牙治疗牙龈炎的疗效. 临床医药文献电子杂志, 2015, 2(23): 4808–4809.
[7] Yu J, Jin HN, Bai YJ, et al. A stabilizer and liquid preparation for hyaluronidase: CN, 104768535A. 2015-07-08 (in Chinese).禹具, 金荷娜, 白永俊, 等. 用于透明质酸酶的稳定剂和包括透明质酸酶的液体制剂: 中国, 104768535A. 2015-07-08.
[8] Xue W. Strain Screening and Optimization of Fermentation Medium for Higher Production of Hyaluronidase. Jinan: Shandong University, 2015 (in Chinese).薛蔚. 产透明质酸酶菌株的筛选及发酵条件的优化.济南: 山东大学, 2015.
[9] Yu XM, Zhang JL, Sun YC, et al. Establishment of digital model for levan production based on fermentation optimization and kinetics. Food Fermen Ind, 2016, 42(12): 20–25 (in Chinese).于晓萌, 张京良, 孙永超, 等. 基于发酵优化和动力学建立Levan果聚糖生产的数字化模型. 食品与发酵工业, 2016, 42(12): 20–25.
[10] Zhang Y, Feng XH, Li S, et al. Fed-batch fermentation kinetics of ε-polylysine by. MY 5-36. Chin J Bioprocess Eng, 2012, 10(3): 23–27 (in Chinese).张扬, 冯小海, 李莎, 等.. MY 5-36产ε-聚赖氨酸分批补料发酵动力学. 生物加工过程, 2012, 10(3): 23–27.
[11] Allen AG, Lindsay H, Seilly D, et al. Identification and characterisation of hyaluronate lyase from. Microb Pathog, 2004, 36(6): 327–335.
[12] Yan FH, Zhou JM, Wu RC. Colorimetric determination of reducing sugar by methanoic acid pretreatment bagasse with 3,5-dinitrosalicylic acid. Food Res and Dev, 2015, 36(2): 126–128 (in Chinese).彦繁鹤, 周金梅, 吴如春. DNS法测定甘蔗渣中还原糖含量. 食品研究与开发, 2015, 36(2): 126–128.
[13] Roukas T, Liakopoulou-Kyriakides M. Production of pullulan from beet molasses byin a stirred tank fermentor. J Food Eng, 1999, 40(1/2): 89–94.
[14] Hu B, Liu H, Wu ZL, et al. Study on D ribose production by fed-batch fermentation. Chem React Eng and Technol, 2006, 22(2): 151–155 (in Chinese).胡滨, 刘虎, 吴兆亮, 等. 补料发酵生产D-核糖工艺的研究. 化学反应工程与工艺, 2006, 22(2): 151–155.
[15] Xia Y, Wang B, Wang GX, et al. Establishment of batch fermentation kinetics model of polysaccharide ofgroup C. Chin J Biol, 2014, 27(11): 1473–1476 (in Chinese).夏永, 王斌, 王公孝, 等. C群流行性脑膜炎球菌多糖分批发酵动力学模型的建立. 中国生物制品学杂志, 2014, 27(11): 1473–1476.
[16] Mahesh N, Balakumar S, Parkavi R, et al. Optimization and production of hyaluronidase by streptococcus mitis MTCC 2695. Biomolecul, 2012, 1: 101.
[17] Su K. Study on optimal cultivation condition and characterization of hyaluronidase from[D]. Jinan: Shandong University, 2014 (in Chinese).苏康. 噬尼古丁节杆菌产透明质酸酶条件优化及酶学性质研究[D]. 济南: 山东大学, 2014.
[18] Wang Y, Piao MZ, Sun YH. Genetic algorithm for fermentation kinetics of submerged fermentation by. Chin J Biotech, 2008, 24(8): 1454–1457 (in Chinese).王莹, 朴美子, 孙永海. 基于遗传算法的羊肚菌液体发酵动力学模型的建立. 生物工程学报, 2008, 24(8): 1454–1457.
(本文责编 郝丽芳)
Establishment of kinetics digital model for hyaluronate lyase productionbased on fermentation optimization ofA152
Yanhui Jiang1, Jingliang Zhang2,3, and Xiaolu Jiang1,3,4
1 College of Food Science and Engineering, Ocean University of China, Qingdao 266003, Shandong, China2 College of Medicine and Pharmacy, Ocean University of China, Qingdao 266003, Shandong, China3 Marine Biomedical Research Institute of Qingdao, Qingdao 266071, Shandong, China4 State Key Laboratory of Bioactive Seaweed Substances, Qingdao Brightmoon Seaweed Group Co. Ltd, Qingdao 266400, Shandong, China
In order to produce hyaluronate lyase of high yield, we optimized the fermentationA152 in quadruple fermentation of 5 L, and studied the kinetics of fermentation. Both the highest biomass and enzyme activity could be achieved when the rotation speed was 400 r/min and the ventilation volume was 3.5 L/min. In addition, digital models of cell growth, product synthesis and substrate consumption were built by equation of logistic, luedeking-piret, product synthesis and substrate consumption. Nonlinear fitting and estimation of optimal parameters were obtained by MATLAB. The model correlated well between prediction and experimental data, and reflected the change rules of cell growth, hyaluronidase synthesis and substrate consumption during the process of producing hyaluronate lyase. The establishment of fermentation kinetics digital models could provide basis for controlling and prediction of the production process.
hyaluronate lyase, fermentation optimization, kinetics model, nonlinear fitting
December 13, 2016;
June 8, 2017
Xiaolu Jiang. Tel: +86-532-82032290; E-mail: jiangxl@ouc.edu.cn
Supported by:Scientific and Technological Project in Shandong Province (No. 2015GSF115002).
山东省科技厅 (No. 2015GSF115002) 资助。
2017-09-15
网络出版地址:http://kns.cnki.net/kcms/detail/11.1998.Q.20170915.1039.001.html

